UNSURUNSUR PERIODE KETIGA Nama Kelompok Syawalina Mufidah Vina

![Tabel unsur periode ketiga 11 (Na) [Ne] 3 s 1 23 12 (Mg) [Ne] Tabel unsur periode ketiga 11 (Na) [Ne] 3 s 1 23 12 (Mg) [Ne]](https://slidetodoc.com/presentation_image/52a2cd35ae4ab4b210466b67d342d828/image-2.jpg)



























- Slides: 34

UNSUR-UNSUR PERIODE KETIGA Nama Kelompok : - Syawalina Mufidah - Vina Gita Andriani - Silmiani Arofah - Regian Hastu Dwanti XII IPA 2
![Tabel unsur periode ketiga 11 Na Ne 3 s 1 23 12 Mg Ne Tabel unsur periode ketiga 11 (Na) [Ne] 3 s 1 23 12 (Mg) [Ne]](https://slidetodoc.com/presentation_image/52a2cd35ae4ab4b210466b67d342d828/image-2.jpg)
Tabel unsur periode ketiga 11 (Na) [Ne] 3 s 1 23 12 (Mg) [Ne] 3 s 3 24 13 14 15 16 17 18 (Al) (Si) (P) (S) (Cl) (Ar) [Ne] [Ne] 3 s 23 p 1 3 s 23 p 2 3 s 23 p 3 3 s 23 p 4 3 s 23 p 5 3 s 23 p 6 27 28 31 32 35, 5 40

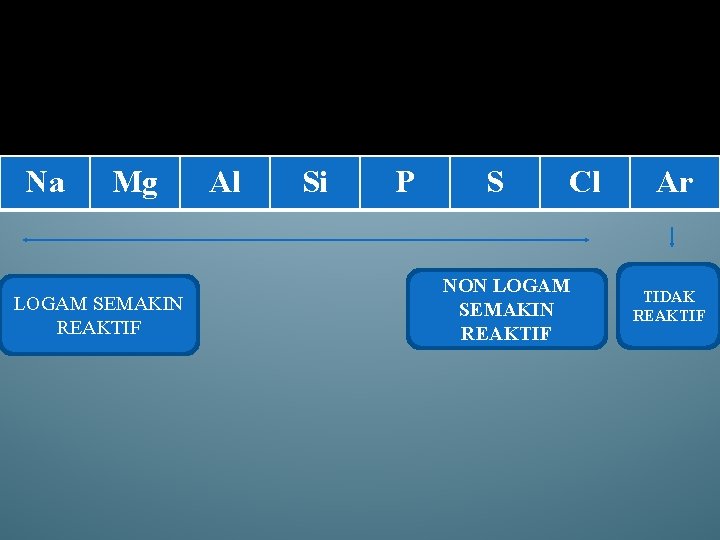
Na Mg LOGAM SEMAKIN REAKTIF Al Si P S Cl NON LOGAM SEMAKIN REAKTIF Ar TIDAK REAKTIF

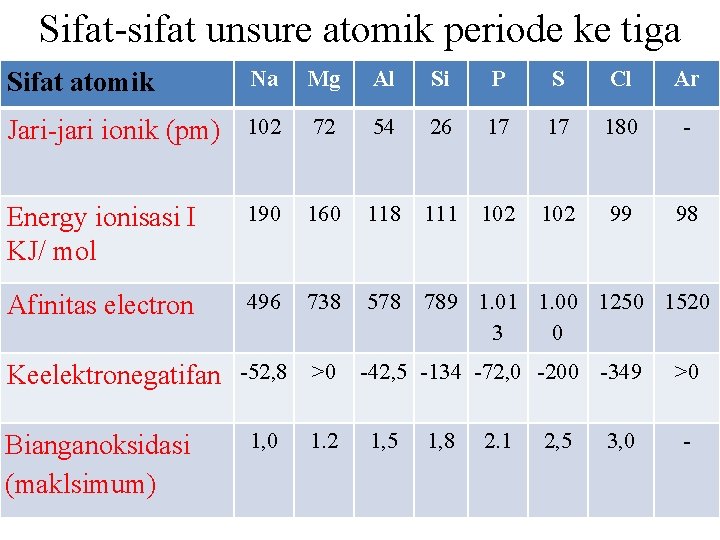
PERIODE 3 Dari table diatas, terlihat adanya keteraturan sifat atomik dari Na dan Ar yang secara umum dirumuskan sebagai berikut: - Nilai jari atom berkurang dari Na ke Ar. - Nilai energy ionisasi bertambah dai Na ke Ar, dengan Fluktuasi nilai dari Mg ke Al dan dari P ke S. - Nilai afinitas electron bertambah dari Na ke Cl, dengan fluktuasi nila untk al dan P. (abaikan tanda –negatif pada nilai afinitas electron, yang berate energy dilepaskan). - Nilai keelektronegatifan bertambah dari Na ke Cl. - Nilai bilangan oksidasi maksimum bertambah dari Na ke Cl.

Sifat sifat fisis unsure periode ke tiga Kekuatan ikatan atau gaya antar partikel pada struktur unsure dapat dijelaskna sebagai berikut ; - Kekuatan ikatan logam bertambah dari Na ke Al. - Kekuatan iaktan logam dipengaruhi oleh rapat muatan ion positif dan rapat muatan awan electron. Muatan inti positif dan muatan awan electron bertambah dari Na ke Al, sementara jumlah kulit dalam tetap. Hal ini menyebabkan gaya tarik inti dan elekron semakin besar danb jari atom berkurang. Dengan demikian, rapat muatan ino positif dan rapat muatan awan electron bertambahn sehingga daya tarik menarik ion positi dan awan electron semakin kuat. - Kekuatan kovalen dalam struktur kovalen raksasa Si. Struktur kovalen raksasa Si merupakan struktur yang stabil dan simetris sehingga memilikiikatan kovalen yang cukup kuat. - Kekuatan gaya London S > P >Cl dan > Ar

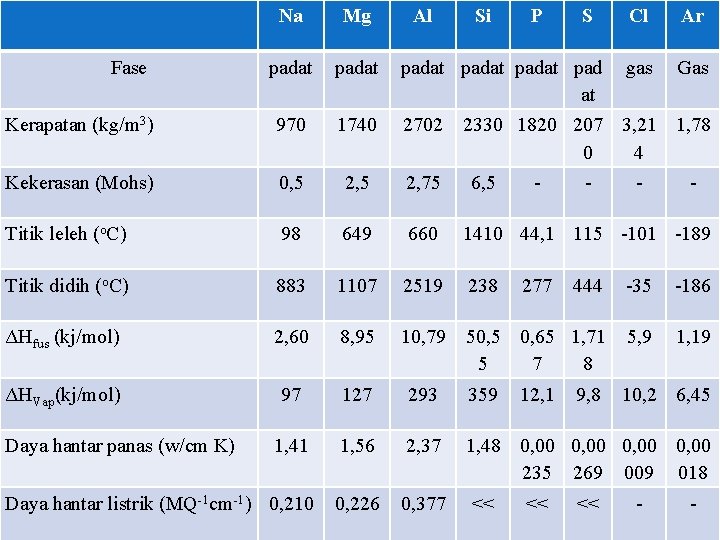
Sifat sifat fisis secara umum dirumuskan sebagi berikut: 1. Kerapatan bertambah dari Na ke Al, lalu berkurang dari Al ke Ar. Nilai kerapatan bergantung pada nilai masa atom, jari-jari atom, dan factor kerapatan perunit sel dalam unsure. 2. Nilai kerapatan semakin besar pertambahan masa atom dan factor kerapatan, dan sebaliknya, semakin kecil dengan pertanbangan jari 0 jari atom. Karna factor kerapatan per unit sel untuk logam Na, Mg, dan Al hampir sama, pertambahan nilai kerapatan dari logam Na ke Al dapat dijelaskan dari kenaikan nilai mas atom dan penurunan jari atom. Selanjutnya, fariasi nilai kerapatan P, S, Cl, dan Ar (non logam) terkait dengan kekuatan gaya London S ≥ P ≥ Cl ≥Ar. 2. Kekrasan bertambah dari Na ke Si Pertambahan kekerasan dapat dijelaskan dari kekuatan ikatan loigam yang meningkat dari Na ke Al dan kekuatan ikatan kofalen pada Si.

3. Titik leleh dan ΔHfus bertambah dari Na ke Si, lalu berkurang dari Si ke Ar. Kenaikan titik leleh dan ΔHfus dari Na ke Si dapat dijelaskan dengan kekuatan ikatan logam yang meningkat dari Na ke Al, dan kekeuatan ikatan kovalen pada Si. Sedangkan kecenderungan penurunan titiki leleh dan ΔHfus dari Si ke Ar terkait dengan variasi kekuatan daya London S > P > Cl > Ar. 4. Titik didih dan ΔHvap bertambah dari Na ke Si, lalu berkutang dari Si ke Ar. Kenikan dan penurunan titik didih serta ΔHvap dapat dijelaskan seperti halnya kecenderungan titik leleh dan ΔHvap.

5. Daya hantar panas dan daya hantar listrik Na, Mg, dan Al (logam) lebih baik dibandingkan Si (semi logam) dan P, S, Cl, dan Ar (nonlogam). - Na, Mg, dan Al (logam) memiliki daya hantar listrik dan panas yang baik karna electron-elektron valensi dalam ikatan logamnya dapat bergerak bebas. Daya hantar listrikdan panas dari Na ke Al - Si (semi logam) memiliki ikatan kovalen dimana electronelektronnya terikat ke inti atom. Meski daya hantar listrik Si lebih buruk disbanding logam, namun masih lebih baik dibandingkan non logam. Dengan kenaikna suhu, lebih banyak electron yang lepas sehingga daya hantar listrik Si meningkat. Unsure dengan sifat demikian disebut semi konduktor. -P, S, Cl dan Ar (non logam) tidak memiliki daya hantar listrik yang baik karna struktur unsurnya tidak memiliki electronelektron bebas. Untuk daya hantar panasnya, kekuatan gaya London yang melemah menyebabkan partikel-partikel menjadi lebih mudah bergerak, sehingga P , S , Cl dan Ardapat menghantar panas meski sedikit.

1. Dampak pemanfaatan alumunium (Al) : Emisi CO 2 dari sel elektrolisis yang berpengaruh terhadap pemanasan global: 2 Al 2 O 3 + 3 C → 4 Al + 3 CO 2 Emisi senyawa PFC (Perfluorocarbon), yaitu ; CF 4 dan C 2 F 6, yang berkontribusi terhadap pemanasan global. PFC dihasilkan dari ‘efek anode’, yaitu reaksi anode C dengan fluoride sewaktu konsentrasi Al 2 O 3 dalam kliorit (Na 3 Al. F 6) berkurang. Rusaknya ekosistem permukaan tanah akibat penambangan bauksit. 2. Pemanfaatan osbestos (silikat) untuk kontruksi, insulasi panas/listrik, dan bahan tahan api telah menimbulokan gangguan paru-paru. Serat asbestos mikro yang ringan dan halus menimbulkan iritasi dan paru akan mengecil, menjadi keras, serta berlubang sehingga menghalangi transportasi O 2 dan CO 2 dari dan ke paru-paru. Gangguan ini juga disebut asbestos dan dapat berujung pada kanker paru-paru. 3. Bijih fosfat mentah mengandung 2 -4% F. sewaktu bijih fosfat diubah menjadi fosfa yang mudah larut dalam air, fluoride dilepas ke udara sehingga menyebabkan rusaknya tanaman dan kerancunan pada ternak. Proses tersebut juga menghasilkan limbah fosfogipsum putih yang bersifat radioaktif karna bijih fosfat mengandung uranium dan produk peluruhnya.

4. Pemanfaatan unsur P pada deterjen dan pupuk telah menyebabkan eutrofikasi, yakni suburnya tanaman air fitoplankton. Hal ini menyebabkan kadar O 2 dalam air berkurang sehingga organisme air lainnya akan mati. 5. SO 2 dalam konsentrasi tinggi di udara, jika terhirup dapat bereaksi dengan air dalam paru -paru membentuk H 2 SO 4. akibatnya terjadi pendarahan yang akan mengisi paru-paru sehingga penderita menjadi lemas. SO 2 juga sering diakitkan dengan hujan asam.

Aplikasi unsur-unsur periode ketiga dalam kehidupan sehari-hari: 1. Alumunium : Al mudah terbentuk dan tahan panas sehingga digunakan untuk peralatan masak dan lembaran alumunium. Paduan Al dengan unsur-unsur seperti Cu, Mg, Si dan Mn digunakan untuk pesawat terbang dan roket, karna tidak hanya kuat tetapi juga ringan. Al(OH)3 digunakan sebagian obat maag untuk mengatsi asam lambung. Aplikasi lainnya : Al digunakan untuk kable lisrik karna sifat nya yang ringan meski daya hantar listriknya hanya ~60% daya hantar listrik CU. 2. Silikon : Si digunakan untuk membuat komponen elektronik seperti semi konduktor dan diode (komponen elektronik yang dapat menghantarkan listrik satu arah) Silika (Si. O 2) digunakan sebagain bahan baku gelas dan keramik. Asbes tidak muidah terbakar dan kuat, digunakan untuk insulator seperti pakaian pelindung panas. Pasir silica (Si. O 2) digunakan untuk campuran semen. Senyawa silikat (Al 2 Si 2 O 5(OH)4) atau kaolin digunakan untuk membuat tembikar. Aplikasi lainnya: silicon karbida (Si. C) bersifat kuat dan tahan panas yang digunakan untuk tungku, pipa termokopel, bahan abrasive, alat pemotong, dan komponen mekanik seperti impeller pompa dan katub.

3. Fosfor : Fosfor penting untuk pertumbuhan tanaman sehingga digunakan sebagai pupuk dalam bentuk senyawanya, seperti (NH 3)4 PO 4 dan Ca 3(PO 4)2. Fosfor merah digunakan untuk ujung korek api. Fosfor akan bereaksi dengan zat dikotak korek api untuk menghasilkan nyala api. Fosfor p[utih digunakan untuk bom asap. 4. Belerang : Belerang dapat mengikat molekul-molekul karet yang panjang sehingga tidak selip melalui proses vulkanisir. Karet menjadi lebih kuat dan keras dan mudah dicetak, tetapi tidak elastis. Karet vulkanisir digunakan pada ban mobil, truk dan pesawat terbang, bumper karet mobil, penghapus pensil dan sarung tangan lateks. Belerang bersaa KNO 3, dan karbon digunakan dalam pembuatan serbuk mesiu. Kebanyak belerang digunakan untuk memproduksi senyawa asam sulfat H 2 SO 4, yaitu senyawa yang mempunyai banyak kegunaan seperti bahan pembuat cat, pembuatan pupuk dan penyamaan kulit.

Senyawa hidroksida unsure-unsur periode ketiga dapat bersifat asam atau basa ; 1. Senyawa hidroksida bersifat basa jika senyawa tersebut melepaskan ion OH-. Hal ini berlaku untuk M akan mudah melepas electron menjadi bermuatan parsial positif, dan elektronik tersebut akan diterima oleh atom O yang akan mejadai bermuatan parsial negative. Ikatan yang terbentuk antara M dan O merupakan ikatan ionic yang dapat melapas ikatan OHMOH → M+ + OH-

2. Senyawa hidroksida bersifat asam jika senyawa tersebut melepas ion H+. Hal ini berlaku untuk M dengan energy ionisasi yang besar. M akan sukar melepas electron dan cenderung menggunakan electron besama O membentuk ikatan kovalen. Akibatnya, senyawa MOH tidak melepas ion OH-. Akan tetapi, karna ikata O minta bersifat polar maka dapat bereaksi dengan pelarut air (terhidrolisisi) dan melepas ion H+. MOH → MO- + H+ Oleh karna itu, energy ionisasi unsure-unsur periode ketiga bertambah dari Na ke Cl. Dari penjelasan diatas, dapat disimpulkan ; Sifat basa hidroksida berkurang dan sifat asam hidroksida bertambah dar Na ke Cl. Senyawa –senyawa hidroksida dari unsure-unsur periode ketiga disebelah kanan dari Si sampai Cl bersifat stabil dan cenderung terurai menjadi senyaw asam nya.

Proses ekstrasi unsure-unsur periode ketiga : Unsure-unsur periode ketiga berada dialam dalam bentuk unsure dan senyawanya. Proses ekstrasi unsure-unsure Na, Mg, Cl, dan Ar telah dibahas di subbab A dan B. disini akan dibahas ekstrasi 4 unsur lain nya, yaitu Al, Si, P dan S. 1. Alumunium (Al) Proses ekstraksi Al yang paling ekonomis dikenal sebagai proses Hall. Heroulet, yang di ekstrasi Al dari bauksit menggunakan metode elektrolisis. Baulksit sendiri mengandung sekitar 50% Al 2 O 3, Fe(III) oksida, berbagai zat pengotor lainnya. -Tahapan ekstrasi Al 4 dari bauksit; a. Bauksit dihancurkan dan Al 2 O 3 dipisahkan dari zat pengotor lainnya dalam bauksit dengan melarutkannya dalam Na. OH pekat. Capmuran ini dipanaslkan dalam tangki bertekanan dan menghasilkan Na. Al (OH)4. Al 2 O 3 + 2 Na. OH + 3 H 2 O ――> 2 Na. Al(OH)4 Tidak seperti Na. Al(OH)4 yang larut dalam air, kebanyakan zat pengotor tidak larut termasuk Fe(III) oksida, sehingga produk rekasi perlu disaring.

b. Na. Al 4, diencerkan dengan air, gas CO 2 dilewatkan melalui larutan naal(OH)4 untuk mendapatkan endapan al(oh)3. naal(OH)4 ――> Al(OH)3 + naoh selanjutnya produk reaksi disaring untuk memperoleh Al(OH)3 yang kemudian dipanaskan untuk mendapatkan bubuk Al 2 o 3. c. Al 2 O 3 kemudian dolarutkan dilelehkan kriolit (Na 3 Al. F 6) dimana al 2 o 3 terdisosiasi menjadi Al 3+ dan O 2 -. campuran ini dimasukkan kedalam sel eletrolisis, dimana reaksi eletrolisi terjadi: katoda (grafit) : Al 3+ + 3 e → Al anoda (garfit) : 2 O 2 - → O 2 + 4 e sel : 4 Al 3+ + 6 O 2 - → 4 Al + 3 O 2 lelehan al yang terbentuk pada katode membentuk lapisan didasar sel dan diambil secara berkala.

Pada awalnya, Al sangan sulit diambil dari senyawanya meski proses elektrolisis telah diketahui pada saat itu. Ha ini antara lain disebabkan senyawa Al 2 O 3 mempunyai titik yang sangat tinggi (~2000 o. C). baru tahun pada tahun 1886 Charles Hall menemukan bahwa Al 2 O 3 dapat larut dalam lelehan kriolit(Na 3 Al. F 6). Dimana campuran yang terbentuk memiliki titk leleh yang lebih rendah, yakni 850 o. C.

2. Silicon( Si) Meski jumlah senyawa silikat banyak dialam, namun pengambilan Si dari senyawa silikat cuku sulit. Karenanya, Si di ekstraksi dari senyawa oksida (silikat) atau sulfidanya dengan metode reduksi. Berikut tahapan ekstraksi Si dari Si. O 2 ; Si. O 2 dipanaskan dengan kokas (C) pada suhu sekitar 3000 o. C dalam tungku pembakaranatau tanur listrik. Pereaksi ditambahkan dari atas tungku. Si. O 2 + 2 C 3000 C Si + 2 CO Lelehan Si yang dihasilkan dikeluarkan dari bawah tungku dan akan membentuk padatan Si yang dihasilkan cukup murni yang dapat digunakan Negara lain untuk pembuatan paduan dengan logam lain.

Untuk mendapatkan Si dengan kemurnian tinggi, maka diperlukan tahapan pemurnian berikut: 1. Si dipanaskan dengan Cl 2 Si + 2 Cl 2 → Si. Cl 4 2. Lelehan Si. Cl 4 yang dihasilkan dimurnikan dengan proses distilasi. 3. Si. Cl 4 lalu direduksi menjadi Si melalui pemanasan dengan H 2 atau Mg. Si. Cl 4 + 2 H 2 →Si + 4 HCL Si. Cl 4 + 2 Mg → Si + 2 Mg. Cl 2 3. Produk reaksi dicuci dengan air panas untuk memperoleh Si. 4. Si dimurnikan dengan alat ZONE REFINING. Didalam alat ini batang Si dilewatkan secara perlahan melalui alat pemanas. Pada zona pemanasan, batangan Si tersebut akan meleleh. karna zat pengotor lebih mudah larut dalam lelehan disbanding padatan Si, maka pengotor tersebut akan berkumpul dalam lelehan Si. Dalam lelehan yang tidak murni tersebut akan tersu berpindah sepanjang batangan Si, selama proses. Ketika daerah lelehan yang rtidak murni telah sampai keujung, maka ujung ini akan dibiarkan membentuk padatan sebelum dipotong. Si dengan kemurnian tinggi (≥ 99%) digunakan sebagai bahan baku diindustri elektronik, keramik, dan untuk pembuatan padual Al.

3. Fosfor (P) diekstraksi dari senyawa fosfat Ca 3(PO 4)2 melalui metode reduksi. Ca 3 (PO 4)2 dalam bantuan fosfat dipanaskan dengan kokas (C) dan pasir si O 2 pada suhu 1400 -15000 C. Ca 3(PO 4)2 + 3 Si. O 2 + 5 c → 3 Ca. Si. O 3 + 5 CO + 2 P Fosfor yang dihasilkan dapat memiliki beberapa alotrpi, diantaranya fosfor putih, fosfor merah, fosfor hitam. Yang paling terkenal adalah fosfor putih (P 4), diperoleh dari kondensasi uap fosfor. Fosfor putih tidak berwana, mempunyai titik leleh 44 oc, dan mudah bereaksi dengan oksigen membentuk P 4 O 10 sehingga harus disimpan dalam air. Fosfor merah dapat diperoleh dari pemanasan fosfor putih tanpa udara pada tekanan atmosfer. Fosfo hitam diperoleh dari pemanasan fosfor putih atau fosfor merah Tetapi pada tekanan yang sangat tinggi.

4. Belerang (S) Belarang (S) dapat diekstraksi dari alam dalam bentuk unsure ataupun dari senyawanya. Proses ekstraksi S dalam bentuk unsure. Belerang terdapat dialam sebagai endapan dibawah tanah. Penambang S pada awalnya menyulitkan karna tertutup oleh lapisan pasir, krikil dan lumpur. Lapisanlapisan ini yang menyebabkan kemungkinan runtuhnya tambang tersebut. Disamping itu, endapan ini mengandung gas beracun SO 2 dan H 2 S. hal ini berhasil diatasi dengan suatu metode yang disebut PROSES FRASCH. Tingkat kemurnian S yang dihasilkan sekitar 99, 5%. Proses ekstrasi S dari senyawa sulfida. Pada awalnya, senyawa sulfida seperti Cu. S dan Pb. S hanya digunakan untuk pengambilan logam seperti Cu dan Pb melalui rekasi berikut; Cu. S + O 2 → Cu + SO 2 akan tetapi gas SO 2 yang dihasilkan telah menyebabkan polusi udara dan juga hujan asam. Untuk itu, sekarang SO 2 tidak dbuang keudara, tetapi direaksikan dengan H 2 S un tuk mengahsilkan belerang (S). 2 H 2 S + SO 2 → 3 S + 2 H 2 O Cara uang sama juga digunakan untuk mengekstraksikan belerang yang berada sebagai gas H 2 S dalam gas alam. Metode ekstraksi S dalam senyawa sulfida sekarang menjadi penting dibanding proses Frasch.

Bilanagn oksidasi maksimum Na Mg Al Si P S Cl +1 +2 +3 +4 +5 +6 +7 Senyawa hidroksida Na. OH Mg(OH)2 Al(OH) Si(OH)4 P(OH)5 S(OH)6 Cl(OH)7 Jenis ikatan Ionik 3 Ionik kovalen SO 2 merupakan salah satu komponen polusi udara dan penyebab timbulnya hujan asam

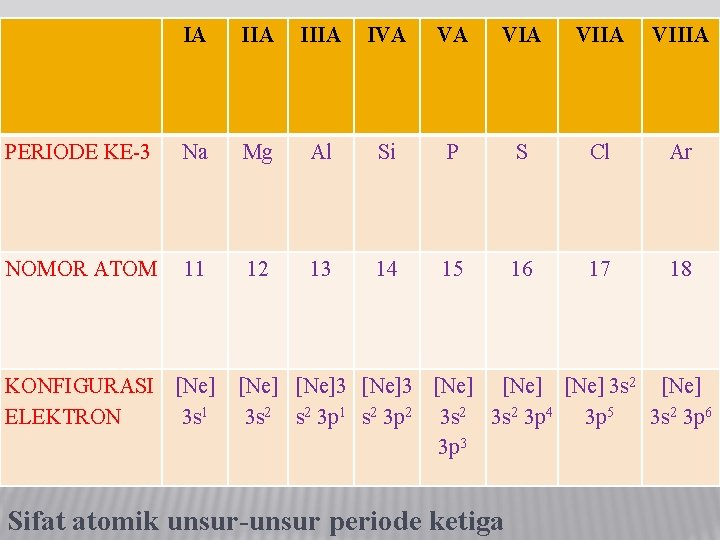
IA IIIA IVA VA VIIA VIIIA PERIODE KE-3 Na Mg Al Si P S Cl Ar NOMOR ATOM 11 12 13 14 15 16 17 18 KONFIGURASI [Ne] ELEKTRON 3 s 1 [Ne]3 [Ne] 3 s 2 [Ne] 3 s 2 3 p 1 s 2 3 p 2 3 s 2 3 p 4 3 p 5 3 s 2 3 p 6 3 p 3 Sifat atomik unsur-unsur periode ketiga

Sifat- sifat unsur periode ketiga Logam 1. Natrium (Na) = putihmetalik 2. Magnesium (Mg) = putihmetalik 3. Alumunium (Al) = metalik Semi- logam / metalloid 1. Silicon (Si) = abu-abugelap, sedikitkebiruan Non- logam 1. Fosfor (P) = tidakberwarna / merah / putihmetalik 2. Belerang (S) = kuningpucat 3. Klorin (Cl) = kuningkehijauan 4. Agon (Ar) = tidakberwarna

Sifat-sifat unsure atomik periode ke tiga Na Mg Al Si P S Cl Ar Jari-jari ionik (pm) 102 72 54 26 17 17 180 - Energy ionisasi I KJ/ mol 190 160 118 111 102 99 98 Afinitas electron 496 738 578 789 1. 01 1. 00 1250 1520 3 0 Sifat atomik Keelektronegatifan -52, 8 >0 -42, 5 -134 -72, 0 -200 -349 Bianganoksidasi (maklsimum) 1, 0 1. 2 1, 5 1, 8 2. 1 2, 5 3, 0 >0 -

Na Mg padat padat pad at Kerapatan (kg/m 3) 970 1740 2702 Kekerasan (Mohs) 0, 5 2, 75 Titik leleh (o. C) 98 649 660 1410 44, 1 115 -101 -189 Titik didih (o. C) 883 1107 2519 238 444 -35 -186 ΔHfus (kj/mol) 2, 60 8, 95 10, 79 50, 5 0, 65 1, 71 5 7 8 5, 9 1, 19 ΔHVap(kj/mol) 97 127 293 359 10, 2 6, 45 1, 41 1, 56 2, 37 1, 48 0, 00 235 269 009 018 Daya hantar listrik (MQ-1 cm-1) 0, 210 0, 226 0, 377 Fase Daya hantar panas (w/cm K) Al Si P S Cl Ar gas Gas 2330 1820 207 3, 21 1, 78 0 4 6, 5 << - 277 12, 1 << - 9, 8 << - -

Unsur Natrium Keberadaandialam Na terdapat dalam garam batu. Na. Cl, sendawa Chili Na. NO 3, karnalit KMg. Cl 3 ; 6 H 2 O, trona Na 5(CO 3)2 ; (HCO 3) ; 2 H 2 O, dan air laut (Simak Subbab B) Magnesium Mg berada sebagai senyawa Mg. Cl 2 di air lautdan deposit garam. Juga dalam senyawa karbonat dalam mineral magnesit (Mg. CO 3) dan dolomite (Mg. Ca(CO 3)2), dan dalam senyawa epsomit (Mg. SO 4 ; 7 H 2 O) ( lihatsubbab B ) Alumunium Al adalah unsure ke-3 terbanyak dikerakbumi setelah O dan Si. Al ditemukan di batuan yang mengandung alumino silikat (campuran Al, O Si) , korundum( Al 2 O 3) , kriolit Na 3 AIF 6, dan bauksit (AL 2 O 3. x. H 2 O) silicon.

Silicon Si merupakan unsure ke du terbanyak di kerak bumi setelah O dengan kadar ~25, 7%. Si ditemukan sebagai silica (Si. O 2) dan senyawa silikat( campuran Si , O dan logam lain). Ada dua jenis silica, yakni yang benbetuk Kristal (kuarsa, kristobalit, tridimit) dan yang non Kristal (oniks, gata atau akik, jesper, batu api). Sedangkan senyawa silikat menyusun 95% dari bebatuan. Banyak senyawa silikat merupakan senyawa aluminosilikat. Senyawa ini terbentuk dari senyawa silikat dimana sebagian atom Si telah diganti dengan atom Al. senyawa aluminosilikat dapat dibedakan menurut pembentukannya : Feldspart : atom Si yang diganti dengan Al berasal dari silikat. Jumlah atom Si yang diganti bisa sampai separuh nya, contohnya ; Na. Al. Si 3 O 8 (albit) dan Ca(Al. Si. O 4)2 (anortit). Mika : atom Si yang diganti dengan Al berasal dari senyawa silikat. Contohnya : KAl 2(Al. Si 3 O 10) (OH)2 (muskovit).

Fosfor (P) ditemukan pada bebatuan fosfat sebagai senyawa fluorapatit Ca 5(PO 4)3 F, hidroksiapatit Ca 5(PO 4)3(OH) dan klorapatit Ca 5(PO 4)3 Cl. Belerang (S) ditemukan dalam bentuk unsure dan senyawanya. Sebagai unsure, belerang terdapat didaerah pegunungan vulkanik dan sebagai endapan pada kedalaman ≥ 100 m dibawah tanah. Endapan ini kemungkinan terbentuk dari reduksi Ca. SO 4 menjadi unsure S oleh bakteri. Sebagai senyawa, belerang terdapat dalam senyawa sulfide seperti Fe. S 2, Pb. S, Cu 2 S dan H 2 S dalam gas alam dan dalam senyawa sulfat seperti Ca. SO 4. 2 H 2 O. Klorin Cl ditemukan sebagai klorida dalam air laut dan garam batu. Argon Ar terdapat di udara dengan kadar 0, 934% udara kering.

Daya reduksi dan daya oksidasi unsur-unsur periode ketiga. Unsur Bilangan oksidasi Na +1, 0 Mg +2, +1, 0 Al +3, 0 keterangan Na memiliki daya reduksi terkuat. Hal in dapat dilihat dari reaksi Na yang berlangsung hebat dengan air. 2 Na + 2 H 2 O → 2 Na. OH + H 2 Mg memiliki daya reduksi dibawah Na. Mg bereaksi lebih lambat dengan air disbanding Na. Mg + 2 H 2 O → Mg(OH)2 + H 2 Al memiliki daya reduksi dibawah Na dan Mg. Al juga bereaksi cepat dengan udara membentuk lapisan oksida yang sangat setabil. Kedua hal tersebut mencegah Al bereaksi dengan air kecuali jika air berada sebagai uap air panas. 2 Al + 3 H 2 O → Al 2 O 3 + 3 H 2

Si Si memiliki daya reduksi dan daya oksidasi yang lemah. Si juga bereaksi cepat dengan udara membentuk lapisan oksida Si. O 2 yang stabil, sehingga Si tidak bereaksi dengan air meski berupa uap air panas Dengan daya reduksi yang lemah Si hanya bereaksi dengan oksidator kuat seperti O dan Cl. Reaksi berlangsung pada suhu tinggi. Si + O 2 → Si. O 2 Si + 2 Cl 2 → Si. Cl 4 Dengan daya oksidasi yang lemah, Si hanya bereaksi dengan reduktor kuat seperti Mg. Si. Cl 4 + 2 Mg → Si + 2 Mg. Cl 2

P +5, +4, +3, +1, 0, 2, -3 P memiliki daya reduksi dan daya oksidasi yang lemah. Dengan daya reduksi yang lemah, P hanya bereaksi dengan oksidator kuat sperti O dan Cl P 4 + 3 O 2 → P 4 O 6 P 4 + 6 Cl 2 → 4 PCl 3 Dengan daya oksidasi yang lemah, P hanya bereaksi dengan reduktor lkuat seperti Ca. P 4 + 6 Ca → 2 Ca 3 P 2

S +6, +5, +4, +2, 0, -2 S memiliki daya reduksi yang lemah dari P, tetapi memiliki daya oksidasi yang lebih kuat. Dengan daya reduksi yang lemah, S hanya bereaksi dengan okisidator kuat seperti O dan Cl. S 8 + 8 O 2 → 8 SO 2 S 8 + 4 Cl 2 → 4 S 2 Cl 2 Dengan daya oksidasi yang lebih kuat, S dapat mengoksidasi logam. Cu + S → Cus Fe + S → Fe. S Cl +7, +5, +4, +3, +1, 0, -1 Cl memiliki daya reduksi yang lemah tetapi daya oksidasinya sangat kuat. Dengan daya reduksi yang lemah, Cl hanya bereaksi dengan oksidator lebih kuat, seperti F Cl 2 + F 2 → 2 CIF Cl 2 + 3 F 2 → 3 Cl. F 2

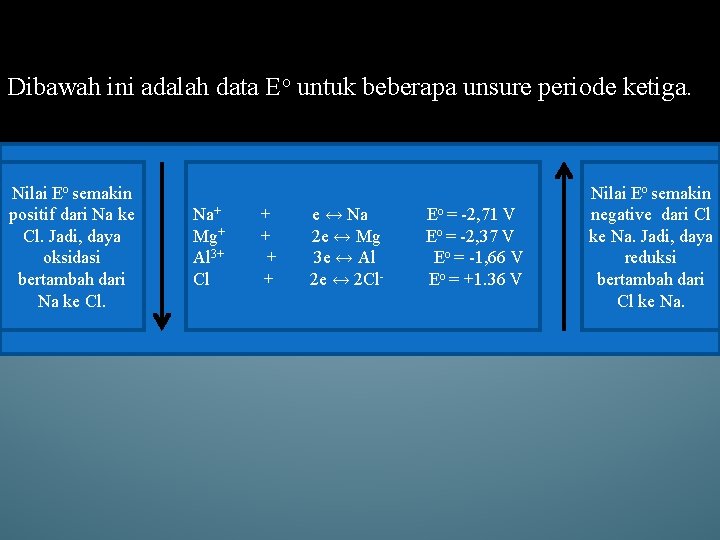
Dibawah ini adalah data Eo untuk beberapa unsure periode ketiga. Nilai Eo semakin positif dari Na ke Cl. Jadi, daya oksidasi bertambah dari Na ke Cl. Na+ Mg+ Al 3+ Cl + + e ↔ Na 2 e ↔ Mg 3 e ↔ Al 2 e ↔ 2 Cl- Eo = -2, 71 V Eo = -2, 37 V Eo = -1, 66 V Eo = +1. 36 V Nilai Eo semakin negative dari Cl ke Na. Jadi, daya reduksi bertambah dari Cl ke Na.