Tata Nama Senyawa Dan Persamaan Reaksi Untuk SMK




















- Slides: 25

Tata Nama Senyawa Dan Persamaan Reaksi Untuk SMK Teknologi Dan Pertanian Kelas X Semester 1 Penyusun : SMK Negeri 7 Bandung

STANDAR KOMPETENSI Memahami konsep penulisan lambang unsur dan persamaan reaksi Hal. : 2 tatanama senyawa Adaptif

KOMPETENSI DASAR Memahami lambang unsur Memahami rumus kimia Menyetarakan persamaan reaksi Hal. : 3 tatanama senyawa Adaptif

TUJUAN PEMBELAJARAN 1. 2. 3. 4. 5. 6. Menuliskan nama unsur Menuliskan nama senyawa biner Menuliskan senyawa ion Menuliskan senyawa terner Menuliskan senyawa organik Menyetarakan suatu persamaan kimia dengan benar Hal. : 4 tatanama senyawa Adaptif

PENGANTAR Tabel sistem periodik unsur Hal. : 5 tatanama senyawa Adaptif

LANJUTAN Kita tahu bahwa atom suatu unsur dapat bergabung dengan atom unsur lain untuk membentuk senyawa, melalui mekanisme ikatan kimia Hal. : 6 tatanama senyawa Adaptif

BAHASAN BAHAN AJAR 1. 2. 3. 4. 5. Tatanama unsur Tatanama senyawa biner Tatanama senyawa ion Tatanama senyawa terner Persamaan kimia Hal. : 7 tatanama senyawa Adaptif

TATANAMA UNSUR Menurut BERZELIUS (1779 -1848) cara penamaan tatanama unsur sbb: 1. Setiap unsur ditandai dengan 1 atau 2 huruf 2. Untuk yang menggunakan satu huruf, ditulis dengan huruf besar yaitu huruf pertama dari nama ilmiah unsur yang bersangkutan 3. Untuk yang menggunakan dua huruf caranya sbb : Ø Huruf pertama ditulis dengan huruf besar yaitu huruf pertama dari nama ilmiah unsur yang bersangkutan Ø Huruf kedua ditulis dengan huruf kecil yaitu salah satu huruf lain dari nama ilmiah unsur yang bersangkutan Hal. : 8 tatanama senyawa Adaptif

TATANAMA SENYAWA BINER Senyawa biner adalah senyawa yang terdiri dari dua jenis unsur. Senyawa biner diberi nama dengan menggunakan nama unsur pertama yang diikuti oleh bagian utama dari nama unsur bagian kedua yang digabungkan dengan akhiran “ida” Nama unsur pertama untuk senyawa biner adalah unsur yang bersifat logam(lebih bermuatan positif) dan diikuti yang bersifat non logam (lebih bermuatan negatif) Contoh : a. HCl ↔ hidrogen + klor + ida = hidrogen klorida (asam klorida) Hal. : 9 tatanama senyawa Adaptif

LANJUTAN 2. NO ↔ Nitrogen + oksigen + ida = nitrogen oksida Pada penamaan senyawa biner sering digunakan awalan yang diambil bilangan yunani yang menyatakan jumlah atom penyusun senyawa. Awalan awalan yang biasa digunakan terdapat dalam tabel sbb : Jumlah atom awalan Jumlah atom Awalan 1 Mono- 6 Heksa- 2 di- 7 Hepta- 3 Tri- 8 Okta- 4 Tetra- 9 Nona- 5 Penta- 10 Deka- Hal. : 10 tatanama senyawa Adaptif

LANJUTAN Catatan : awalan “mono” tidak digunakan jika jumlah atom unsur pertama sama dengan satu Contoh : 1. N 2 O 3 = di-nitrogen+tri-oksida+ida = dinitrogen trioksida 2. CS 2 = karbon+di-sulfur+ida = karbon disulfida Hal. : 11 tatanama senyawa Adaptif

TATA NAMA SENYAWA ION Senyawa ion merupakan senyawa yang tderdiri dari ion positif(kation) dan ion negatif (anion) Nama senyawa ion merupakan susunan nama kation diikuti dengan nama anionnya Nama nama senyawa ion yang mempunyai lebih dari satu bilangan oksidasi dibedakan dengan menuliskan bilangan oksidasinya Hal. : 12 tatanama senyawa Adaptif

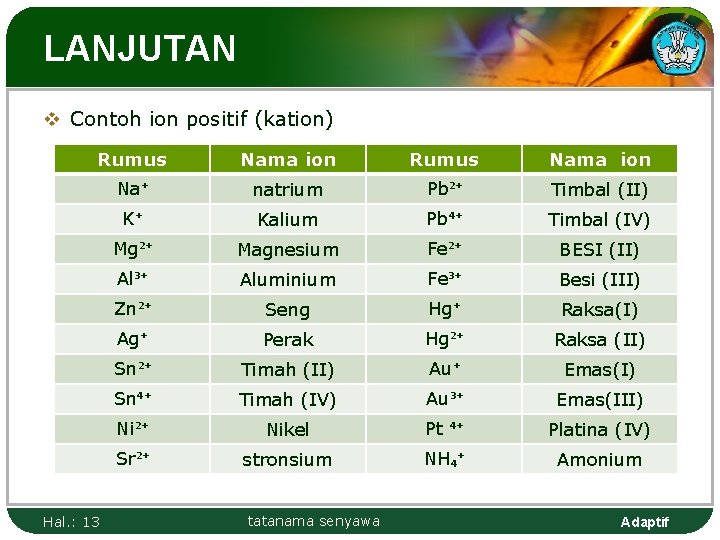
LANJUTAN v Contoh ion positif (kation) Rumus Nama ion Na⁺ natrium Pb²⁺ Timbal (II) K⁺ Kalium Pb⁴⁺ Timbal (IV) Mg²⁺ Magnesium Fe²⁺ BESI (II) Al³⁺ Aluminium Fe³⁺ Besi (III) Zn²⁺ Seng Hg⁺ Raksa(I) Ag⁺ Perak Hg²⁺ Raksa (II) Sn²⁺ Timah (II) Au⁺ Emas(I) Sn⁴⁺ Timah (IV) Au³⁺ Emas(III) Ni²⁺ Nikel Pt ⁴⁺ Platina (IV) Sr²⁺ stronsium NH₄⁺ Amonium Hal. : 13 tatanama senyawa Adaptif

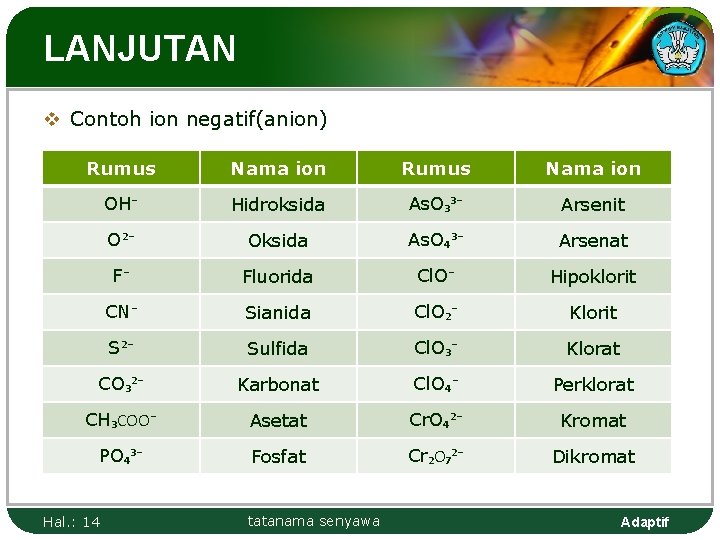
LANJUTAN v Contoh ion negatif(anion) Rumus Nama ion OH⁻ Hidroksida As. O₃³⁻ Arsenit O²⁻ Oksida As. O₄³⁻ Arsenat F⁻ Fluorida Cl. O⁻ Hipoklorit CN⁻ Sianida Cl. O₂⁻ Klorit S²⁻ Sulfida Cl. O₃⁻ Klorat CO₃²⁻ Karbonat Cl. O₄⁻ Perklorat CH₃COO⁻ Asetat Cr. O₄²⁻ Kromat PO₄³⁻ Fosfat Cr₂O₇²⁻ Dikromat Hal. : 14 tatanama senyawa Adaptif

LANJUTAN Contoh : 1. 2. 3. 4. Hal. : 15 Na. Cl : natrium + klorida = natrium klorida Ca. CO₃ : kalsium + karbonat = kalsium karbonat Fe. Cl₂ : besi (II) + klorida = besi (II) klorida Fe(NO₃)₃ : besi (III) + nitrat = besi (III) nitrat tatanama senyawa Adaptif

TATANAMA SENYAWA TERNER Istilah terner dalam kimia digunakan untuk menggambarkan suatu senyawa kimia yang terdiri dari tiga buah unsur aktif Senyawa terner meliputi senyawa asam, basa dan garam Hal. : 16 tatanama senyawa Adaptif

SENYAWA ASAM Asam adalah suatu senyawa yang biasanya dapat larut dalam air dan melepaskan ion hidrogen(H⁺) Suatu senyawa asam bereaksi dengan basa untuk membentuk garam Asam merupakan senyawa yang bersifat korosif dan mempunyai rasa yang asam Nama suatu senyawa asam ditulis dengan awalan “asam” yang diikuti dengan nama anionnya. Contoh : 1. H₂SO₄ = Asam sulfat 2. HNO₃ = Asam nitrat 3. CH₃COOH = Asam asetat 4. H₃PO₄ = Asam fosfat Hal. : 17 tatanama senyawa Adaptif

SENYAWA BASA Basa adalah suatu senyawa kaustik yang biasanya dapat larut dalam air dan melepaskan ion hidroksida(OH⁻) Suatu senyawa basa bereaksi dengan asam untuk membentuk garam Nama senywa bsa dituliskan dengn nama kationnya diikuti dengan kata “hidroksida” Contoh : 1. Na. OH = Natrium hidroksida 2. Mg(OH)₂ = Magnesium hidroksida Hal. : 18 tatanama senyawa Adaptif

SENYAWA GARAM Garam adalah zat yang dihasilkan dari reaksi antara senyawa basa dan senyawa asam Garam merupakan senyawa ion yang terdiri dari kation dan anion, sehingga penamaan garam sama dengan penamaan senyawa ion Contoh : 1. Na. Cl = natrium klorida 2. Al₂(SO₄)₃ = aluminium sulfat Hal. : 19 tatanama senyawa Adaptif

TATANAMA SENYAWA ORGANIK Senyawa organik adalah senyawa yang pada mulanya membatasi pada senyawa yang berasal dari makhluk hidup, tetapi sekarang mencakup senyawa karbon buatan. Contoh : 1. CO(NH₂)₂ = Urea 2. C₆H₁₂O₆ = Glukosa Hal. : 20 tatanama senyawa Adaptif

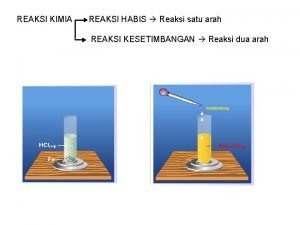
PERSAMAAN REAKSI Persamaan reaksi didefinisikan penulisan suatu reaksi atau perubahan kimia yang mengacu pada hukum dasar kimia Mereaksikan antara timah nitrat dengan kalium iodida dan membentuk endapan kuning Hal. : 21 tatanama senyawa Adaptif

LANJUTAN Pada persamaan reaksi ada 2 macam daerah yaitu Daerah sebelah kiri tanda panah pada persamaan reaksi disebut pereaksi Daerah sebelah kanan tanda panah pada persamaan reaksi disebut hasil reaksi Simbol “+” berarti “bereaksi dengan” Simbol “→” berarti “ menghasilkan” Simbol wujud : (aq) berarti larutan; (l) berarti cairan ; (s) berarti padatan ; dan (g) berarti gas Hal. : 22 tatanama senyawa Adaptif

PENYETARAAN REAKSI Dasar penyetaraan reaksi adalah hukum lavoiser Bunyi hukum lavoiser adalah “massa zat sebelum reaksi sama dengan massa zat sesudah reaksi” Bunyi hukum lavoiser dibuktikan dengan “jumlah atom disebelah kiri tanda panah pada persamaan reaksi sama dengan jumlah kanan tanda panah Hal. : 23 tatanama senyawa Adaptif

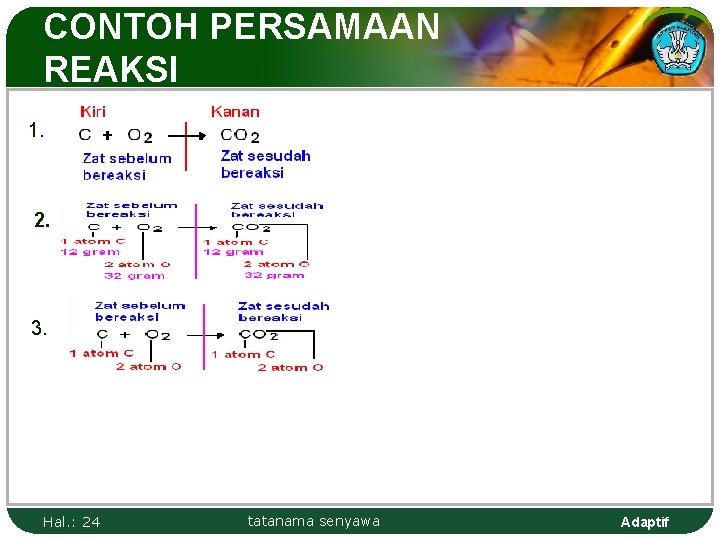
CONTOH PERSAMAAN REAKSI 1. 2. 3. Hal. : 24 tatanama senyawa Adaptif

AKHIR “Terima kasih” Tim Penyusun : Rochim Muliawan, S. Pd, Dra. Hj. Nunun Kusworini dan Oktaviani Budiarti, S. Pd SMK Negeri 7 Bandung Hal. : 25 tatanama senyawa Adaptif
 Optis aktif adalah
Optis aktif adalah Nomenklatur adalah
Nomenklatur adalah Tentukan jumlah atom cp cs ct ck
Tentukan jumlah atom cp cs ct ck Reaksi senyawa karbon
Reaksi senyawa karbon Ch3-ch2-ch=ch2 + hcl →
Ch3-ch2-ch=ch2 + hcl → Program kerja tata usaha smk 2019 doc
Program kerja tata usaha smk 2019 doc Reaksi redoks merupakan gabungan dari
Reaksi redoks merupakan gabungan dari Reaksi reaksi pada gas mulia
Reaksi reaksi pada gas mulia 2 metil butanamina
2 metil butanamina Contoh mengindeks nama perusahaan
Contoh mengindeks nama perusahaan Nama senyawa berikut adalah
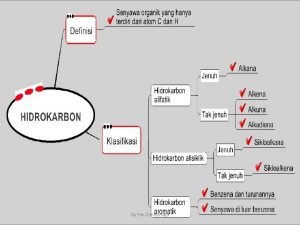
Nama senyawa berikut adalah Nama senyawa hidrokarbon
Nama senyawa hidrokarbon Nama senyawa si
Nama senyawa si Nama senyawa nu
Nama senyawa nu Persamaan dari reaksi proses fotosintesis adalah
Persamaan dari reaksi proses fotosintesis adalah Bab 2 reaksi redoks dan elektrokimia
Bab 2 reaksi redoks dan elektrokimia Jenis-jenis frasa tingkatan 3
Jenis-jenis frasa tingkatan 3 Kata asal
Kata asal Ayat frasa nama + frasa adjektif
Ayat frasa nama + frasa adjektif Contoh peta konsep iman kepada allah
Contoh peta konsep iman kepada allah Kata sendi nama tingkatan 1
Kata sendi nama tingkatan 1 Kata terbitan awalan
Kata terbitan awalan Yaumul azifah
Yaumul azifah Jenang sela wader kalen sesondheran
Jenang sela wader kalen sesondheran Moj tata opis
Moj tata opis Materi etika dan tata krama siswa
Materi etika dan tata krama siswa