LAJU REAKSI Laju Reaksi Laju reaksi adalah laju
![Laju Reaksi Laju reaksi adalah laju berkurangnya konsentrasi reaktan ([A]) dan laju bertambahnya konsentrasi Laju Reaksi Laju reaksi adalah laju berkurangnya konsentrasi reaktan ([A]) dan laju bertambahnya konsentrasi](https://slidetodoc.com/presentation_image_h2/65749110fecde0e56ba99e4a350ebc90/image-2.jpg)


- Slides: 7

LAJU REAKSI
![Laju Reaksi Laju reaksi adalah laju berkurangnya konsentrasi reaktan A dan laju bertambahnya konsentrasi Laju Reaksi Laju reaksi adalah laju berkurangnya konsentrasi reaktan ([A]) dan laju bertambahnya konsentrasi](https://slidetodoc.com/presentation_image_h2/65749110fecde0e56ba99e4a350ebc90/image-2.jpg)
Laju Reaksi Laju reaksi adalah laju berkurangnya konsentrasi reaktan ([A]) dan laju bertambahnya konsentrasi produk ([B]) Berlangsungnya suatu reaksi merupakan hasil tumbukan antar partikel zat. semakin besar kemungkinan terjadinya tumbukan semakin cepat kemungkinan terjadinya reaksi. Laju reaksi akan berbanding lurus dengan banyaknya tumbukan molekul per detik Tidak semua tumbukan menghasilkan reaksi, melainkan tumbukan yang memiliki energi yang cukup dan arah tumbukan yang tepat Tumbukan yang menghasilkan reaksi yaitu tumbukan efektif Agar tumbukan efektif terjadi maka dibutuhkan energi aktivasi. Energi aktivasi adalah energi minimum yang harus dimiliki oleh partikel pereaksi sehingga menghasilkan tumbukan efektif

Faktor-faktor yang Mempengaruhi Laju. Reaksi 1 Konsentrasi 2 Suhu atau Temperatur 3 Luas Permukaan 4 Katalis

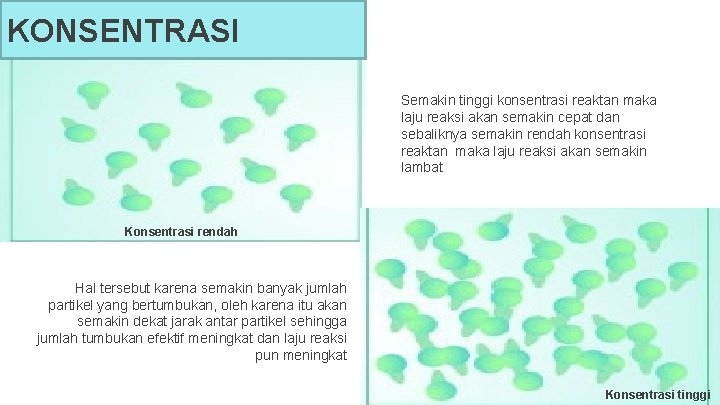
KONSENTRASI Semakin tinggi konsentrasi reaktan maka laju reaksi akan semakin cepat dan sebaliknya semakin rendah konsentrasi reaktan maka laju reaksi akan semakin lambat Konsentrasi rendah Hal tersebut karena semakin banyak jumlah partikel yang bertumbukan, oleh karena itu akan semakin dekat jarak antar partikel sehingga jumlah tumbukan efektif meningkat dan laju reaksi pun meningkat Konsentrasi tinggi

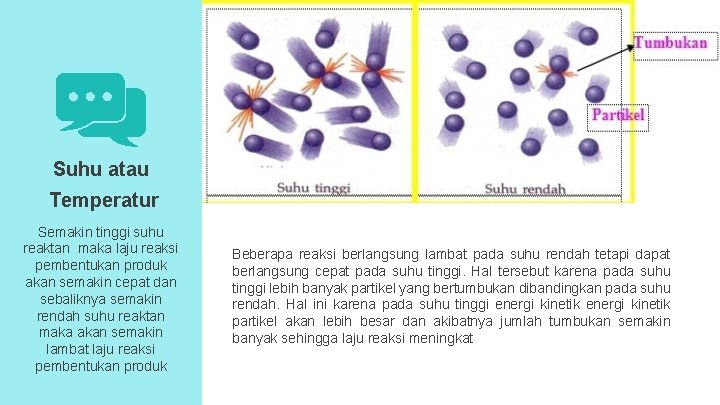
Suhu atau Temperatur Semakin tinggi suhu reaktan maka laju reaksi pembentukan produk akan semakin cepat dan sebaliknya semakin rendah suhu reaktan maka akan semakin lambat laju reaksi pembentukan produk Beberapa reaksi berlangsung lambat pada suhu rendah tetapi dapat berlangsung cepat pada suhu tinggi. Hal tersebut karena pada suhu tinggi lebih banyak partikel yang bertumbukan dibandingkan pada suhu rendah. Hal ini karena pada suhu tinggi energi kinetik partikel akan lebih besar dan akibatnya jumlah tumbukan semakin banyak sehingga laju reaksi meningkat

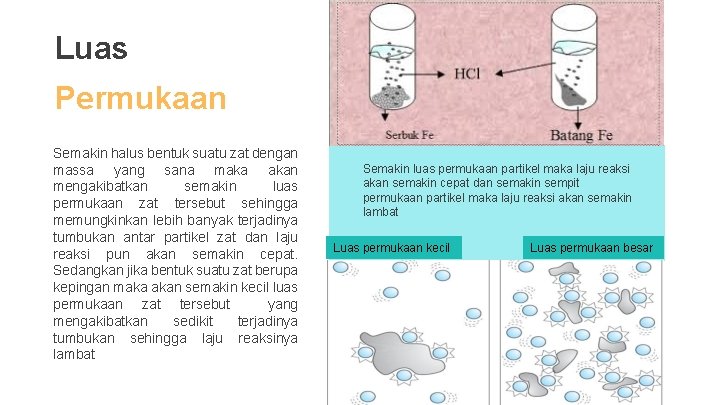
Luas Permukaan Semakin halus bentuk suatu zat dengan massa yang sana maka akan mengakibatkan semakin luas permukaan zat tersebut sehingga memungkinkan lebih banyak terjadinya tumbukan antar partikel zat dan laju reaksi pun akan semakin cepat. Sedangkan jika bentuk suatu zat berupa kepingan maka akan semakin kecil luas permukaan zat tersebut yang mengakibatkan sedikit terjadinya tumbukan sehingga laju reaksinya lambat Semakin luas permukaan partikel maka laju reaksi akan semakin cepat dan semakin sempit permukaan partikel maka laju reaksi akan semakin lambat Luas permukaan kecil Luas permukaan besar

Katalis membantu reaksi berlangsung lebih cepat menuju arah kesetimbangan Ketika terjadinya reaksi maka akan terbentuk zat kompleks teraktivasi dan letaknya berada puncak energi. Jika reaksi terjadi, maka penguraian zat kompleks teraktivasi akan memberikan zat hasil reaksi (produk) Pengaruh katalis pada laju reaksi berhubungan dengan energi aktivasi (Ea). Energi aktivasi berfungsi untuk memutuskan ikatan-ikatan pada reaktan sehingga akan terbentuk ikatan baru pada produk.