KIMIA DASAR FAKULTAS PETERNAKAN KELAS 1 Dr Surya




























- Slides: 35

KIMIA DASAR FAKULTAS PETERNAKAN (KELAS 1) Dr. Surya Lubis, M. Si Dr. M. Daud

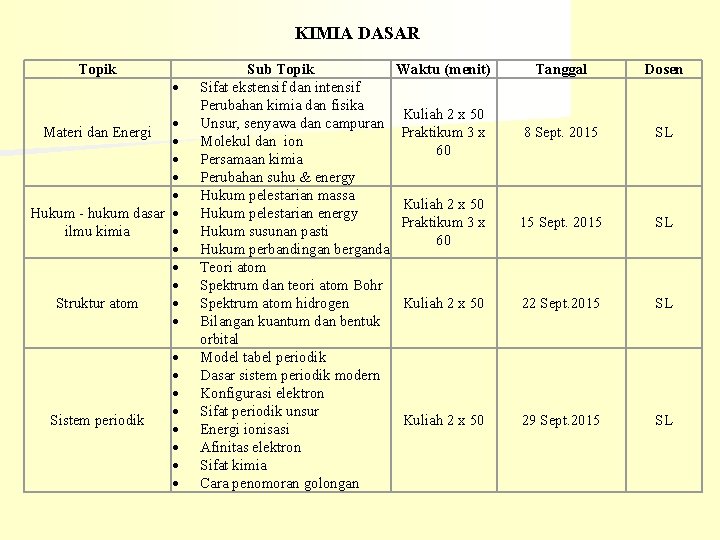
KIMIA DASAR Topik Materi dan Energi Hukum - hukum dasar ilmu kimia Struktur atom Sistem periodik Sub Topik Sifat ekstensif dan intensif Perubahan kimia dan fisika Unsur, senyawa dan campuran Molekul dan ion Persamaan kimia Perubahan suhu & energy Hukum pelestarian massa Hukum pelestarian energy Hukum susunan pasti Hukum perbandingan berganda Teori atom Spektrum dan teori atom Bohr Spektrum atom hidrogen Bilangan kuantum dan bentuk orbital Model tabel periodik Dasar sistem periodik modern Konfigurasi elektron Sifat periodik unsur Energi ionisasi Afinitas elektron Sifat kimia Cara penomoran golongan Waktu (menit) Tanggal Dosen Kuliah 2 x 50 Praktikum 3 x 60 8 Sept. 2015 SL Kuliah 2 x 50 Praktikum 3 x 60 15 Sept. 2015 SL Kuliah 2 x 50 22 Sept. 2015 SL Kuliah 2 x 50 29 Sept. 2015 SL

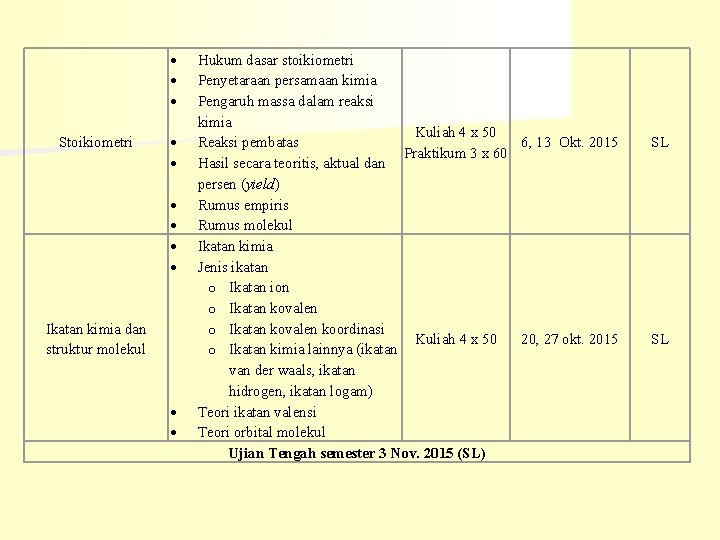
Stoikiometri Ikatan kimia dan struktur molekul Hukum dasar stoikiometri Penyetaraan persamaan kimia Pengaruh massa dalam reaksi kimia Kuliah 4 x 50 Reaksi pembatas 6, 13 Okt. 2015 Praktikum 3 x 60 Hasil secara teoritis, aktual dan persen (yield) Rumus empiris Rumus molekul Ikatan kimia Jenis ikatan o Ikatan ion o Ikatan kovalen koordinasi Kuliah 4 x 50 20, 27 okt. 2015 o Ikatan kimia lainnya (ikatan van der waals, ikatan hidrogen, ikatan logam) Teori ikatan valensi Teori orbital molekul Ujian Tengah semester 3 Nov. 2015 (SL) SL SL

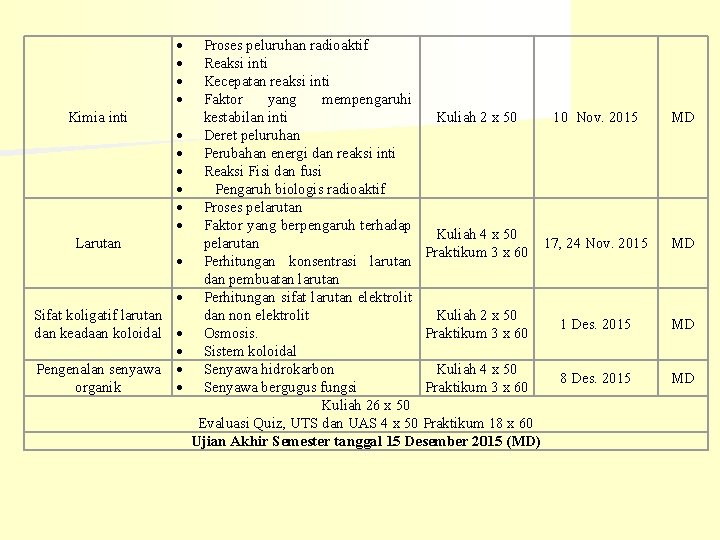
Kimia inti Larutan Sifat koligatif larutan dan keadaan koloidal Pengenalan senyawa organik Proses peluruhan radioaktif Reaksi inti Kecepatan reaksi inti Faktor yang mempengaruhi kestabilan inti Kuliah 2 x 50 10 Nov. 2015 Deret peluruhan Perubahan energi dan reaksi inti Reaksi Fisi dan fusi Pengaruh biologis radioaktif Proses pelarutan Faktor yang berpengaruh terhadap Kuliah 4 x 50 pelarutan 17, 24 Nov. 2015 Praktikum 3 x 60 Perhitungan konsentrasi larutan dan pembuatan larutan Perhitungan sifat larutan elektrolit dan non elektrolit Kuliah 2 x 50 1 Des. 2015 Osmosis. Praktikum 3 x 60 Sistem koloidal Senyawa hidrokarbon Kuliah 4 x 50 8 Des. 2015 Senyawa bergugus fungsi Praktikum 3 x 60 Kuliah 26 x 50 Evaluasi Quiz, UTS dan UAS 4 x 50 Praktikum 18 x 60 Ujian Akhir Semester tanggal 15 Desember 2015 (MD) MD MD

REFERENSI: 1. Will, J. W. , R. H. Petrucci, T. W. Mc. Creary and A. C. Perry, 2005, General Chemistry, 4 th Edition, Pearson Preintice Hall, New Jersey. 2. Syukri, S, 1999, Kimia Dasar, ITB, Bandung. 3. Keenan, C. W. , D. C. Kleinfelter and J. H. Wood, 1989, Imu kimia untuk Universitas, alih bahasa A. H. Pudjaatmaka, Erlangga, Jakarta. 4. Zumdahl, S. S. and S. A. Zumdahl, 2007, Chemistry, 7 th edition, Houghton Mifflin, New York. 5. Whitten, K. W. , R. E. Davis, M. L. Peck and G. G. Stanley, 2003, General Chemistry, 7 th edition, Brooks/Cole, USA.

KIMIA DASAR • • • Materi dan energi Hukum-hukum dasar ilmu kimia Struktur atom Konfigurasi elektron Ikatan kimia Kimia inti Unsur-unsur penting dalam bidang pertanian Koloidal Larutan Pengenalan senyawa organik (sifat fisika dan kimia)

ILMU KIMIA





ENERGI: E = mc 2 E = h c/

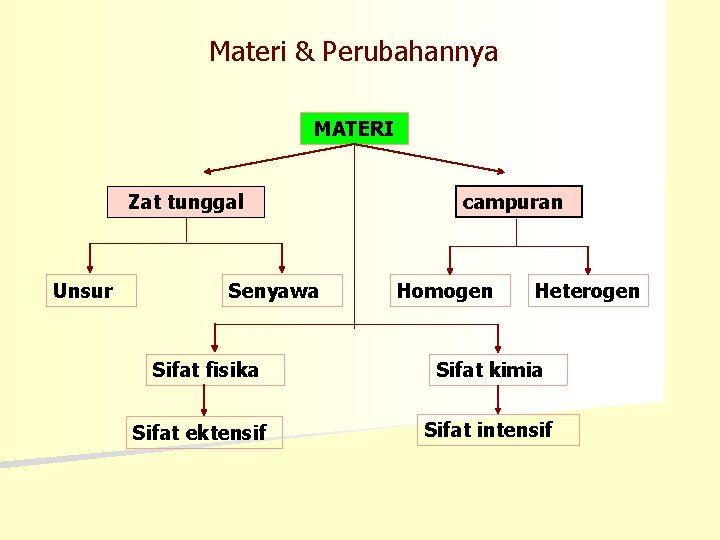
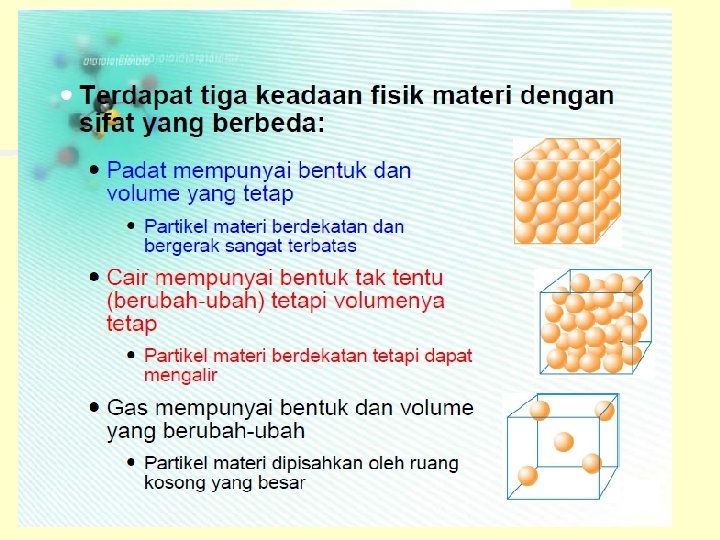
Materi & Perubahannya MATERI Zat tunggal Unsur Senyawa Sifat fisika Sifat ektensif campuran Homogen Heterogen Sifat kimia Sifat intensif

Unsur • Zat tunggal yg tidak dpt diuraikan lagi menjadi zat lain yg lbh sederhana dgn reaksi kimia biasa Au, Cu • Unsur alam : nomor 1 sampai 92 • Unsur buatan: nomor 93 sampai 108 n Unsur Logam, non logam dan metaloid. n Unsur metaloid: unsur peralihan dari logam ke non logam sehingga mempunyai beberapa sifat logam dan non logam • Alotrop: bentuk yg berbeda dr unsur yg sama Contoh: grafit dan intan bentuk alotrop dr karbon n Sampai awal abad 19 memberikan lambang unsur berdasarkan bentuk gambar tertentu n Menurut sistem Berzelius unsur mempunyai lambang yg terdiri dari 1 huruf atau 2 huruf H, C, O, N, Ca

Penulisan lambang unsur 1. Unsur yg tdr dr 1 huruf harus memakai huruf kapital 2. Unsur yg tdr dr 2 huruf harus memakai huruf besar pd yg pertama dan huruf kecil pd yg kedua Co : unsur cobalt tidak ditulis CO : karbon monoksida (senyawa) n


Senyawa yi: zat yg dpt diuraikan secara kimia menjadi dua zat atau lebih dgn sifat berbeda dari asalnya Air : gas Hidrogen & gas oksigen Gula: arang & air Garam dapur: logam Natrium & gas chlor Batu kapur: kapur tohor & karbondioksida

Penulisan unsur dibedakan atas: • mono atom: besi (Fe) tembaga (Cu) karbon (C) emas (Au), dll • diatom : H 2, O 2, N 2, F 2, Cl 2, Br 2, I 2 • tetraatom : P 4 Penulisan Senyawa : air (H 2 O) gula pasir (sukrosa C 12 H 22 O 11) alkohol (etanol C 2 H 5 OH) Rumus molekul hidrogen = H 2 Lambang atom hidrogen = H Molekul = gabungan atom-atom Molekul Unsur atom-atomnya sejenis: H 2, O 2, N 2 Molekul senyawa atom-atomnya berbeda jenis: Na. Cl, H 2 O, CH 4 Atom = partikel terkecil penyusun unsur Molekul = partikel terkecil penyusun senyawa

Ion: Partikel bermuatan yang terbentuk dengan cara transfer elektron antara unsur atau padanan unsur Kation: ion bermuatan positif, Ca 2+ + 2 e. Anion : ion bermuatan negatif , F 2 + 2 e- 2 FSenyawa Ionik • Beberapa ion sederhana: Kation (Na+, Mg 2+, Al 3+ Anion (Cl-, O 2 -, N 3 -) • Ion Poliatom Golongan khusus dari ion yang mana kelompok atom tersebut cenderung untuk bersama: NH 4+, NO 3 -, SO 42 -, OHRumus untuk beberapa senyawa ionik


Campuran homogen atau larutan, tidak dapat dibedakan satu dgn lainnya n Campuran heterogen, dapat dibedakan dgn mudah n Ciri-cirinya: 1. Masing-masing komponen mempunyai rasa tersendiri gula rasanya manis msh dpt dirasakan dlm larutan gula 2. Komponen penyusun campuran dpt dipisahkan secara fisika penyaringan, penyulingan, penguapan, kristalisasi, kromatografi 3. Komponen penyusunnya tidak mempunyai perbandingan jumlah tertentu n

n Larutan: zar terlarut kadarnya kecil dan zat pelarut kadarnya besar n Kelarutan: jumlah maksimum zat yg dpt larut dlm pelarut tertentu n Cepat lambatnya suatu zat terlarut dalam pelarut ditentukan oleh: besar kecilnya partikel, suhu dan pengadukan.




n n a. b. c. d. Diskusi B Dapatkah larutan itu cairan, padatan atau gas ? Manakah diantara zat berikut larutan atau campuran heterogen? Cairan susu sapi Minyak goreng Amalgam perak ( digunakan untuk pengisi gigi terdiri atas perak dan merkuri yg tersebar secara merata) lumpur

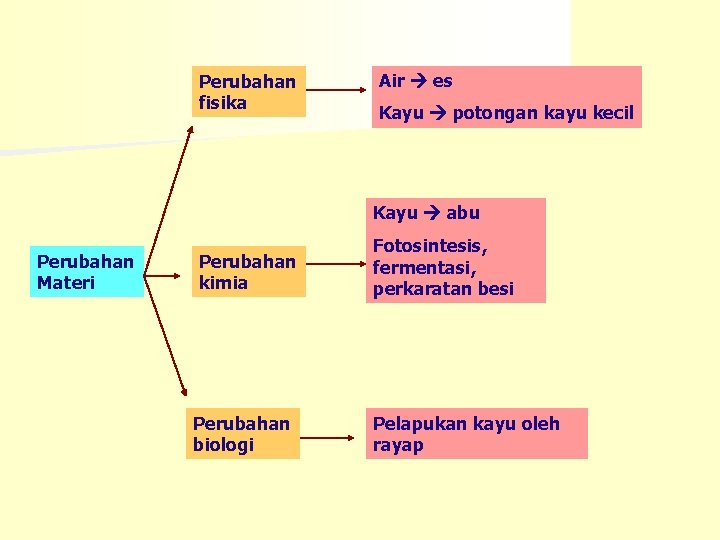
Perubahan fisika Air es Kayu potongan kayu kecil Kayu abu Perubahan Materi Perubahan kimia Perubahan biologi Fotosintesis, fermentasi, perkaratan besi Pelapukan kayu oleh rayap

Perubahan apakah ini ?

n Diskusi Pada urutan berikut manakah yang merupakan perubahan kimia dan manakah perubahan fisika? a. Gas Oksigen dicairkan, sebagian oksigen cair digunakan sebagai bahan bakar pesawat ruang angkasa, sebagian diuapkan dimasukan ke ruang penumpang, kemudian O 2 digunakan untuk bernafas dan berubah menjadi CO 2 dan H 2 O b. Lemak daging sapi dipanaskan di penggorengan sampai cair, dan dipanaskan terus sampai berubah kecoklat-coklatan dan menyebarkan bau menyengat, apabila terus dipanaskan lemak akan menyala dan terbakar. c. Nasi sudah menjadi bubur d. Susu menjadi basi

PERSAMAAN REAKSI n Menggambarkan reaksi kimia yang terdiri atas rumus kimia pereaksi dan hasil reaksi disertai koefisiennya masing-masing PENTING!!! Ø Reaksi kimia mengubah zat-zat asal (pereaksi/ reaktan) menjadi zat baru (produk). Ø Jenis dan jumlah atom yang terlibat dalam reaksi tidak berubah. Ø Ikatan kimianya yang berubah, dimana ikatan kimia pereaksi diputus dan terbentuk ikatan kimia baru dalam produknya.

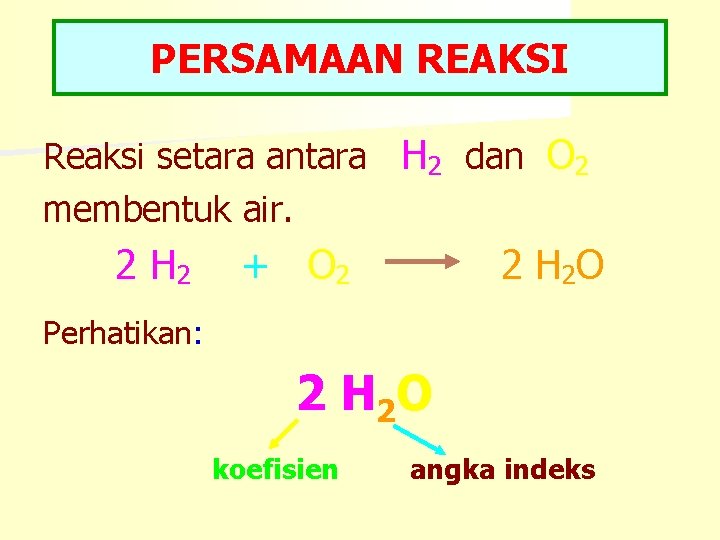
PERSAMAAN REAKSI Reaksi setara antara H 2 dan O 2 membentuk air. 2 H 2 + O 2 2 H 2 O Perhatikan: 2 H 2 O koefisien angka indeks

PENYETARAAN PERSAMAAN REAKSI KIMIA Contoh ; n Langkah 1: Al(s) + H 2 SO 4(aq) n Langkah 2: 2 Al(s) + 3 H 2 SO 4(aq) Al 2(SO 4)3(aq) + H 2(g) (belum setara) Al 2(SO 4)3(aq) + 3 H 2(g) setara) LANGKAH-LANGKAH PENYETARAAN: - Tetapkan koefisien salah satu zat (biasanya yang paling kompleks), sama dengan 1, dan zat lain dengan abjad. - Setarakan lebih dahulu unsur yang berkaitan langsung dengan zat yang diberi koefisien 1. - Setarakan unsur lain. Biasanya unsur O disetarakan paling akhir.

PERUBAHAN ENERGI Energi : Bentuk energi : kemampuan melakukan kerja 1. kinetik 2. potensial 3. panas 4. cahaya 5. listrik 6. kimia 7. nuklir

1. Energi kinetik : energi yang dimiliki suatu materi yang bergerak Ek = ½ m v 2. Energi potensial: energi yang dikandung suatu materi berdasarkan tinggi rendah kedudukannya Ep = m g h 3. Energi panas: energi yang ditimbulkan karena adanya gerakan partikel q = w c (t 2 -t 1) = w c ∆t 4. Energi cahaya: energi yang dimilki oleh gerakan foton dalam bentuk gelombang elektromagnetik v = c/λ → Ec = h ν

5. Energi listrik : energi yang diakibatkan oleh gerakan partikel bermuatan dalam suatu media (konduktor) W=q. E 6. Energi kimia: energi yang dikandung suatu senyawa dalam bentuk energi ikatan antara atom-atomnya/ reaksi kimia 7. Energi nuklir: energi yang terkandung dalam inti atom karena adanya ikatan yang kuat antara partikel di dalamnya.