REAKSI REDOKS Reaksi Reduksi 1 Reaksi yang mengalami




















- Slides: 22

REAKSI REDOKS

Reaksi Reduksi 1. Reaksi yang mengalami penurunan bilangan oksidasi 2. Oksidator 3. Reaksi yang menerima elektron 4. Reaksi pelepasan oksigen

Reaksi Oksidasi 1. Reaksi yang mengalami kenaikan bilangan oksidasi 2. Reduktor 3. Reaksi yang menyerahkan elektron 4. Reaksi pengikatan oksigen

ATURAN BILOKS 1. Unsur bebas dan molekul unsur biloksnya = 0 Contoh : 4 K + O 2 → 2 K 2 O P 4 + 6 I 2 → 4 PI 3 Ba + Cl 2 → Ba. Cl 2

2. Logam dalam senyawa biloksnya selalu positif (+) Contoh : 2 K + Cl 2 → 2 KCl K = +1 Mg + Cl 2 → Mg. Cl 2 Mg =+2 3 Fe + 3 Cl 2 → 3 Fe. Cl 2 Fe = +2 2 Fe + 3 Cl 2 → 2 Fe. Cl 3 Fe = +3

3. Hidrogen dalam senyawa biloksnya = +1 Kecuali : bersenyawa langsung dengan logam, hidrogen = -1 Contoh : 2 H 2 + O 2 → 2 H 2 O H=+1 H 2 + 2 K → 2 KH H 2 + Mg → Mg. H 2 H=-1

4. Oksigen dalam senyawa biloksnya=-2 Kecuali : a. peroksida = -1 b. superoksida = -1/2 c. OF 2 = +2 Contoh : 2 H 2 + O 2 → 2 H 2 O O=-2 H 2 + O 2 → H 2 O 2 O=-1 K + O 2 → KO 2 O=-1/2

5. Biloks ion = muatannya a. monoatomik b. poliatomik Contoh : O 2 - = -2 Na+ = +1 Cl- = -1 NH 4+ = +1 NO 3 - = -1 Al 3+ = +3 Cr 2 O 72 - = -2 SO 42 - = -2

6. Total biloks senyawa = 0 Contoh : KCl. O 4 = 0 Mn. O 2 = 0 H 2 SO 4 = 0 H 2 O = 0 KO 2 = 0

CONTOH SOAL: 1. Tentukan biloks Cl dalam senyawa KCl. O 4 Jawab : 1 K + 1 Cl + 4 O = 0 1(+1) + 1(Cl) + 4(-2) = 0 +1 + Cl - 8 = 0 Cl = +7

2. Tentukan biloks Cr dalam senyawa Cr 2 O 72 - Jawab : 2 Cr + 7 O = -2 2(Cr) + 7(-2) = -2 2 Cr - 14 = -2 2 Cr = +12 Cr = +6

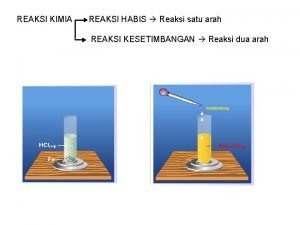
A. Penyetaraan Persamaan Reaksi Redoks 1. Metode Bilangan Oksidasi 2. Metode Ion Elektron

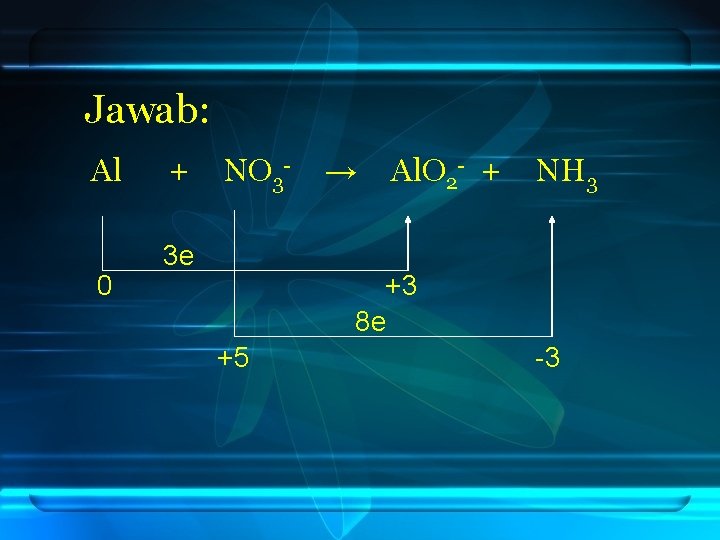
Contoh: 1. Tuliskan persamaan reaksi ion yang terjadi antara Al dan NO 3 - dalam suasana basa dengan cara perubahan biloks jika diketahui perubahan yang terjadi Al/Al. O 2 dan NO 3 -/NH 3

Jawab: Al 0 + NO 3 - 3 e → Al. O 2 - + NH 3 +3 8 e +5 -3

8 Al + 3 NO 3 - → 8 Al. O 2 - + 3 NH 3 + 5 OH+ 2 H 2 O 8 Al + 3 NO 3 - + 5 OH- + 2 H 2 O → 8 Al. O 2 + 3 NH 3

Contoh: 2. Tuliskan pers. reaksi ion yang terjadi antara KI + KOH + KMn. O 4 jika diketahui I-/I 2 dan Mn. O 4 - /Mn. O 2

Jawab: Langkah 1: oksidasi : I- → I 2 reduksi : Mn. O 4 - → Mn. O 2 Langkah 2: oksidasi : 2 I- → I 2 reduksi : Mn. O 4 - → Mn. O 2 + 4 OH-

Langkah 3: Oks : 2 I- → I 2 + 2 e ) x 3 Red : Mn. O 4 - +2 H 2 O + 3 e→Mn. O 2 +4 OH- ) x 2 Langkah 4: oksidasi : 6 I- → 3 I 2 + 6 e reduksi : 2 Mn. O 4 - +4 H 2 O + 6 e→ 2 Mn. O 2 + 8 OH-

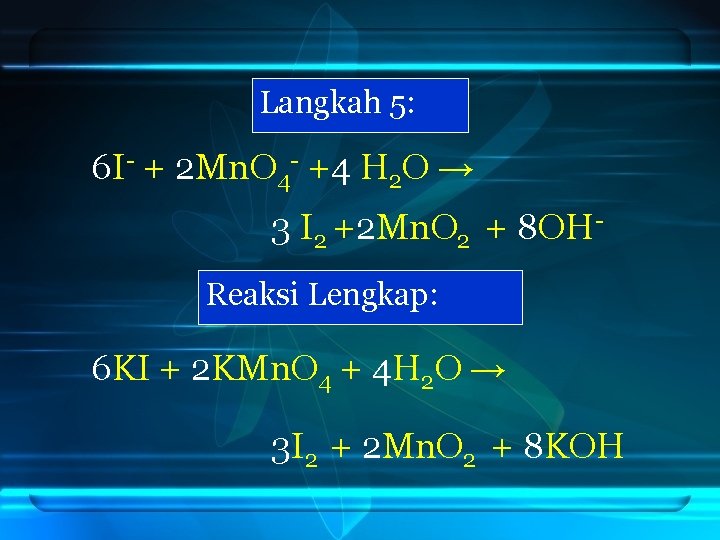
Langkah 5: 6 I- + 2 Mn. O 4 - +4 H 2 O → 3 I 2 +2 Mn. O 2 + 8 OHReaksi Lengkap: 6 KI + 2 KMn. O 4 + 4 H 2 O → 3 I 2 + 2 Mn. O 2 + 8 KOH

Pertanyaan: 1. Reaksi: 2 K + Cl 2 → 2 KCl Bilangan oksidasi K dalam senyawa KCl reaksi adalah … +1

2. Zat yang mengalami penurunan bilangan oksidasi dalam reaksi redoks disebut … oksidator

 Reaksi redoks pada pemutihan pakaian
Reaksi redoks pada pemutihan pakaian Algoritma yang merupakan gabungan dari beberapa rbm
Algoritma yang merupakan gabungan dari beberapa rbm Sebutkan tiga konsep yang menjelaskan reaksi redoks!
Sebutkan tiga konsep yang menjelaskan reaksi redoks! Penyetaraan reaksi redoks
Penyetaraan reaksi redoks Materi penyetaraan reaksi redoks kelas 12
Materi penyetaraan reaksi redoks kelas 12 Notasi sel volta
Notasi sel volta Contoh soal reaksi redoks
Contoh soal reaksi redoks Dalam proses perkaratan besi, besi bertindak sebagai … *
Dalam proses perkaratan besi, besi bertindak sebagai … * Reaksi
Reaksi Ninhidrin hanya akan mengalami reaksi deaminasi oksidatif
Ninhidrin hanya akan mengalami reaksi deaminasi oksidatif Untuk pasangan state yang berarti tidak dapat dibedakan?
Untuk pasangan state yang berarti tidak dapat dibedakan? Lambang determinan matriks
Lambang determinan matriks Elektron valensi fluor
Elektron valensi fluor Contoh soal titrimetri
Contoh soal titrimetri Kromosom
Kromosom Reduksi fsa
Reduksi fsa Struktur nyala api bunsen
Struktur nyala api bunsen Pada benda yang mengalami gerak jatuh bebas
Pada benda yang mengalami gerak jatuh bebas Codona suburdana
Codona suburdana Ch3-ch2-ch=ch2+hcl→
Ch3-ch2-ch=ch2+hcl→ Reaksi reaksi gas mulia
Reaksi reaksi gas mulia Tentukan produk reaksi dari reaksi amina berikut
Tentukan produk reaksi dari reaksi amina berikut Redoks potansiyeli nedir
Redoks potansiyeli nedir