REDOKS DAN SEL ELEKTROKIMIA PENYETARAN REAKSI REDOKS Dalam


























- Slides: 42

REDOKS DAN SEL ELEKTROKIMIA

PENYETARAN REAKSI REDOKS Dalam menyetarakan reaksi redoks JUMLAH ATOM dan MUATAN harus sama

Metode ½ Reaksi Langkah-langkah: 1. Tuliskan ½ reaksi reduksi / ½ reaksi oksidasi 2. Samakan jumlah atom-atom yang berubah biloksnya. 3. Samakan Jumlah O dan H dengan cara: a. Suasana Asam 4. 5. * Samakan O dengan menambahkan H 2 O 6. * Samakan jumlah H dengan Menambah H+ b. Suasana Basa 7. 8. 9. x * Samakan O dengan menambah OH- sebanyak 2 kekurangannya. * Samakan H dengan menambahkan H 2 O 10. 4. Samakan muatnnya dengan menambahkan elektron ( e- )

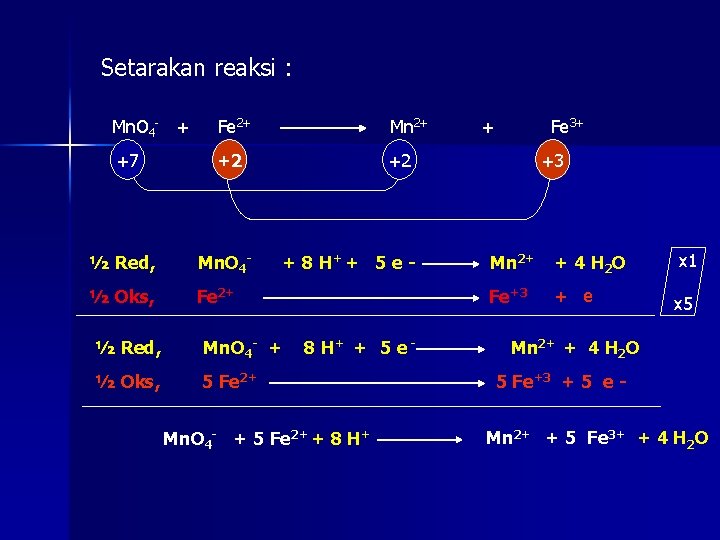
Setarakan reaksi : Mn. O 4 - + Fe 2+ Mn 2+ +7 +2 +2 ½ Red, Mn. O 4 - ½ Oks, Fe 2+ + 8 H+ + 5 e - ½ Red, Mn. O 4 - + ½ Oks, 5 Fe 2+ 8 H+ + 5 e - Mn. O 4 - + 5 Fe 2+ + 8 H+ + Fe 3+ +3 Mn 2+ + 4 H 2 O Fe+3 + e x 1 x 5 Mn 2+ + 4 H 2 O 5 Fe+3 + 5 e Mn 2+ + 5 Fe 3+ + 4 H 2 O

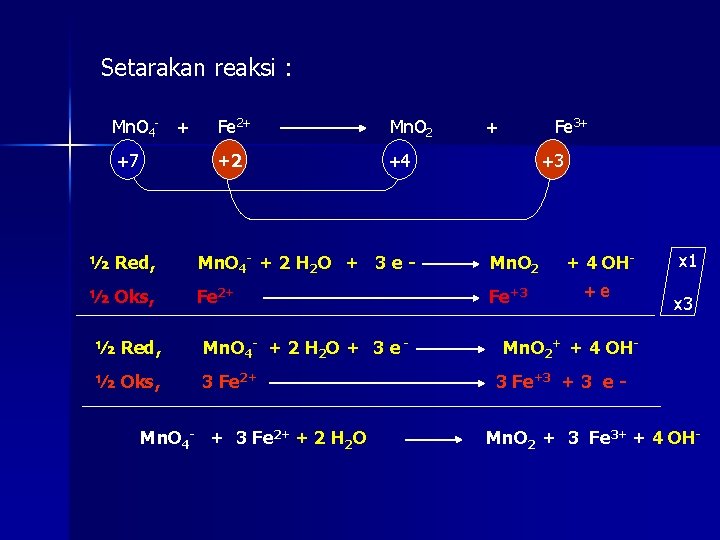
Setarakan reaksi : Mn. O 4 - + Fe 2+ Mn. O 2 +7 +2 +4 + Fe 3+ +3 ½ Red, Mn. O 4 - + 2 H 2 O + 3 e - Mn. O 2 ½ Oks, Fe 2+ Fe+3 ½ Red, Mn. O 4 - + 2 H 2 O + 3 e - ½ Oks, 3 Fe 2+ Mn. O 4 - + 3 Fe 2+ + 2 H 2 O + 4 OH+e x 1 x 3 Mn. O 2+ + 4 OH 3 Fe+3 + 3 e Mn. O 2 + 3 Fe 3+ + 4 OH-

Metode Bilangan Oksidasi 1. Tentukan reaksi ½ Reaksi redusi dan ½ Reaksi oksidasi’ 2. Samakan atom-atom yang berubah biloksnya. 3. Tentukan perubahan biloksnya. (dikalikan dengan jumlah atomnya) 4. Gunakan perubahan biloksnya sebagai koefisien dengan cara menyilangkan. 5. Setarakan muatanya, dalam suasana basa dengan OH-, dalam asam dengan H+ (sekaligus menyamakan H dan O )

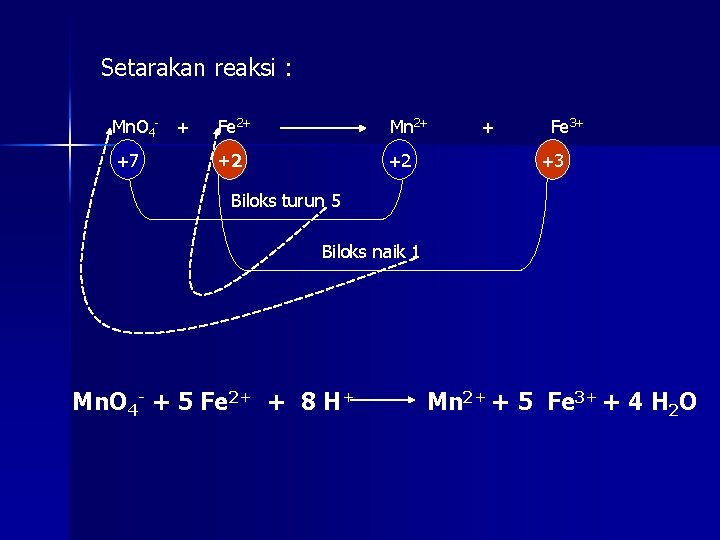
Setarakan reaksi : Mn. O 4 - + Fe 2+ Mn 2+ +7 +2 +2 + Fe 3+ +3 Biloks turun 5 Biloks naik 1 Mn. O 4 - + 5 Fe 2+ + 8 H+ Mn 2+ + 5 Fe 3+ + 4 H 2 O

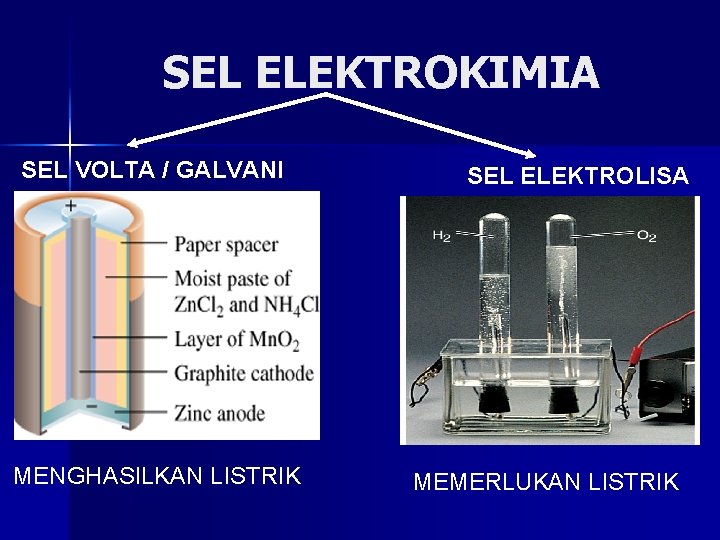
SEL ELEKTROKIMIA SEL VOLTA / GALVANI MENGHASILKAN LISTRIK SEL ELEKTROLISA MEMERLUKAN LISTRIK

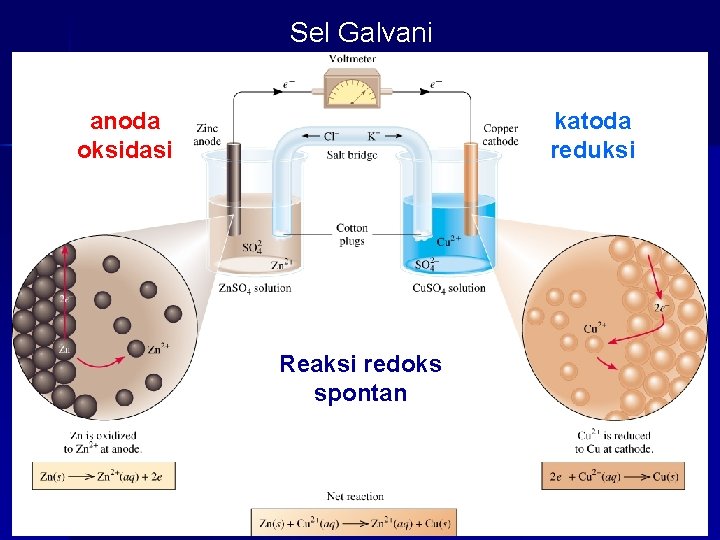
Sel Galvani anoda oksidasi katoda reduksi Reaksi redoks spontan 19. 2

PENULISAN PREAKSI PADA SEL VOLTA Ada 3 cara penulisan 1. Reaksi elektroda : menggambarkan reaksi pada masing -masing elektroda 2. Katoda : Cu 2+ + 2 e 3. Anoda : Zn Cu Zn 2+ + 2 e 2. Reaksi Sel: Merupakan penjumlahan dari reaksi elektroda. 3. Zn + Cu 2+ Zn 2+ + 3. Notasi Sel: Menggambarkan perubahan pada ion-ionnya. 4. Zn / Zn 2+ // Cu 2+/ Cu Cu

Standard Reduction Potentials Standard reduction potential (E 0) adalah potensial yang berkaitan dengan reaksi reduksi pada elektroda bila semua zat terlarut berkonsentrasi 1 M dan semua gas pada 1 atm. Reduction Reaction 2 e- + 2 H+ (1 M) E 0 = 0 V Standard hydrogen electrode (SHE) H 2 (1 atm)

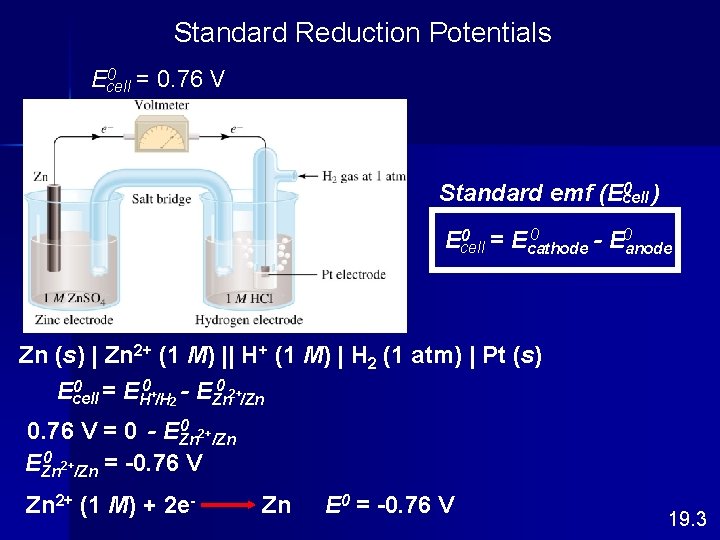
Potensial Reduksi Standar logam Zn Zn (s) | Zn 2+ (1 M) || H+ (1 M) | H 2 (1 atm) | Pt (s) Anode (oxidation): Zn (s) Cathode (reduction): 2 e- + 2 H+ (1 M) Zn (s) + 2 H+ (1 M) Zn 2+ (1 M) + 2 e. H 2 (1 atm) Zn 2+ + H 2 (1 atm) 19. 3

Standard Reduction Potentials 0 = 0. 76 V Ecell 0 ) Standard emf (Ecell 0 0 = E 0 Ecell cathode - Eanode Zn (s) | Zn 2+ (1 M) || H+ (1 M) | H 2 (1 atm) | Pt (s) 0 = E 0 + - E 0 2+ Ecell H /H 2 Zn /Zn 0 2+ 0. 76 V = 0 - EZn /Zn 0 2+ EZn /Zn = -0. 76 V Zn 2+ (1 M) + 2 e- Zn E 0 = -0. 76 V 19. 3

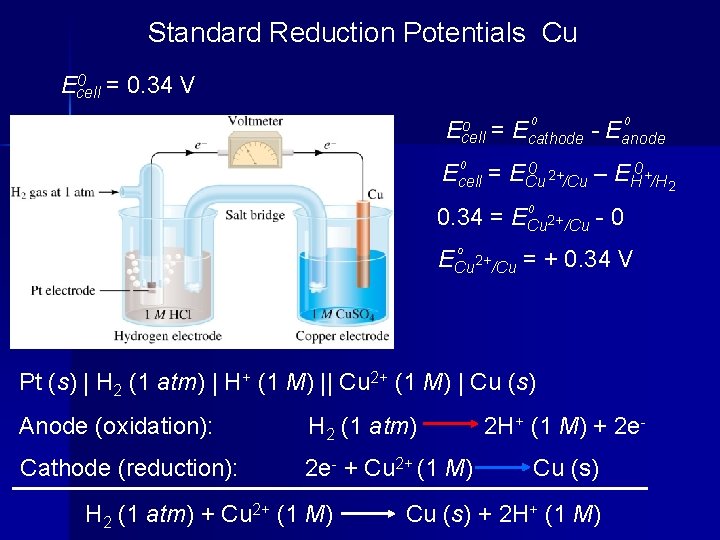
Standard Reduction Potentials Cu 0 = 0. 34 V Ecell 0 0 o = E Ecell cathode - Eanode 0 2+ 0 Ecell = ECu /Cu – EH +/H 2 0 0. 34 = ECu 2+ /Cu - 0 0 o ECu 2+/Cu = + 0. 34 V Pt (s) | H 2 (1 atm) | H+ (1 M) || Cu 2+ (1 M) | Cu (s) Anode (oxidation): H 2 (1 atm) Cathode (reduction): 2 e- + Cu 2+ (1 M) H 2 (1 atm) + Cu 2+ (1 M) 2 H+ (1 M) + 2 e. Cu (s) + 2 H+ (1 M)

Sel Galvani Perbedaan potensial listrik antara katoda dan anoda disebut: • cell voltage (potensial sel) • electromotive force (emf) (gaya gerak listrik • cell potential (potensial sel) Zn (s) + Cu 2+ (aq) Notasi Sel Cu (s) + Zn 2+ (aq) [Cu 2+] = 1 M & [Zn 2+] = 1 M Zn (s) | Zn 2+ (1 M) || Cu 2+ (1 M) | Cu (s) anoda katoda 19. 2

Berapa E sel yang tersusun atas elektroda Cd dalam 1, 0 M Cd(NO 3)2 dan elektroda Cr dalam 1, 0 M Cr(NO 3)3 ? (Data Eo lihat tabel Hal. 57. ) Cd 2+ (aq) + 2 e- Cd (s) E 0 = -0. 40 V Cd is the stronger oxidizer Cr 3+ (aq) + 3 e- Cr (s) Anode (oxidation): E 0 = -0. 74 V Cr 3+ (1 M) + 3 e- x 2 Cr (s) Cathode (reduction): 2 e- + Cd 2+ (1 M) 2 Cr (s) + 3 Cd 2+ (1 M) Cd will oxidize Cr Cd (s) x 3 3 Cd (s) + 2 Cr 3+ (1 M) 0 0 = E 0 Ecell cathode - Eanode 0 = -0. 40 – (-0. 74) Ecell 0 = 0. 34 V Ecell 19. 3

PERSMAAN NERNST Untuk kondisi larutan yang tidak standar (konsentrasi tidak 1 M ) maka Potensial sel ditentukan dengan persamaan Nernst. Esel = Eosel - 0, 0592 log K n EOsel pada keadaan standar (dicari dulu) n = Jumlah elektron yang terlibat dalam reaksi K = Tetapan kesetimbangan

n Soal No. 29 hal 60 Jawab: Esel = Eosel - 0, 0592 n log K n=2 Eosel= Eo. Cu - Eo. Zn Zn = +0, 34 – (-0, 76) Zn 2+ + 2 e Cu 2+ + 2 e = + 1, 10 Volt Esel = + 1, 10 - 0, 0592 2 = +1, 109 volt log 1 M 2 M Cu

n Soal No. 30 hal 60 Jawab: Esel = Eosel - 0, 0592 n Mg+2 log Ag+ n=2 Eosel= Eo. Ag - Eo. Mg = +0, 8 – (-2, 37) Mg Mg 2+ + 2 e 2 Ag+ + 2 e = + 3, 17 Volt Esel = + 3, 17 - 0, 0592 2 = + 3, 2292 volt log 0, 01 1 2 Ag

REAKSI AKAN BERLANGSUNG SPONTAN JIKA MEMILIKI HARGA EOSEL ( + ) REAKSI TIDAK AKAN BERLANGSUNG JIKA MEMILIKI HARGA EOSEL ( - )

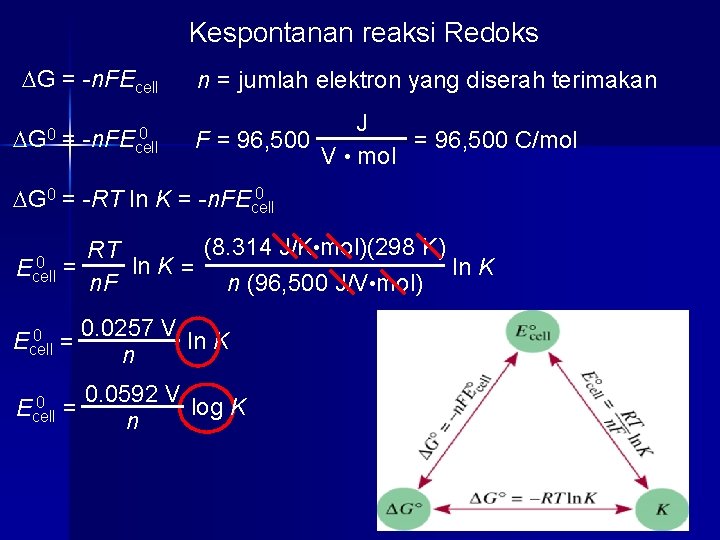
Kespontanan reaksi Redoks DG = -n. FEcell DG 0 = 0 -n. FEcell n = jumlah elektron yang diserah terimakan J F = 96, 500 C/mol V • mol 0 DG 0 = -RT ln K = -n. FEcell (8. 314 J/K • mol)(298 K) RT 0 = ln K Ecell n. F n (96, 500 J/V • mol) 0 Ecell = 0 Ecell 0. 0257 V ln K n 0. 0592 V log K = n

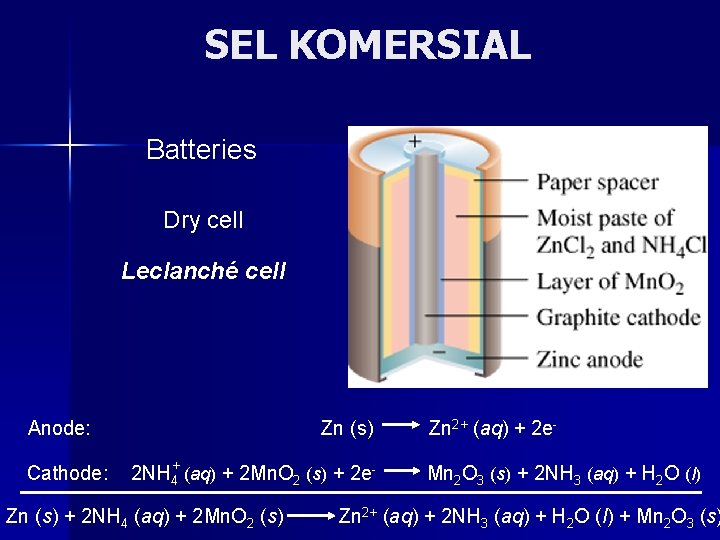
SEL KOMERSIAL Batteries Dry cell Leclanché cell Anode: Cathode: Zn (s) 2 NH 4+ (aq) + 2 Mn. O 2 (s) + 2 e- Zn (s) + 2 NH 4 (aq) + 2 Mn. O 2 (s) Zn 2+ (aq) + 2 e. Mn 2 O 3 (s) + 2 NH 3 (aq) + H 2 O (l) Zn 2+ (aq) + 2 NH 3 (aq) + H 2 O (l) + Mn 2 O 3 (s)

Batteries Mercury Battery Anode: Cathode: Zn(Hg) + 2 OH- (aq) Hg. O (s) + H 2 O (l) + 2 e. Zn(Hg) + Hg. O (s) Zn. O (s) + H 2 O (l) + 2 e. Hg (l) + 2 OH- (aq) Zn. O (s) + Hg (l)

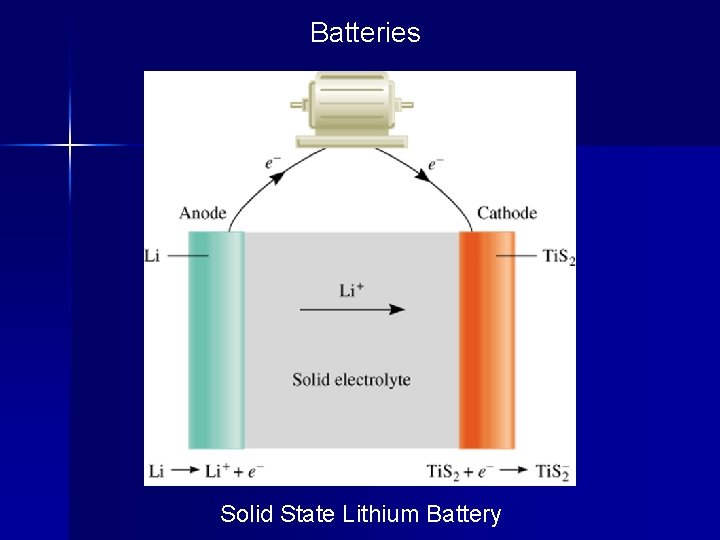
Batteries Solid State Lithium Battery

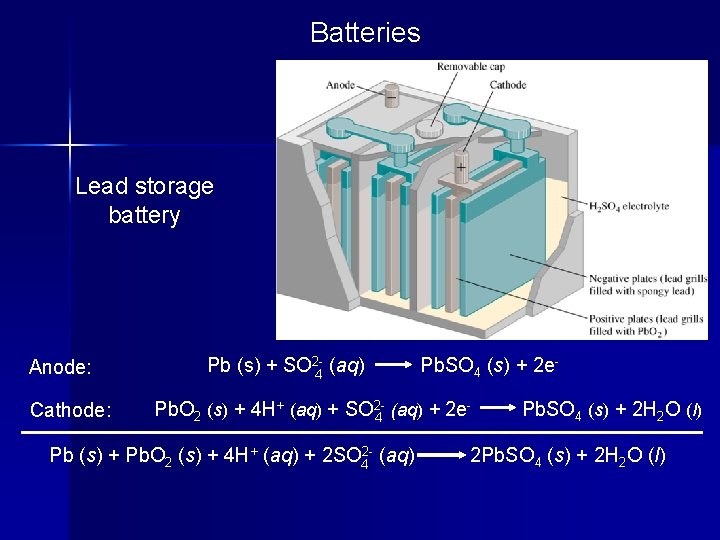
Batteries Lead storage battery Anode: Cathode: Pb (s) + SO 2 -4 (aq) Pb. SO 4 (s) + 2 e- Pb. O 2 (s) + 4 H+ (aq) + SO 24 (aq) + 2 e Pb (s) + Pb. O 2 (s) + 4 H+ (aq) + 2 SO 42 - (aq) Pb. SO 4 (s) + 2 H 2 O (l) 2 Pb. SO 4 (s) + 2 H 2 O (l)

Batteries A fuel cell is an electrochemical cell that requires a continuous supply of reactants to keep functioning Anode: Cathode: 2 H 2 (g) + 4 OH- (aq) O 2 (g) + 2 H 2 O (l) + 4 e 2 H 2 (g) + O 2 (g) 4 H 2 O (l) + 4 e 4 OH- (aq) 2 H 2 O (l)

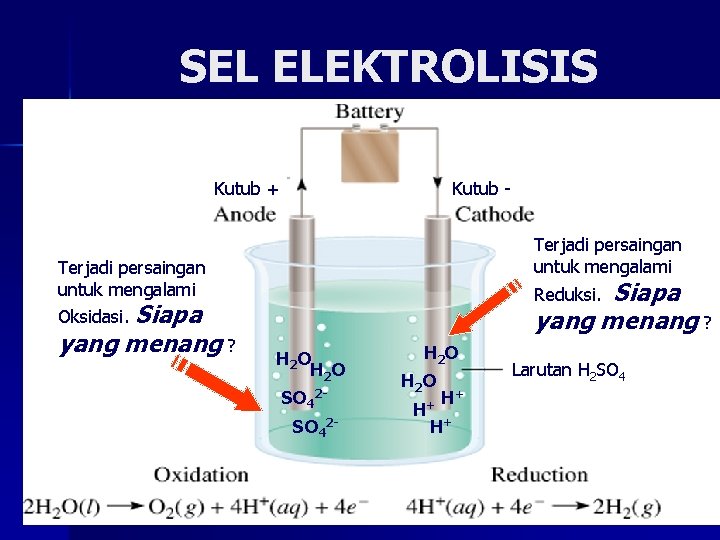
SEL ELEKTROLISIS Kutub + Kutub Terjadi persaingan untuk mengalami Siapa yang menang ? Reduksi. Oksidasi. H 2 O SO 42 - H 2 O H+ H+ H+ Larutan H 2 SO 4

REAKSI PADA ELEKTRODA Reaksi Pada Katoda ( - ) tergantung pada jenis kationnya (ion positif) * ion logam aktif (Gol I A, II A, Al dan Mn ) tidak direduksi yang direduksi air. 2 H 2 O + 2 e H 2 (g) + 2 OH- * Kation lain akan direduksi. Mx+ + x e M

REAKSI PADA ANODA Dipengaruhi oleh jenis anoda yang digunakan dan jenis anionnya. Sisa asam Oksi tidak dioksidasi yang dioksidasi air (SO 42 - NO 3 - ) Inert, C, Pt, Au Anion 2 H 2 O 4 H+ + 2 O 2 + 4 e Sisa asam lain dan OHdioksidasi Anoda 2 X- Anoda tidak inert akan teroksidasi M Mx+ + x e X 2 (g) +2 e

Tuliskan reaksi yang terjadi di katoda dan anoda pada lektrolisis: a. Larutan KCl elektroda grafit. b. Larutan K 2 SO 4 elektroda grafit. c. Larutan Cu(NO 3)2 elektroda Cu d. Lelehan Mg. Cl 2 eletroda platina e. Larutan Na. OH elektroda grafit

Jawab A. Katoda (-) Reduksi 2 H 2 O + 2 e ----- H 2 + 2 OHB. Anoda (+) Anoda 2 Cl- ---- Cl 2 + 2 e B. Katoda (-) Reduksi 2 H 2 O + 2 e ----- H 2 + 2 OHAnoda (+) Anoda 2 H 2 O ---- O 2 + 4 H+ 4 e C. Katoda (-) Reduksi Cu 2+ + 2 e ------- Cu Anoda (+) Anoda Cu ------ Cu+2 + 2 e D. Katoda (-) Reduksi Mg 2+ + 2 e ------- Mg Anoda (+) Anoda 2 Cl- ---- Cl 2 + 2 e

HUKUM FARADAY Hukum Faraday I : Massa zat yang dibebaskan pada elektroda berbanding lurus dengan jumlah listrik ( Q ) yang digunakan. G ≈ Q Q = i. t G = i. t Kuat Arus Hukum Faraday II : Waktu (detik) Massa zat yang dibebaskan pada elektroda berbanding lurus dengan massa ekivalen zat itu. G ≈ ME Ar ME = Biloks k= 1 96500 C G = k. i. t. E G = i. t. E 96500 C

Hubungan kwantitatif jumlah arus, mol e-, p. H dan volum gas F= F= i. t 96500 C Mol e- = C 96500 C Mol e- = F = mol e- i. t 96500 C C 96500 C Dengan konsep Stoikiometri kita dapat mengubah mol e. Mol H+ / OHp. H Mol e- Mol Zat Massa / Volume

Soal: Jika kuat arus sebesar 5 Amper dilewatkan kedalam 1 liter larutan Cu. SO 4 selama 5 menit dengan menggunakan elektroda Pt. Maka tentukanlah : a. Reaksi elektrodanya b. Massa endapan yang terbentuk. Ar Cu 63, 5 c. Volume gas yang terbentuk. Diukur pada suhu 27 o. C tekanan 1 atm. d. p. H larutan setelah elektrolisis. (volume larutan dianggap idak berubah). Kerjakan soal-soal latihan yang ada pada buku ! No 45 s/d 50

Menurut Hukum Faraday II. Massa zat yang dihasilkan dalam elektrolisis berbanding lurus dengan Massa Ekivalen zat. Untuk beberapa sel yang disusun seri berlaku : G 1 : G 2 = E 1 : E 2

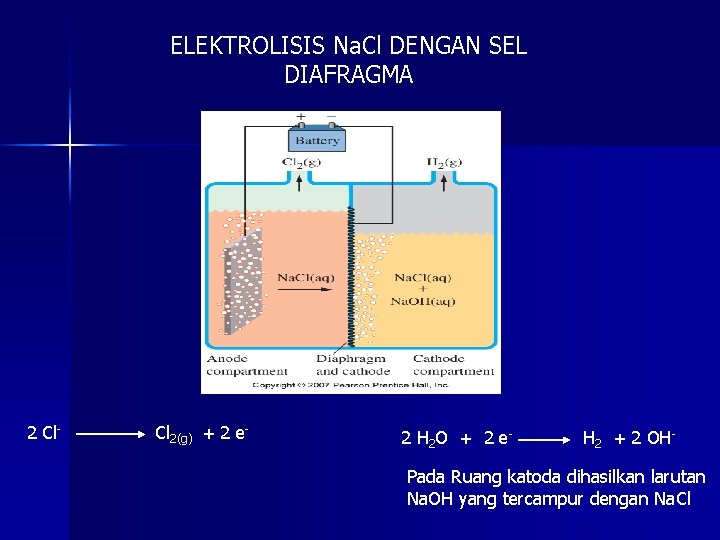
ELEKTROLISIS Na. Cl DENGAN SEL DIAFRAGMA 2 Cl- Cl 2(g) + 2 e- 2 H 2 O + 2 e - H 2 + 2 OH- Pada Ruang katoda dihasilkan larutan Na. OH yang tercampur dengan Na. Cl

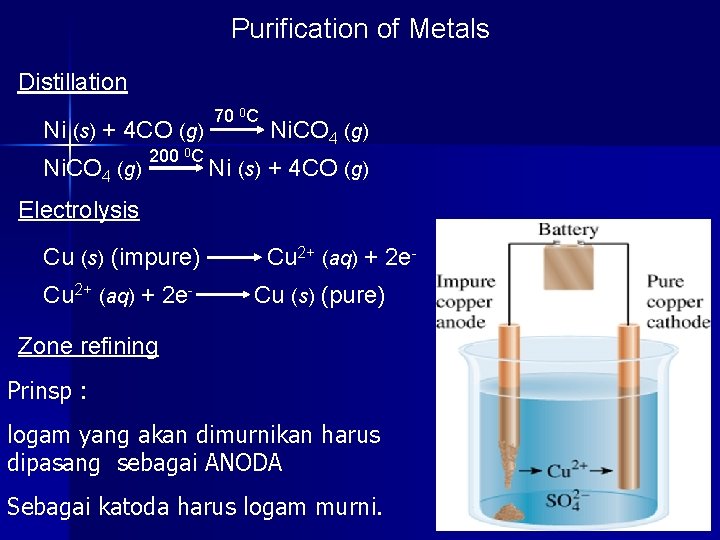
Purification of Metals Distillation Ni (s) + 4 CO (g) Ni. CO 4 (g) 200 0 C 70 0 C Ni. CO 4 (g) Ni (s) + 4 CO (g) Electrolysis Cu (s) (impure) Cu 2+ (aq) + 2 e- Cu 2+ (aq) + 2 e. Cu (s) (pure) Zone refining Prinsp : logam yang akan dimurnikan harus dipasang sebagai ANODA Sebagai katoda harus logam murni. 20. 2

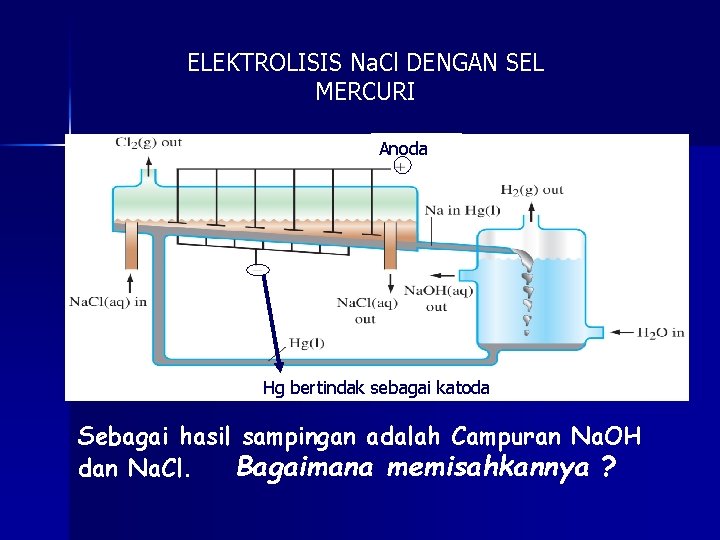
ELEKTROLISIS Na. Cl DENGAN SEL MERCURI Anoda Hg bertindak sebagai katoda Sebagai hasil sampingan adalah Campuran Na. OH dan Na. Cl. Bagaimana memisahkannya ?

Industrial Electrolysis Processes

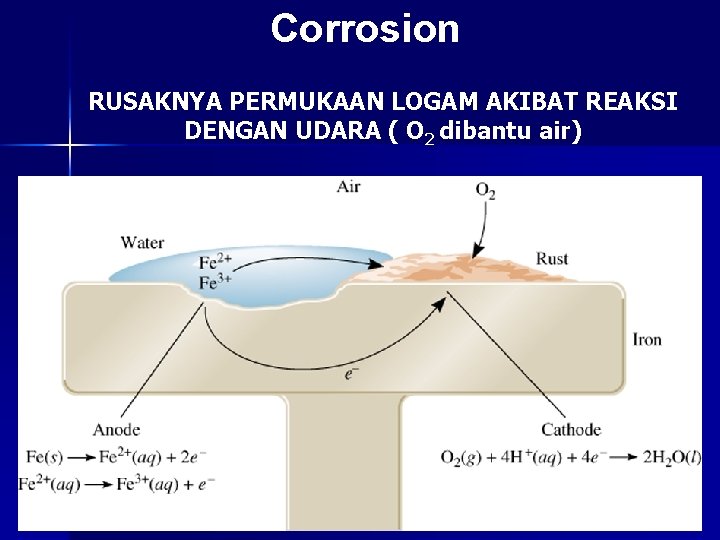
Corrosion RUSAKNYA PERMUKAAN LOGAM AKIBAT REAKSI DENGAN UDARA ( O 2 dibantu air)

PERLINDUNGAN KATODA / PENGORBANAN ANODA Prinsip : Logam yang lebih reaktif (Eo kecil) akan lebih dahulu berkarat. Syarat : Logam yang akan digunakan untuk melindungi harus lebih reaktif

Anoda dikorbankan untuk melindungi Katoda
 Tuliskan persamaan reaksi proses pengkaratan pada besi
Tuliskan persamaan reaksi proses pengkaratan pada besi Contoh reaksi redoks
Contoh reaksi redoks Algoritma yang merupakan gabungan dari beberapa rbm adalah
Algoritma yang merupakan gabungan dari beberapa rbm adalah Sel galvani
Sel galvani Perbedaan prokariotik dan eukariotik
Perbedaan prokariotik dan eukariotik Sel haiwan
Sel haiwan Persamaan nernst
Persamaan nernst Persamaan redoks
Persamaan redoks Materi penyetaraan reaksi redoks kelas 12
Materi penyetaraan reaksi redoks kelas 12 Sebutkan tiga konsep yang menjelaskan reaksi redoks!
Sebutkan tiga konsep yang menjelaskan reaksi redoks! Contoh soal reaksi redoks
Contoh soal reaksi redoks Reaksi redoks
Reaksi redoks Vakuola berukuran besar
Vakuola berukuran besar Organel s
Organel s Ch3-ch3+cl2 →ch3-ch2-cl+hcl
Ch3-ch3+cl2 →ch3-ch2-cl+hcl Gas mulia
Gas mulia Contoh amina dalam kehidupan sehari-hari
Contoh amina dalam kehidupan sehari-hari Macam macam membran kehamilan
Macam macam membran kehamilan Plasmolisis adalah
Plasmolisis adalah Pelarut non air yang dapat bercampur dengan air adalah
Pelarut non air yang dapat bercampur dengan air adalah Reaksi kimia dalam larutan air
Reaksi kimia dalam larutan air Dalam ruangan 5 liter berlangsung reaksi kesetimbangan 2so3
Dalam ruangan 5 liter berlangsung reaksi kesetimbangan 2so3 Laju reaksi
Laju reaksi Redoks potansiyeli nedir
Redoks potansiyeli nedir Contoh titrasi redoks
Contoh titrasi redoks Reakcja redoks
Reakcja redoks Redoks
Redoks Redoks tepkimesi
Redoks tepkimesi Yükseltgenme basamakları
Yükseltgenme basamakları çinko yükseltgenme basamağı
çinko yükseltgenme basamağı Tepkime kendiliğinden gerçekleşiyorsa
Tepkime kendiliğinden gerçekleşiyorsa Bikromatometri
Bikromatometri Atraktilozid
Atraktilozid Reaksi kompleks
Reaksi kompleks Contoh soal kinetika kimia orde 1
Contoh soal kinetika kimia orde 1 Lipopolisakarida terdapat dalam dinding sel . . . *
Lipopolisakarida terdapat dalam dinding sel . . . * Sumber tenaga tidak boleh diperbaharui
Sumber tenaga tidak boleh diperbaharui Protein dalam sel
Protein dalam sel Protein dalam sel
Protein dalam sel Peran khalon dalam pembelahan sel
Peran khalon dalam pembelahan sel Jasad golgi fungsi
Jasad golgi fungsi Plant tissue concept map
Plant tissue concept map Tata letak berorientasi produk
Tata letak berorientasi produk