Reaksi Redoks Spontan Reaksi redoks spontan adalah reaksi























- Slides: 26

Reaksi Redoks Spontan Reaksi redoks spontan adalah reaksi redoks yang berlangsung serta-merta. Contohnya adalah reaksi antara logam zink dengan larutan tembaga(II) sulfat. Sementara itu, reaksi kebalikannya tidak terjadi. Oleh karena itu, dapat dikatakan bahwa kebalikan dari reaksi spontan adalah tidak spontan.

Susunan Sel Volta Logam zink dicelupkan dalam larutan yang mengandung ion Zn 2+ sementara sepotong logam tembaga dicelupkan dalam larutan ion Cu 2+. Logam zink akan larut sambil melepas dua elektron. Elektron yang dibebaskan tidak memasuki larutan tetapi tertinggal pada logam zink itu. Elektron tersebut selanjutnya akan mengalir ke logam tembaga melalui kawat penghantar. Ion Cu 2+ akan mengambil elektron dari logam tembaga kemudian mengendap.

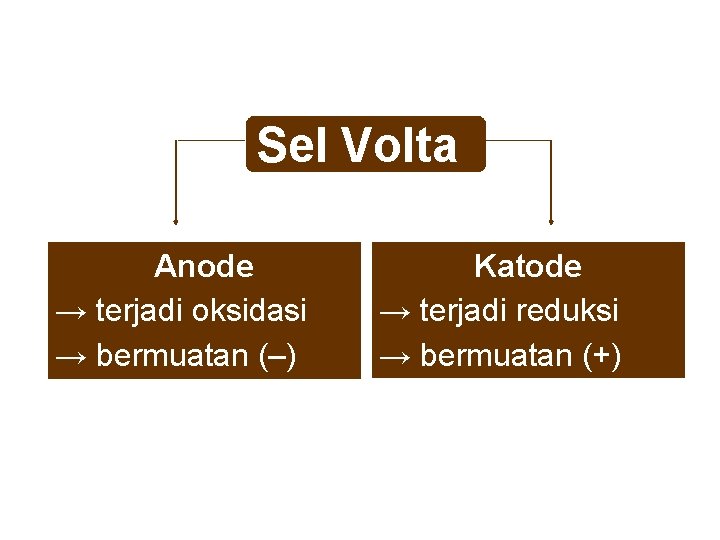
Sel Volta Anode → terjadi oksidasi → bermuatan (–) Katode → terjadi reduksi → bermuatan (+)

Notasi Sel Volta Susunan suatu sel volta dinyatakan dengan suatu notasi singkat yang disebut diagram sel. a. Anode biasanya digambarkan di sebelah kiri, sedangkan katode di sebelah kananpada anode terjadi oksidasi Zn menjadi Zn 2+. b. Di katode terjadi reduksi ion Cu 2+ menjadi Cu. c. Dua garis sejajar (||) yang memisahkan anode dan katode menyatakan jembatan garam, sedangkan garis tunggal menyatakan batas antarfase

Potensial Elektrode Standar (E⁰) Potensial sel yang dihasilkan oleh suatu elektrode (M) dengan elektrode hidrogen disebut potensial elektrode itu dan dinyatakan dengan lambang E. Apabila pengukuran dilakukan pada kondisi standar, yaitu pada suhu 25°C dengan konsentrasi ion-ion 1 M dan tekanan gas 1 atm, disebut potensial elektrode standar dan diberi lambang E°.

q Elektrode yang lebih mudah mengalami reduksi dibandingkan terhadap elektrode hidrogen mempunyai potensial elektrode bertanda positif (diberi tanda positif), sedangkan elektrode yang lebih sukar mengalami reduksi diberi tanda negatif. q Potensial elektrode sama dengan potensial reduksi. q Adapun potensial oksidasi sama nilainya dengan potensial reduksi, tetapi tandanya berlawanan.

Potensial Sel Katode adalah elektrode yang mempunyai harga E° lebih besar (lebih positif), sedangkan anode adalah yang mempunyai E° lebih kecil (lebih negatif).

Contoh Tentukanlah E°sel yang disusun dari kedua elektrode itu. Jawab: Potensial sel adalah selisih potensial katode dengan anode. Katode merupakan elektrode yang potensial reduksinya lebih positif, dalam hal ini yaitu perak. E°sel = E°(katode) – E°(anode) E°sel = +0, 80 V – (– 2, 37 V) = +3, 17 volt

Potensial Reaksi Redoks

Deret Keaktifan Logam (Deret Volta) Susunan unsur-unsur logam berdasarkan potensial elektrode standarnya disebut deret elektrokimia atau deret volta. Semakin kiri kedudukan suatu logam dalam deret volta, Ø logam semakin reaktif (semakin mudah melepas elektron), Ø logam merupakan reduktor yang semakin kuat. Sebaliknya, semakin kanan kedudukan logam dalam deret volta, Ø logam semakin kurang reaktif (semakin sukar melepas elektron), Ø kationnya merupakan oksidator yang semakin kuat.

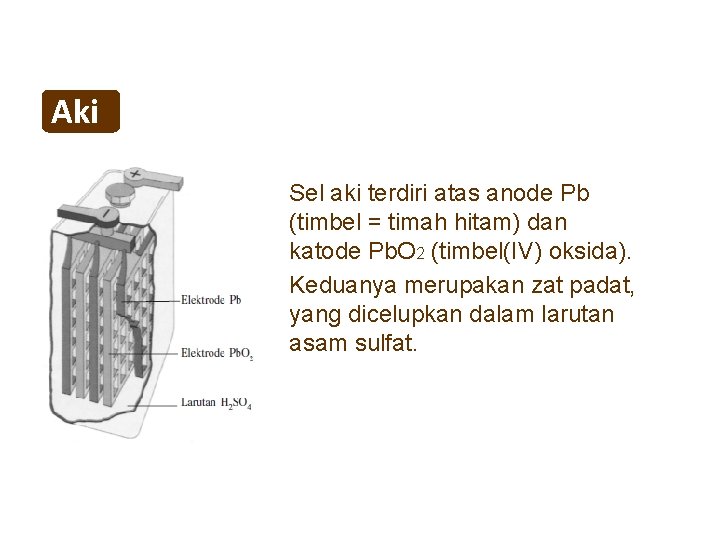
Aki Sel aki terdiri atas anode Pb (timbel = timah hitam) dan katode Pb. O 2 (timbel(IV) oksida). Keduanya merupakan zat padat, yang dicelupkan dalam larutan asam sulfat.


Baterai Kering (Sel Leclanche)

Baterai Alkalin

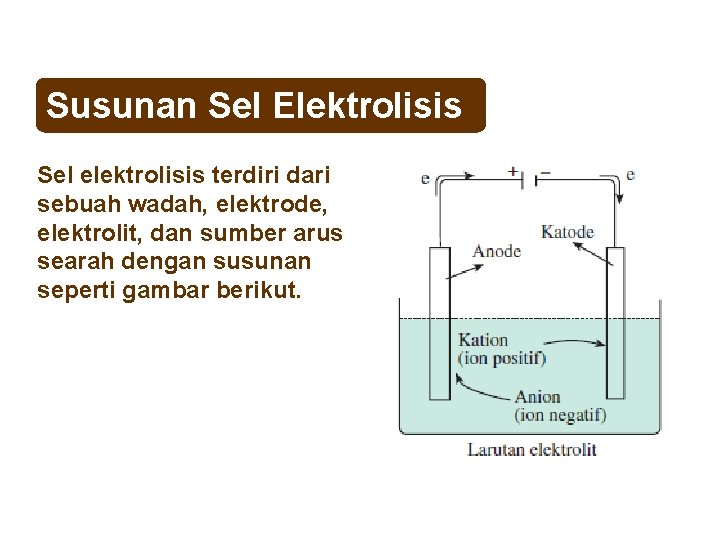
Susunan Sel Elektrolisis Sel elektrolisis terdiri dari sebuah wadah, elektrode, elektrolit, dan sumber arus searah dengan susunan seperti gambar berikut.

Reaksi-reaksi Elektrolisis Reaksi elektrolisis terdiri dari reaksi katode, yaitu reduksi, dan reaksi anode, yaitu oksidasi. a. Spesi yang mengalami reduksi di katode adalah spesi yang potensial reduksinya paling besar. b. Spesi yang mengalami oksidasi di anode adalah spesi yang potensial oksidasinya paling besar.

Reaksi-reaksi di Katode (Reduksi) Reaksi di katode bergantung pada jenis kation dalam larutan. Jika kation berasal dari logam-logam aktif (logam golongan IA, IIA, Al atau Mn), yaitu logam yang potensial standar reduksinya lebih kecil (lebih negatif daripada air), maka air yang tereduksi. Sebaliknya, kation selain yang disebutkan di atas akan tereduksi.

Reaksi-reaksi di Anode (Oksidasi) Jika anode tidak terbuat dari Pt, Au atau grafit, maka anode itu akan teroksidasi. Elektrode Pt, Au, dan grafit (C) digolongkan sebagai elektrode inert (sukar bereaksi). Jika anode terbuat dari elektrode inert, maka reaksi anode bergantung pada jenis anion dalam larutan. Anion sisa asam oksi seperti SO 42– , NO 2– , PO 42– , dan F– , mempunyai potensial oksidasi lebih negatif daripada air. Anion-anion seperti itu sukar dioksidasi sehingga air yang teroksidasi. Jika anion lebih mudah dioksidasi daripada air, seperti Br – , dan I– , maka anion itu yang teroksidasi.

Hukum-hukum Faraday Hukum Faraday 1 “Massa zat yang dibebaskan pada elektrolisis (G) berbanding lurus dengan jumlah listrik yang digunakan (Q)”. G ≈Q Jumlah muatan listrik (Q) sama dengan hasil kali dari kuat arus (i) dengan waktu (t). Q = i × t (coulomb) Jadi, G ≈ i t

Hukum Faraday 2 "Massa zat yang dibebaskan pada elektrolisis (G) berbanding lurus dengan massa ekivalen zat itu (ME)". G ≈ ME Penggabungan hukum Faraday I dan II menghasilkan persamaan sebagai berikut. G = k × i × t × ME. . (2. 5) (k = tetapan/pembanding)

Faraday menemukan harga k = 1 96. 500 Jadi, G = k × i × t × ME dapat dinyatakan sebagai berikut. dengan, G = massa zat yang dibebaskan (dalam gram) i = kuat arus (dalam ampere) t = waktu (dalam detik) ME = massa ekivalen Massa ekivalen dari unsur-unsur logam sama dengan massa atom relatif (Ar) dibagi dengan bilangan oksidasinya (biloks).

Stoikiometri Reaksi Elektrolisis Stoikiometri reaksi elektrolisis didasarkan pada anggapan bahwa arus listrik adalah aliran elektron. Muatan listrik dari 1 mol elektron adalah 96. 500 coulomb. Jumlah muatan dari 1 mol elektron ini sama dengan tetapan Faraday (1 F). 1 F ≡ 1 mol elektron ≡ 96. 500 coulomb Hubungan kuat arus dan waktu dengan jumlah mol elektron:

Penggunaan Elektrolisis dalam Industri Dapat disebutkan tiga bidang industri yang menggunakan elektrolisis, yaitu produksi zat, pemurnian logam, dan penyepuhan. a. Produksi Zat Banyak zat kimia dibuat melalui elektrolisis, misalnya logam-logam alkali, magnesium, aluminium, fluorin, klorin, natrium hidroksida, natrium hipoklorit, dan hidrogen peroksida. b. Pemurnian Logam Contoh terpenting dalam bidang ini adalah pemurnian tembaga. c. Penyepuhan (electroplating) dimaksudkan untuk melindungi logam terhadap korosi atau untuk memperbaiki penampilan.

Korosi adalah reaksi redoks antara suatu logam dengan berbagai zat di lingkungannya yang menghasilkan senyawa-senyawa yang tak dikehendaki. a. Pada peristiwa korosi, logam mengalami oksidasi, sedangkan oksigen (udara) mengalami reduksi. b. Korosi merupakan proses elektrokimia. Pada korosi besi, bagian tertentu dari besi itu berlaku sebagai anode, di mana besi mengalami oksidasi. c. Elektron yang dibebaskan di anode mengalir ke bagian lain dari besi itu yang berlaku sebagai katode, di mana oksigen tereduksi. atau

Cara-cara Mencegah Korosi Besi 1) Mengecat Jembatan, pagar dan railing biasanya dicat. Cat menghindarkan kontak besi dengan udara dan air. 2) Melumuri dengan oli atau gemuk Cara ini diterapkan untuk berbagai perkakas dan mesin. Oli dan gemuk mencegah kontak besi dengan air. 3) Dibalut dengan plastik Berbagai macam barang, misalnya rak piring dan keranjang sepeda dibalut dengan plastik. Plastik mencegah kontak besi dengan udara dan air.

4) Tin plating (pelapisan dengan timah) Kaleng-kaleng kemasan terbuat dari besi yang dilapisi dengan timah. Pelapisan dilakukan secara elektrolisis, yang disebut electroplating. 5) Galvanisasi (pelapisan dengan zink) Pipa besi, tiang telpon, badan mobil, dan berbagai barang lain dilapisi dengan zink. 6) Cromium plating (pelapisan dengan kromium) 7) Sacrificial protection (pengorbanan anode)