PENYETARAAN REAKSI REDOKS Kelas XII MIPA Semester Ganjil
























- Slides: 25

PENYETARAAN REAKSI REDOKS Kelas : XII MIPA Semester : Ganjil Imam Wahyudi, S. Pd SMA Negeri 1 Purwodadi 1

Kompetensi Dasar Menyetarakan persamaan kimia reaksi redoks dan memperkirakan reaksi yang dapat terjadi berdasarkan potensial elektroda 2

Indikator Pencapaian Kompetensi : 1. Menjelaskan persamaan reaksi kimia 2. Menjelaskan pengertian reaksi redoks 3. Menyebutkan pengertian reaksi reduksi 4. Menyebutkan pengertian reaksi oksidasi 5. Menuliskan reaksi reduksi 6. Menuliskan reaksi oksidasi 7. Menyebutkan aturan bilangan oksidasi 8. Menyebutkan cara penyetaraan reaksi redoks 9. Menyelesaikan penyetaraan reaksi redoks dengan cara setengah reaksi dan cara bilangan oksidasi 10. Menyelesaikan penyetaraan reaksi redoks dalam suasana asam dan suasana basa 3

Oksidasi Bilangan oksidasi Reduksi 4

PENGERTIAN REAKSI REDOKS • Reaksi kimia dimana terjadi perubahan bilangan oksidasi (Pengertian lebih luas) • Reaksi kimia dimana terjadi transfer elektron • Reaksi kimia dimana terjadi pengikatan dan pelepasan oksigen (pengertian lama) 5

Bilangan oksidasi adalah muatan suatu atom / unsur dalam suatu molekul / senyawa yang ditentukan karena perbedaan harga elektronegatifitas. 6

Penentuan Bilangan Oksidasi 1. Bilangan oksidasi setiap atom dlm unsur bebas adalah nol. Misalnya unsur Cl = 0, B = 0 2. Bilangan oksidasi ion suatu atom sama dengan muatan ion tersebut. a. Na+ biloks Na adalah +1 b. Fe 3+ biloks Fe adalah +3 3. Pada suatu senyawa atau ion, umumnya biloks atom untuk : a. Golongan IA adalah +1 b. Golongan VIIA adalah -1 4. Bilangan oksidasi H dalam senyawa adalah +1, kecuali pada senyawa hidrida ( Na. H, Li. H, Ca. H 2 ) bilangan oksidasi H = -1. 7

5. Bilangan oksidasi O dlm senyawa adalah -2, kecuali pada senyawa peroksidaseperti H 2 O 2 bilangan oksidasi O adalah -1. Dan pd senyawa superoksida seperti KO 2, Rb. O 2 biloks O adalah -½. Sementara untuk senyawa OF 2 biloks O adalah +2. 6. Jumlah total biloks atom dlm suatu senyawa adalah nol. Dan jumlah total biloks untuk senyawa bermuatan adalah besarnya sama dengan muatannya. a. H 2 SO 4 total biloks sama dengan nol b. CO 32 - total biloks sama dengan -2 8

LATIHAN SOAL Tentukan bilangan oksidasi dari unsur – unsur berikut : 1. S dalam senyawa HSO 42. Mn dalam senyawa KMn. O 4 3. Cr dalam senyawa Cr 2 O 72 - 9

PEMBAHASAN 1. S dalam senyawa HSO 4 BO H + BO S + 4. BO O = -1 1 + BO S + 4. ( -2 ) = -1 BO S – 7 = -1 BO S = +6 2. Mn dalam senyawa KMn. O 4 BO K + BO Mn + 4. BO O = 0 1 + BO Mn + 4. ( -2 ) = 0 BO Mn – 7 = 0 BO Mn = +7 10

PEMBAHASAN 3. Cr dalam senyawa Cr 2 O 722. BO Cr + 7. BO O = -2 2. BO Cr + 7. ( -2 ) = -2 2. BO Cr – 14 = -2 2. BO Cr = +12 Cr = +6 11

REAKSI PARO Reaksi redoks dpt dikatakan sbg reaksi gabungan antara 2 reaksi paro yaitu reaksi reduksi dan oksidasi Reaksi oksidasi dpt mempunyai 3 pengertian : a. Reaksi yg menyebabkan terjadinya kenaikan biloks. Misalnya : K K+ + e 0 +1 b. Reaksi pengikatan oksigen. Misalnya : C + O 2 CO 2 0 + +4 12

REAKSI PARO c. Reaksi pelepasan hidrogen. Misalnya : CH 4 C + 2 H 2 -4 0 13

Reaksi reduksi dpt mempunyai 3 pengertian : a. Reaksi yg menyebabkan terjadinya penurunan biloks. Misalnya : K+ K + e +1 0 b. Reaksi pelepasan oksigen. Misalnya : CO 2 C + O 2 +4 0 c. Reaksi pengikatan hidrogen. Misalnya : C + 2 H 2 CH 4 0 -4 14

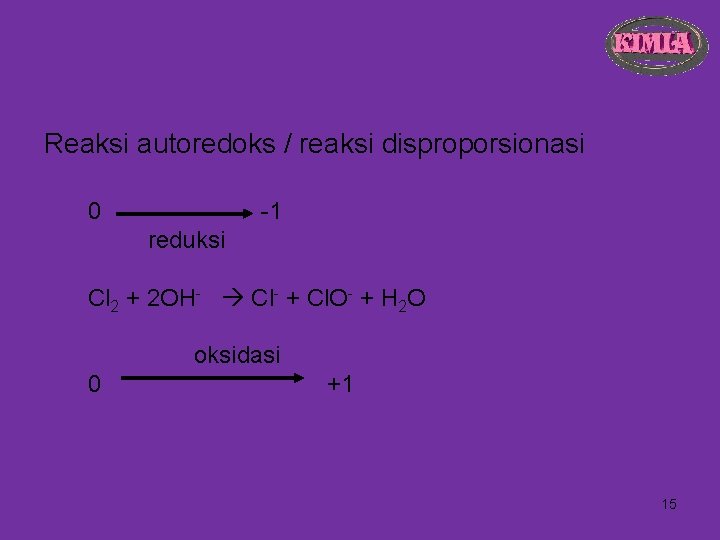
Reaksi autoredoks / reaksi disproporsionasi 0 -1 reduksi Cl 2 + 2 OH- Cl- + Cl. O- + H 2 O oksidasi 0 +1 15

Penyetaraan Reaksi redoks Ada 2 metode untuk menyetarakan suatu reaksi redoks, yaitu metode setengah reaksi dan metode bilangan oksidasi Adapun pedoman penyetaraan reaksi redoks sebagai berikut : a. Dlm suasana asam => Pihak yg kurang O ditambah H 2 O sebanyak kekurangannya, kemudian pihak yg lain ditambah H+ sehingga jumlah atom – atom sebelah kiri dan kanan tanda reaksi adalah sama b. Dlm suasana basa => Pihak yg kelebihan O ditambah H 2 O sebanyak kelebihannya, kemudian pihak yg lain ditambah OH- sehingga jumlah atom – atom sebelah kiri dan kanan tanda reaksi adalah sama 16

1. Metode ½ reaksi atau metode ion elektron Langkah – langkah penyetaraan reaksi model ½ reaksi a. Cara reaksi paro oksidasi dan reaksi paro reduksi. Reaksi akan lebih mudah jika kita tulis dlm bentuk ion yg mengalami perubahan bilangan oksidasi saja. b. Setarakan O maupun H menggunakan prinsip diatas, baik dlm suasana asam maupun basa c. Samakan muatan dg menambahkan elektron masing – masing setengah reaksi redoks d. Samakan jumlah elektron di sebelah kiri dan kanan tanda reaksi ( jml elektron merupakan kelipatan terkecil dari elektron di kiri dan kanan tanda reaksi Example : Setarakan persamaan reaksi dibawah ini dgn menggunakan metode ½ reaksi Sn + HNO 3 Sn. O 2 + NO 2 + H 2 O ( suasaa asam ) 17

Penyelesaian Pisahkan reaksi paro oksidasi dan reduksi Oksidasi : Sn Sn. O 2 ( kiri kurang 2 O ) Reduksi : NO 3 - NO 2 ( kanan kurang 1 O ) a. Setarakan jumlah O dan H Oksidasi : Sn + 2 H 2 O Sn. O 2 + 4 H+ Reduksi : NO 3 - + 2 H+ NO 2 + H 2 O b. Setarakan muatan dgn menambahkan elektron Oksidasi : Sn + 2 H 2 O Sn. O 2 + 4 H+ + 4 e Reduksi : 1 e + NO 3 - + 2 H+ NO 2 + H 2 O c. Samakan jumlah elektron di kiri dan kanan Oksidasi : Sn + 2 H 2 O Sn. O 2 + 4 H+ + 4 e ( kali 1 ) Reduksi : 1 e + NO 3 - + 2 H+ NO 2 + H 2 O ( kali 4 ) Hasil yg diperoleh : Oksidasi : Sn + 2 H 2 O Sn. O 2 + 4 H+ + 4 e Reduksi : 4 e + 4 NO 3 - + 8 H+ 4 NO 2 + 4 H 2 O Redoks : Sn + 4 NO 3 - + 4 H+ Sn. O 2 + 4 NO 2 + 2 H 2 O Atau : Sn + 4 HNO 3 Sn. O 2 + 4 NO 2 + 2 H 2 O 18

LATIHAN SOAL Setarakan persamaan reaksi berikut : 1. Fe 2+ + Mn. O 4 - Fe 3+ + Mn 2+ ( suasana asam ) 2. Al + NO 3 - Al. O 2 - + NH 3 ( suasana basa ) 3. HNO 3 + H 2 S NO + S + H 2 O ( suasana asam ) 19

PEMBAHASAN 1. Oksidasi : Fe 2+ Fe 3+ Reduksi : Mn. O 4 - Mn 2+ Penyetaraan jumlah atom dan jumlah muatan Mn. O 4 - + 8 H+ + 5 e Mn 2+ + 4 H 2 O Fe 2+ Fe 3+ + e X 1 X 5 5 Fe 2+ + Mn. O 4 - + 8 H+ 5 Fe 3+ + Mn 2+ + 4 H 2 O 20

2. Oksidasi : Al Al. O 2 Reduksi : NO 3 - NH 3 Penyetaraan jumlah atom dan jumlah muatan Al + 4 OH Al. O 2 - + 2 H 2 O + 3 e NO 3 - + 4 H 2 O + 8 e NH 3 + 5 OHAl + 4 OH Al. O 2 - + 2 H 2 O + 3 e NO 3 - + 6 H 2 O + 8 e NH 3 + 9 OH- X 8 X 3 8 Al + 3 NO 3 - + 4 H 2 O 8 Al. O 2 - + 3 NH 3 + 5 OH- 21

3. Oksidasi : H 2 S S Reduksi : HNO 3 NO Penyetaraan jumlah atom dan jumlah muatan HNO 3 + 3 H+ + 3 e NO + 2 H 2 O H 2 S S + 2 H+ + 2 e X 2 X 3 2 HNO 3 + 3 H 2 S 2 NO + 3 S + 4 H 2 O 22

2. Metode bilangan oksidasi Dalam metode bilangan oksidasi ini didasari atas jumlah elektron yang terlibat. Oleh sebab itu untuk menyetarakan reaksi ini jumlah elektron yang berada di kiri maupun dikanan tanda reaksi harus sama, maka untuk penyelesaiannya dilakukan dengan cara menyilangkan. Dimana perubahan bilangan oksidasi pada reaksi oksidasi digunakan sebagai koefisien pada reaktan yang mengalami reaksi reduksi dan sebaliknya. Contoh : Sn + HNO 3 Sn. O 2 + NO 2 + H 2 O 23

Pembahasan Sn + HNO 3 Sn. O 2 + NO 2 + H 2 O 0 +5 +4 +4 1 Sn + 4 HNO 3 1 Sn. O 2 + 4 NO 2 Karena dlm suasana asam maka yang kekurangan O harus ditambah dengan H 2 O Sehingga hasil akhir reaksi redoksnya adalah : Sn + 4 HNO 3 Sn. O 2 + 4 NO 2 + 2 H 2 O 24

TUGAS Setarakanlah reaksi redoks dibawah ini : 1. Fe 3+ + Sn 2+ Fe 2+ + Sn 4+ 2. Ag + HNO 3 Ag. NO 3 + NO 2 + H 2 O 25
 Penyetaraan reaksi redoks kelas 12
Penyetaraan reaksi redoks kelas 12 Persamaan redoks
Persamaan redoks Cara membedakan reaksi redoks dan bukan redoks
Cara membedakan reaksi redoks dan bukan redoks Reaksi redoks pada daur ulang perak
Reaksi redoks pada daur ulang perak Modul agama katolik kelas 12
Modul agama katolik kelas 12 Materi kelas xii semester 1
Materi kelas xii semester 1 Materi korosi kimia kelas 12
Materi korosi kimia kelas 12 Oksidator adalah
Oksidator adalah Contoh soal reaksi redoks
Contoh soal reaksi redoks Dalam proses perkaratan besi, besi bertindak sebagai … *
Dalam proses perkaratan besi, besi bertindak sebagai … * Notasi sel volta
Notasi sel volta Vlaovi
Vlaovi Integral substitusi
Integral substitusi Penyetaraan ankapin 2 ke ant 4
Penyetaraan ankapin 2 ke ant 4 Contoh amina dalam kehidupan sehari-hari
Contoh amina dalam kehidupan sehari-hari Reaksi reaksi gas mulia
Reaksi reaksi gas mulia Reaksi ch3 ch2 ch2 ch2 + hcl disebut reaksi
Reaksi ch3 ch2 ch2 ch2 + hcl disebut reaksi Materi ips kelas 7 semester 2 kegiatan ekonomi
Materi ips kelas 7 semester 2 kegiatan ekonomi Materi atletik sd
Materi atletik sd Materi fiqih kelas xi semester 2
Materi fiqih kelas xi semester 2 Materi segitiga smp kelas 7 semester 2
Materi segitiga smp kelas 7 semester 2 Kkm prakarya kelas 9 semester 1 dan 2
Kkm prakarya kelas 9 semester 1 dan 2 Aktivitas 1 prakarya kelas 11 semester 1
Aktivitas 1 prakarya kelas 11 semester 1 Peta konsep aritmatika sosial beserta penjelasannya
Peta konsep aritmatika sosial beserta penjelasannya Peta konsep sosiologi kelas 11
Peta konsep sosiologi kelas 11 Pitutur tembang gambuh pada 2
Pitutur tembang gambuh pada 2