ION DAN SENYAWA KOMPLEK Pengertian Ion Kompleks adalah









- Slides: 11

ION DAN SENYAWA KOMPLEK

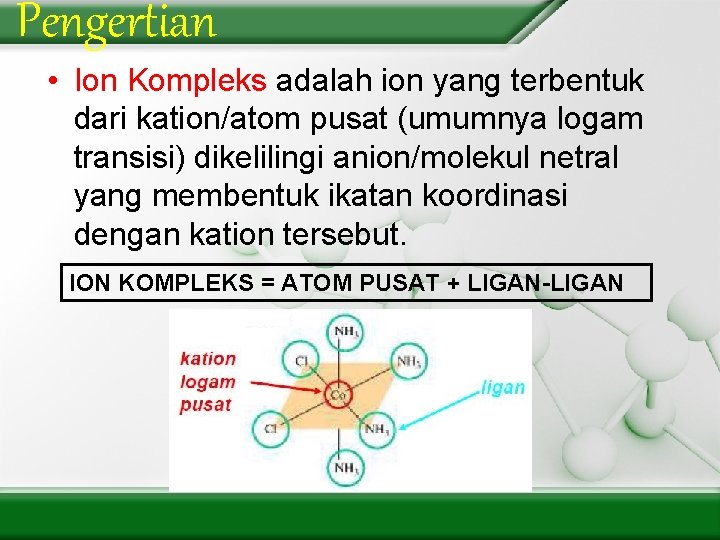
Pengertian • Ion Kompleks adalah ion yang terbentuk dari kation/atom pusat (umumnya logam transisi) dikelilingi anion/molekul netral yang membentuk ikatan koordinasi dengan kation tersebut. ION KOMPLEKS = ATOM PUSAT + LIGAN-LIGAN

• Jenis ikatan yang terjadi pada ion kompleks adalah ikatan kovalen koordinasi – Ligan : donor pasangan elektron – Ion pusat : aseptor pasangan elektron Jenis ligan : - Unidentat - Bidentat - Polidentat

CONTOH 1. Atom pusat Ag+ dan dua buah ligan NH 3 Muatan ion kompleks = 1+2(0)=+1 Rumus ion kompleks = [Ag(NH 3)2]+ 2. Atom pusat Cr 3+ dan empat buah ligan NH 3 Serta dua buah ligan Cl. Muatan ion kompleks = 3+4(0)+2(-1)=+1 Rumus ion kompleks = [Cr(NH 3)4 Cl 2]+

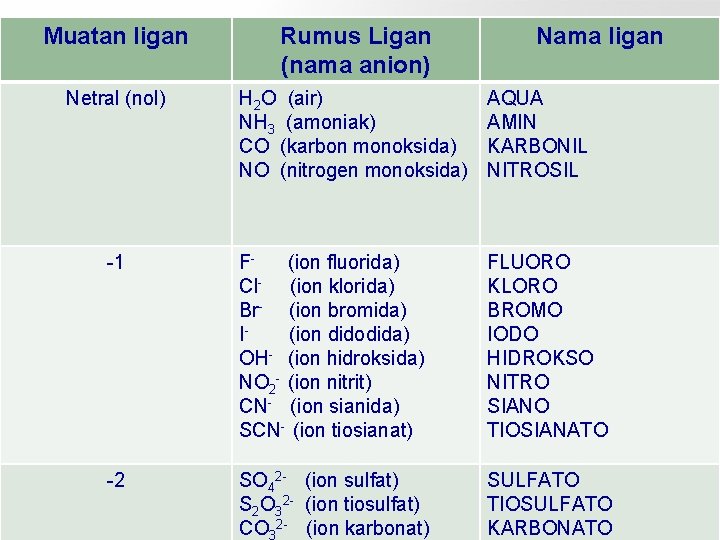
Muatan ligan Rumus Ligan (nama anion) Nama ligan Netral (nol) H 2 O (air) NH 3 (amoniak) CO (karbon monoksida) NO (nitrogen monoksida) AQUA AMIN KARBONIL NITROSIL -1 F(ion fluorida) Cl- (ion klorida) Br- (ion bromida) I(ion didodida) OH- (ion hidroksida) NO 2 - (ion nitrit) CN- (ion sianida) SCN- (ion tiosianat) FLUORO KLORO BROMO IODO HIDROKSO NITRO SIANO TIOSIANATO -2 SO 42 - (ion sulfat) S 2 O 32 - (ion tiosulfat) CO 32 - (ion karbonat) SULFATO TIOSULFATO KARBONATO

Senyawa kompleks (ada 3 macam) • Kation + ion kompleks negatif • Contoh : – K 2[Zn(CN)4] : kalium tetrasiano zinkat(II) • Ion kompleks positif + anion • Contoh : – [Zn(H 2 O)4]Cl 2 : tetraakua zink(II) klorida • Ion kompleks positif + ion kompleks negatif • Contoh : – [Zn(H 2 O)4][Ag(CN)2]2 : tetraakua zink(II) disiano argentat(I)

Bilangan koordinasi • Adalah Jumlah Ligan yang terikat pada atom pusat. Contoh: • a. ) [Ag(NH 3)2]+ : bilangan koordinasi Ag+ adalah 2. • b. ) [Cu(NH 3)4]2+ : bilangan koordinasi Cu 2+ adalah 4. • c. ) [Fe(CN)6]3 - : bilangan koordinasi Fe 3+ adalah 6. Cara mencari bilangan koordinasi dan bilangan Oksidasi atom pusat : [Cu(NH 3)2(CN)2]- : Ligannya adalah dua molekul NH 3 dan Dua buah ion CNBilangan koordinasi Cu=2+2=4 Bilangan oksidasi Cu (muatan atom pusat)=X Muatan atom pusat Cu =X Muatan total 2 buah NH 3 =0 Muatan total 2 buah CN=-2 + Muatan ion kompleks =-1 Jadi, harga X=+1

Aturan tata nama �Urutan penamaan : Jumlah ligan – nama ion pusat �Jumlah ligan : Menggunakan awalan jumlah mono, di, tri, tetra, penta, heksa �Nama ligan : �Ligan anion berakhiran o (atau a) �Ligan molekul netral sesuai ketentuan penamaan �Nama ion pusat : Disertai biloksnya berupa angka romawi dalam kurung �Ion kompleks positif : nama logam dalam bahasa Indonesia �Ion kompleks negatif : nama logam dalam bahasa Latin diberi akhiran at


Geometri Ion Kompleks

 Apa itu senyawa kompleks
Apa itu senyawa kompleks Pengertian senyawa kompleks
Pengertian senyawa kompleks Rantai karbon terbuka
Rantai karbon terbuka Pengertian unsur senyawa dan campuran
Pengertian unsur senyawa dan campuran Kompleks birikmalarning ahamiyati
Kompleks birikmalarning ahamiyati Pengurangan bilangan kompleks
Pengurangan bilangan kompleks Teks prosedur adalah
Teks prosedur adalah Kd teks eksplanasi kelas 11
Kd teks eksplanasi kelas 11 Pengertian teks prosedur kompleks
Pengertian teks prosedur kompleks Struktur hidrokarbon karbosiklik
Struktur hidrokarbon karbosiklik Ejemplo de fuerza ion ion
Ejemplo de fuerza ion ion Ion dipolo
Ion dipolo