IKATAN IONIS IKATAN IONIK IKATAN ELEKTROVALEN Ikatan yang














- Slides: 18


(IKATAN IONIS/ IKATAN IONIK/ IKATAN ELEKTROVALEN) Ikatan yang terjadi karena adanya serah terima elektron Senyawanya → Senyawa ion/ senyawa ionik/ senyawa ionis/ senyawa elektrovalen Kadang-kadang disebut juga senyawa polar INGAT!!! Senyawa ionik pasti polar… Senyawa polar belum tentu ionik…. .

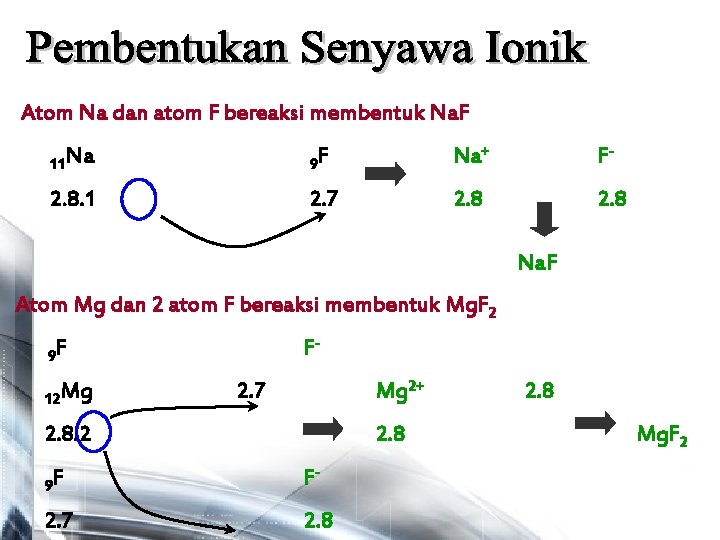
Atom Na dan atom F bereaksi membentuk Na. F 11 Na 9 F Na+ F- 2. 8. 1 2. 7 2. 8 Na. F Atom Mg dan 2 atom F bereaksi membentuk Mg. F 2 F- 9 F 12 Mg Mg 2+ 2. 7 2. 8. 2 2. 8 9 F F- 2. 7 2. 8 Mg. F 2

Pembentukan senyawa ionik → ditentukan oleh energi ionisasi dan afinitas elektron dari atom-atom penyusunnya Energi Ionisasi : energi yang diperlukan untuk melepaskan elektron M(g) + EI → M+(g) + e. Afinitas Elektron : Energi yang dilepaskan ketika sebuah atom netral menerima elektron A(g) + e- → A-(g) + AE Senyawa ionik makin mudah terbentuk → EI <<, AE>>

Kristal terdiri atas kation 2 dan anion 2 yang tersusun teratur Pola yang teratur & berulang menghasilkan kisi Energi kisi : energi yang dibebaskan ketika sejumlah mol kation dan sejumlah mol anion didekatkan dari jarak terhingga sampai ke kedudukan setimbang dalam suatu kisi kristal 1 mol senyawa ionik pada 0 K

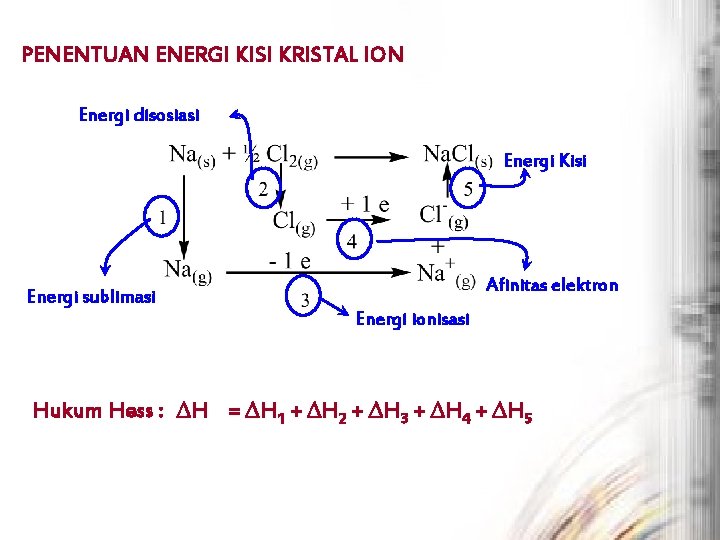
PENENTUAN ENERGI KISI KRISTAL ION Energi disosiasi Energi Kisi Afinitas elektron Energi sublimasi Energi ionisasi Hukum Hess : H = H 1 + H 2 + H 3 + H 4 + H 5

Z* = Z – S Z* = Zef = muatan inti efektif Z = muatan inti = nomor atom S = tetapan penyaringan (screening/shielding constant), tergantung pada konfigurasi elektron. Aturan Slater 1. Pengelompokan : (1 s) (2 s, 2 p) (3 s, 3 p) (3 d) (4 s, 4 p) (4 d) (4 f) (5 s 5 p), … 2. Elektron pada ns np berkontribusi 0, 35 3. Elektron pada kulit n-1 berkontribusi 0, 85 4. Elektron pada kulit n-2 (dst) berkontribusi 1

2 2 s 2 2 p 6 3 s 2 3 p 3 P = 1 s 15 S = (4 x 0, 35) + (8 x 0, 85) +(2 x 1) = 1, 40 + 6, 80 + 2 = 10, 20 Z* = Z-S = 15 – 10, 20 = 4, 80 8 O → Z* = 4, 55 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 Ca = 1 s 20 S = (1 x 0, 35) + (8 x 0, 85) +(10 x 1) = 17, 15 Z* = Z-S = 20 -17, 15 = 2, 85 r+ < ratom netral < r-

BESARNYA JARI-JARI ION / ATOM Menentukan r+ dan r- : Jarak antara ion Na+ F- = 2, 31 Å r+ + r- = 2, 31 Å Jika dihitung : r+ = 0, 945 Å r- = 1, 365 Å

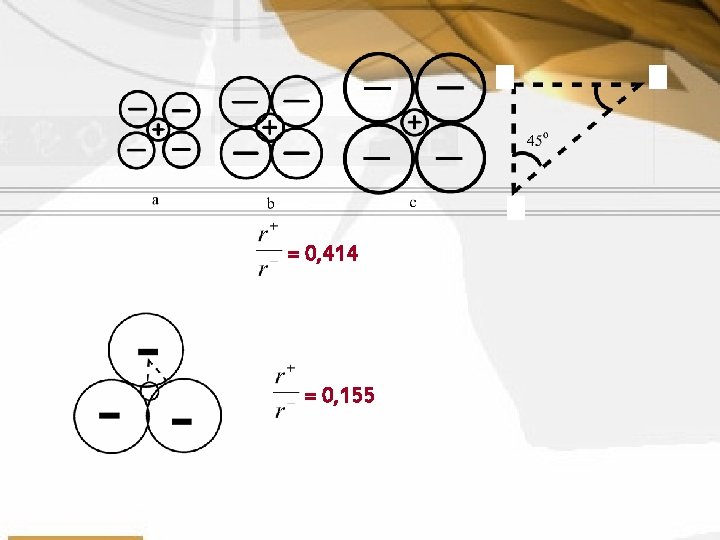
Meramalkan bentuk kristal Pengaruh jari-jari ion terhadap struktur kristal Dijelaskan dengan bilangan koordinasi (jumlah ion positif yang mengelilingi sebuah ion negatif, atau sebaliknya) Membuat kristal menjadi stabil

= 0, 414 = 0, 155

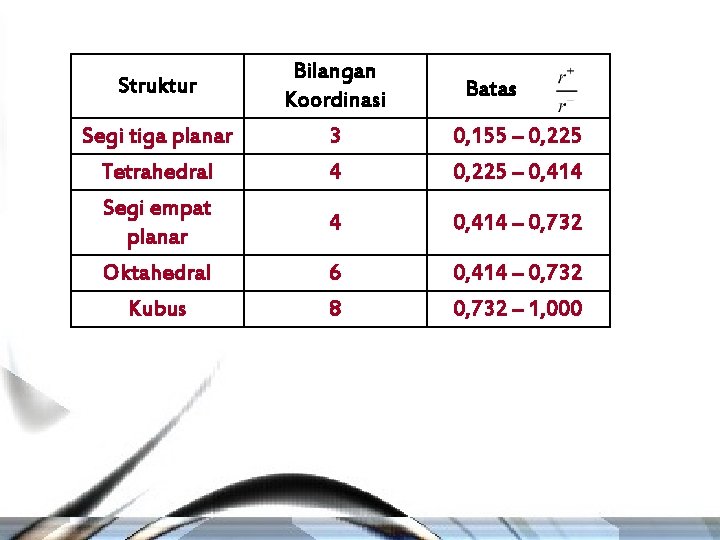
Struktur Bilangan Koordinasi Segi tiga planar 3 0, 155 – 0, 225 Tetrahedral Segi empat planar Oktahedral Kubus 4 0, 225 – 0, 414 4 0, 414 – 0, 732 6 8 0, 414 – 0, 732 – 1, 000 Batas

a. Struktur / Susunan Kristal b. dalam keadaan padat, senyawa ionis terdapat dalam bentuk kristal tertentu → kristal ion → ? c. b. Isomorf d. isomorf adalah senyawa dengan bentuk kristal yang sama → dapat dijelaskan dari konfigurasi elektron e. Na. F Na+ F- f. 2. 8 g. Mg. O Mg 2+ h. 2. 8 O 2 - i. Ca. Cl 2 dan K 2 S ? ? ? Isomorf? ? ? ISOMORF

c. Daya hantar listrik dalam keadaan lelehan maupun larutan, senyawa ionis dapat menghantarkan arus listrik d. Titik leleh dan titik didih Gaya elektrostatis kuat Butuh energi besar untuk merusak ikatan Titik leleh dan titik didih besar

e. Kelarutan Senyawa ionik larut dalam pelarut polar f. Reaksi ion reaksi tidak bergantung pada ion pasangannya dalam larutan : Na. Cl + Ag. No 3 → Ag. Cl + Na. NO 3

Hitung Energi Kisi Mg. F 2, jika diketahui : -Panas pembentukan Mg. F 2 = -1102, 6 k. J/mol -Energi sublimasi Mg = 146, 4 k. J/mol -Energi disosiasi F 2 = 158, 9 k. J/mol -Energi Ionisasi Mg(g) = 2184, 0 k. J/mol -Afinitas elektron F(g) = -334, 7 k. J/mol ? ? ? !!!

Hitung muatan inti efektif dari : a. Elektron 3 d b. Elektron 4 s dari atom Cr (NA=24)

Berapakah jari-jari ion K+ dan ion Cl- pada kristal KCl, jika diketahui jarak antar ion K+ Cl- = 3, 14 Å ? ? ? ? @? ? !!! @@$$**