KIMIA ANORGANIK REAKSI KIMIA ANORGANIK Presentasi Power Point






































![Reaksi Senyawa Kompleks a Reaksi pertukaran ligan a Reaksi redoks [*Fe(CN)6]4 - + [Fe(CN)6]3 Reaksi Senyawa Kompleks a Reaksi pertukaran ligan a Reaksi redoks [*Fe(CN)6]4 - + [Fe(CN)6]3](https://slidetodoc.com/presentation_image_h/a750ee685c378fc2884158db7d58cbb0/image-53.jpg)




- Slides: 58

KIMIA ANORGANIK REAKSI KIMIA ANORGANIK Presentasi Power. Point® disiapkan oleh Haryo Kuntoro Adi Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia

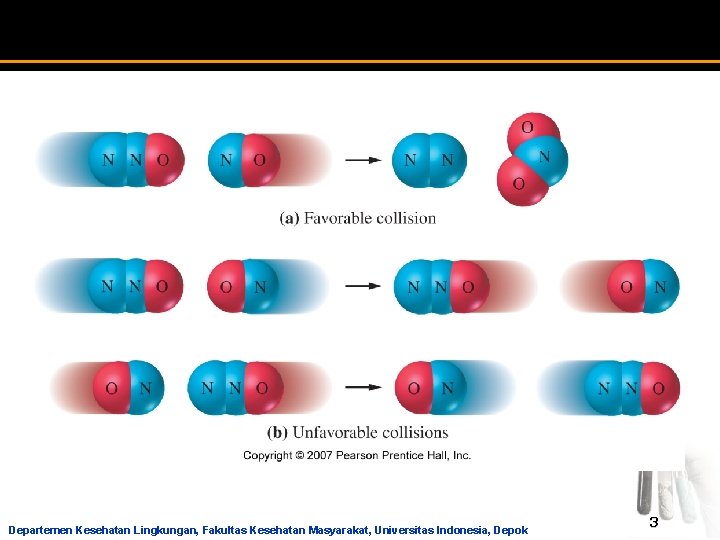
Teori Tumbukan a Agar terjadi reaksi molekul harus bertumbukan. a Makin banyak jumlah tumbukan laju reaksi semakin cepat. a Semakin tinggi suhu maka semakin tinggi energi kinetik molekul yang tersedia sehingga reaksi semakin cepat. a Tidak semua tumbukan menghasilkan produk. a Hanya sebagian kecil tumbukan yang menghasilkan produk. a Agar reaksi dapat terjadi molekul-molekul reaktan harus memiliki orientasi tumbukan dan energi kinetik yang cukup. Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok 3

Persamaan Kimia Suatu persamaan yang menggambarkan suatu reaksi kimia. Persamaan Matematika a. X + b. Y = c. Z Persamaan Kimia a. X + b. Y c. Z Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

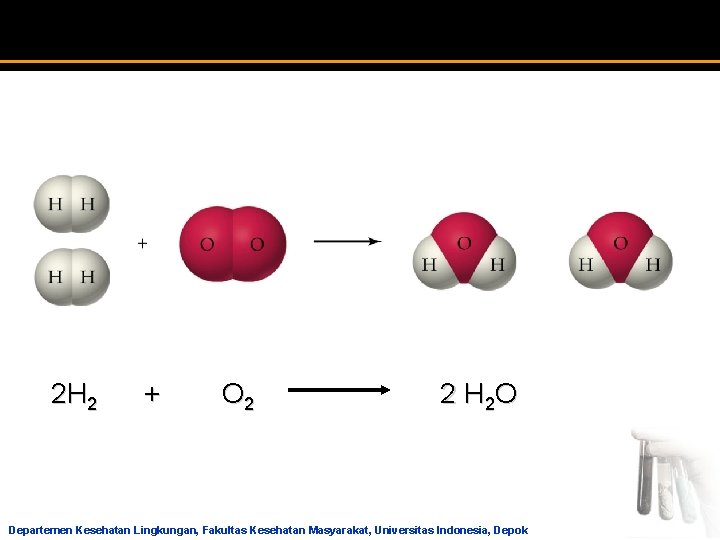
2 H 2 + O 2 2 H 2 O Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

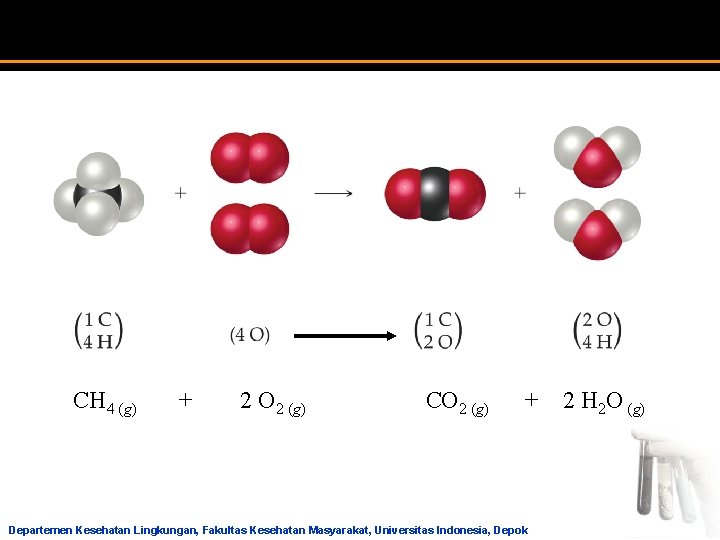
CH 4 (g) + 2 O 2 (g) CO 2 (g) + 2 H 2 O (g) Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Anatomi Persamaan Kimia Ca. CO 3 (s) Reaktan Ca. O (s) + CO 2 (g) Produk / Hasil a Reaktan = zat yang bereaksi a Produk = zat hasil reaksi (s) , (g) = Gambaran keadaan fisik (wujud) setiap komponen a = Kondisi tertentu yang berlaku selama reaksi a Koefisien menggambarkan jumlah zat / partikel yang bereaksi atau dihasilkan Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

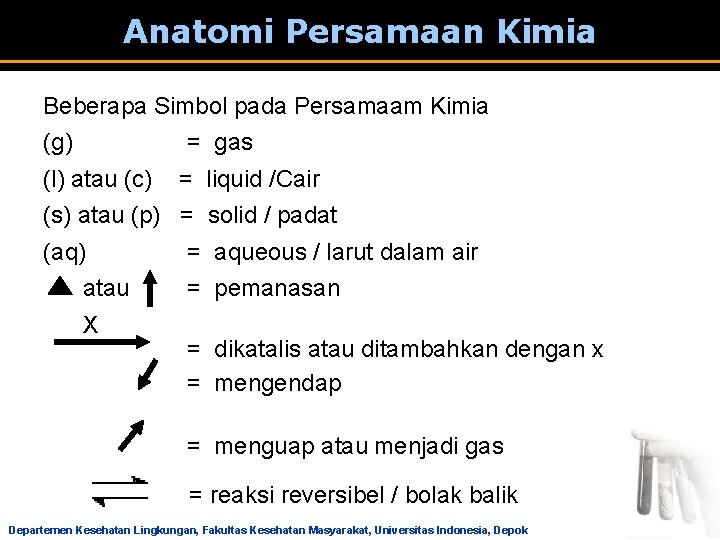
Anatomi Persamaan Kimia Beberapa Simbol pada Persamaam Kimia (g) = gas (l) atau (c) = liquid /Cair (s) atau (p) = solid / padat (aq) = aqueous / larut dalam air atau = pemanasan X = dikatalis atau ditambahkan dengan x = mengendap = menguap atau menjadi gas = reaksi reversibel / bolak balik Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

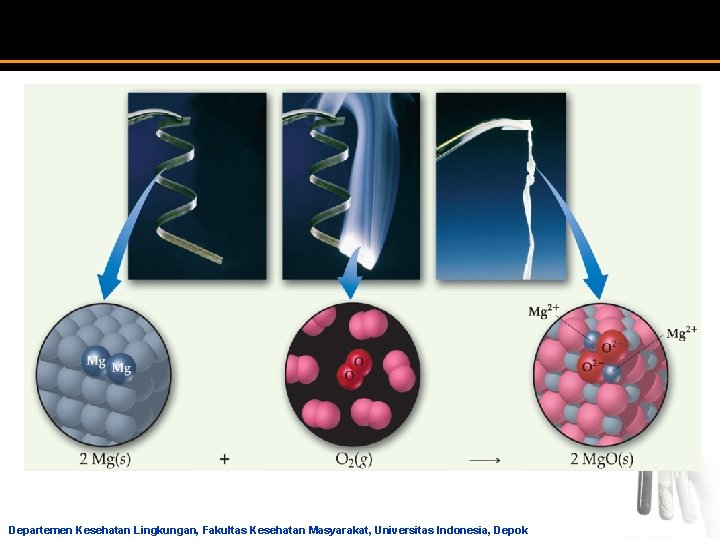
Jenis Reaksi Kimia Anorganik Reaksi Penggabungan atau Sintesa a Dua atau lebih pereaksi membentuk satu produk dalam reaksi penggabungan 2 H 2 + O 2 2 H 2 O N 2 (g) + 3 H 2 (g) 2 NH 3 (g) C 3 H 6 (g) + Br 2 (l) C 3 H 6 Br 2 (l) 2 Mg (s) + O 2 (g) 2 Mg. O (s) Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

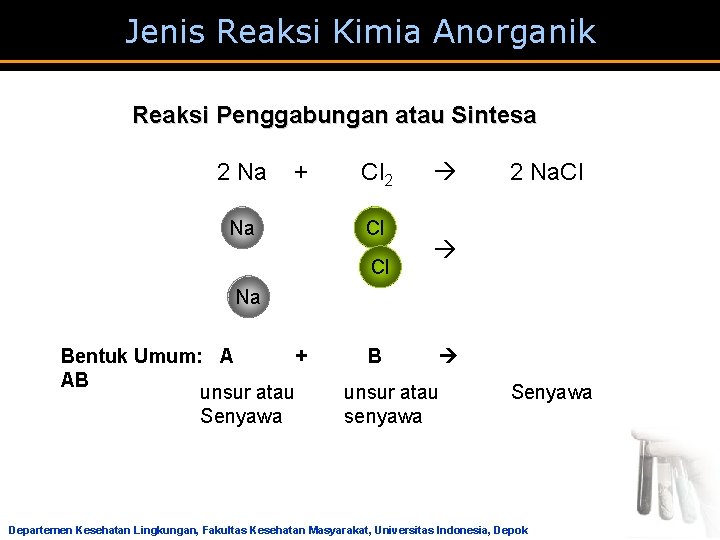
Jenis Reaksi Kimia Anorganik Reaksi Penggabungan atau Sintesa 2 Na + Cl 2 2 Na. Cl Na Cl Cl Na Bentuk Umum: A + B AB unsur atau Senyawa senyawa Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Jenis Reaksi Kimia Anorganik Reaksi Penggabungan atau Sintesa 2 Mg + O 2 2 Mg. O Mg Mg 2+ O O 2 - Mg Mg 2+ Bentuk Umum: A + B AB unsur atau Senyawa senyawa Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Jenis Reaksi Kimia Anorganik Reaksi Penguraian a Dalam reaksi dekomposisi, senyawa terurai menjadi dua atau lebih unsur-unsur atau senyawa penyusunnya. a Dekomposisi biasanya hasil dari elektrolisis atau pemanasan. 2 Ag 2 O 4 Ag + O 2 Ca. CO 3 (s) Ca. O (s) + CO 2 (g) 2 KCl. O 3 (s) 2 KCl (s) + O 2 (g) 2 Na. N 3 (s) 2 Na (s) + 3 N 2 (g) Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Jenis Reaksi Kimia Anorganik Reaksi Penguraian 2 H 2 O 2 H 2 + O 2 H O H + H O H Bentuk Umum: AB Senyawa A + B Dua atau lebih unsur atau senyawa Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Jenis Reaksi Kimia Anorganik Reaksi Pergantian Tunggal (Subtitusi) a Reaksi pergantian tunggal dicirikan oleh unsur atau ion dari senyawa tunggal menggantikan unsur lain Reaksi Pergantian Tunggal Mg + Cu. SO 4 Mg. SO 4 Pola Umum: A + BC + AC Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok Cu + B

Jenis Reaksi Kimia Anorganik POW! Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

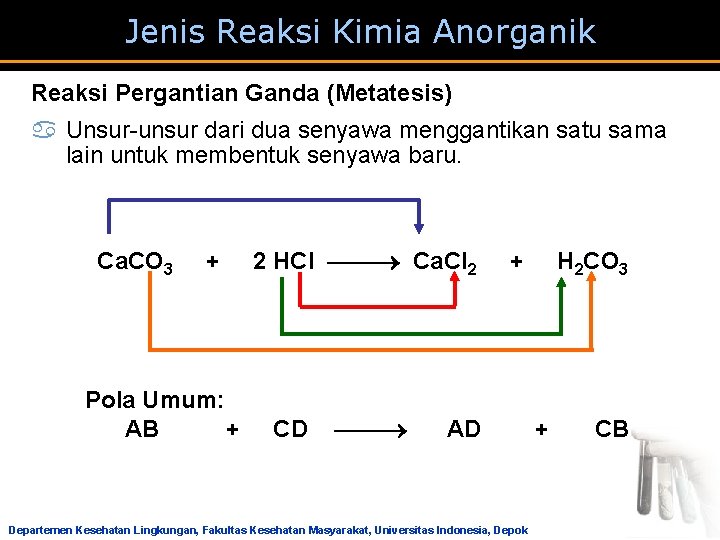
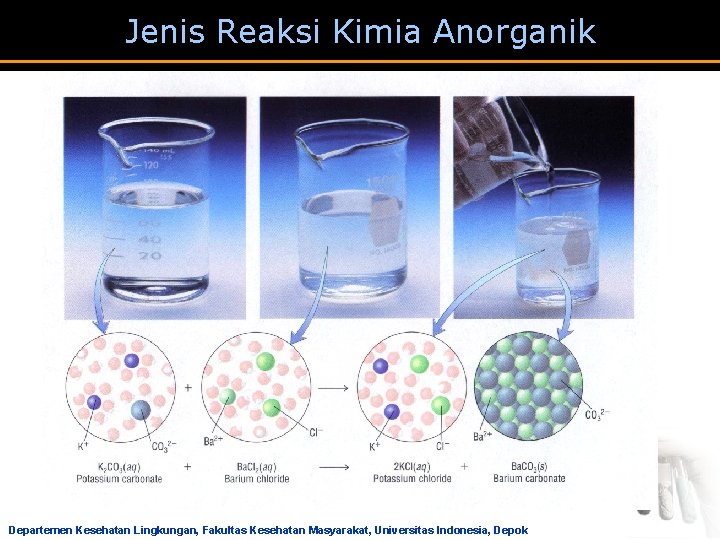
Jenis Reaksi Kimia Anorganik Reaksi Pergantian Ganda (Metatesis) a Unsur-unsur dari dua senyawa menggantikan satu sama lain untuk membentuk senyawa baru. Ca. CO 3 + Pola Umum: AB + 2 HCl Ca. Cl 2 CD + AD Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok H 2 CO 3 + CB

Jenis Reaksi Kimia Anorganik Ag. NO 3(aq) + KCl(aq) KNO 3 (aq) + Ag. Cl(s) Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Jenis Reaksi Kimia Anorganik Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Reaksi Reduksi dan Oksidasi Pengertian awal a Reaksi oksidasi Reaksi dengan oksigen Terjadi penambahan oksigen Mg + O 2 2 Mg. O a Reaksi reduksi Reaksi pengurangan (reduksi) oksigen Pb. O + H 2 Pb + H 2 O Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Reaksi Reduksi dan Oksidasi Ditinjau dari reaksi ion (melibatkan elektron) a Reaksi Oksidasi Reaksi melepaskan elektron Cu (s) Cu 2+ (aq) + e– a Reaksi Reduksi Reaksi penangkapan elektron Zn 2+ (aq) + e– Zn (s) Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Reaksi Reduksi dan Oksidasi a Reaksi melepas elektron berarti memberi elektron kepada atom yang lain a Reaksi oksidasi selalu disertai dengan reaksi reduksi Cu(s) Cu 2+(aq) + 2 e– 2 Ag+(aq) + 2 e– 2 Ag(s) oksidasi reduksi Cu(s) + 2 Ag+(aq) + 2 e– Cu 2+(aq) + 2 e– + 2 Ag(s) Cu(s) + 2 Ag+(aq) Cu 2+(aq) + 2 Ag(s) Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Reaksi Reduksi dan Oksidasi a Zat yang mengalami oksidasi = memberi elektron = zat pereduksi = reduktor a Zat yang mengalami reduksi = menerima elektron = zat pengoksidasi = oksidator Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Bilangan Oksidasi a Reaksi oksidasi dan reduksi kebanyakan tidak jelas terjadi perpindahan elektron a Setiap atom diberi suatu harga yang disebut bilangan oksidasi a Konsep bilangan oksidasi digunakan untuk memudahkan dalam penentuan reaksi oksidasi dan reduksi. a Penentuan bilangan oksidasi memiliki aturan khusus Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Bilangan Oksidasi Aturan bilangan oksidasi 1. Unsur-unsur dan molekul-molekul beratom sejenis (Na, Fe, S, O 2, N 2, dsb) = 0 (nol) 2. Atom Hidrogen = +1, kecuali senyawa hibrida (CH 4, NH 3, KH, Na. H, Ba. H 2, dsb) = -1 a Atom Oksigen = -2, kecuali a F 2 O = +2 3. Senyawa peroksida (H 2 O 2, Na 2 O 2, dsb) = -1 4. Atom logam dalam senyawa = + sesuai dengan valensi (Ag. Cl = +1, Zn. SO 4=+2) 5. Jumlah total senyawa netral = 0 (nol) 6. Jumlah total senyawa ion = muatan ion Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Reaksi Reduksi dan Oksidasi Ditinjau dari bilangan oksidasi a Reaksi Oksidasi Reaksi kenaikan bilangan oksidasi a Reaksi Reduksi Reaksi penurunan bilangan oksidasi CH 4 + 2 O 2 → CO 2 + 2 H 2 O -4 +1 0 +4 – 2 +1 -2 Oksidasi Reduksi Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

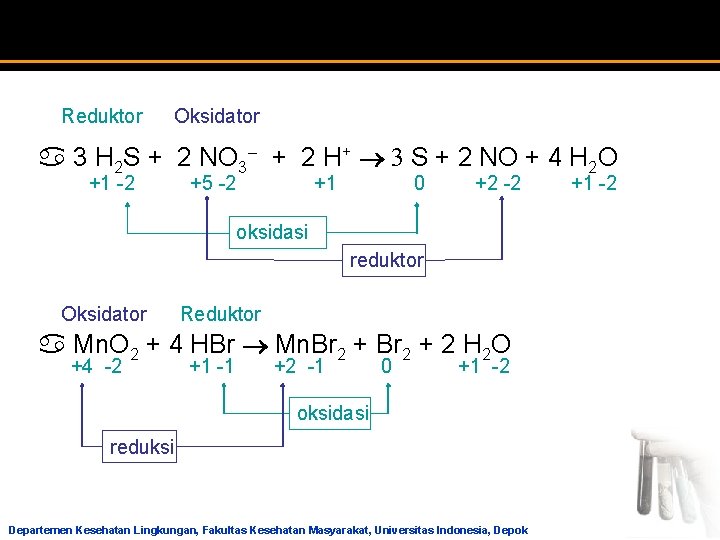
a 3 H 2 S + 2 NO 3– + 2 H+ 3 S + 2 NO + 4 H 2 O a Mn. O 2 + 4 HBr Mn. Br 2 + 2 H 2 O 29 Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Reduktor Oksidator a 3 H 2 S + 2 NO 3– + 2 H+ 3 S + 2 NO + 4 H 2 O +1 -2 +5 -2 +1 0 +2 -2 +1 -2 oksidasi reduktor Oksidator Reduktor a Mn. O 2 + 4 HBr Mn. Br 2 + 2 H 2 O +4 -2 +1 -1 +2 -1 0 +1 -2 oksidasi reduksi Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Reaksi Reduksi dan Oksidasi Rangkuman a Reaksi oksidasi Reaksi pelepasan elektron Reaksi kenaikan bilangan oksidasi a Reaksi reduksi Reaksi penangkapan elektron Reaksi penurunan bilangan oksidasi Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

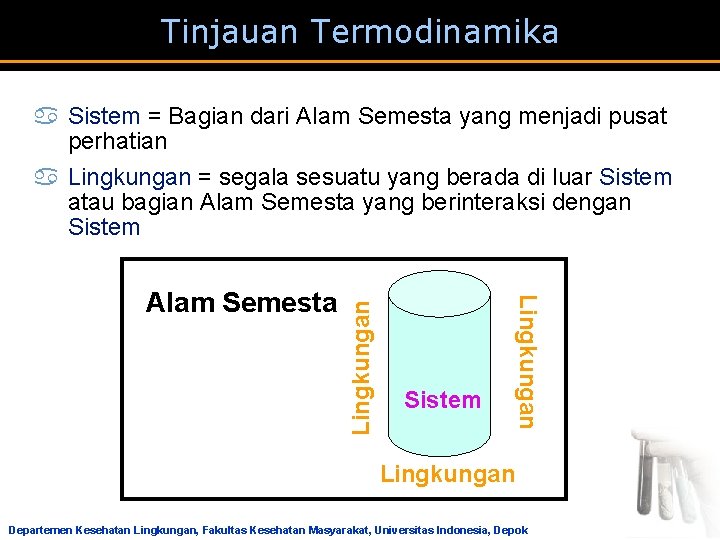
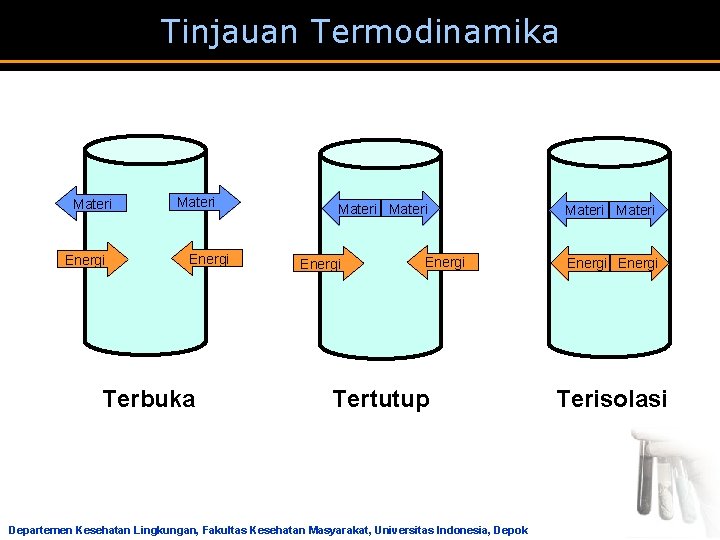
Tinjauan Termodinamika Sistem Lingkungan Alam Semesta Lingkungan a Sistem = Bagian dari Alam Semesta yang menjadi pusat perhatian a Lingkungan = segala sesuatu yang berada di luar Sistem atau bagian Alam Semesta yang berinteraksi dengan Sistem Lingkungan Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

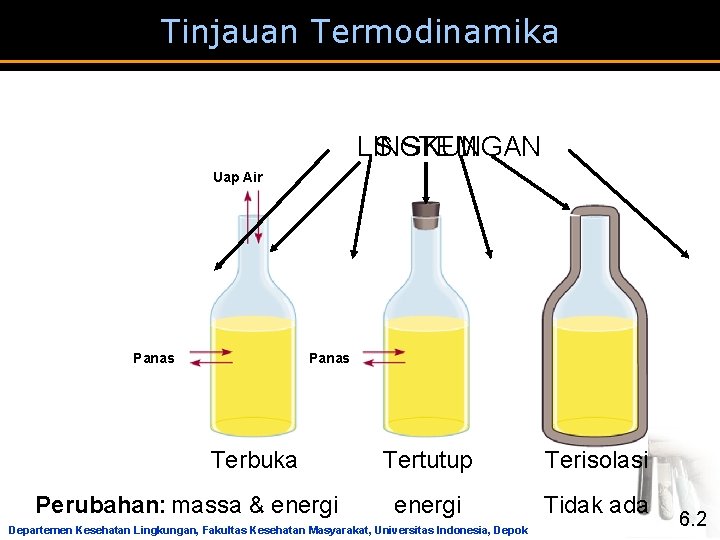
Tinjauan Termodinamika LINGKUNGAN SISTEM Uap Air Panas Terbuka Perubahan: massa & energi Tertutup Terisolasi energi Tidak ada Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok 6. 2

Tinjauan Termodinamika Materi Energi Terbuka Materi Energi Tertutup Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok Materi Energi Terisolasi

Energi • Kemampuan untuk melakukan kerja atau memindahkan panas • Kasat mata • Hanya dapat dirasakan dampaknya terhadap suatu materi • Pertukaran energi antara sistem dan lingkungan dalam bentuk – Kerja – Panas (kalor) Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Energi Reaksi Kimia a Kalor reaksi, qrxn. Jumlah perpindahan panas antara sistem dan lingkungan ketika reaksi kimia berlangsung pada suhu tetap. a Entalpi (H) Merupakan besaran termodinamika yang menyatakan kandungan energi dalam zat/sistem Tidak dapat ditentukan. Perubahan entalpi (ΔH) dapat diukur dari suatu reaksi sama dengan jumlah kalor yang diserap atau dilepas Perubahan entalpi dinyatakan dalam kilojoule per mol (k. J/mol) Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Reaksi Eksoterm a Reaksi yang membebaskan kalor, qrxn < 0 a Suhu sistem > suhu lingkungan a Kalor berpindah dari sistem ke lingkungan a Disertai kenaikan suhu. a ΔH reaksi negatif 2 H 2 (g) + O 2 (g) 2 H 2 O (l) + panas H 2 O (g) H 2 O (l) + panas C(s) + O 2(g) CO 2(g) + 393. 5 k. J ΔH = -393. 5 k. J Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Reaksi Endoterm a Reaksi yang memerlukan kalor, qrxn > 0. a Suhu sistem < suhu lingkungan a Kalor berpindah dari lingkungan ke sistem a Disertai dengan penurunan suhu. a ΔH reaksi positif panas + 2 Hg. O (s) 2 Hg (l) + O 2 (g) panas + H 2 O (s) H 2 O (l) Ca. CO 3(s) Ca. O(s) + CO 2(g) - 178. 5 k. J ΔH = +178. 5 k. J Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Reaksi Kesetimbangan Reaksi reversibel (dapat balik) a Reaksi yang berlangsung dua arah a Reaksi tidak berkesudahan a Contoh: Dekomposisi Ca. CO 3 z Pada suhu tinggi Ca. CO 3 → Ca. O + CO 2 z Pada suhu rendah Ca. O + CO 2 → Ca. CO 3 Ca. O + CO 2 Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok 39

Keadaan Kesetimbangan a Reaksi berlangsung ke arah pembentukan produk atau kearah ruas kanan (reaksi maju) a Segera setelah terbentuk produk maka terjadi reaksi pembentukan reaktan dari molekul produk atau reaksi ke arah ruas kiri (reaksi balik). a Reaksi berlangsung dalam dua arah yang berlawanan. a Pada suatu saat tertentu, laju reaksi pembentukan produk (reaksi ke arah ruas kanan) sama dengan laju reaksi pembentukan kembali reaktan (reaksi ke arah ruas kiri) a Keadaan setimbang atau Kesetimbangan reaksi telah tercapai Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok 40

Keadaan Kesetimbangan a Skala makroskopis Tidak ada perubahan yang dapat diamati atau diukur (konsentrasi zat dianggap tetap atau tidak berubah) Reaksi seolah-olah telah berhenti. Keadaan seperti itu disebut keadaan setimbang (kesetimbangan) a Skala mikroskopis Dalam keadaan setimbang reaksi tetap berlangsung pada tingkat molekul Konsentrasi zat yang bereaksi berubah-ubah Keseimbangan kimia disebut kesetimbangan dinamis Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok 41

Hukum Kesetimbangan a A + b B …. g G + h H …. [G]g[H]h …. Kc= [A]m[B]n …. a Pembilang adalah hasil kali konsentrasi spesies-spesies yang ditulis disebelah kanan persamaan ([G], [H] …) masing-masing konsentrasi dipangkatkan dengan koefisien dalam persamaan reaksi yang setara (g, h …). a Penyebut adalah hasil kali konsentrasi spesies-spesies yang ditulis disebelah kiri persamaan ([A]. [B]. . ) juga setiap konsentrasi dipangkatkan dengan koefisien reaksinya (a, b, …). a Nilai numerik tetapan kesetimbangan Kc sangat tergantung pada jenis reaksi dan suhu. Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok 42

Reaksi Kesetimbangan a Reaksi dapat diibedakan menjadi dua macam yaitu: Reaksi kesetimbangan homogen Reaksi kesetimbangan heterogen. Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok 43

Reaksi Kesetimbangan Homogen a Reaksi kesetimbangan dimana semua fasa senyawa yang bereaksi sama a Contoh : N 2(g) + 3 H 2(g) 2 NH 3(g) H 2 O(l) H+(aq) + OH-(aq) CH 3 COOH(aq) CH 3 COO-(aq) + H+(aq) Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok 44

Reaksi Kesetimbangan Heterogen a Reaksi kesetimbangan dimana reaktan dan produk yang berbeda fasa. a Contoh : Ca. CO 3(s) Ca. O(s) + CO 3(g) Ag 2 Cr. O 4(s) Ag 2+(aq) + Cr. O 42 -(aq) 2 C(s) + O 2(g) 2 CO(g) 2 Na. HCO 3(s) Na 2 CO 3(s) + CO 2(g) + H 2 O(g) Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok 45

Pergeseran Kesetimbangan a Pergeseran kesetimbangan dapat dipengaruhi oleh berbagai faktor antara lain: Konsentrasi Temperatur Tekanan dan volume Penambahan zat lain atau katalis Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok 46

Reaksi Asam-Basa Teori Arrhenius a Dasar teorinya adalah pengionan dalam air a Asam jika melepaskan ion H+ HCl → H+ + Cla Basa jika melepaskan ion OH Na. OH → Na+ + OHa Reaksi antara asam dan basa adalah reaksi penetralan HCl + Na. OH → Na. Cl + H 2 O Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

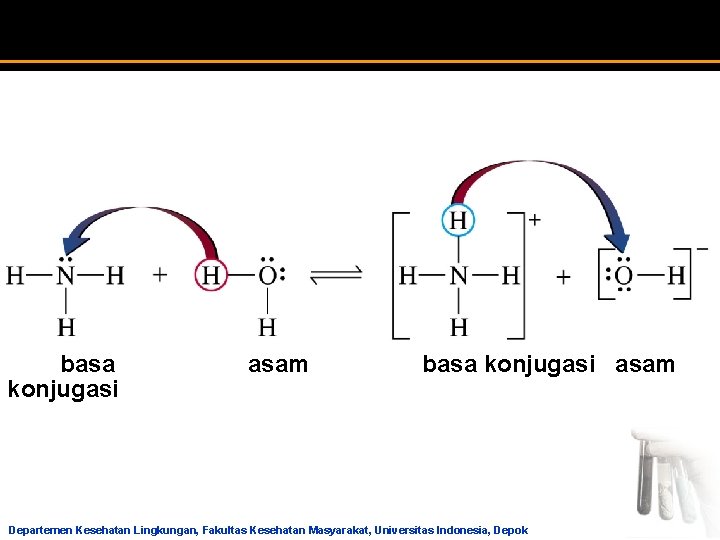
Reaksi Asam-Basa Teori Bronsted-Lowry a a Dasar teorinya : pertukaran proton (H+) Asam jika sebagai donor proton (H+) Basa jika sebagai akseptor proton Struktur basa harus memiliki satu atom yang memiliki pasangan elektron bebas H 2 O + NH 3 NH 4+ + OHasam basa asam konjugasi basa konjugasi a Asam kuat = basa konjugasi lemah a Basa kuat = asam konjugasi lemah Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

basa konjugasi asam Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Reaksi Asam-Basa HCl (asam) + H 2 O (basa) H 3 O+ (asam) + Cl− (basa) NH 4+ (asam) + H 2 O (basa) H 3 O+ (asam) + NH 3 (basa) + H 2 O (asam) NH 4+ (asam) + OH− (basa) CH 3 COO− + H 2 O CH 3 COOH + OH− (basa) (asam) (basa) Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

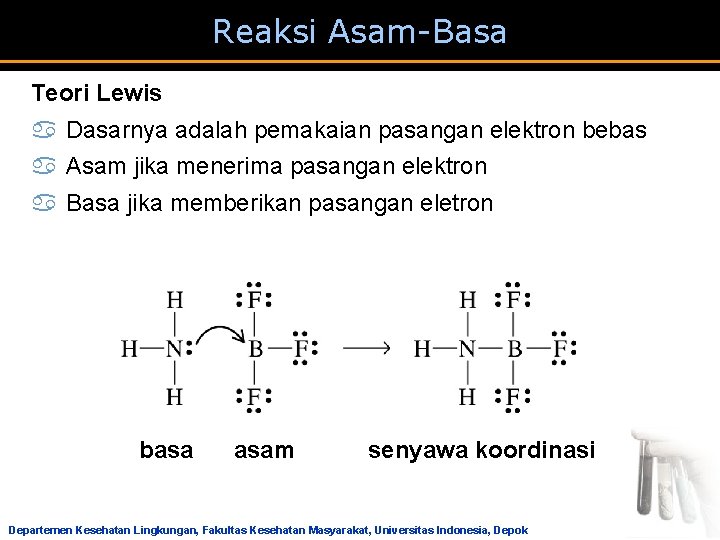
Reaksi Asam-Basa Teori Lewis a Dasarnya adalah pemakaian pasangan elektron bebas a Asam jika menerima pasangan elektron a Basa jika memberikan pasangan eletron basa asam senyawa koordinasi Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

BF 3 + F− → BF 4− (asam) (basa) BF 3 + OMe 2 → BF 3 OMe 2 (asam) (basa) I 2 + I− → I 3− (asam) (basa) Si. F 4 + 2 F− → Si. F 62− (asam) (basa) Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Reaksi Senyawa Kompleks a Dua ligan atau lebih dapat bereaksi dengan atom logam untuk membentuk kompleks koordinasi. a Ligan dapat berupa ion atau molekul netral yang memiliki sepasang elektron bebas a Reaksi senyawa kompleksasi terdiri dari: Reaksi pertukaran ligan z satu atau lebih ligan diganti oleh yang lain Reaksi redoks z terjadi pertukaran elektron yang mengubah keadaan oksidasi atom logam pusat Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok
![Reaksi Senyawa Kompleks a Reaksi pertukaran ligan a Reaksi redoks FeCN64 FeCN63 Reaksi Senyawa Kompleks a Reaksi pertukaran ligan a Reaksi redoks [*Fe(CN)6]4 - + [Fe(CN)6]3](https://slidetodoc.com/presentation_image_h/a750ee685c378fc2884158db7d58cbb0/image-53.jpg)
Reaksi Senyawa Kompleks a Reaksi pertukaran ligan a Reaksi redoks [*Fe(CN)6]4 - + [Fe(CN)6]3 - → [*Fe(CN)6]3 - + [Fe(CN)6]4[(NH 3)5 Co]2+ + 5 H 3 O+ + H 2 O ↔ [Co(H 2 O)6]2+ + 5 NH 4+ Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

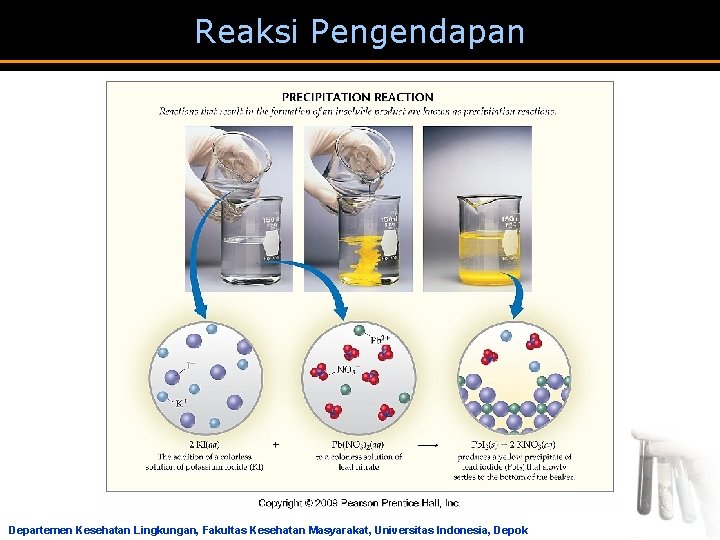
Reaksi Pengendapan a Reaksi yang salah satu produknya berbentuk endapan. a Endapan terjadi karena zat yang terjadi tidak atau sukar larut didalam air atau pelarutnya. a Tidak semua zat mengendap, sehingga reaksi pengendapan juga dipergunakan untuk identifikasi sebuah kation atau anion. Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Reaksi Pengendapan Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Reaksi Pengendapan Ag. NO 3(aq) + HCl(aq) → Ag. Cl(s) + HNO 3(aq) Ca. Cl 2(aq) + Na 2 CO 3(aq) → Ca. CO 3 (s) + 2 Na. Cl (aq) Ba(NO 3)2 (aq) + K 2 SO 4 (aq) → Ba. SO 4 (s) + 2 KNO (aq) Ag. NO 3 (aq) + Na. Br (aq) → Ag. Br (s) + Na. NO 3 (aq) Fe. Cl 3 (aq) + 3 KOH (aq) → Fe(OH)3 (s) + 3 KCl (aq) Pb (NO 3)2 (aq) + K 2 SO 4 (aq) → Pb. SO 4 (s) + 2 KNO 3(aq) Cu(NO 3)2 (aq) + 2 Na. OH → Cu(OH)2 (s) + 2 Na. NO 3 (aq) Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Reaksi Fasa Padat a Reaksi dapat terjadi antara dua zat padat. a Tingkat difusi antar padatan relatif kecil sehingga reaksi kimia terjadi sangat lambat. a Reaksi dapat dipercepat dengan meningkatkan suhu reaksi dan menghaluskan reaktan untuk meningkatkan luas permukaan kontak. Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok

Contoh : Fe 2 O 3(s)+ 2 Al(s) → 2 Fe(s) + Al 2 O 3(s) Zr. O 2 (s) + Si. O 2 (s) → Zr. Si. O 4(s) 2 Ti. O 2 (s) + B 4 C (s) → 2 Ti. B 2 (s) + 4 CO (g) Ti. Cl 4 (s) + 2 B (s) + 4 Na (s) → Ti. B 2 (s) + 4 Na. Cl (s) 3 Si. O 2(s) + 6 C(s) + 2 N 2(g) → Si 3 N 4(s) + 6 CO(g) Departemen Kesehatan Lingkungan, Fakultas Kesehatan Masyarakat, Universitas Indonesia, Depok
 Jenis reaksi
Jenis reaksi Presentasi administrasi perkantoran power point
Presentasi administrasi perkantoran power point Non air atau non air
Non air atau non air Atom
Atom Reaksi redoks pada daur ulang perak
Reaksi redoks pada daur ulang perak Reaksi ch3 ch2 ch2 ch2 + hcl disebut reaksi
Reaksi ch3 ch2 ch2 ch2 + hcl disebut reaksi Unsur unsur gas mulia
Unsur unsur gas mulia 2-etil-1-butanamina
2-etil-1-butanamina Dapat dibedakan menjadi
Dapat dibedakan menjadi Contoh soal neraca massa tanpa reaksi kimia
Contoh soal neraca massa tanpa reaksi kimia Reaksi kimia dalam larutan air
Reaksi kimia dalam larutan air Reaksi kimia anabolisme
Reaksi kimia anabolisme Termokimia mempelajari hubungan antara reaksi kimia dengan
Termokimia mempelajari hubungan antara reaksi kimia dengan Ciriciri reaksi oksidasi
Ciriciri reaksi oksidasi Rumus qc dan kc
Rumus qc dan kc Power traiangle
Power traiangle Power bi training powerpoint
Power bi training powerpoint Point point power
Point point power Limbah anorganik dari penjahit pakaian
Limbah anorganik dari penjahit pakaian Tuz hosil qiladigan oksidlar
Tuz hosil qiladigan oksidlar Pelarut non air
Pelarut non air Katlı oranlar kanunu
Katlı oranlar kanunu Jumlah isomer dari senyawa nh2oh adalah
Jumlah isomer dari senyawa nh2oh adalah Senyawa karbon anorganik
Senyawa karbon anorganik 4 isopropil heptana
4 isopropil heptana Enzim
Enzim Pertanyaan tentang teori belajar gagne
Pertanyaan tentang teori belajar gagne Materi teknik presentasi
Materi teknik presentasi Tata tertib presentasi online
Tata tertib presentasi online Pengertian presentation layer
Pengertian presentation layer Presentasi matematika tentang kubus
Presentasi matematika tentang kubus Presentasi penjualan
Presentasi penjualan Tata krama sekretaris
Tata krama sekretaris Dr anin indriani
Dr anin indriani Contoh presentasi fit and proper test
Contoh presentasi fit and proper test Presentasi dahi
Presentasi dahi Pendahuluan dalam presentasi
Pendahuluan dalam presentasi Storyboard presentasi
Storyboard presentasi Tidak bisa menjawab pertanyaan saat presentasi
Tidak bisa menjawab pertanyaan saat presentasi Penulisan daftar pustaka dari slide presentasi
Penulisan daftar pustaka dari slide presentasi Cara membuat ppt bernarasi
Cara membuat ppt bernarasi Tanda tempo
Tanda tempo Alat peraga presentasi
Alat peraga presentasi Model integrasi presentasi
Model integrasi presentasi Rangkuman teknik presentasi
Rangkuman teknik presentasi Jelaskan teknik presentasi efektif metode kupas!
Jelaskan teknik presentasi efektif metode kupas! Tahap presentasi
Tahap presentasi Komunikasi oral adalah
Komunikasi oral adalah Apa yang dimaksud perangkat lunak pembuat presentasi
Apa yang dimaksud perangkat lunak pembuat presentasi Kuis persiapan presentasi penjualan
Kuis persiapan presentasi penjualan Outline presentasi
Outline presentasi Analisis produk berdasarkan nilai
Analisis produk berdasarkan nilai Sistematika presentasi
Sistematika presentasi Pendahuluan presentasi
Pendahuluan presentasi Sekian presentasi dari kelompok kami
Sekian presentasi dari kelompok kami Jenis huruf yang dianjurkan untuk presentasi adalah
Jenis huruf yang dianjurkan untuk presentasi adalah Teknik yam dalam presentasi
Teknik yam dalam presentasi Malpresentasi adalah
Malpresentasi adalah Gambar buat presentasi powerpoint
Gambar buat presentasi powerpoint