Ikatan kimia Ricin Annullene C 18 H 18



- Slides: 38

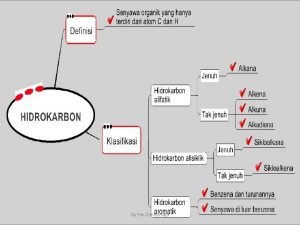
Ikatan kimia Ricin Annullene, C 18 H 18 Nanotube

Area ikatan kimia l Deskripsi klasik l Deskripsi kuantum Ikatan ionik Ikatan kovalen Bentuk molekul Ikatan komplek koordinasi Interaksi spektrokopi Aplikasi mutakhir

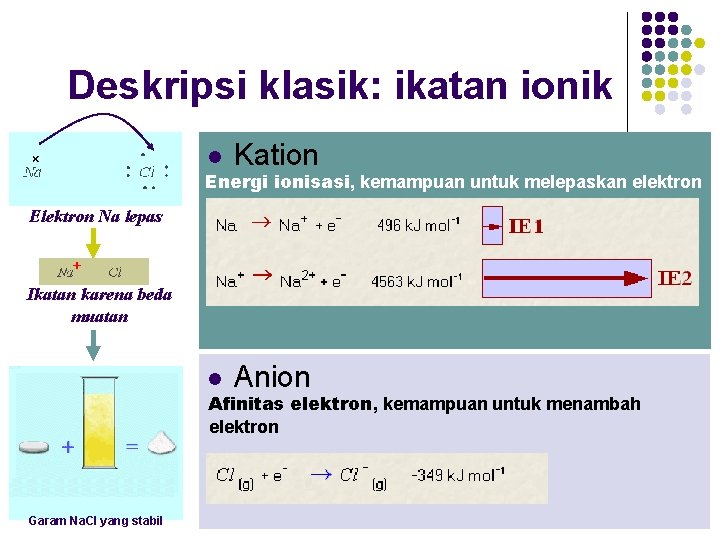
Deskripsi klasik: ikatan ionik l Kation l Anion Energi ionisasi, kemampuan untuk melepaskan elektron Elektron Na lepas Ikatan karena beda muatan Afinitas elektron, kemampuan untuk menambah elektron Natrium Klorina Garam Na. Cl yang stabil

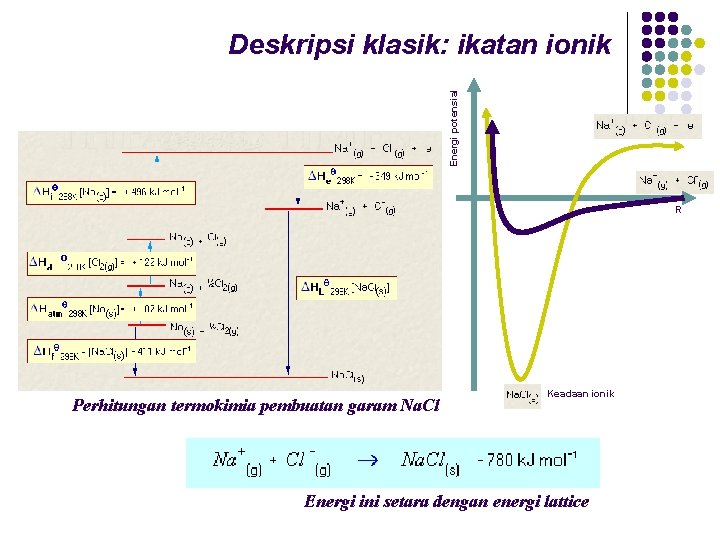
Energi potensial Deskripsi klasik: ikatan ionik R Perhitungan termokimia pembuatan garam Na. Cl Keadaan ionik Energi ini setara dengan energi lattice

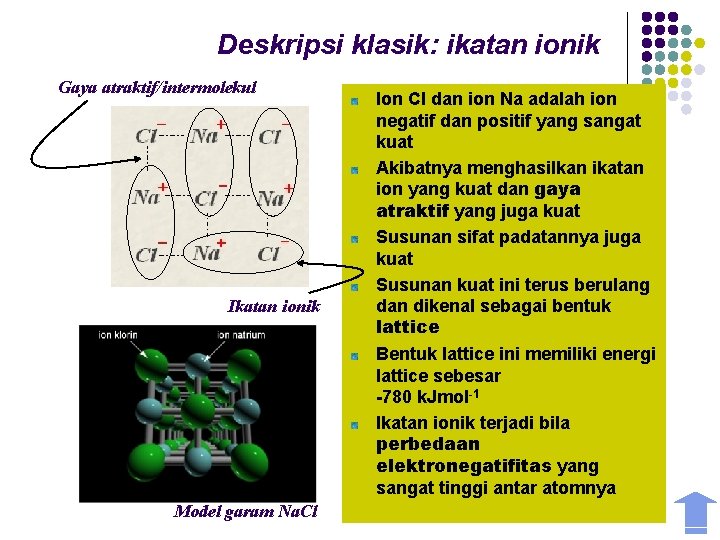
Deskripsi klasik: ikatan ionik Gaya atraktif/intermolekul Ikatan ionik Model garam Na. Cl Ion Cl dan ion Na adalah ion negatif dan positif yang sangat kuat Akibatnya menghasilkan ikatan ion yang kuat dan gaya ion klorina natrium atraktif yang jugaionkuat Susunan sifat padatannya juga kuat Susunan kuat ini terus berulang dan dikenal sebagai bentuk lattice Bentuk lattice ini memiliki energi lattice sebesar -780 k. Jmol-1 Ikatan ionik terjadi bila perbedaan elektronegatifitas yang sangat tinggi antar atomnya

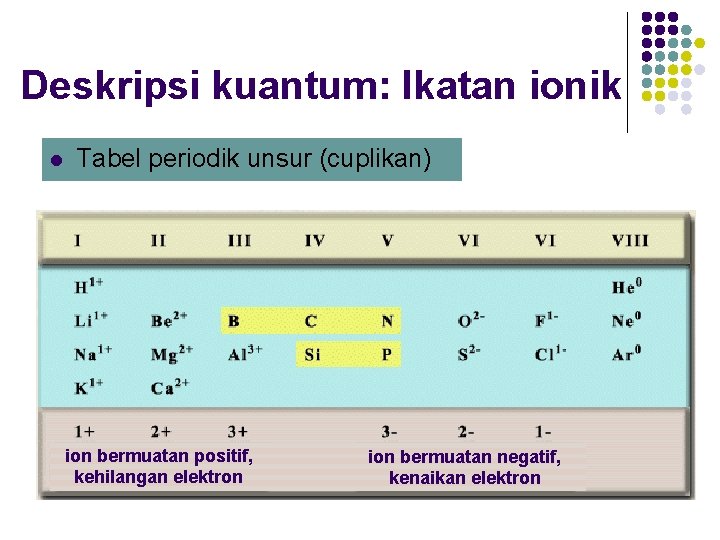
Deskripsi kuantum: Ikatan ionik l Tabel periodik unsur (cuplikan) ion bermuatan positif, kehilangan elektron ion bermuatan negatif, kenaikan elektron

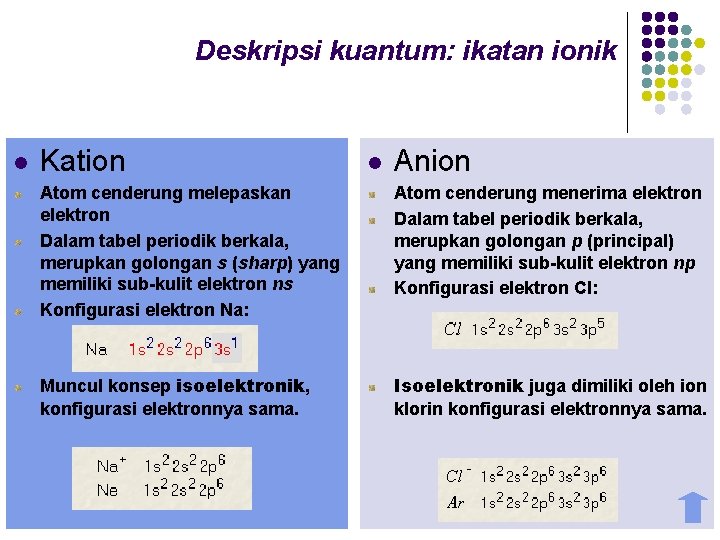
Deskripsi kuantum: ikatan ionik l Kation l Anion Atom cenderung melepaskan elektron Dalam tabel periodik berkala, merupkan golongan s (sharp) yang memiliki sub-kulit elektron ns Konfigurasi elektron Na: Atom cenderung menerima elektron Dalam tabel periodik berkala, merupkan golongan p (principal) yang memiliki sub-kulit elektron np Konfigurasi elektron Cl: Muncul konsep isoelektronik, konfigurasi elektronnya sama. Isoelektronik juga dimiliki oleh ion klorin konfigurasi elektronnya sama.

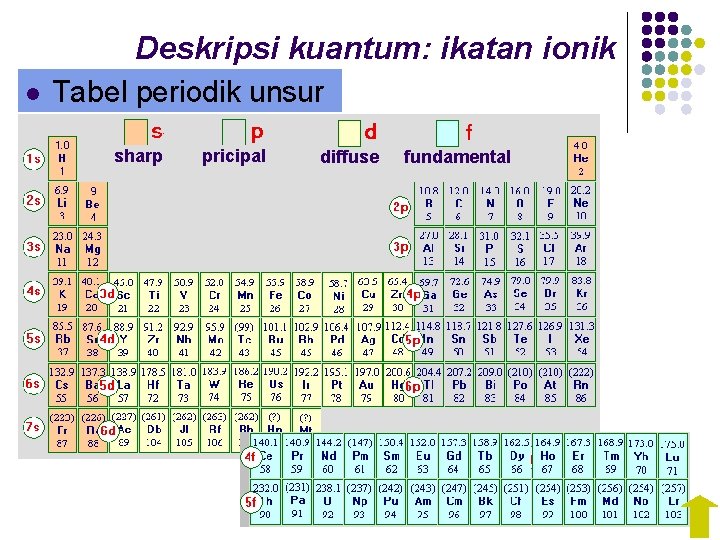
Deskripsi kuantum: ikatan ionik l Tabel periodik unsur sharp pricipal diffuse fundamental

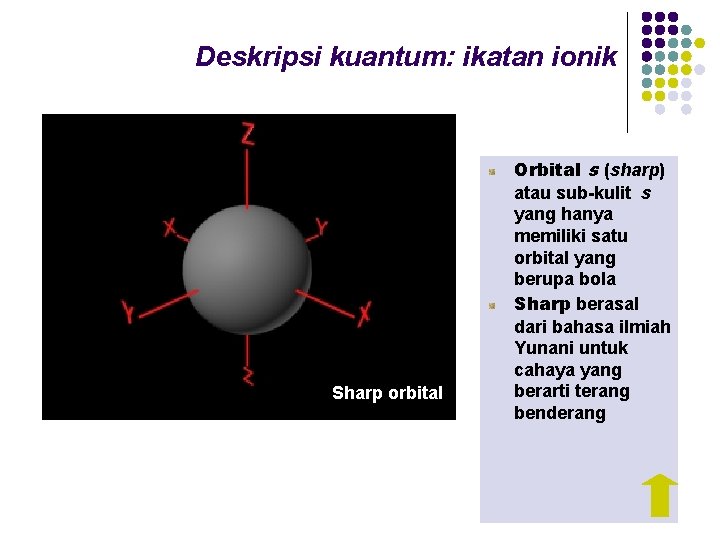
Deskripsi kuantum: ikatan ionik Sharp orbital Orbital s (sharp) atau sub-kulit s yang hanya memiliki satu orbital yang berupa bola Sharp berasal dari bahasa ilmiah Yunani untuk cahaya yang berarti terang benderang

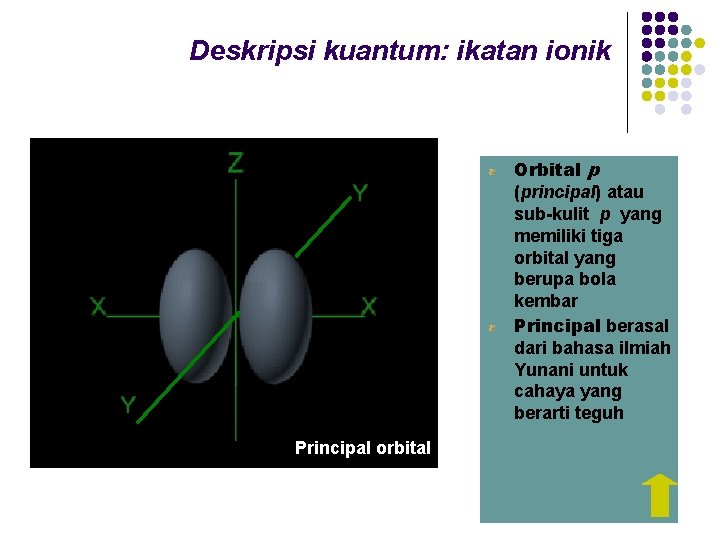
Deskripsi kuantum: ikatan ionik Orbital p (principal) atau sub-kulit p yang memiliki tiga orbital yang berupa bola kembar Principal berasal dari bahasa ilmiah Yunani untuk cahaya yang berarti teguh Principal orbital

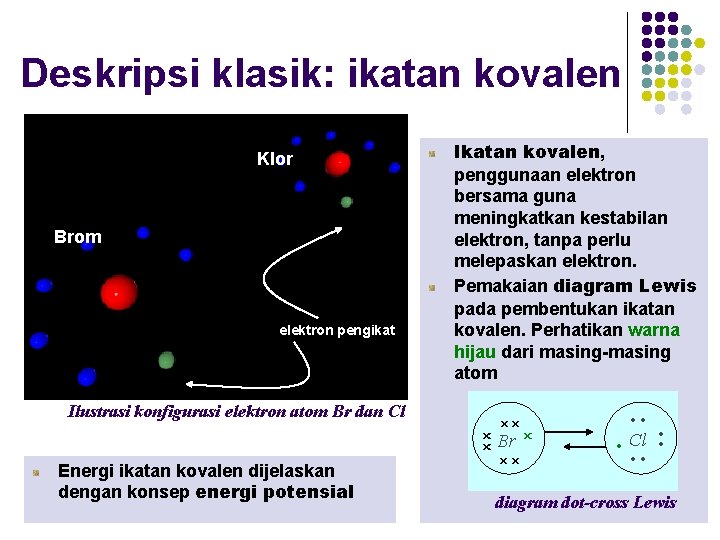
Deskripsi klasik: ikatan kovalen Klor Brom elektron pengikat Ikatan kovalen, penggunaan elektron bersama guna meningkatkan kestabilan elektron, tanpa perlu melepaskan elektron. Pemakaian diagram Lewis pada pembentukan ikatan kovalen. Perhatikan warna hijau dari masing-masing atom Ilustrasi konfigurasi elektron atom Br dan Cl Energi ikatan kovalen dijelaskan dengan konsep energi potensial diagram dot-cross Lewis

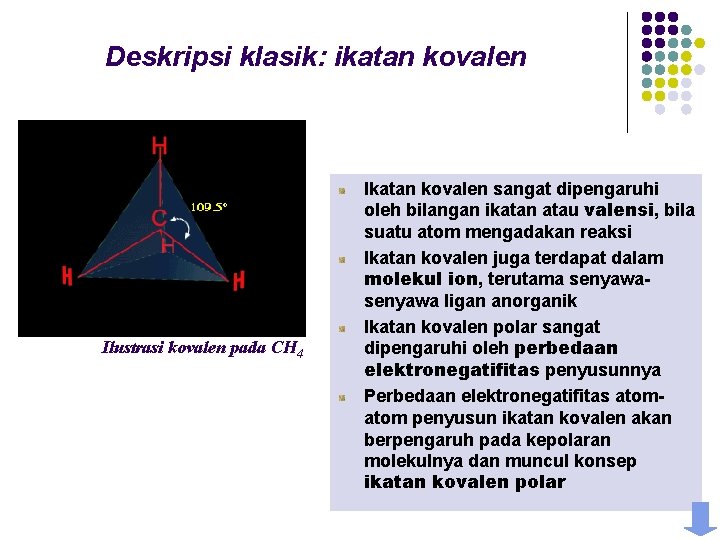
Deskripsi klasik: ikatan kovalen Ilustrasi kovalen pada CH 4 Ikatan kovalen sangat dipengaruhi oleh bilangan ikatan atau valensi, bila suatu atom mengadakan reaksi Ikatan kovalen juga terdapat dalam molekul ion, terutama senyawa ligan anorganik Ikatan kovalen polar sangat dipengaruhi oleh perbedaan elektronegatifitas penyusunnya Perbedaan elektronegatifitas atom penyusun ikatan kovalen akan berpengaruh pada kepolaran molekulnya dan muncul konsep ikatan kovalen polar

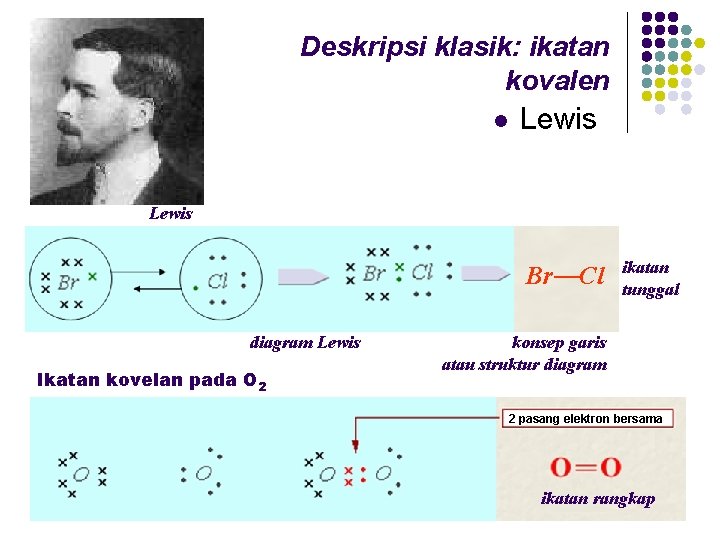
Deskripsi klasik: ikatan kovalen l Lewis Br Cl diagram Lewis Ikatan kovelan pada O 2 ikatan tunggal konsep garis atau struktur diagram 2 pasang elektron bersama ikatan rangkap

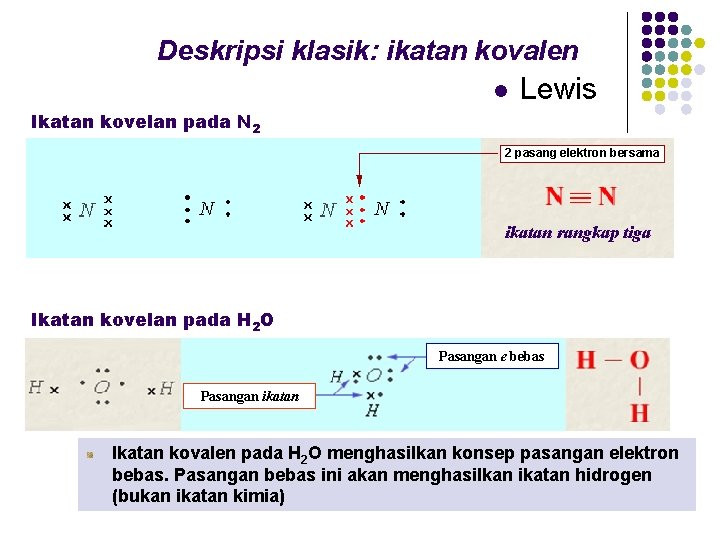
Deskripsi klasik: ikatan kovalen l Lewis Ikatan kovelan pada N 2 2 pasang elektron bersama ikatan rangkap tiga Ikatan kovelan pada H 2 O Pasangan e bebas Pasangan ikatan Ikatan kovalen pada H 2 O menghasilkan konsep pasangan elektron bebas. Pasangan bebas ini akan menghasilkan ikatan hidrogen (bukan ikatan kimia)

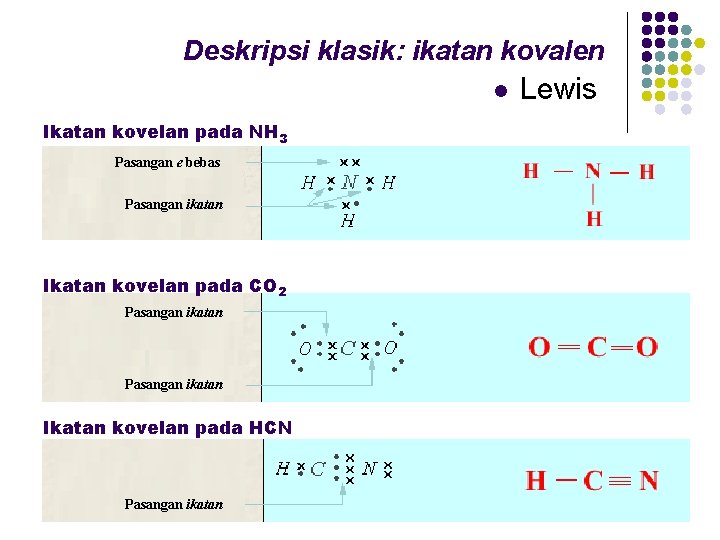
Deskripsi klasik: ikatan kovalen l Ikatan kovelan pada NH 3 Pasangan e bebas Pasangan ikatan Ikatan kovelan pada CO 2 Pasangan ikatan Ikatan kovelan pada HCN Pasangan ikatan Lewis

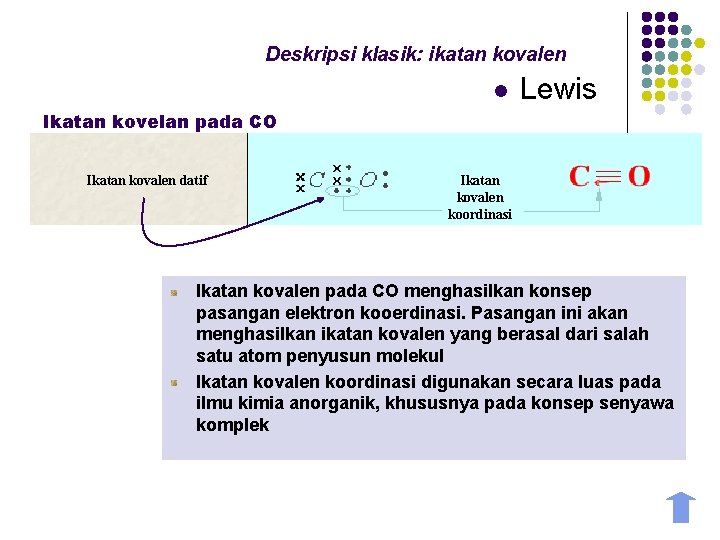
Deskripsi klasik: ikatan kovalen l Lewis Ikatan kovelan pada CO Ikatan kovalen datif Ikatan kovalen koordinasi Ikatan kovalen pada CO menghasilkan konsep pasangan elektron kooerdinasi. Pasangan ini akan menghasilkan ikatan kovalen yang berasal dari salah satu atom penyusun molekul Ikatan kovalen koordinasi digunakan secara luas pada ilmu kimia anorganik, khususnya pada konsep senyawa komplek

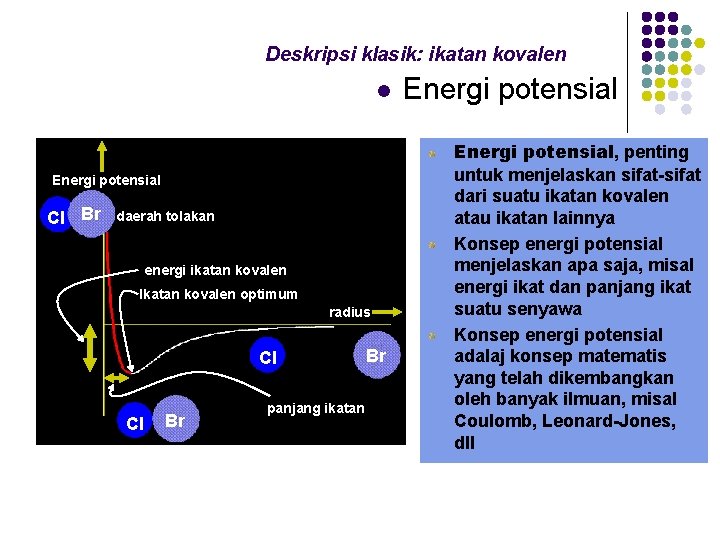
Deskripsi klasik: ikatan kovalen l Energi potensial Cl Br daerah tolakan energi ikatan kovalen Ikatan kovalen optimum radius Cl Cl Br panjang ikatan Br Energi potensial, penting untuk menjelaskan sifat-sifat dari suatu ikatan kovalen atau ikatan lainnya Konsep energi potensial menjelaskan apa saja, misal energi ikat dan panjang ikat suatu senyawa Konsep energi potensial adalaj konsep matematis yang telah dikembangkan oleh banyak ilmuan, misal Coulomb, Leonard-Jones, dll

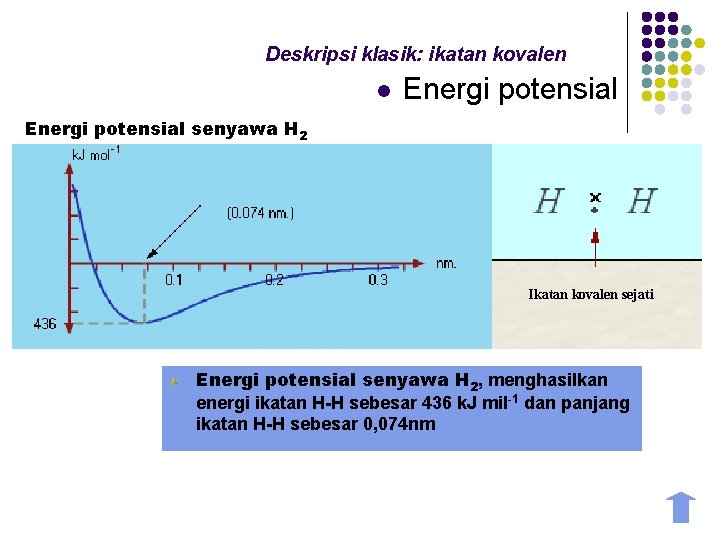
Deskripsi klasik: ikatan kovalen l Energi potensial senyawa H 2 Energi potensial Cl Br daerah tolakan energi ikatan kovalen Ikatan kovalen optimum Ikatan kovalen sejati radius Cl Br Cl Energi potensial senyawa H 2, menghasilkan energi ikatan H-H sebesar 436 k. J mil-1 dan panjang ikatan Br ikatan H-H sebesar 0, 074 nm

Deskripsi klasik: ikatan kovalen l Valensi Derajat valensi atom-atom (Cuplikan Tebel periodik unsur) Angka biru adalah harga valensi atom yang akan menentukan bilangan ikatannya Valensi akan sangat mempengaruhi ikatan kimia dan kepolaran ikatan kovalen suatu molekul ion

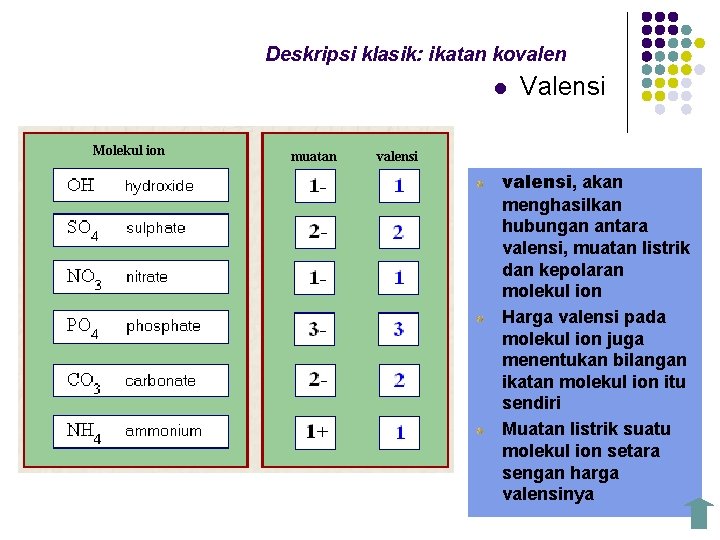
Deskripsi klasik: ikatan kovalen l Molekul ion muatan Valensi valensi, akan menghasilkan hubungan antara valensi, muatan listrik dan kepolaran molekul ion Harga valensi pada molekul ion juga menentukan bilangan ikatan molekul ion itu sendiri Muatan listrik suatu molekul ion setara sengan harga valensinya

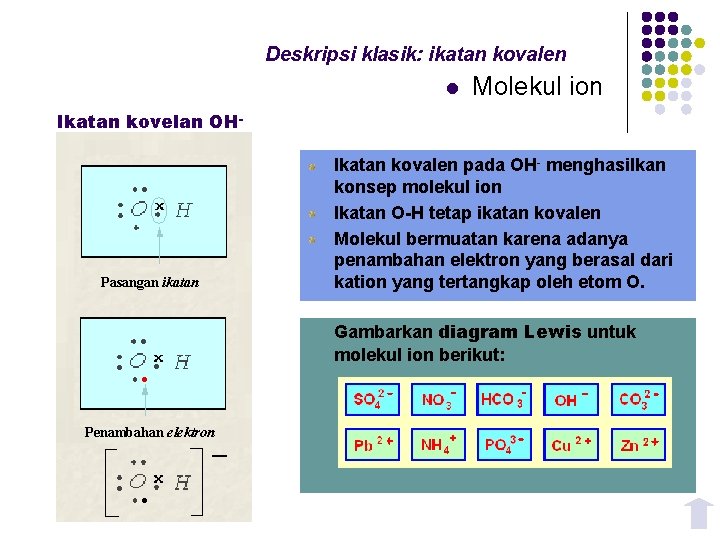
Deskripsi klasik: ikatan kovalen l Molekul ion Ikatan kovelan OH- Pasangan ikatan Ikatan kovalen pada OH- menghasilkan konsep molekul ion Ikatan O-H tetap ikatan kovalen Molekul bermuatan karena adanya penambahan elektron yang berasal dari kation yang tertangkap oleh etom O. Gambarkan diagram Lewis untuk molekul ion berikut: Penambahan elektron

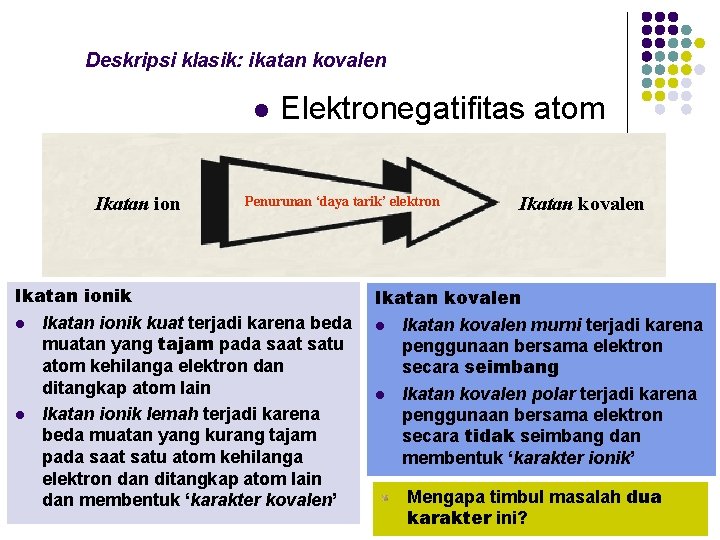
Deskripsi klasik: ikatan kovalen l Ikatan ion Elektronegatifitas atom Penurunan ‘daya tarik’ elektron Ikatan ionik l Ikatan ionik kuat terjadi karena beda muatan yang tajam pada saat satu atom kehilanga elektron dan ditangkap atom lain l Ikatan ionik lemah terjadi karena beda muatan yang kurang tajam pada saat satu atom kehilanga elektron dan ditangkap atom lain dan membentuk ‘karakter kovalen’ Ikatan kovalen l Ikatan kovalen murni terjadi karena penggunaan bersama elektron secara seimbang l Ikatan kovalen polar terjadi karena penggunaan bersama elektron secara tidak seimbang dan membentuk ‘karakter ionik’ Mengapa timbul masalah dua karakter ini?

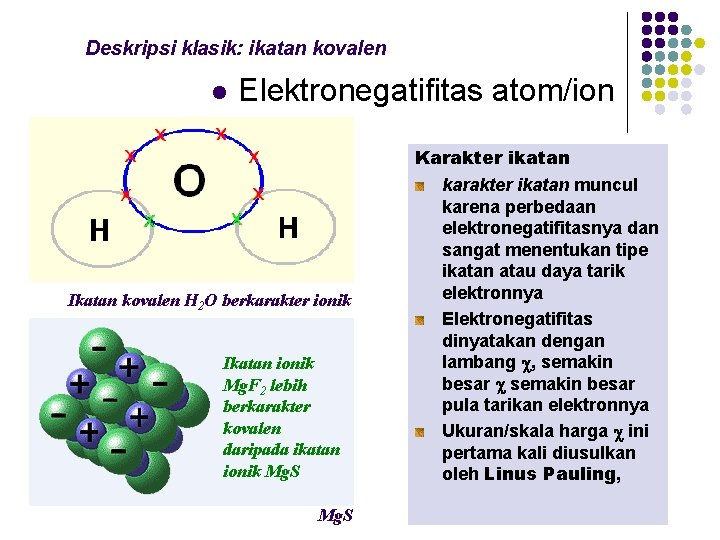
Deskripsi klasik: ikatan kovalen l Elektronegatifitas atom/ion Ikatan kovalen H 2 O berkarakter ionik Ikatan ionik Mg. F 2 lebih berkarakter kovalen daripada ikatan ionik Mg. S Karakter ikatan karakter ikatan muncul karena perbedaan elektronegatifitasnya dan sangat menentukan tipe ikatan atau daya tarik elektronnya Elektronegatifitas dinyatakan dengan lambang , semakin besar pula tarikan elektronnya Ukuran/skala harga ini pertama kali diusulkan oleh Linus Pauling,

Deskripsi klasik: ikatan kovalen l Pauling Elektronegatifitas atom/ion Linus Pauling, mengusulkan harga usulan skala antara derajat elektronegatifitas atom antara = 0 sampai = 4 Pada skala Pauling, atom yang paling tinggi adalah F, = 4. aom yang paling rendah adalah Cs, = 0, 7 Semakin besar harga semakin besar karakter ioniknya Karakter ionik > 50% bila > 1, 7

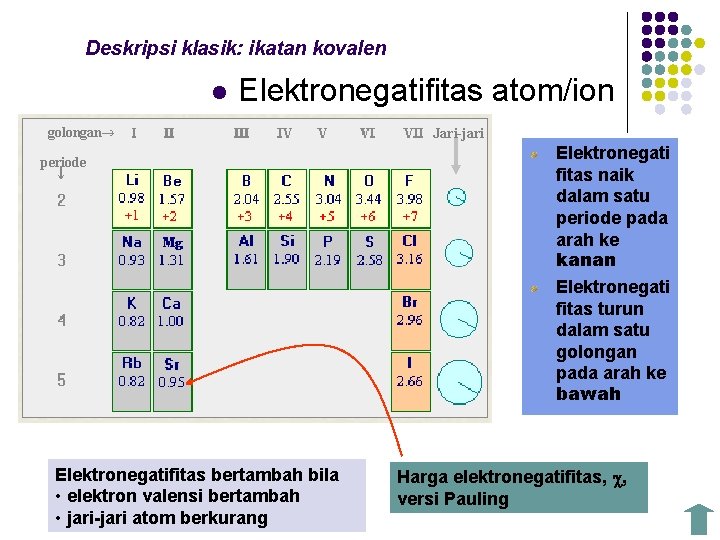
Deskripsi klasik: ikatan kovalen l Elektronegatifitas atom/ion golongan periode Elektronegatifitas bertambah bila • elektron valensi bertambah • jari-jari atom berkurang Jari-jari Elektronegati fitas naik dalam satu periode pada arah ke kanan Elektronegati fitas turun dalam satu golongan pada arah ke bawah Harga elektronegatifitas, , versi Pauling

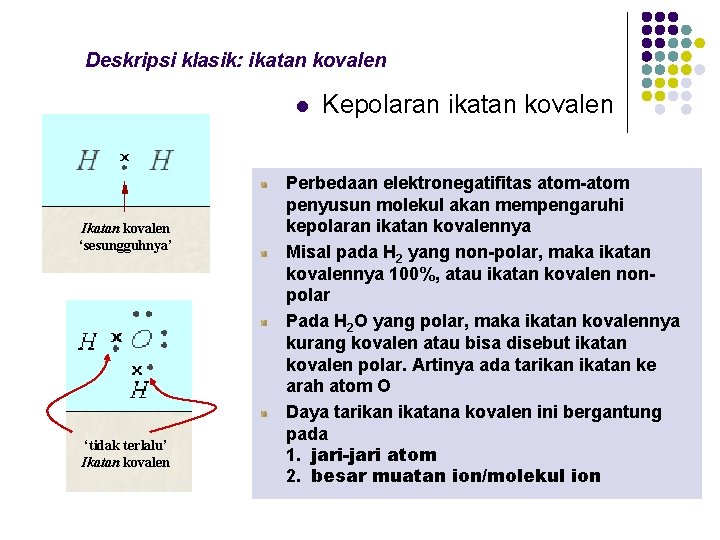
Deskripsi klasik: ikatan kovalen l Ikatan kovalen ‘sesungguhnya’ ‘tidak terlalu’ Ikatan kovalen Kepolaran ikatan kovalen Perbedaan elektronegatifitas atom-atom penyusun molekul akan mempengaruhi kepolaran ikatan kovalennya Misal pada H 2 yang non-polar, maka ikatan kovalennya 100%, atau ikatan kovalen nonpolar Pada H 2 O yang polar, maka ikatan kovalennya kurang kovalen atau bisa disebut ikatan kovalen polar. Artinya ada tarikan ikatan ke arah atom O Daya tarikan ikatana kovalen ini bergantung pada 1. jari-jari atom 2. besar muatan ion/molekul ion

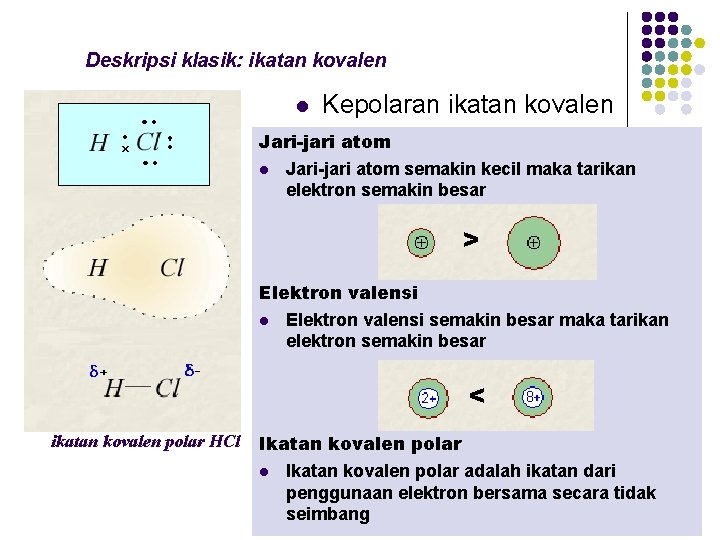
Deskripsi klasik: ikatan kovalen l Kepolaran ikatan kovalen Jari-jari atom l Jari-jari atom semakin kecil maka tarikan elektron semakin besar > Elektron valensi l Elektron valensi semakin besar maka tarikan elektron semakin besar < ikatan kovalen polar HCl Ikatan kovalen polar adalah ikatan dari penggunaan elektron bersama secara tidak seimbang

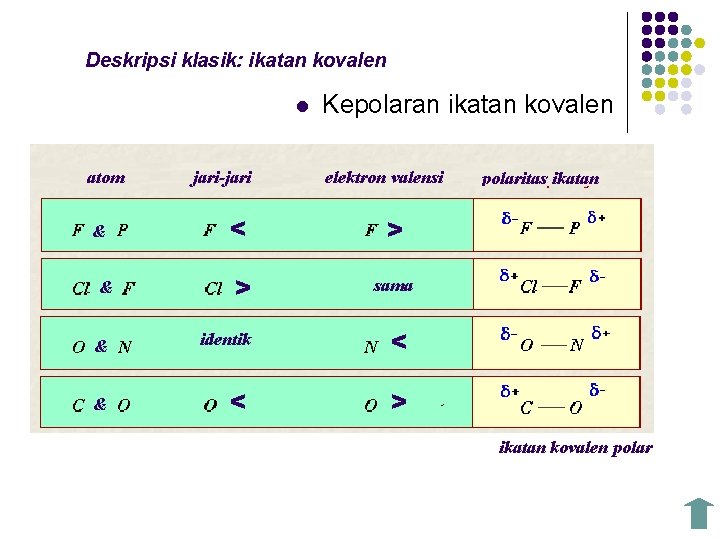
Deskripsi klasik: ikatan kovalen l atom jari-jari Kepolaran ikatan kovalen elektron valensi < > & > sama & identik < & < > & polaritas ikatan kovalen polar

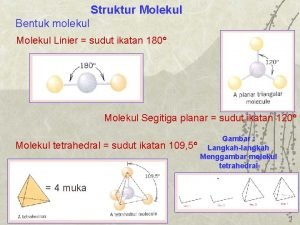
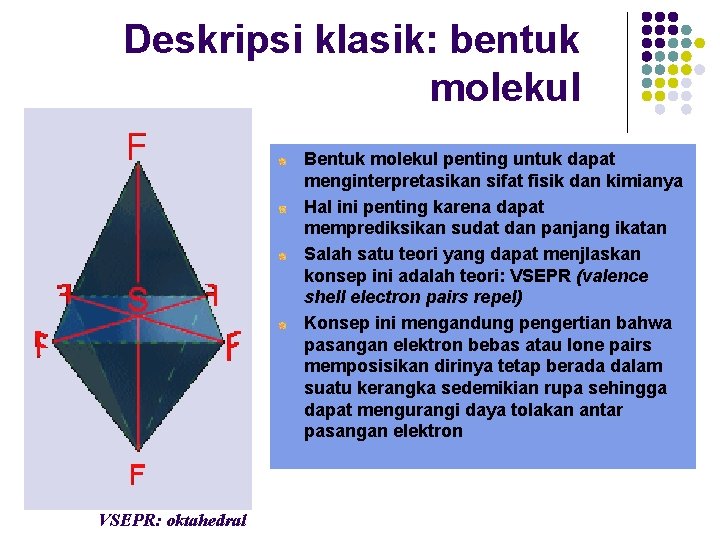
Deskripsi klasik: bentuk molekul Bentuk molekul penting untuk dapat menginterpretasikan sifat fisik dan kimianya Hal ini penting karena dapat memprediksikan sudat dan panjang ikatan Salah satu teori yang dapat menjlaskan konsep ini adalah teori: VSEPR (valence shell electron pairs repel) Konsep ini mengandung pengertian bahwa pasangan elektron bebas atau lone pairs memposisikan dirinya tetap berada dalam suatu kerangka sedemikian rupa sehingga dapat mengurangi daya tolakan antar pasangan elektron VSEPR: oktahedral

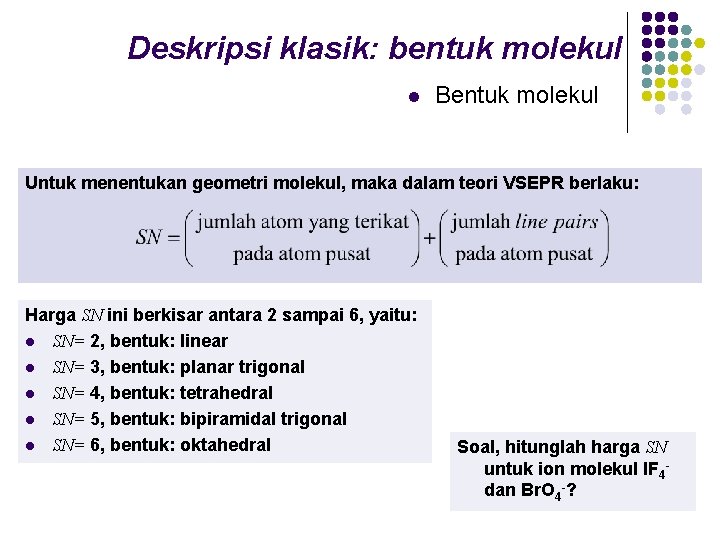
Deskripsi klasik: bentuk molekul l Bentuk molekul Untuk menentukan geometri molekul, maka dalam teori VSEPR berlaku: Harga SN ini berkisar antara 2 sampai 6, yaitu: l SN= 2, bentuk: linear l SN= 3, bentuk: planar trigonal l SN= 4, bentuk: tetrahedral l SN= 5, bentuk: bipiramidal trigonal l SN= 6, bentuk: oktahedral Soal, hitunglah harga SN untuk ion molekul IF 4 dan Br. O 4 -?

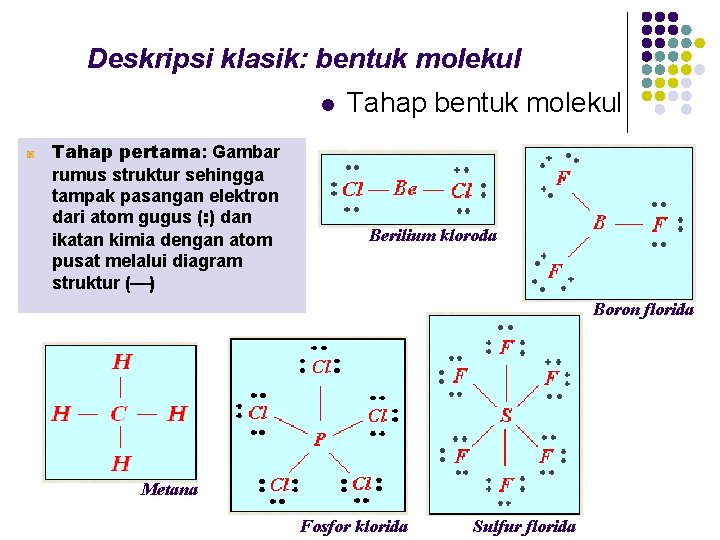
Deskripsi klasik: bentuk molekul l Tahap pertama: Gambar rumus struktur sehingga tampak pasangan elektron dari atom gugus (: ) dan ikatan kimia dengan atom pusat melalui diagram struktur ( ) Tahap bentuk molekul Berilium kloroda Boron florida Metana Fosfor klorida Sulfur florida

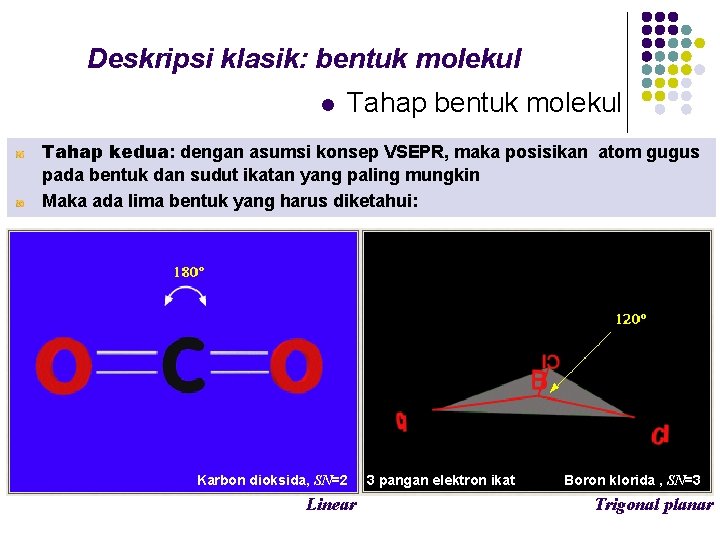
Deskripsi klasik: bentuk molekul l Tahap bentuk molekul Tahap kedua: dengan asumsi konsep VSEPR, maka posisikan atom gugus pada bentuk dan sudut ikatan yang paling mungkin Maka ada lima bentuk yang harus diketahui: Karbon dioksida, SN=2 Linear 3 pangan elektron ikat Boron klorida , SN=3 Trigonal planar

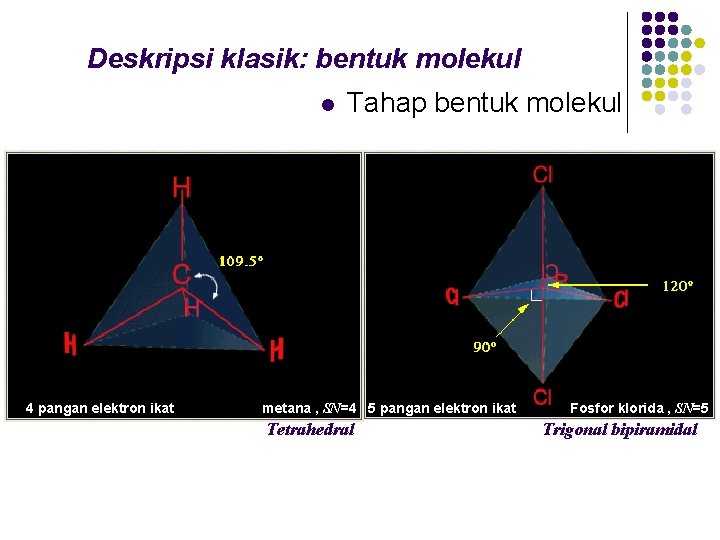
Deskripsi klasik: bentuk molekul l 4 pangan elektron ikat Tahap bentuk molekul metana , SN=4 5 pangan elektron ikat Tetrahedral Fosfor klorida , SN=5 Trigonal bipiramidal

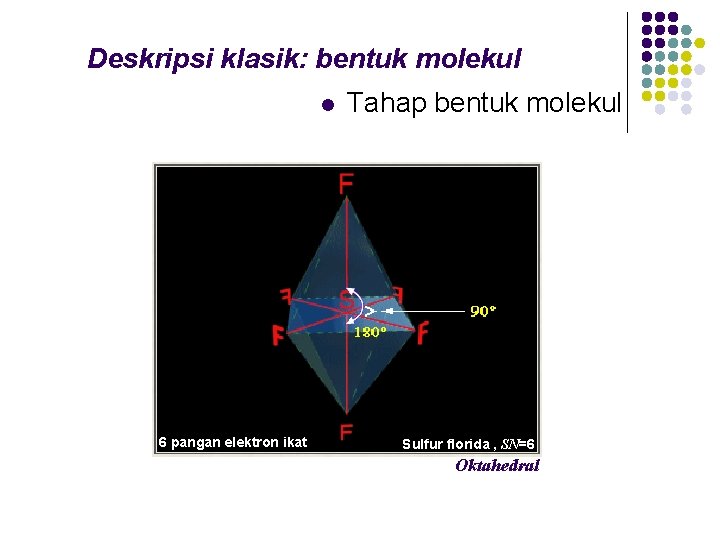
Deskripsi klasik: bentuk molekul l 6 pangan elektron ikat Tahap bentuk molekul Sulfur florida , SN=6 Oktahedral

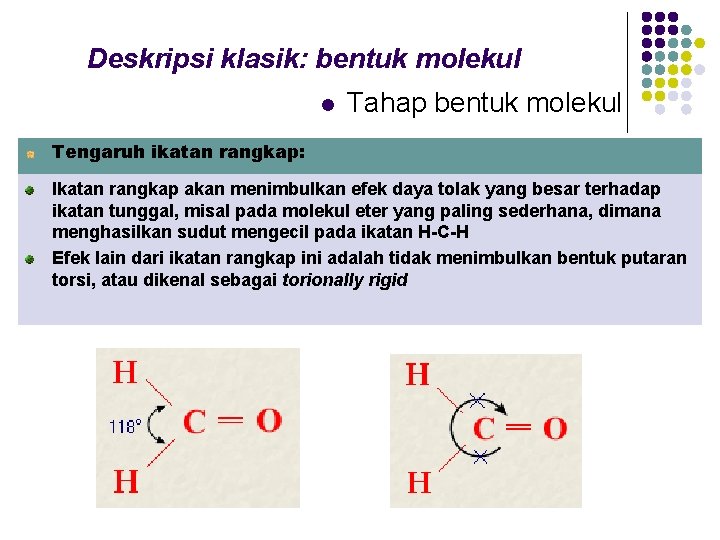
Deskripsi klasik: bentuk molekul l Tahap bentuk molekul Tengaruh ikatan rangkap: Ikatan rangkap akan menimbulkan efek daya tolak yang besar terhadap ikatan tunggal, misal pada molekul eter yang paling sederhana, dimana menghasilkan sudut mengecil pada ikatan H-C-H Efek lain dari ikatan rangkap ini adalah tidak menimbulkan bentuk putaran torsi, atau dikenal sebagai torionally rigid 6 pangan elektron ikat Sulfur florida

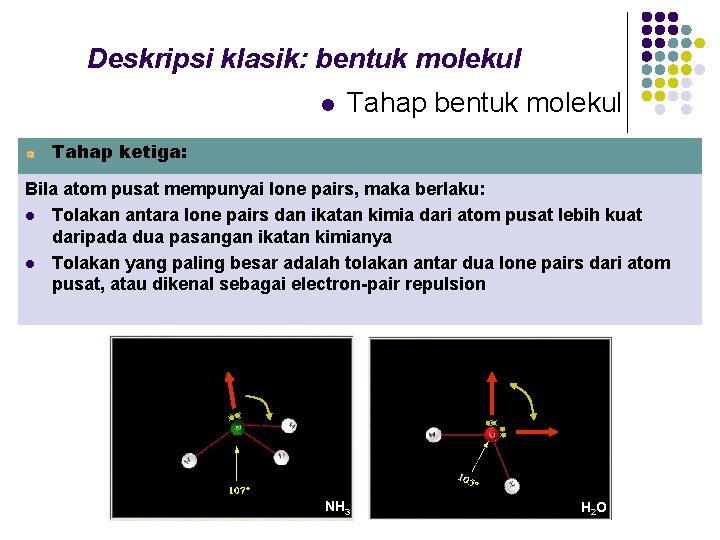
Deskripsi klasik: bentuk molekul l Tahap bentuk molekul Tahap ketiga: Bila atom pusat mempunyai lone pairs, maka berlaku: l Tolakan antara lone pairs dan ikatan kimia dari atom pusat lebih kuat daripada dua pasangan ikatan kimianya l Tolakan yang paling besar adalah tolakan antar dua lone pairs dari atom pusat, atau dikenal sebagai electron-pair repulsion NH 3 H 2 O

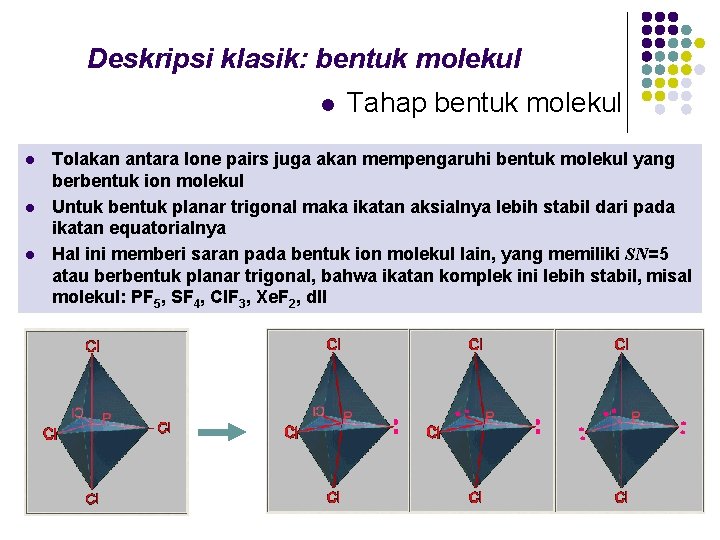
Deskripsi klasik: bentuk molekul l l Tahap bentuk molekul Tolakan antara lone pairs juga akan mempengaruhi bentuk molekul yang berbentuk ion molekul Untuk bentuk planar trigonal maka ikatan aksialnya lebih stabil dari pada ikatan equatorialnya Hal ini memberi saran pada bentuk ion molekul lain, yang memiliki SN=5 atau berbentuk planar trigonal, bahwa ikatan komplek ini lebih stabil, misal molekul: PF 5, SF 4, Cl. F 3, Xe. F 2, dll

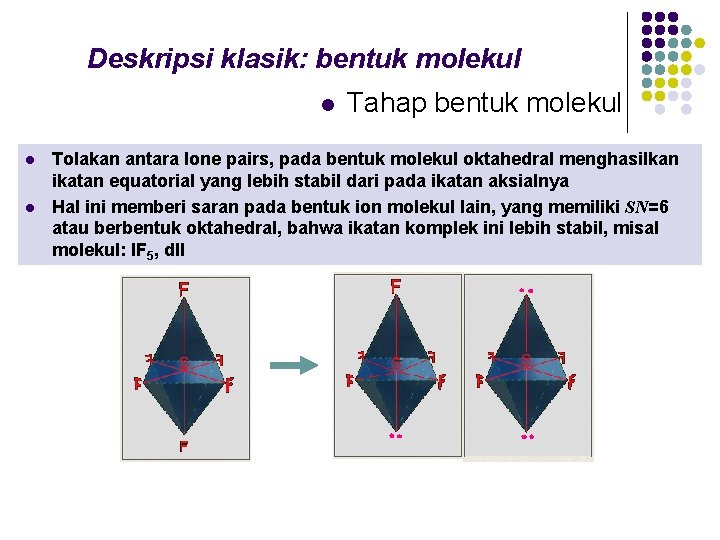
Deskripsi klasik: bentuk molekul l Tahap bentuk molekul Tolakan antara lone pairs, pada bentuk molekul oktahedral menghasilkan ikatan equatorial yang lebih stabil dari pada ikatan aksialnya Hal ini memberi saran pada bentuk ion molekul lain, yang memiliki SN=6 atau berbentuk oktahedral, bahwa ikatan komplek ini lebih stabil, misal molekul: IF 5, dll
 Ikatan datif
Ikatan datif Rice n beans or ricin beans a deadly swap answers
Rice n beans or ricin beans a deadly swap answers Lambang lewis menggambarkan
Lambang lewis menggambarkan Sudut ikatan f2
Sudut ikatan f2 Ikatan kimia
Ikatan kimia Cara membersihkan tali perkhemahan
Cara membersihkan tali perkhemahan Contoh soal ikatan sigma dan phi
Contoh soal ikatan sigma dan phi D
D Karbon dan klorin
Karbon dan klorin Ikatan senat mahasiswa kesehatan masyarakat indonesia
Ikatan senat mahasiswa kesehatan masyarakat indonesia Ijumpi
Ijumpi Jenis jenis bandage
Jenis jenis bandage Nama senyawa berikut adalah
Nama senyawa berikut adalah Ikatan
Ikatan Ikatan
Ikatan Ikatan akuntansi indonesia adalah
Ikatan akuntansi indonesia adalah Ikatan dokter indonesia merupakan organisasi
Ikatan dokter indonesia merupakan organisasi Wheat adalah
Wheat adalah Eginia penulis ikatan cinta
Eginia penulis ikatan cinta Peta konsep gaya antar molekul
Peta konsep gaya antar molekul Ikatan apa
Ikatan apa Elektrovalen
Elektrovalen Peran simbolik makanan adalah
Peran simbolik makanan adalah Hibridisasi atom c pada molekul hcoh adalah
Hibridisasi atom c pada molekul hcoh adalah Energi ikatan
Energi ikatan Kestabilan atom
Kestabilan atom Kode etik ikatan akuntan indonesia dimaksudkan sebagai
Kode etik ikatan akuntan indonesia dimaksudkan sebagai Peran simbolik makanan
Peran simbolik makanan Definisi ikatan datif
Definisi ikatan datif Ikatan peptida
Ikatan peptida Buatlah diagram tingkat energi untuk penguraian gas amonia
Buatlah diagram tingkat energi untuk penguraian gas amonia Label the parts of the dna molecule.
Label the parts of the dna molecule. Bahan pengalir elektrik
Bahan pengalir elektrik Struktur geometri if2-
Struktur geometri if2- Lencana perkhidmatan kelana
Lencana perkhidmatan kelana Orde ikatan
Orde ikatan Perubahan entalpi
Perubahan entalpi Wear your heart on your sleeve idiom meaning
Wear your heart on your sleeve idiom meaning Ion kompleks
Ion kompleks