TRI SETYAWATI Ikatan kovalen koordinat Ikatan ionik Ikatan




















- Slides: 25

TRI SETYAWATI

Ikatan kovalen koordinat Ikatan ionik Ikatan hidrogen Interaksi dipole - interaksi ion-dipole dan dipole-dipole - interaksi ion-induced dipole Ikatan van der waals Ikatan hidrofobik

IKATAN KOVALEN - Penggunaan bersama elektron oleh atom yang berikatan - Setiap atom hidrogen memiliki satu elektron single - Dalam molekul hidrogen kedua atom hidrogen menggunakan bersama 1 pasang elektron - Dalam metana atom karbon melengkapi struktur sel terluarnya 8 elektron dengan menggunakan bersama elektron dengan atom hidrogen


- Ikatan rangkap dua atau rangkap tiga antara dua atom - Dua atom mempunyai 4 dan 6 elektron yang digunakan bersama H H. . - H: C: H

Ikatan kovalen dibentuk antara atom-atom yang menggunakan bersama 2 elektron Ikatan kovalen mempunyai 3 karakteristik a. Jika dua atau lebih ikatan dihubungkan dengan satu atom cenderung membentuk sudut tertentu b. Jarak terdekat antar atom biasanya 1. 2– 1, 6 A c. Mempunyai energi ikatan tinggi 50 -140 kkal/mol

Ikatan kovalen, karena energi ikatannya tinggi irreversibel, perlu intervensi agen katalitik ( suatu enzim) untuk membentuk/ memecah Dalam reaksi enzim, asosiasi substrat pada sisi katalitik enzim dapat terjadi melalui asosiasi lemah, tetapi reaksi enzimatik melibatkan pembentukan dan pemecahan ikatan kovalen Antagonis kompetitif dapat berasosiasi dengan sisi enzim melalui interaksi lemah dan menggantikan substrat

Antagonis irrev membentuk ikatan kovalen dengan enzim -- komplek yang stabil Hambatan irreversibel enzim oleh fosfat organik dan karbamat ----. > ikatan kovalen residu tersebut pada enzim DFT (Diisopropilfosforofluoridat ) dan fosfat organik mengandung atom phosphor , kekurangan elektron karena kekuatan menarik elektron dari halogen

Suatu molekul dapat bereaksi dengan gugus hidroksil serin pada sisi aktif enzim yang mengandung serin melalui serangan elektrofilik pada atom oksigen yang kaya elektron membentuk diisopropilphosphorilserin DFP sebagai inhibitor irrev beberapa enzim yang mengandung serin mis ; asetilkolin esterase, kimotripsin, tripsin dengan menempati sisi aktif -- ikatan kovalen

Nitrogen mustard dan ion etilen imonium sebagai intermediet sangat reaktif dapat dengan mudah di serang oleh karboksilat, phosphat atau anion sulfhidril - Suatu zat pengalkil bifungsional yang mampu membentuk 2 ikatan kovalen -- 2 ikatan silang makromolekul / 2 bagian dari makromolekul yang sama

Pembentukan ikatan kovalen s-s dalam protein antara 2 residu sistein -- struktur protein stabil Ion metal : merkuri, timah, coper bereaksi dengan gugus sulfhidril enzim dan koenzim dg pembentukan ikatan kovalen

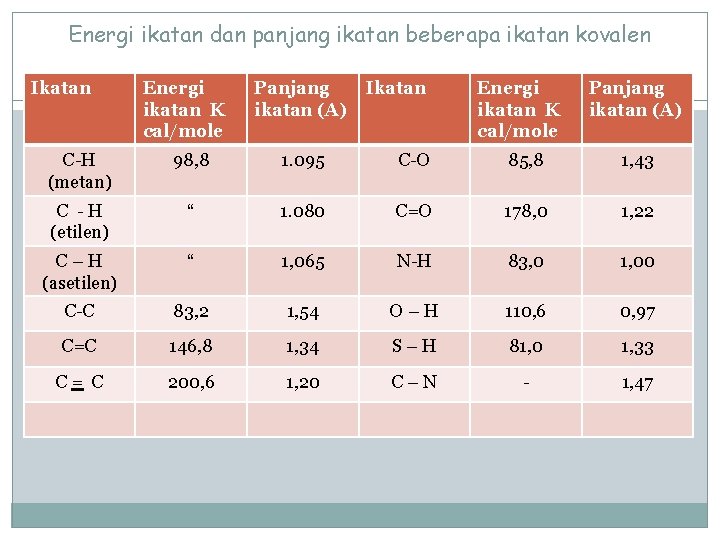
Energi ikatan dan panjang ikatan beberapa ikatan kovalen Ikatan Energi ikatan K cal/mole Panjang ikatan (A) C-H (metan) 98, 8 1. 095 C-O 85, 8 1, 43 C -H (etilen) “ 1. 080 C=O 178, 0 1, 22 C–H (asetilen) “ 1, 065 N-H 83, 0 1, 00 C-C 83, 2 1, 54 O–H 110, 6 0, 97 C=C 146, 8 1, 34 S–H 81, 0 1, 33 C= C 200, 6 1, 20 C–N - 1, 47

IKATAN KOVALEN KOORDINAT - Satu dari atom yang berkontribusi mendonorkan 1 pasang elektron sehingga bermuatan positif aseptor atom bermuatan negatif Atom nitrogen, Kehilangan muatan negatif disekitar intinya


IKATAN IONIK - Ikatan asetilkolin pada sisi anionik enzim

IKATAN HIDROGEN - Atom hidrogen di ikat pada atom yang sangat elektronegatif ( F. S. O, dan N) - Energi ikatannya 2 -5 Kcal/mole - Ikatan antara atom hidrogen dari satu molekul air dengan atom oksigen dari molekul air lainnya - Menstabilkan struktur alfa helix dan plated sheet protein

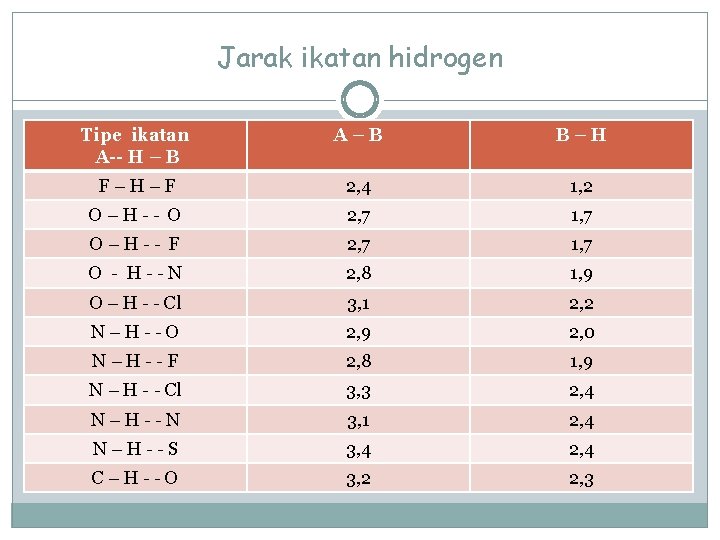
Jarak ikatan hidrogen Tipe ikatan A-- H – B A–B B–H F–H–F 2, 4 1, 2 O–H-- O 2, 7 1, 7 O–H-- F 2, 7 1, 7 O - H--N 2, 8 1, 9 O – H - - Cl 3, 1 2, 2 N–H--O 2, 9 2, 0 N–H--F 2, 8 1, 9 N – H - - Cl 3, 3 2, 4 N–H--N 3, 1 2, 4 N–H--S 3, 4 2, 4 C–H--O 3, 2 2, 3

Contoh ikatan hidrogen Donor Aseptor system Delta G(Kcal/mole) OH O=C Asam format 7, 0 HOH H-O-H Air 3, 4 – 7, 7 F-H F Asam hidrofluorat 6, 8 NH O=C Peptida, asam nukleat 5, 0

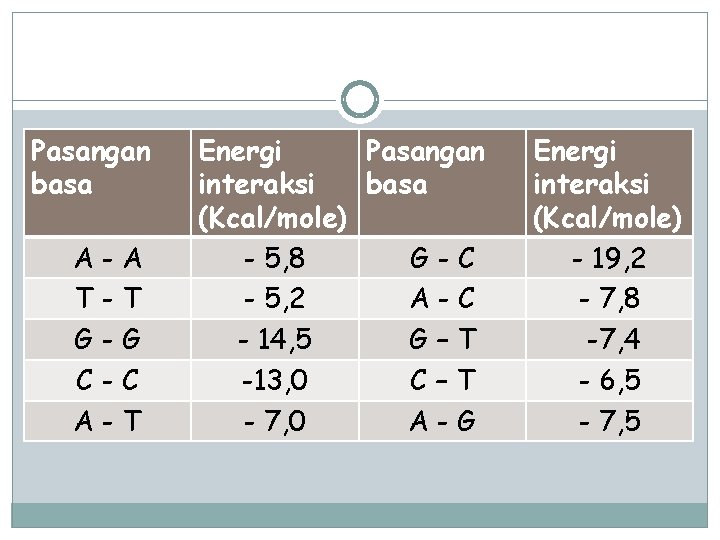
Pasangan basa A-A T-T G-G C-C A-T Energi Pasangan interaksi basa (Kcal/mole) - 5, 8 G-C - 5, 2 A-C - 14, 5 G–T -13, 0 C–T - 7, 0 A-G Energi interaksi (Kcal/mole) - 19, 2 - 7, 8 -7, 4 - 6, 5 - 7, 5

INTERAKSI DIPOLE dua atom yang elektronegativitasnya tidak sama digabung bersama Interaksi Hydrophobic - self-associate senyawa non polar dalam lingkungan air.

Interaksi Electrostatic Interactions antara gugus bermuatan membentuk struktur biomolekul Interaksi elektrostatik antara gugus yang bermuatan berlawanan di dalam/diantara biomolekul : Jembatan garam sebanding dengan ikatan hidrogen tetapi jarak bekerjanya lebih panjang. Memfasilitasi pengikatan ion dan molekul bermuatan pada protein dan asam nukleat

Van der Waals Forces - Ikatan yang lebih lemah dibanding ikatan hidrogen - Bekerja pada jarak yang lebih pendek 2 -4 Ao.

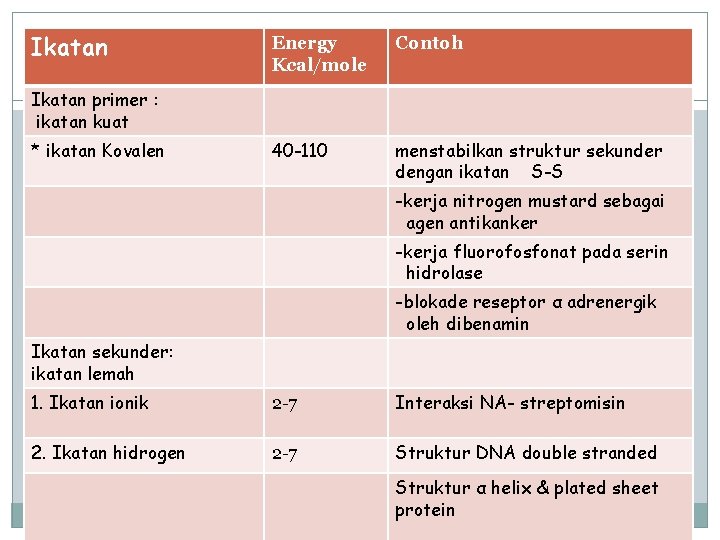
Ikatan Energy Kcal/mole Contoh 40 -110 menstabilkan struktur sekunder dengan ikatan S-S Ikatan primer : ikatan kuat * ikatan Kovalen -kerja nitrogen mustard sebagai agen antikanker -kerja fluorofosfonat pada serin hidrolase -blokade reseptor α adrenergik oleh dibenamin Ikatan sekunder: ikatan lemah 1. Ikatan ionik 2 -7 Interaksi NA- streptomisin 2. Ikatan hidrogen 2 -7 Struktur DNA double stranded Struktur α helix & plated sheet protein

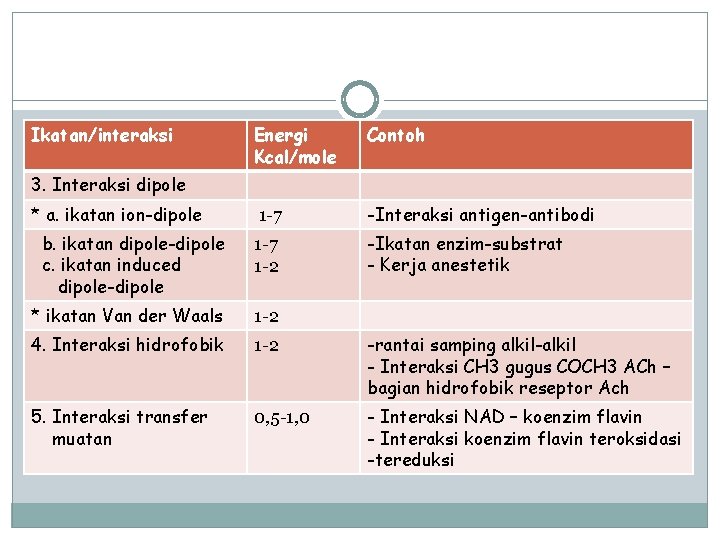
Ikatan/interaksi Energi Kcal/mole Contoh 1 -7 -Interaksi antigen-antibodi b. ikatan dipole-dipole c. ikatan induced dipole-dipole 1 -7 1 -2 -Ikatan enzim-substrat - Kerja anestetik * ikatan Van der Waals 1 -2 4. Interaksi hidrofobik 1 -2 -rantai samping alkil-alkil - Interaksi CH 3 gugus COCH 3 ACh – bagian hidrofobik reseptor Ach 5. Interaksi transfer muatan 0, 5 -1, 0 - Interaksi NAD – koenzim flavin - Interaksi koenzim flavin teroksidasi -tereduksi 3. Interaksi dipole * a. ikatan ion-dipole

 Tri tri tri fru fru fru
Tri tri tri fru fru fru Dinamismo di un cane al guinzaglio
Dinamismo di un cane al guinzaglio Susunan oktet
Susunan oktet Contoh material yang memiliki ikatan ion
Contoh material yang memiliki ikatan ion Ikatan datif
Ikatan datif Ikatan datif
Ikatan datif Kovalen polar
Kovalen polar Momen dipol adalah
Momen dipol adalah Faktor yang mempengaruhi analisis gravimetri
Faktor yang mempengaruhi analisis gravimetri Koordinat kartesius dari. r
Koordinat kartesius dari. r Salah satu bentuk seni rupa terapan yang memberi kebebasan
Salah satu bentuk seni rupa terapan yang memberi kebebasan Contoh soal sistem koordinat bola
Contoh soal sistem koordinat bola Koordinat cartesius titik (12 300°) adalah
Koordinat cartesius titik (12 300°) adalah Soal koordinat polar
Soal koordinat polar Koordinat yang dipakai dalam sistem operasi linux adalah
Koordinat yang dipakai dalam sistem operasi linux adalah Formula jarak koordinat
Formula jarak koordinat Cara dwi koordinat
Cara dwi koordinat Polar chart
Polar chart Matlab'da grafik çizdirme
Matlab'da grafik çizdirme Mita mempunyai 7 tangkai bunga yang berbeda-beda warnanya
Mita mempunyai 7 tangkai bunga yang berbeda-beda warnanya Rumus perbandingan vektor
Rumus perbandingan vektor Nyatakan 1,86 radian ke dalam ukuran sudut …
Nyatakan 1,86 radian ke dalam ukuran sudut … Koordinat titik puncak grafik fungsi kuadrat
Koordinat titik puncak grafik fungsi kuadrat Screen coordinate
Screen coordinate Teknik kunjaya
Teknik kunjaya Menghitung luas dengan koordinat
Menghitung luas dengan koordinat