REACCIONES DE DIEFERENTES GRUPOS FUNCIONALES ALCANOS CLASIFICACIN DE



















- Slides: 108

REACCIONES DE DIEFERENTES GRUPOS FUNCIONALES

ALCANOS

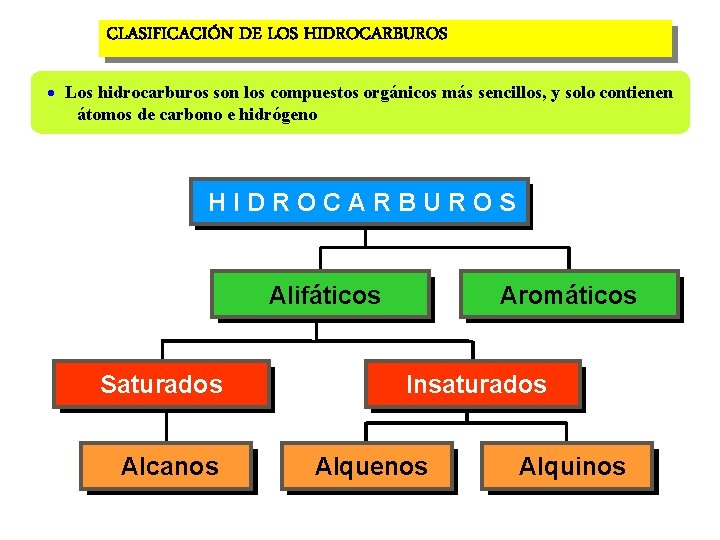
CLASIFICACIÓN DE LOS HIDROCARBUROS Los hidrocarburos son los compuestos orgánicos más sencillos, y solo contienen átomos de carbono e hidrógeno H I D R O C A R B U R O S Alifáticos Saturados Alcanos Aromáticos Insaturados Alquenos Alquinos

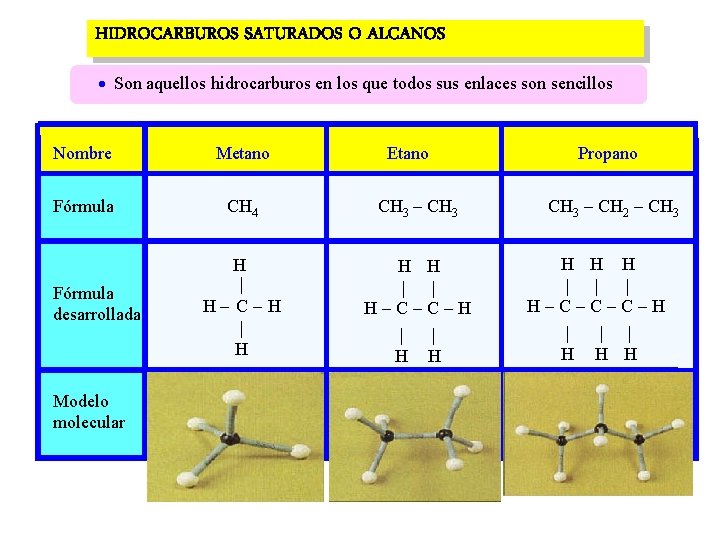
HIDROCARBUROS SATURADOS O ALCANOS Son aquellos hidrocarburos en los que todos sus enlaces son sencillos Nombre Metano Etano Propano Fórmula CH 4 CH 3 - CH 3 CH 3 - CH 2 - CH 3 Fórmula desarrollada Modelo molecular H | H - C - H | H H H | | H - C - H | | H H H | | | H - C - C - H | | | H H H

ALCANOS • Los alcanos son los compuestos orgánicos menos reactivos ya que carecen de grupos funcionales y, por tanto, de enlaces polarizados. • • Las reacciones más importantes de este grupo de compuestos son las halogenaciones radicalarias y la combustión.

Ruptura homolítica u homólisis • Es propia de dos átomos que no tienen una gran diferencia en electronegatividad. Cada átomo "se lleva" un electrón de cada pareja de electrones de enlace: da lugar a radicales libres. • Así se mide la Energía de Disociación.

Ruptura heterolítica o heterólisis • Es propia de dos átomos cuya electronegatividad es diferente. El átomo electronegativo "se lleva" los dos electrones de enlace: da lugar a iones. En general este proceso es menos costoso energéticamente que la ruptura homolítica.

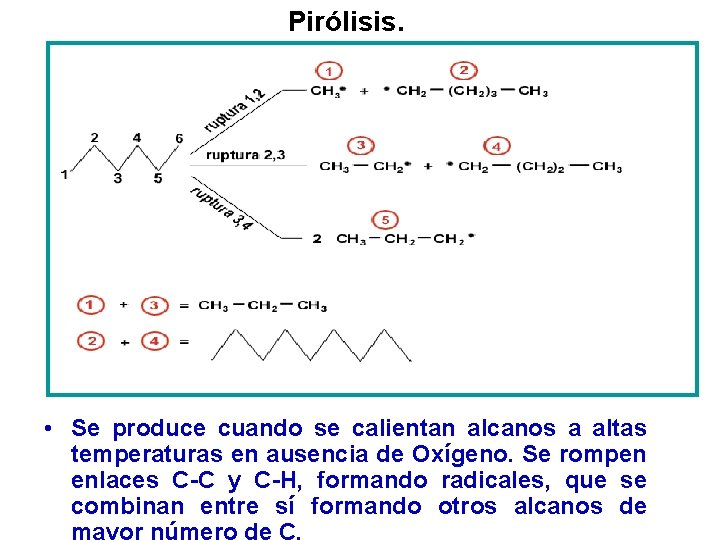
Pirólisis. • Se produce cuando se calientan alcanos a altas temperaturas en ausencia de Oxígeno. Se rompen enlaces C-C y C-H, formando radicales, que se combinan entre sí formando otros alcanos de

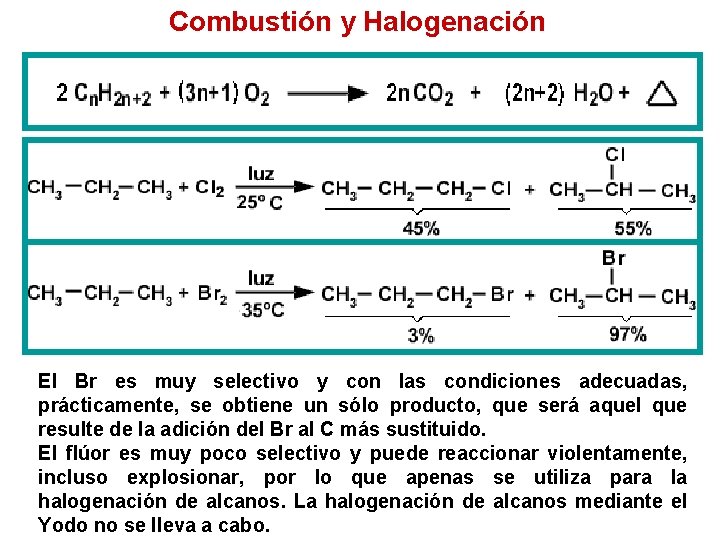
Combustión y Halogenación El Br es muy selectivo y con las condiciones adecuadas, prácticamente, se obtiene un sólo producto, que será aquel que resulte de la adición del Br al C más sustituido. El flúor es muy poco selectivo y puede reaccionar violentamente, incluso explosionar, por lo que apenas se utiliza para la halogenación de alcanos. La halogenación de alcanos mediante el Yodo no se lleva a cabo.

REACCIONES RADICALARIAS

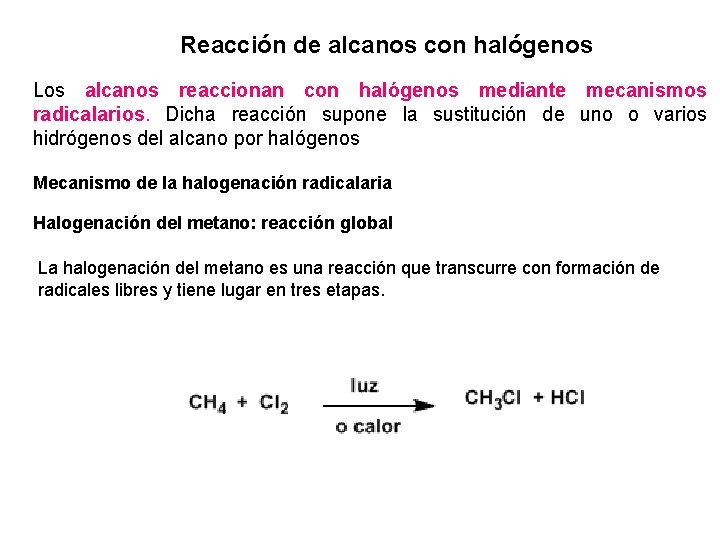
Reacción de alcanos con halógenos Los alcanos reaccionan con halógenos mediante mecanismos radicalarios. Dicha reacción supone la sustitución de uno o varios hidrógenos del alcano por halógenos Mecanismo de la halogenación radicalaria Halogenación del metano: reacción global La halogenación del metano es una reacción que transcurre con formación de radicales libres y tiene lugar en tres etapas.

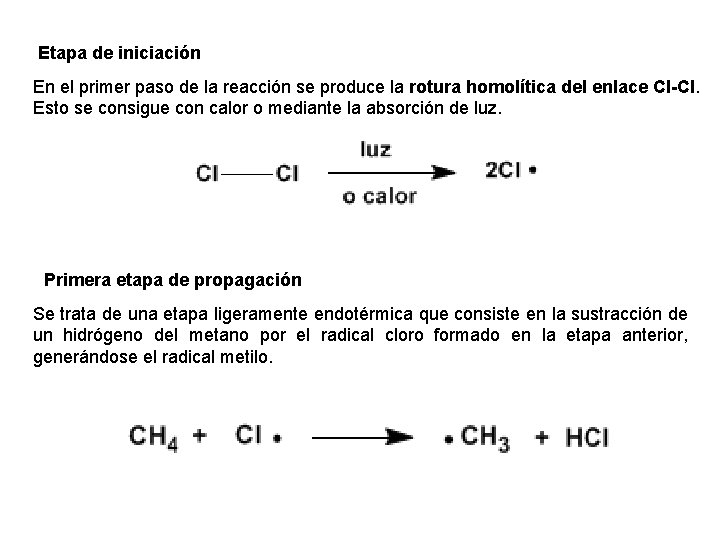
Etapa de iniciación En el primer paso de la reacción se produce la rotura homolítica del enlace Cl-Cl. Esto se consigue con calor o mediante la absorción de luz. Primera etapa de propagación Se trata de una etapa ligeramente endotérmica que consiste en la sustracción de un hidrógeno del metano por el radical cloro formado en la etapa anterior, generándose el radical metilo.

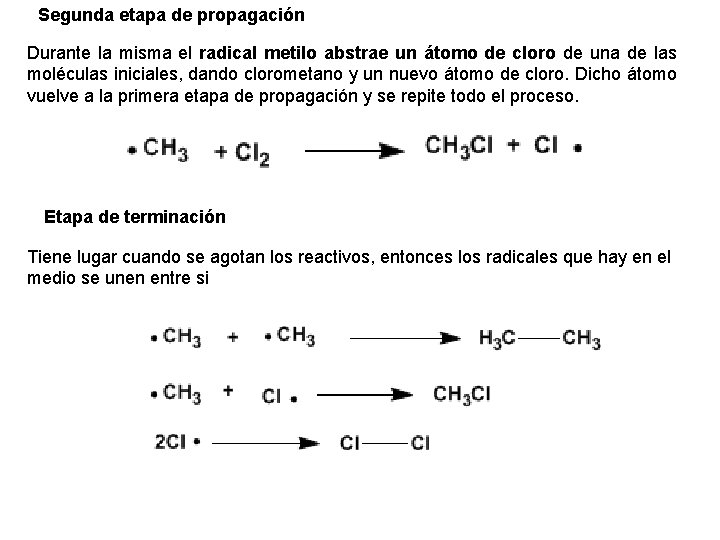
Segunda etapa de propagación Durante la misma el radical metilo abstrae un átomo de cloro de una de las moléculas iniciales, dando clorometano y un nuevo átomo de cloro. Dicho átomo vuelve a la primera etapa de propagación y se repite todo el proceso. Etapa de terminación Tiene lugar cuando se agotan los reactivos, entonces los radicales que hay en el medio se unen entre si

Estabilidad de Radicales Energía necesaria para romper enlaces Al romper de forma homolítica el enlace C-H de un alcano se producen radicales alquilo y átomos de hidrógeno libres. La energía necesaria para que ocurra esta rotura se denomina energía de disocíación y es tanto menor cuanto más estable sea el radical formado. Como puede verse en las siguientes reacciones, la energía necesaria para romper un enlace C-H primario es muy superior a la requerida para romper el enlace C-H terciario

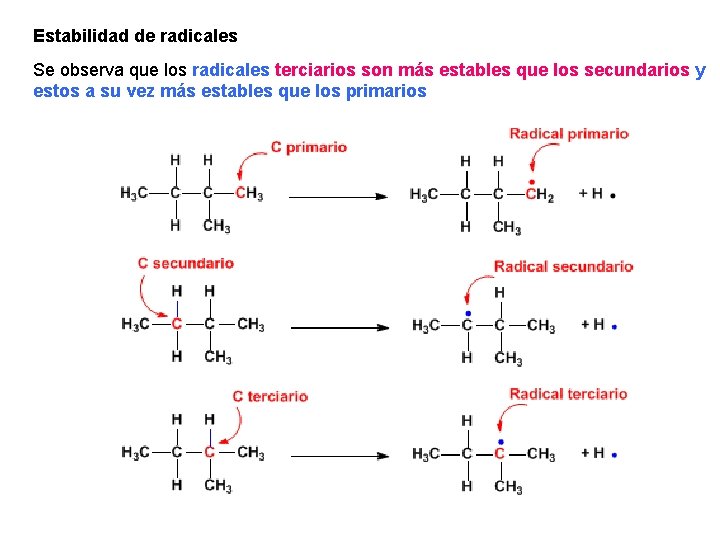
Estabilidad de radicales Se observa que los radicales terciarios son más estables que los secundarios y estos a su vez más estables que los primarios

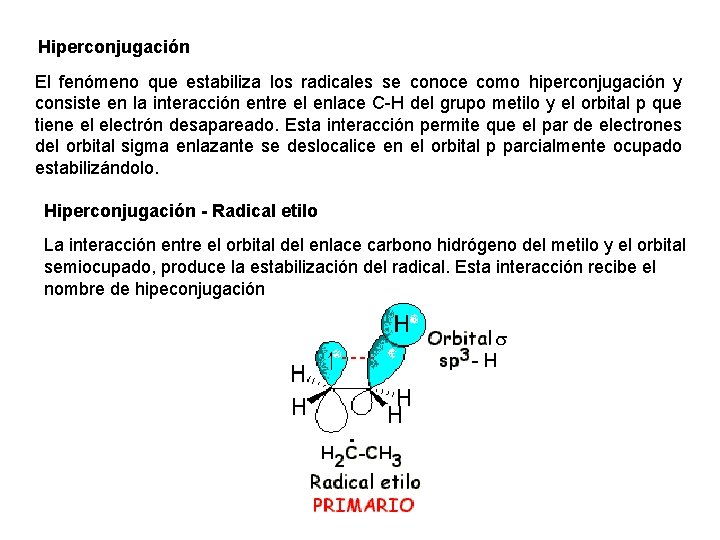
Hiperconjugación El fenómeno que estabiliza los radicales se conoce como hiperconjugación y consiste en la interacción entre el enlace C-H del grupo metilo y el orbital p que tiene el electrón desapareado. Esta interacción permite que el par de electrones del orbital sigma enlazante se deslocalice en el orbital p parcialmente ocupado estabilizándolo. Hiperconjugación - Radical etilo La interacción entre el orbital del enlace carbono hidrógeno del metilo y el orbital semiocupado, produce la estabilización del radical. Esta interacción recibe el nombre de hipeconjugación

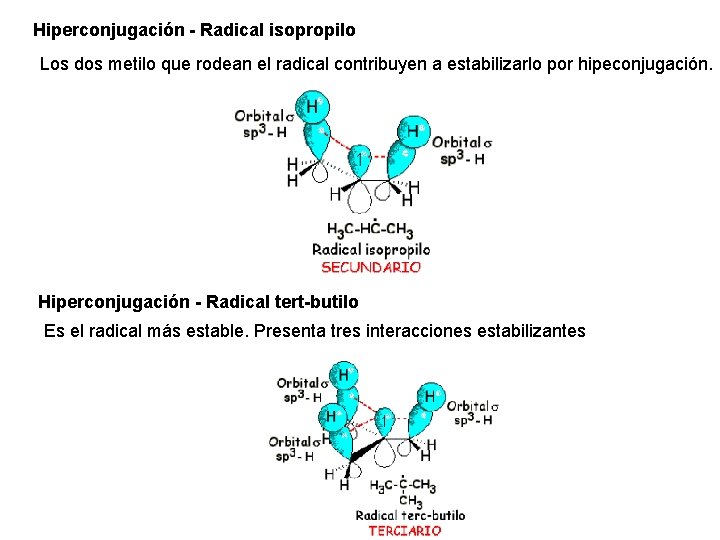
Hiperconjugación - Radical isopropilo Los dos metilo que rodean el radical contribuyen a estabilizarlo por hipeconjugación. Hiperconjugación - Radical tert-butilo Es el radical más estable. Presenta tres interacciones estabilizantes

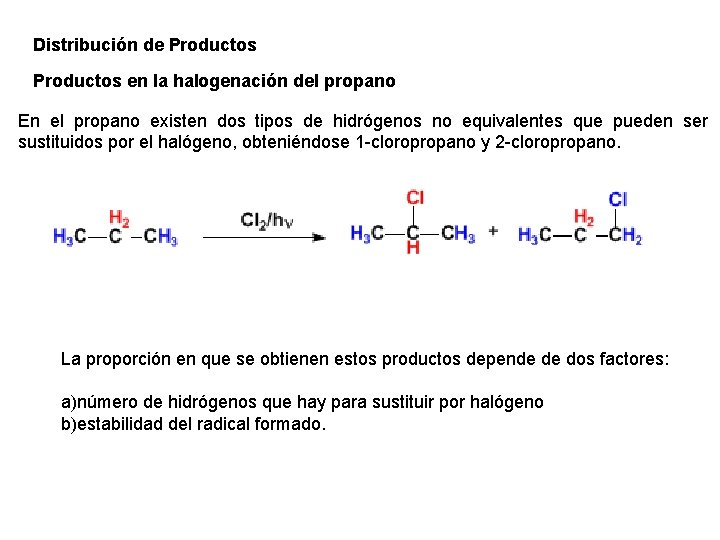
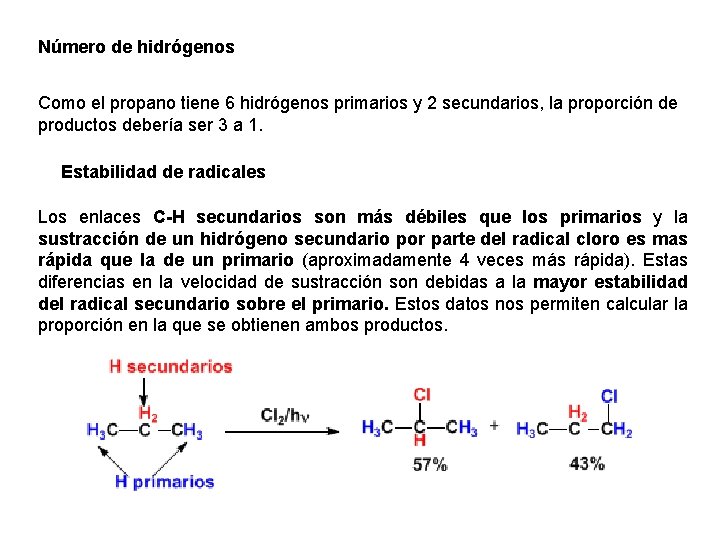
Distribución de Productos en la halogenación del propano En el propano existen dos tipos de hidrógenos no equivalentes que pueden ser sustituidos por el halógeno, obteniéndose 1 -cloropropano y 2 -cloropropano. La proporción en que se obtienen estos productos depende de dos factores: a)número de hidrógenos que hay para sustituir por halógeno b)estabilidad del radical formado.

Número de hidrógenos Como el propano tiene 6 hidrógenos primarios y 2 secundarios, la proporción de productos debería ser 3 a 1. Estabilidad de radicales Los enlaces C-H secundarios son más débiles que los primarios y la sustracción de un hidrógeno secundario por parte del radical cloro es mas rápida que la de un primario (aproximadamente 4 veces más rápida). Estas diferencias en la velocidad de sustracción son debidas a la mayor estabilidad del radical secundario sobre el primario. Estos datos nos permiten calcular la proporción en la que se obtienen ambos productos.

Velocidades relativas F(1 : 1, 2 : 1, 4), Cl(1 : 4 : 5), Br(1 : 250 : 6300). El primer número indica la velocidad con la que se sustituye un hidrógeno primario por el halógeno correspondiente. El segundo valor nos indica la velocidad de sustitución de un hidrógeno secundario por halógeno. El tercer valor se aplica a hidrógenos terciarios. Selectividad y reactividad Cuanto mas reactivo es el halógeno, menos distingue entre hidrógenos primarios, secundarios o terciarios. El flúor halogena casi por igual los tres tipos de hidrógenos y se dice que es poco selectivo. Por el contrario el bromo es muy poco reactivo y busca los hidrógenos más fáciles de arrancar, (los terciarios) y los sustituye 6300 veces más rápido que los primarios. Se dice de él que es muy selectivo

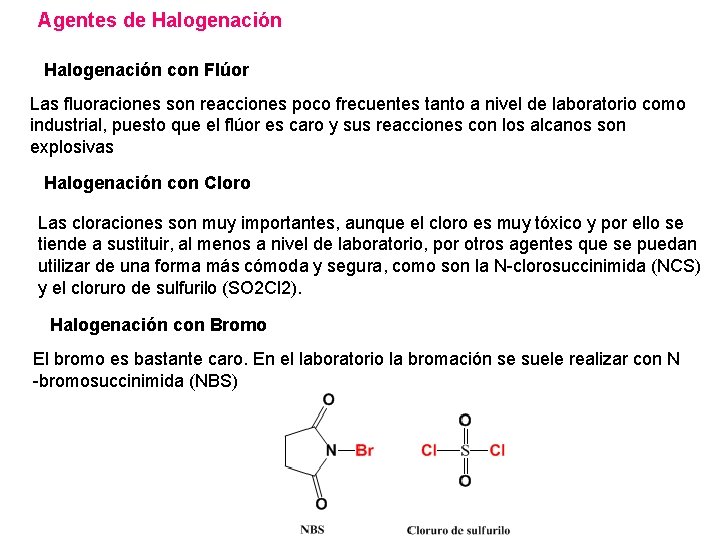
Agentes de Halogenación con Flúor Las fluoraciones son reacciones poco frecuentes tanto a nivel de laboratorio como industrial, puesto que el flúor es caro y sus reacciones con los alcanos son explosivas Halogenación con Cloro Las cloraciones son muy importantes, aunque el cloro es muy tóxico y por ello se tiende a sustituir, al menos a nivel de laboratorio, por otros agentes que se puedan utilizar de una forma más cómoda y segura, como son la N-clorosuccinimida (NCS) y el cloruro de sulfurilo (SO 2 Cl 2). Halogenación con Bromo El bromo es bastante caro. En el laboratorio la bromación se suele realizar con N -bromosuccinimida (NBS)

SUSTITUCIÓN - ELIMINACIÓN

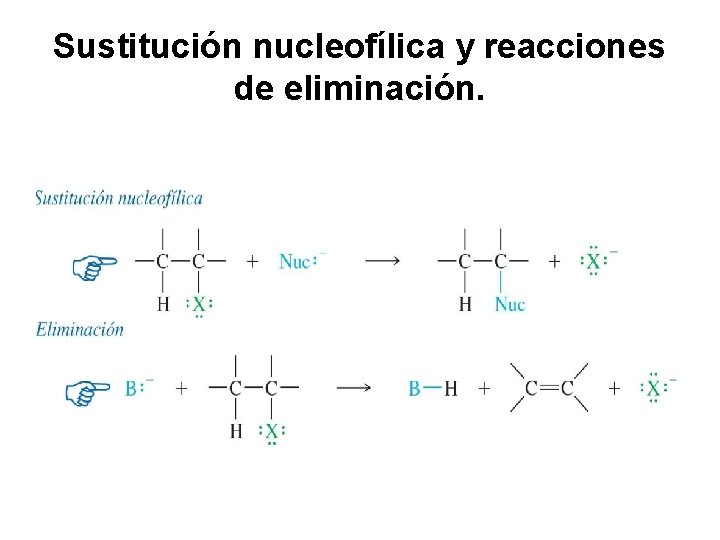
Sustitución nucleofílica y reacciones de eliminación.

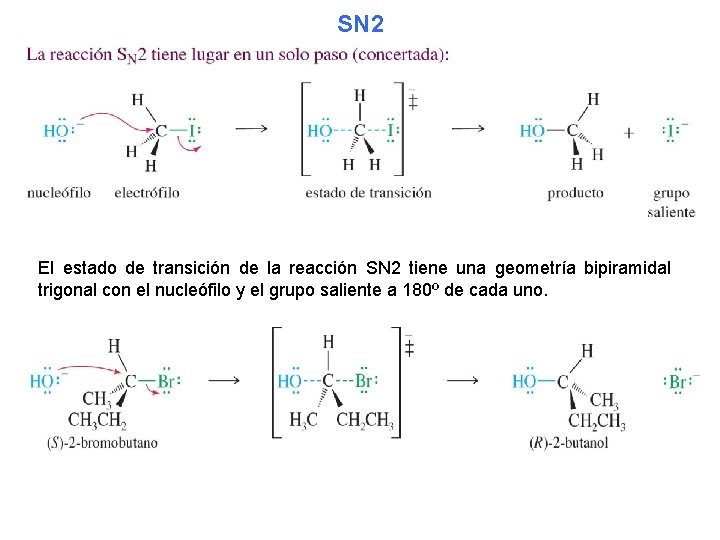
SN 2 El estado de transición de la reacción SN 2 tiene una geometría bipiramidal trigonal con el nucleófilo y el grupo saliente a 180º de cada uno.

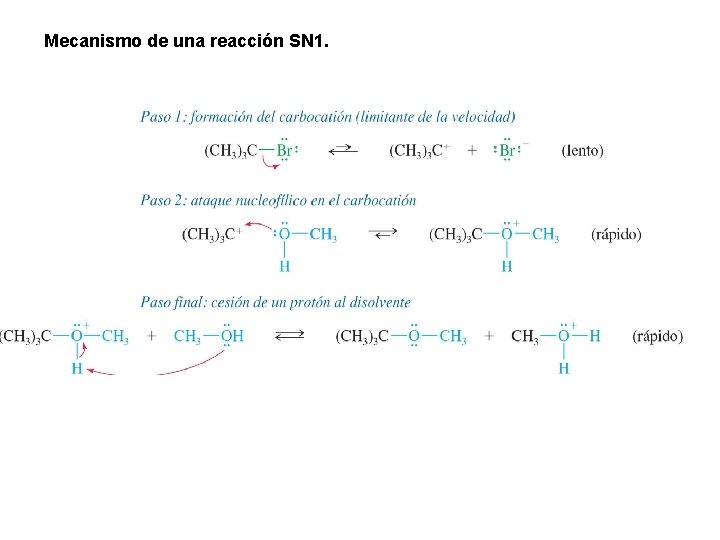
Mecanismo de una reacción SN 1.

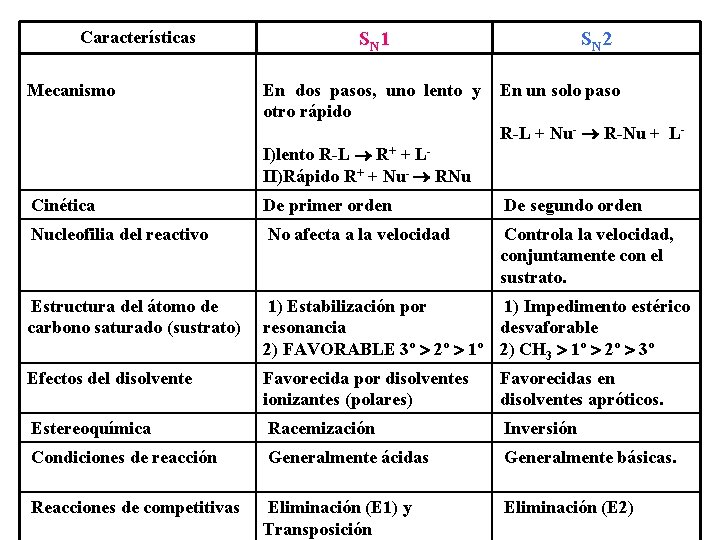
Características Mecanismo SN 1 SN 2 En dos pasos, uno lento y En un solo paso otro rápido R-L + Nu- ® R-Nu + LI)lento R-L ® R+ + LII)Rápido R+ + Nu- ® RNu Cinética De primer orden De segundo orden Nucleofilia del reactivo No afecta a la velocidad Controla la velocidad, conjuntamente con el sustrato. Estructura del átomo de carbono saturado (sustrato) 1) Estabilización por 1) Impedimento estérico resonancia desvaforable 2) FAVORABLE 3º > 2º > 1º 2) CH 3 > 1º > 2º > 3º Efectos del disolvente Favorecida por disolventes ionizantes (polares) Favorecidas en disolventes apróticos. Estereoquímica Racemización Inversión Condiciones de reacción Generalmente ácidas Generalmente básicas. Reacciones de competitivas Eliminación (E 1) y Transposición Eliminación (E 2)

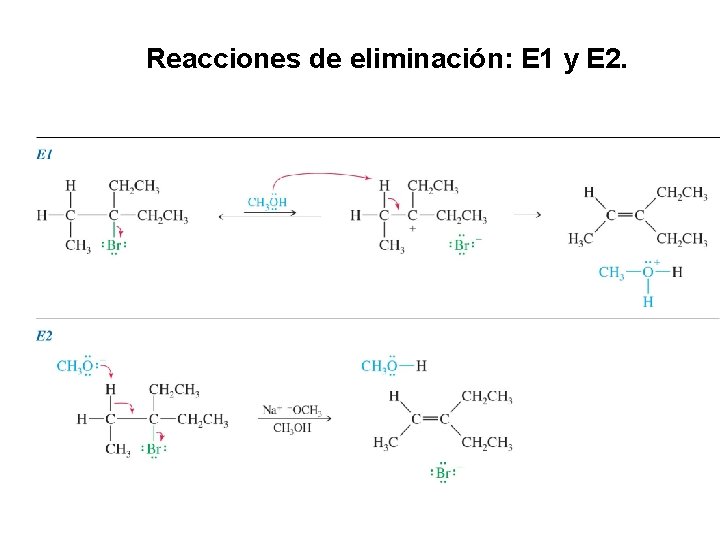
Reacciones de eliminación: E 1 y E 2.

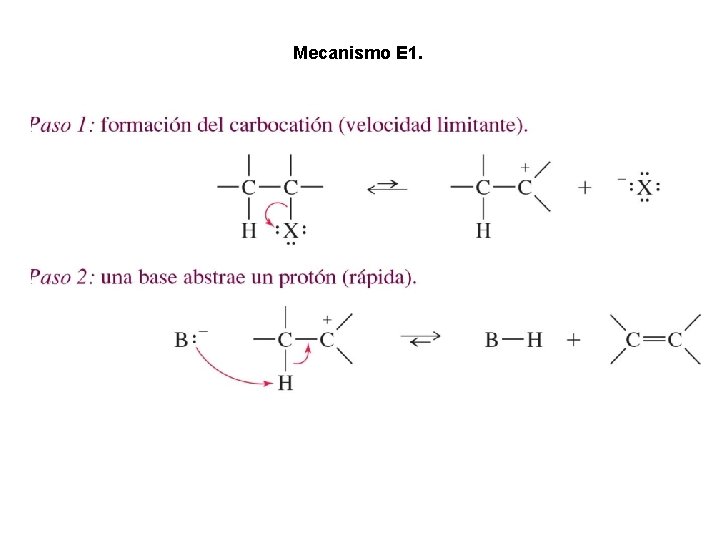
Mecanismo E 1.

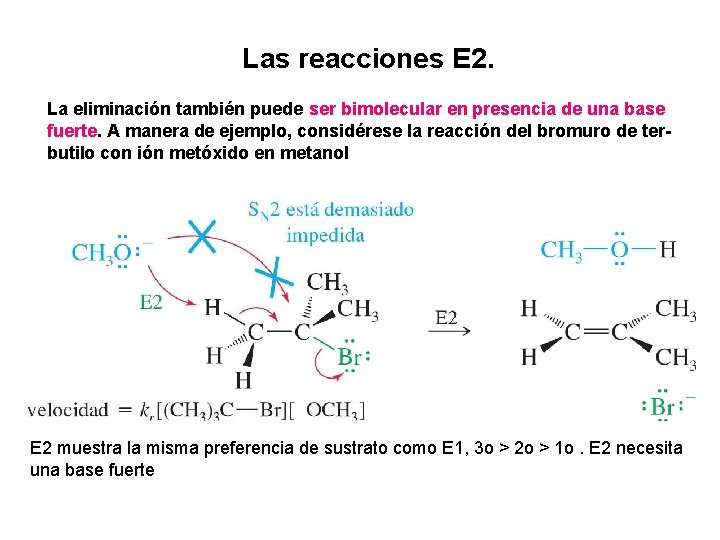
Las reacciones E 2. La eliminación también puede ser bimolecular en presencia de una base fuerte. A manera de ejemplo, considérese la reacción del bromuro de terbutilo con ión metóxido en metanol E 2 muestra la misma preferencia de sustrato como E 1, 3 o > 2 o > 1 o. E 2 necesita una base fuerte

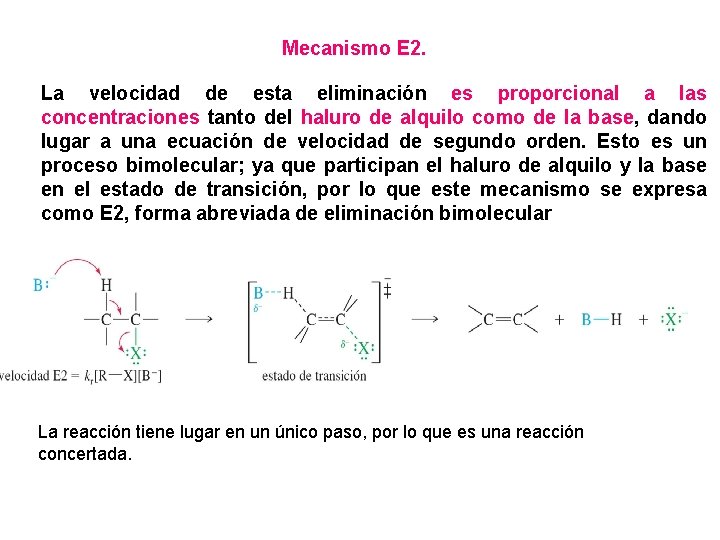
Mecanismo E 2. La velocidad de esta eliminación es proporcional a las concentraciones tanto del haluro de alquilo como de la base, dando lugar a una ecuación de velocidad de segundo orden. Esto es un proceso bimolecular; ya que participan el haluro de alquilo y la base en el estado de transición, por lo que este mecanismo se expresa como E 2, forma abreviada de eliminación bimolecular La reacción tiene lugar en un único paso, por lo que es una reacción concertada.

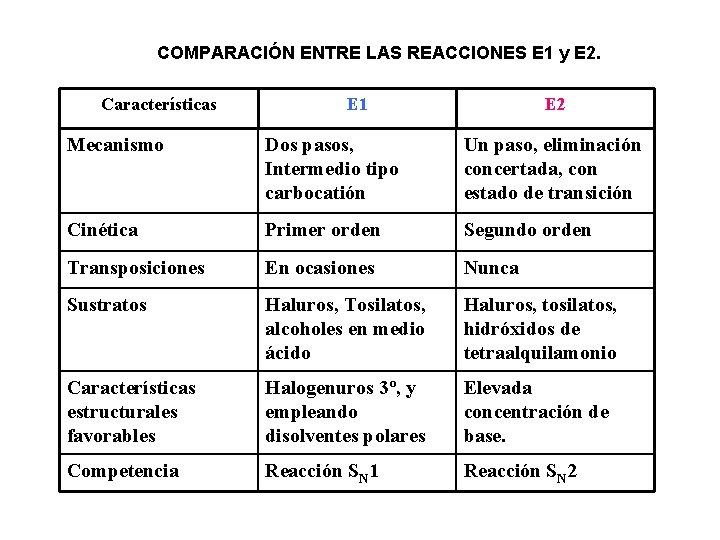
COMPARACIÓN ENTRE LAS REACCIONES E 1 y E 2. Características E 1 E 2 Mecanismo Dos pasos, Intermedio tipo carbocatión Un paso, eliminación concertada, con estado de transición Cinética Primer orden Segundo orden Transposiciones En ocasiones Nunca Sustratos Haluros, Tosilatos, alcoholes en medio ácido Haluros, tosilatos, hidróxidos de tetraalquilamonio Características estructurales favorables Halogenuros 3º, y empleando disolventes polares Elevada concentración de base. Competencia Reacción SN 1 Reacción SN 2

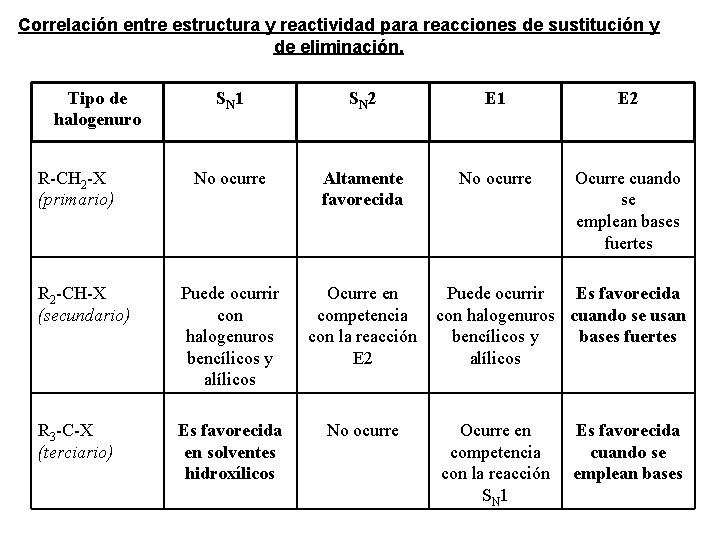
Correlación entre estructura y reactividad para reacciones de sustitución y de eliminación. Tipo de halogenuro R-CH 2 -X (primario) SN 1 SN 2 E 1 E 2 No ocurre Altamente favorecida No ocurre Ocurre cuando se emplean bases fuertes R 2 -CH-X (secundario) Puede ocurrir con halogenuros bencílicos y alílicos R 3 -C-X (terciario) Es favorecida en solventes hidroxílicos Ocurre en Puede ocurrir Es favorecida competencia con halogenuros cuando se usan con la reacción bencílicos y bases fuertes E 2 alílicos No ocurre Ocurre en competencia con la reacción SN 1 Es favorecida cuando se emplean bases

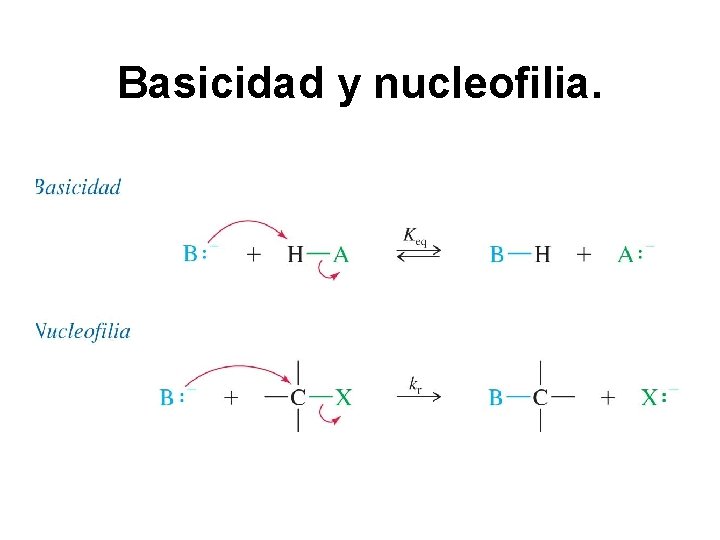
Basicidad y nucleofilia.

ALQUENOS

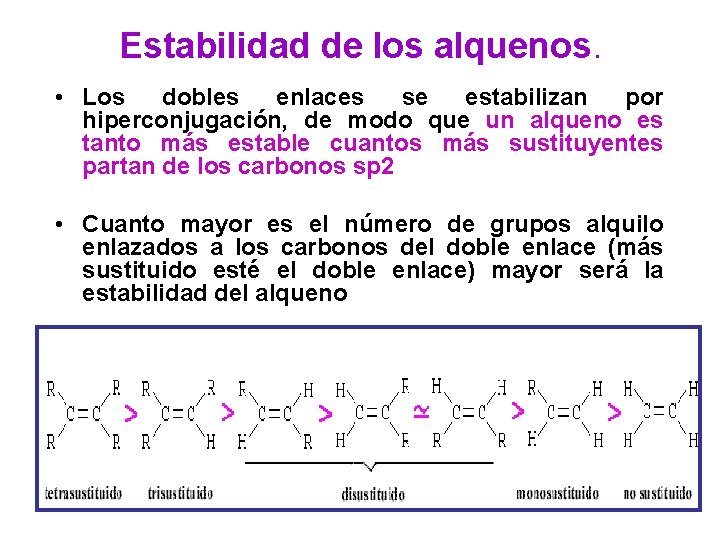
Estabilidad de los alquenos. • Los dobles enlaces se estabilizan por hiperconjugación, de modo que un alqueno es tanto más estable cuantos más sustituyentes partan de los carbonos sp 2 • Cuanto mayor es el número de grupos alquilo enlazados a los carbonos del doble enlace (más sustituido esté el doble enlace) mayor será la estabilidad del alqueno

Reacciones de alquenos Los alquenos adicionan gran variedad de reactivos al doble enlace. 1. Hidrogenación Alquenos 2. Adición de HX a Alquenos Regla de Markovnikov 3. Hidratación de Alquenos 4. Halogenación de Alquenos 5. Hidratación con Acetato de Mercurio 6. Hidroboración Alquenos 7. Oxidación con MCPBA Apertura Oxaciclopropanos 8. Formación de Dioles SIN 9. Ozonolisis 10. Reacciones Radicalarias

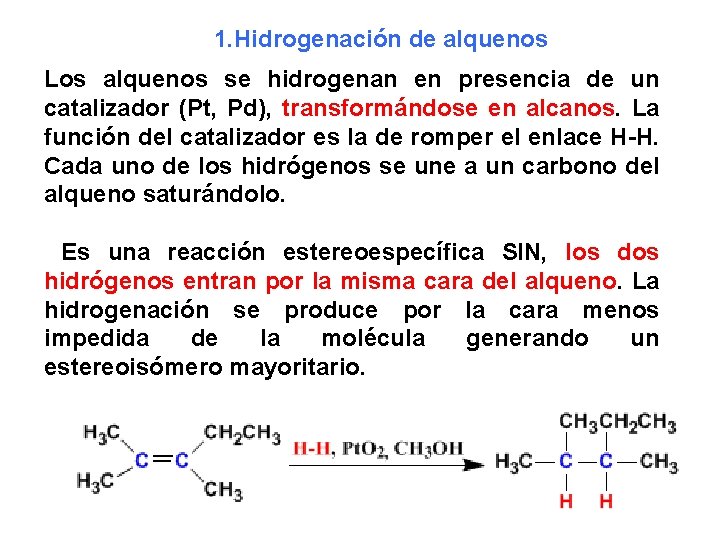
1. Hidrogenación de alquenos Los alquenos se hidrogenan en presencia de un catalizador (Pt, Pd), transformándose en alcanos. La función del catalizador es la de romper el enlace H-H. Cada uno de los hidrógenos se une a un carbono del alqueno saturándolo. Es una reacción estereoespecífica SIN, los dos hidrógenos entran por la misma cara del alqueno. La hidrogenación se produce por la cara menos impedida de la molécula generando un estereoisómero mayoritario.

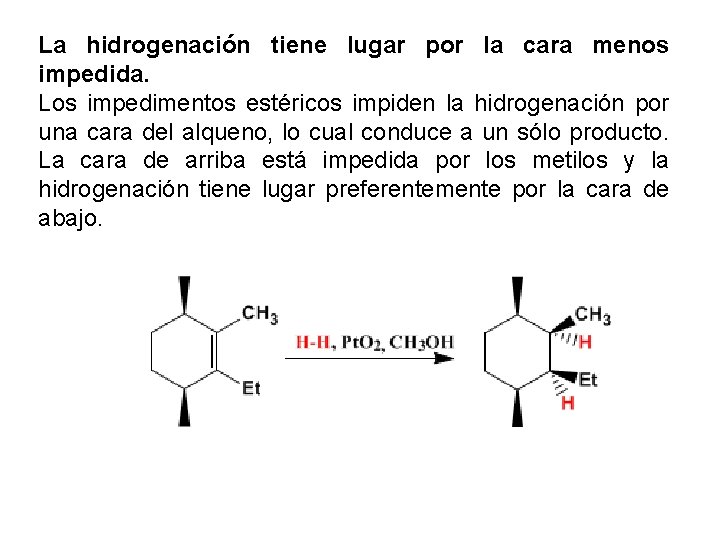
La hidrogenación tiene lugar por la cara menos impedida. Los impedimentos estéricos impiden la hidrogenación por una cara del alqueno, lo cual conduce a un sólo producto. La cara de arriba está impedida por los metilos y la hidrogenación tiene lugar preferentemente por la cara de abajo.

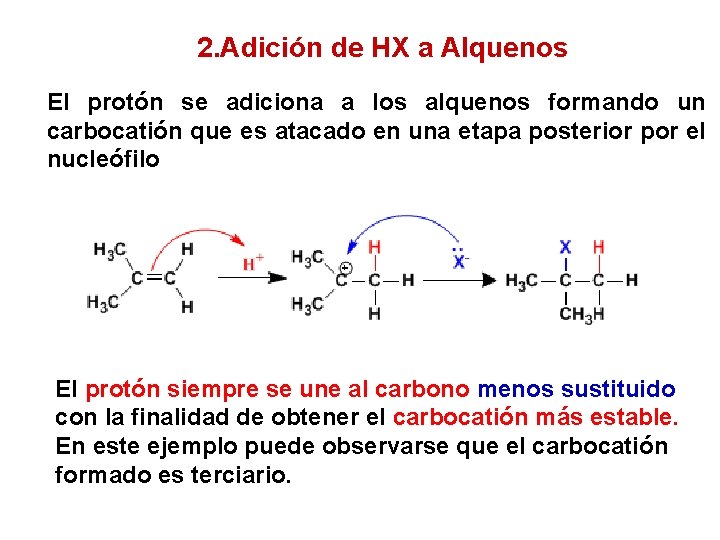
2. Adición de HX a Alquenos El protón se adiciona a los alquenos formando un carbocatión que es atacado en una etapa posterior por el nucleófilo El protón siempre se une al carbono menos sustituido con la finalidad de obtener el carbocatión más estable. En este ejemplo puede observarse que el carbocatión formado es terciario.

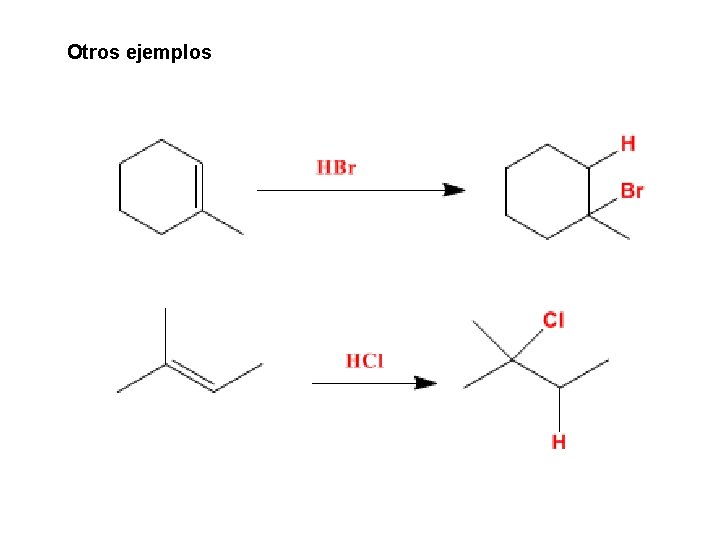
Otros ejemplos

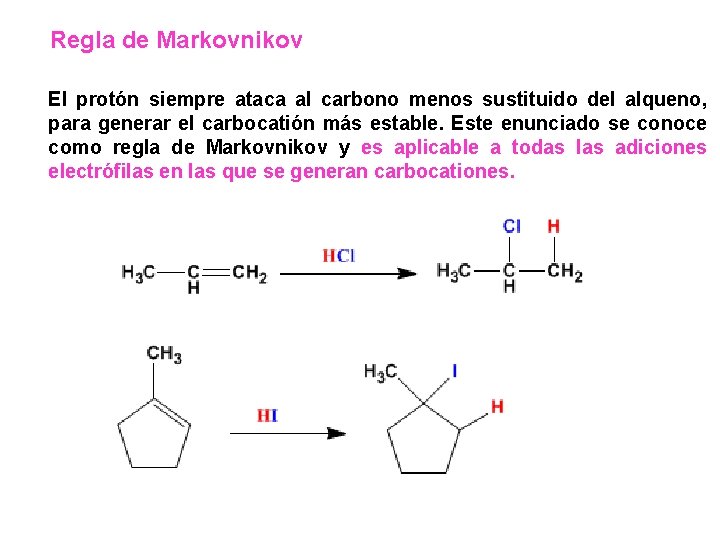
Regla de Markovnikov El protón siempre ataca al carbono menos sustituido del alqueno, para generar el carbocatión más estable. Este enunciado se conoce como regla de Markovnikov y es aplicable a todas las adiciones electrófilas en las que se generan carbocationes.

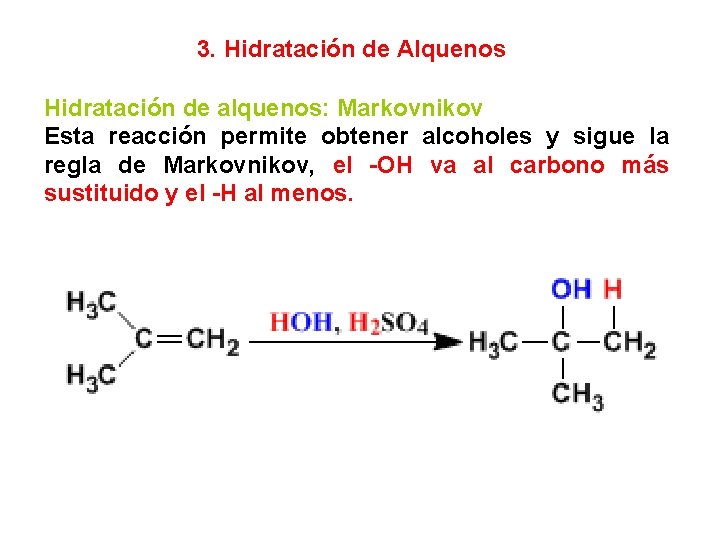
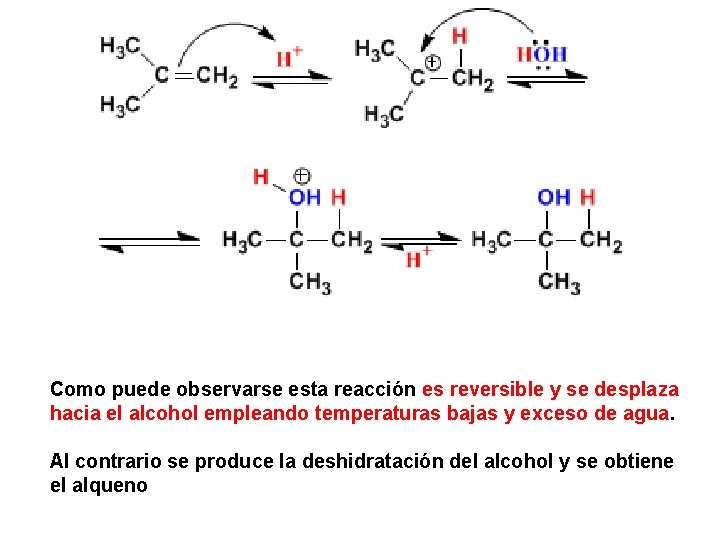
3. Hidratación de Alquenos Hidratación de alquenos: Markovnikov Esta reacción permite obtener alcoholes y sigue la regla de Markovnikov, el -OH va al carbono más sustituido y el -H al menos.

Como puede observarse esta reacción es reversible y se desplaza hacia el alcohol empleando temperaturas bajas y exceso de agua. Al contrario se produce la deshidratación del alcohol y se obtiene el alqueno

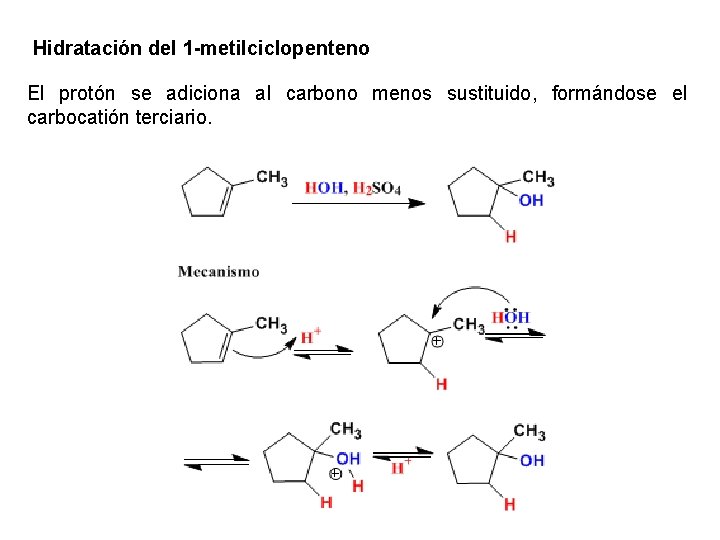
Hidratación del 1 -metilciclopenteno El protón se adiciona al carbono menos sustituido, formándose el carbocatión terciario.

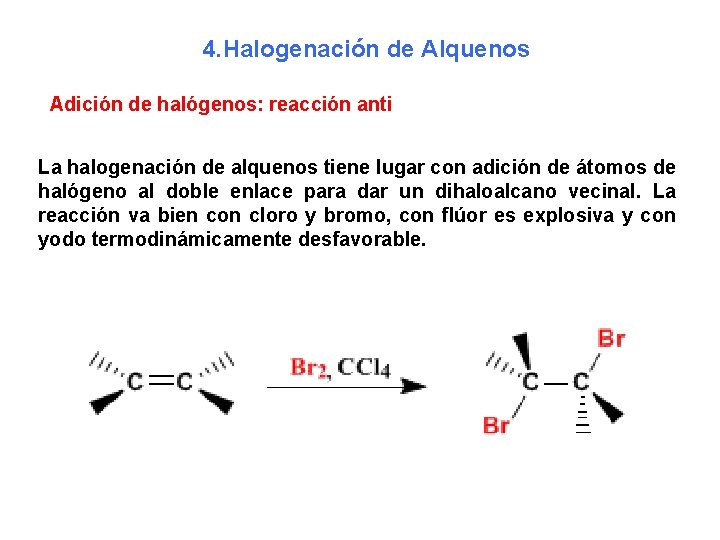
4. Halogenación de Alquenos Adición de halógenos: reacción anti La halogenación de alquenos tiene lugar con adición de átomos de halógeno al doble enlace para dar un dihaloalcano vecinal. La reacción va bien con cloro y bromo, con flúor es explosiva y con yodo termodinámicamente desfavorable.

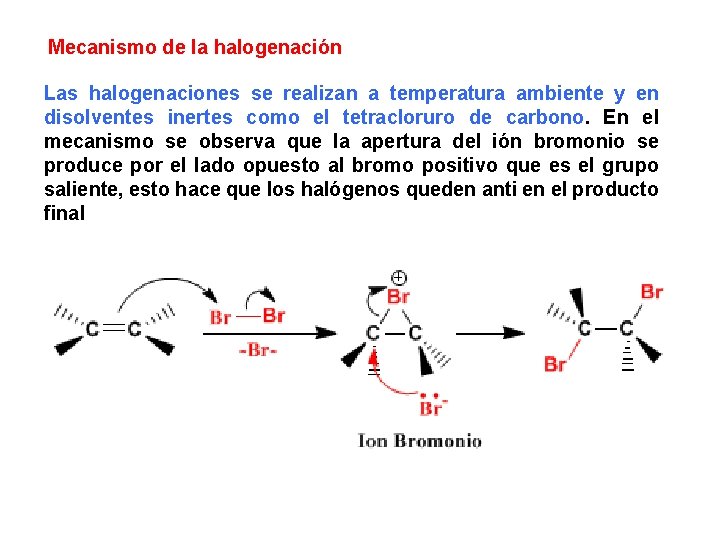
Mecanismo de la halogenación Las halogenaciones se realizan a temperatura ambiente y en disolventes inertes como el tetracloruro de carbono. En el mecanismo se observa que la apertura del ión bromonio se produce por el lado opuesto al bromo positivo que es el grupo saliente, esto hace que los halógenos queden anti en el producto final

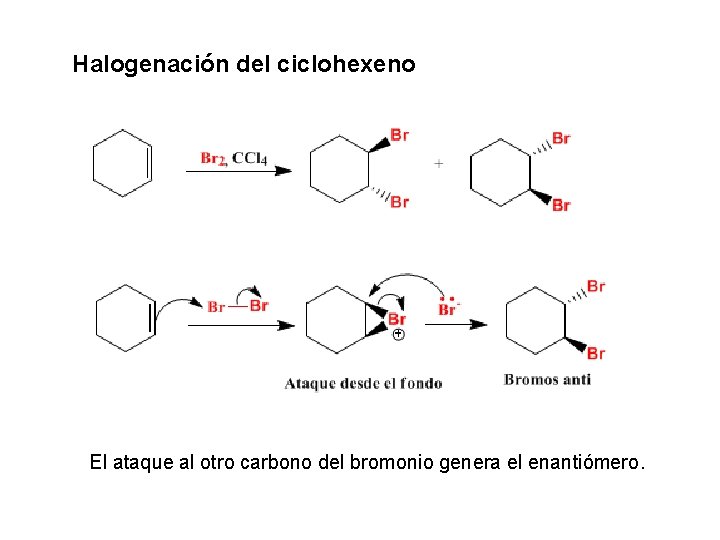
Halogenación del ciclohexeno El ataque al otro carbono del bromonio genera el enantiómero.

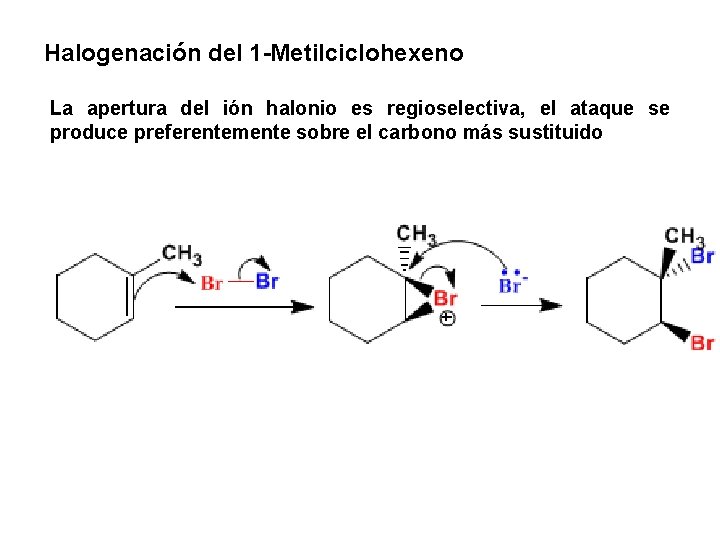
Halogenación del 1 -Metilciclohexeno La apertura del ión halonio es regioselectiva, el ataque se produce preferentemente sobre el carbono más sustituido

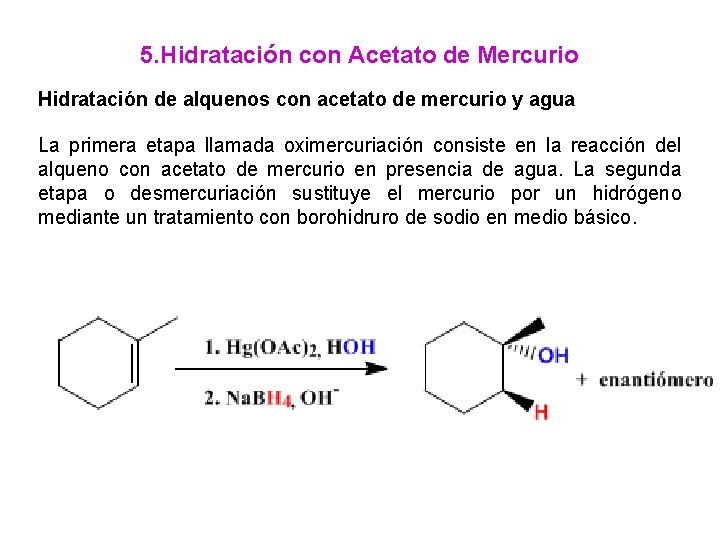
5. Hidratación con Acetato de Mercurio Hidratación de alquenos con acetato de mercurio y agua La primera etapa llamada oximercuriación consiste en la reacción del alqueno con acetato de mercurio en presencia de agua. La segunda etapa o desmercuriación sustituye el mercurio por un hidrógeno mediante un tratamiento con borohidruro de sodio en medio básico.

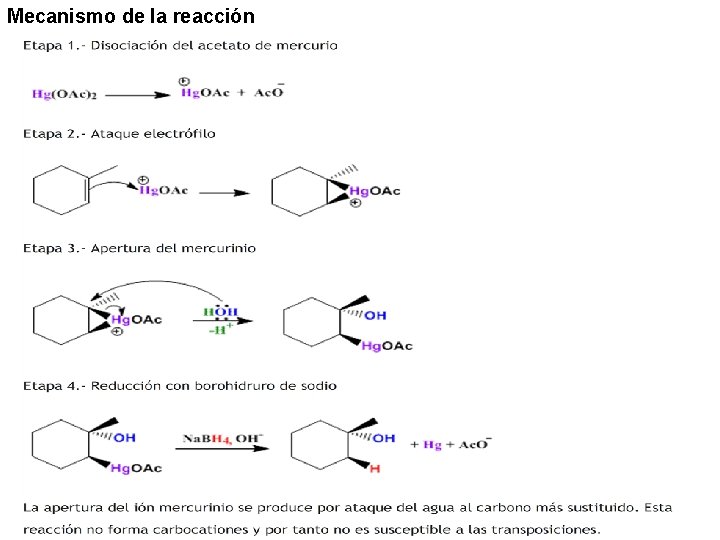
Mecanismo de la reacción

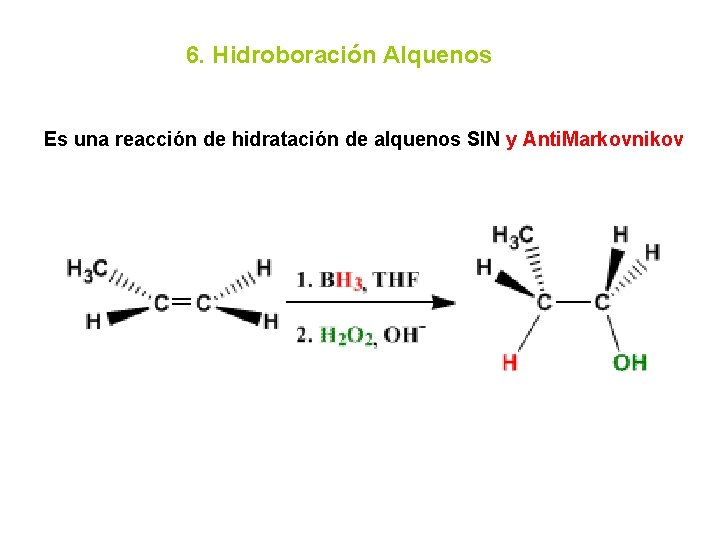
6. Hidroboración Alquenos Es una reacción de hidratación de alquenos SIN y Anti. Markovnikov

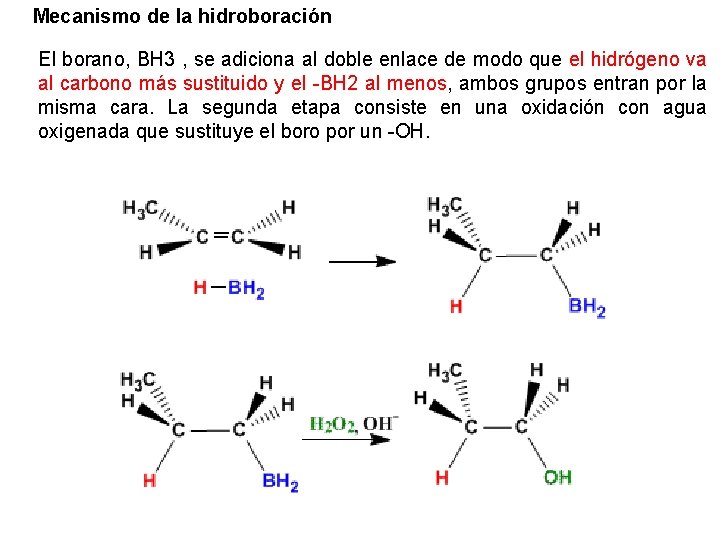
Mecanismo de la hidroboración El borano, BH 3 , se adiciona al doble enlace de modo que el hidrógeno va al carbono más sustituido y el -BH 2 al menos, ambos grupos entran por la misma cara. La segunda etapa consiste en una oxidación con agua oxigenada que sustituye el boro por un -OH.

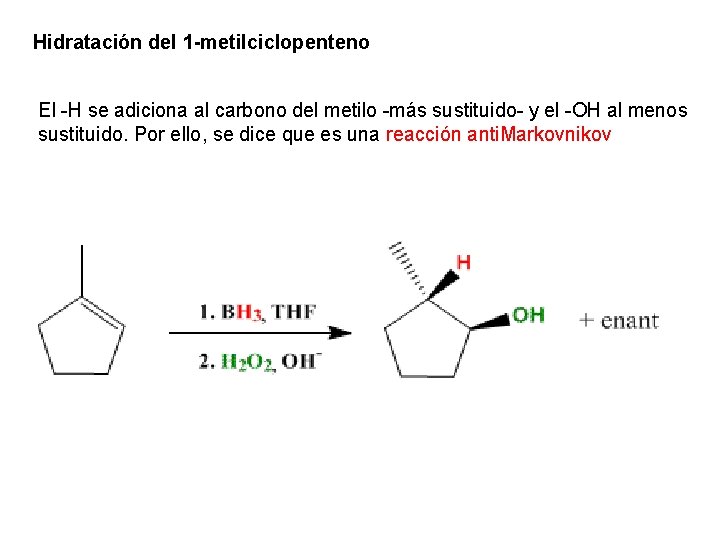
Hidratación del 1 -metilciclopenteno El -H se adiciona al carbono del metilo -más sustituido- y el -OH al menos sustituido. Por ello, se dice que es una reacción anti. Markovnikov

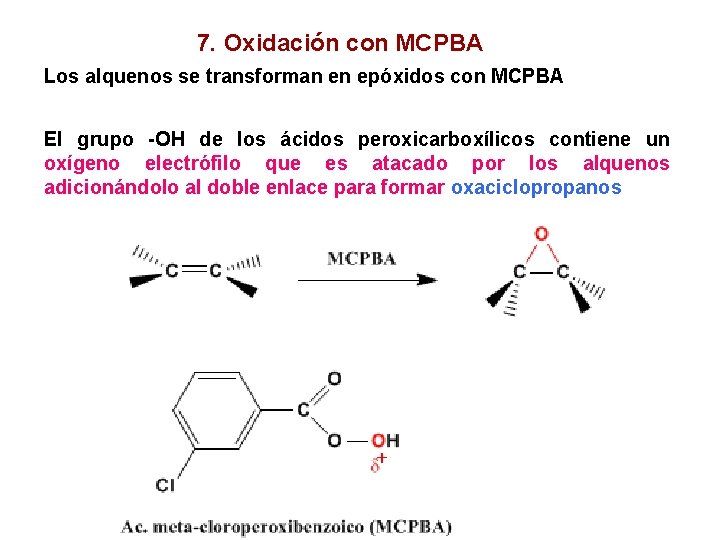
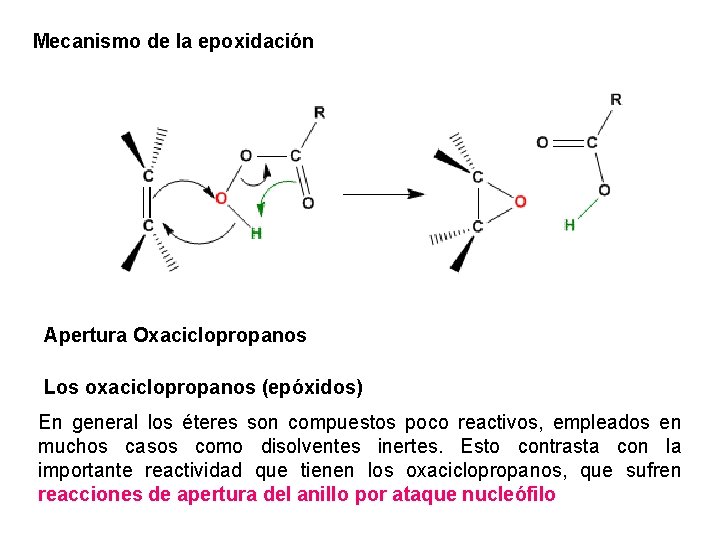
7. Oxidación con MCPBA Los alquenos se transforman en epóxidos con MCPBA El grupo -OH de los ácidos peroxicarboxílicos contiene un oxígeno electrófilo que es atacado por los alquenos adicionándolo al doble enlace para formar oxaciclopropanos

Mecanismo de la epoxidación Apertura Oxaciclopropanos Los oxaciclopropanos (epóxidos) En general los éteres son compuestos poco reactivos, empleados en muchos casos como disolventes inertes. Esto contrasta con la importante reactividad que tienen los oxaciclopropanos, que sufren reacciones de apertura del anillo por ataque nucleófilo

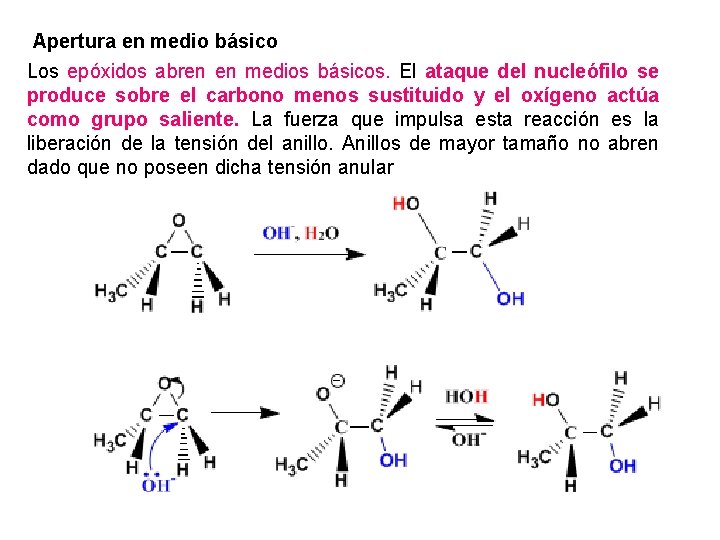
Apertura en medio básico Los epóxidos abren en medios básicos. El ataque del nucleófilo se produce sobre el carbono menos sustituido y el oxígeno actúa como grupo saliente. La fuerza que impulsa esta reacción es la liberación de la tensión del anillo. Anillos de mayor tamaño no abren dado que no poseen dicha tensión anular

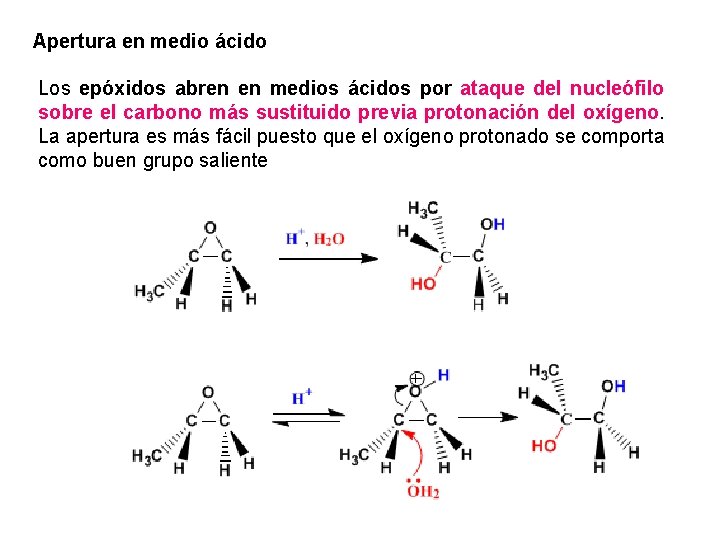
Apertura en medio ácido Los epóxidos abren en medios ácidos por ataque del nucleófilo sobre el carbono más sustituido previa protonación del oxígeno. La apertura es más fácil puesto que el oxígeno protonado se comporta como buen grupo saliente

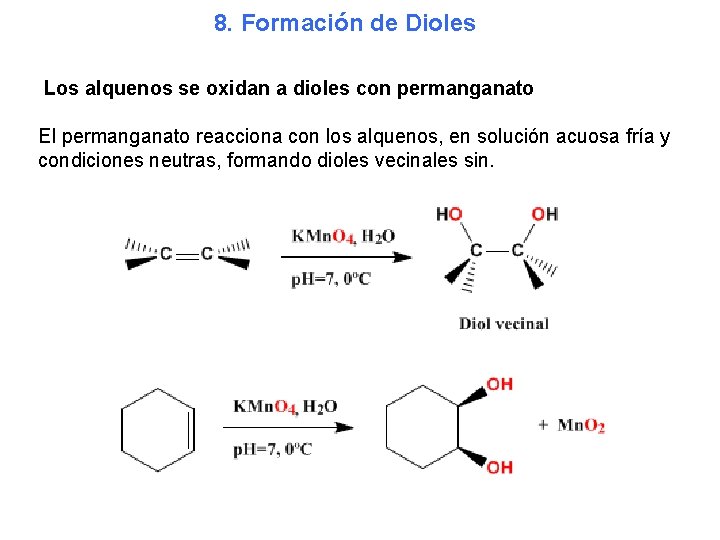
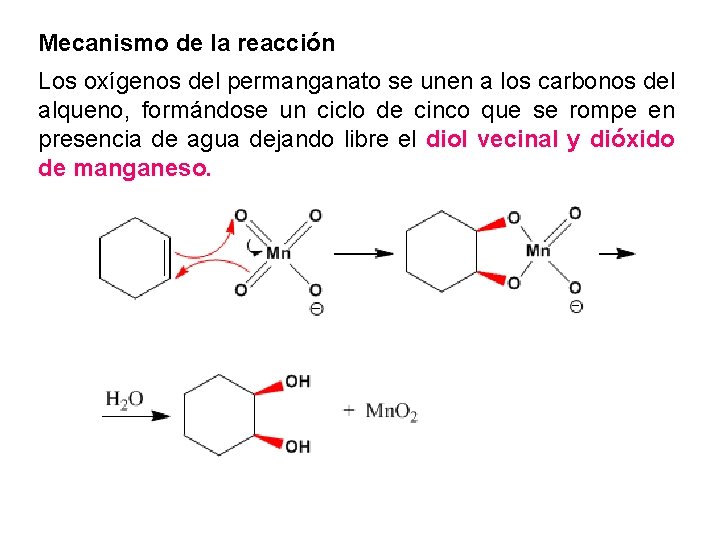
8. Formación de Dioles Los alquenos se oxidan a dioles con permanganato El permanganato reacciona con los alquenos, en solución acuosa fría y condiciones neutras, formando dioles vecinales sin.

Mecanismo de la reacción Los oxígenos del permanganato se unen a los carbonos del alqueno, formándose un ciclo de cinco que se rompe en presencia de agua dejando libre el diol vecinal y dióxido de manganeso.

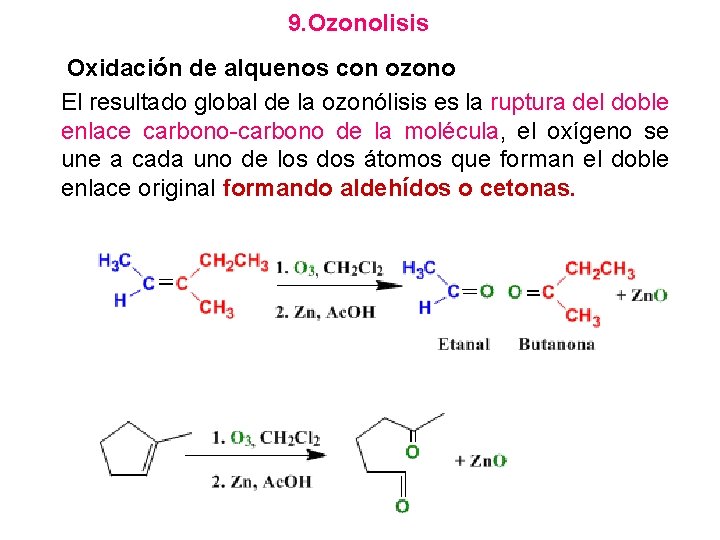
9. Ozonolisis Oxidación de alquenos con ozono El resultado global de la ozonólisis es la ruptura del doble enlace carbono-carbono de la molécula, el oxígeno se une a cada uno de los dos átomos que forman el doble enlace original formando aldehídos o cetonas.

10. Reacciones Radicalarias Adición de HBr anti. Markovnikov a los alquenos El HBr puede adicionarse a los alquenos de forma anti-Markovnikov en presencia de peróxidos. El mecanismo de la reacción es radicalario, siendo desfavorable dicha reacción para el HCl y HI.

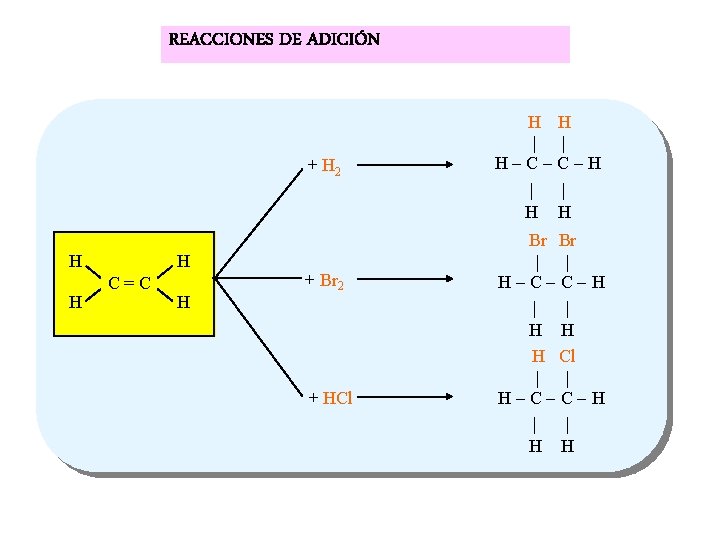
REACCIONES DE ADICIÓN + H 2 H H H C = C H + Br 2 + HCl H H | | H - C - H | | H H Br Br | | H - C - H | | H H H Cl | | H - C - H | | H H

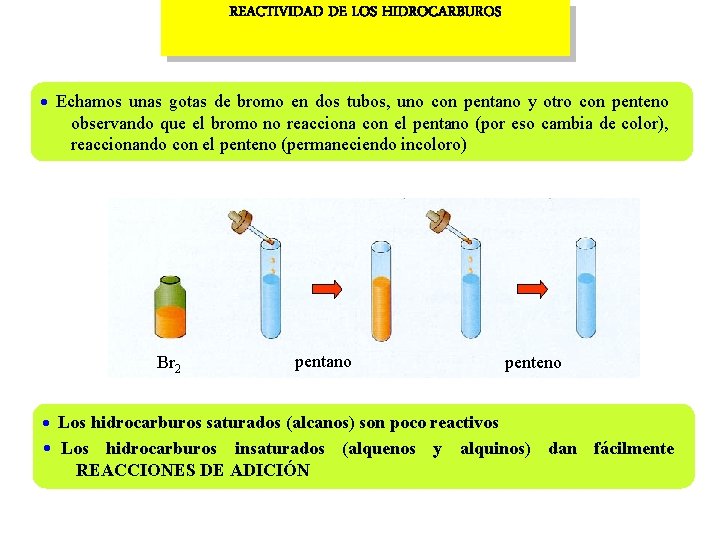
REACTIVIDAD DE LOS HIDROCARBUROS Echamos unas gotas de bromo en dos tubos, uno con pentano y otro con penteno observando que el bromo no reacciona con el pentano (por eso cambia de color), reaccionando con el penteno (permaneciendo incoloro) Br 2 pentano penteno Los hidrocarburos saturados (alcanos) son poco reactivos Los hidrocarburos insaturados (alquenos y alquinos) dan fácilmente REACCIONES DE ADICIÓN

ALQUINOS

1. Alquilación de Alquinos 2. Hidrogenación de Alquinos 3. Reducción Monoelectrónica 4. Hidroboración de Alquinos 5. Adición de HX, agua y halógenos 6. Ciclaciones Catiónicas

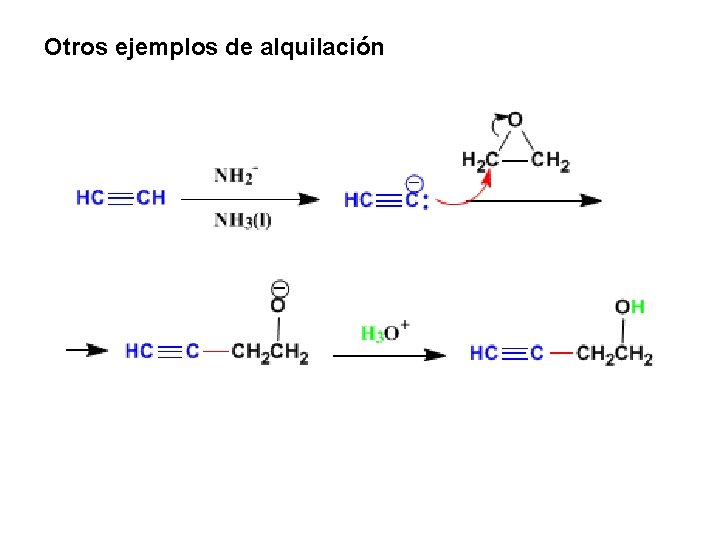
1. Alquilación de Alquinos Alquilación del acetileno Los alquinos terminales tienen un hidrogeno ácido de PKa=25 que podemos arrancar empleando bases fuertes (amiduro en amoniaco líquido). El anión formado es un nucleófilo capaz de atacar a haloalcanos primarios, epoxidos, aldehídos o cetonas generando enlaces carbono-carbono que permiten obtener alquinos de un mayor tamaño. Los haloalcanos secundarios y terciarios no se pueden utilizar en este tipo de reacciones ya que conducen a mecanismos E 2 a causa del carácter fuertemente básico del nucleófilo.

Otros ejemplos de alquilación

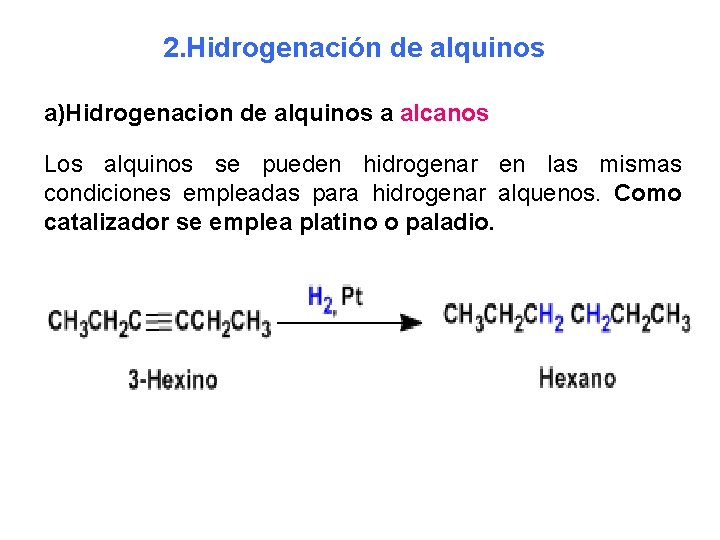
2. Hidrogenación de alquinos a)Hidrogenacion de alquinos a alcanos Los alquinos se pueden hidrogenar en las mismas condiciones empleadas para hidrogenar alquenos. Como catalizador se emplea platino o paladio.

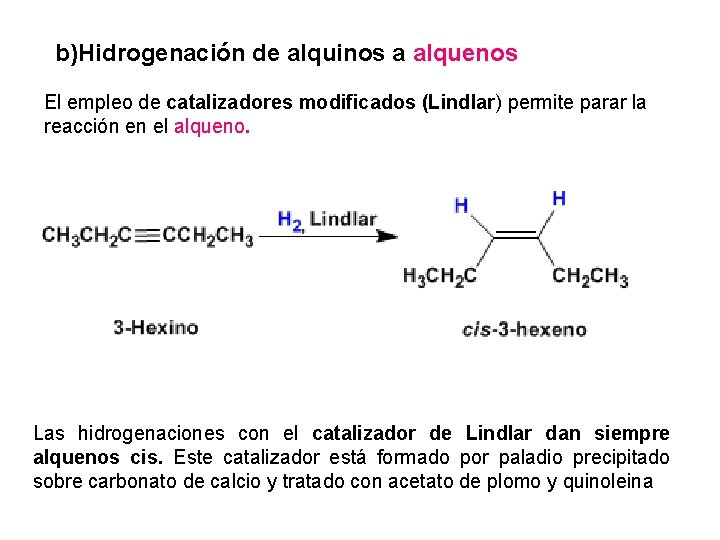
b)Hidrogenación de alquinos a alquenos El empleo de catalizadores modificados (Lindlar) permite parar la reacción en el alqueno. Las hidrogenaciones con el catalizador de Lindlar dan siempre alquenos cis. Este catalizador está formado por paladio precipitado sobre carbonato de calcio y tratado con acetato de plomo y quinoleina

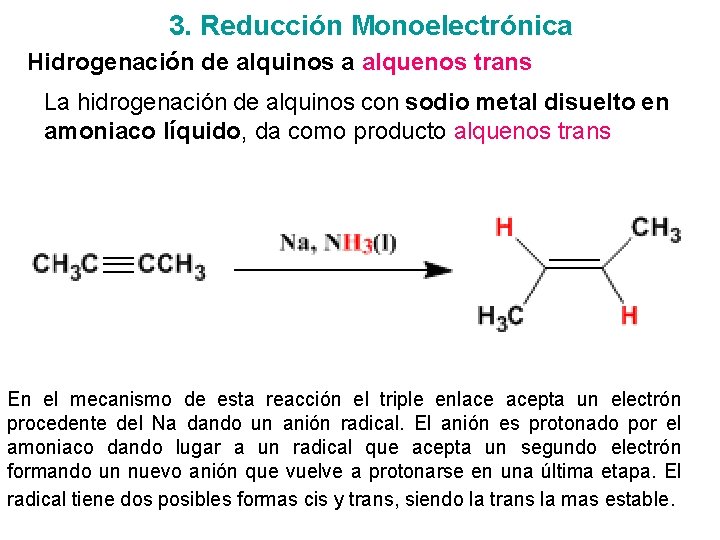
3. Reducción Monoelectrónica Hidrogenación de alquinos a alquenos trans La hidrogenación de alquinos con sodio metal disuelto en amoniaco líquido, da como producto alquenos trans En el mecanismo de esta reacción el triple enlace acepta un electrón procedente del Na dando un anión radical. El anión es protonado por el amoniaco dando lugar a un radical que acepta un segundo electrón formando un nuevo anión que vuelve a protonarse en una última etapa. El radical tiene dos posibles formas cis y trans, siendo la trans la mas estable.

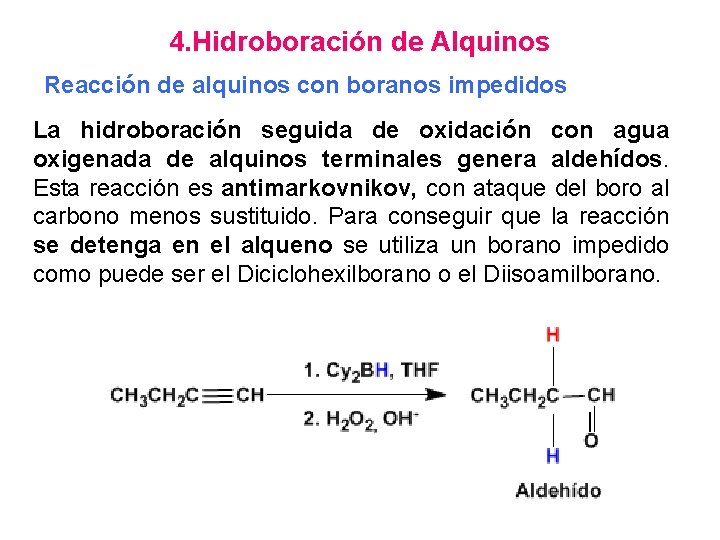
4. Hidroboración de Alquinos Reacción de alquinos con boranos impedidos La hidroboración seguida de oxidación con agua oxigenada de alquinos terminales genera aldehídos. Esta reacción es antimarkovnikov, con ataque del boro al carbono menos sustituido. Para conseguir que la reacción se detenga en el alqueno se utiliza un borano impedido como puede ser el Diciclohexilborano o el Diisoamilborano.

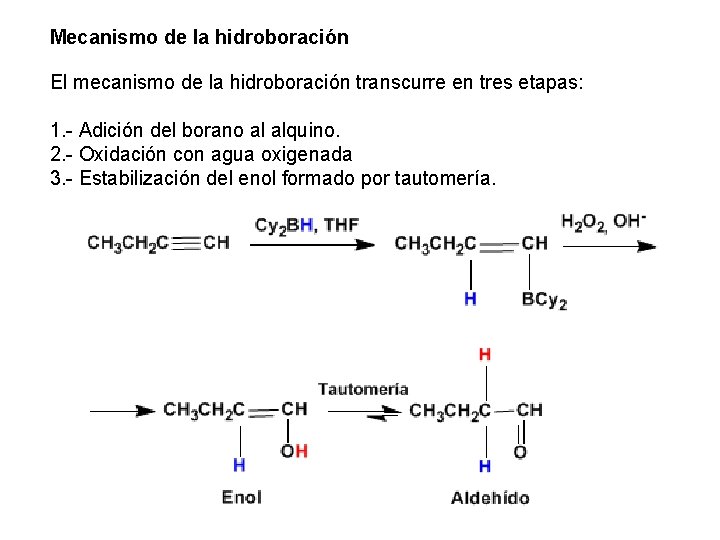
Mecanismo de la hidroboración El mecanismo de la hidroboración transcurre en tres etapas: 1. - Adición del borano al alquino. 2. - Oxidación con agua oxigenada 3. - Estabilización del enol formado por tautomería.

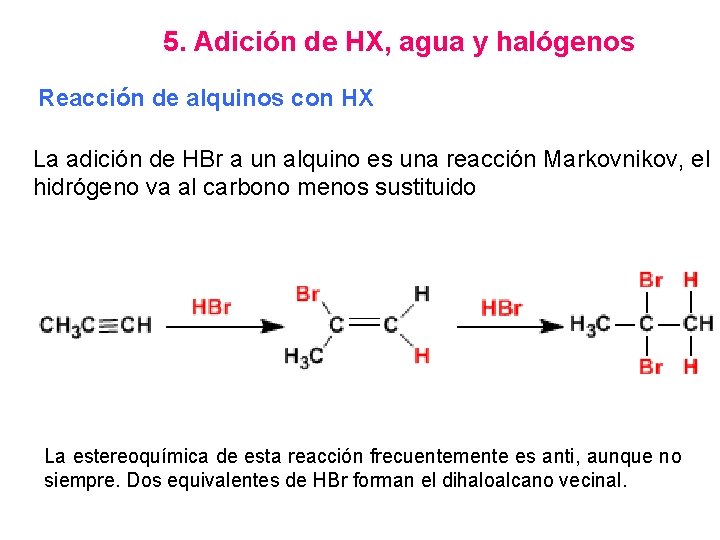
5. Adición de HX, agua y halógenos Reacción de alquinos con HX La adición de HBr a un alquino es una reacción Markovnikov, el hidrógeno va al carbono menos sustituido La estereoquímica de esta reacción frecuentemente es anti, aunque no siempre. Dos equivalentes de HBr forman el dihaloalcano vecinal.

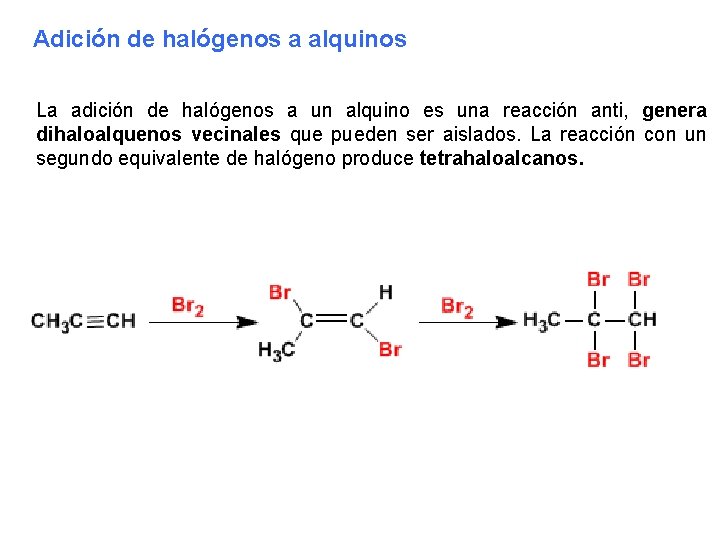
Adición de halógenos a alquinos La adición de halógenos a un alquino es una reacción anti, genera dihaloalquenos vecinales que pueden ser aislados. La reacción con un segundo equivalente de halógeno produce tetrahaloalcanos.

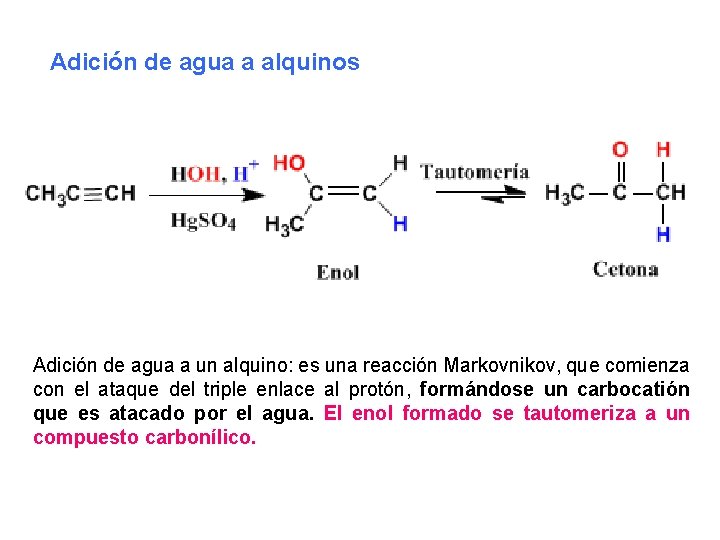
Adición de agua a alquinos Adición de agua a un alquino: es una reacción Markovnikov, que comienza con el ataque del triple enlace al protón, formándose un carbocatión que es atacado por el agua. El enol formado se tautomeriza a un compuesto carbonílico.

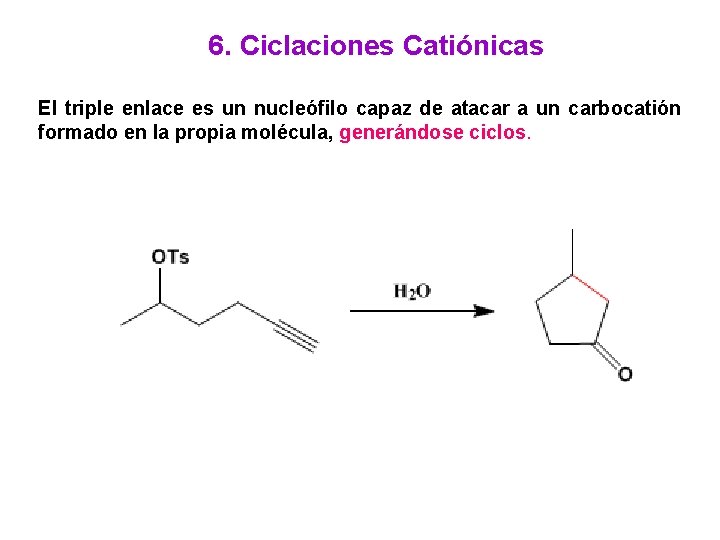
6. Ciclaciones Catiónicas El triple enlace es un nucleófilo capaz de atacar a un carbocatión formado en la propia molécula, generándose ciclos.

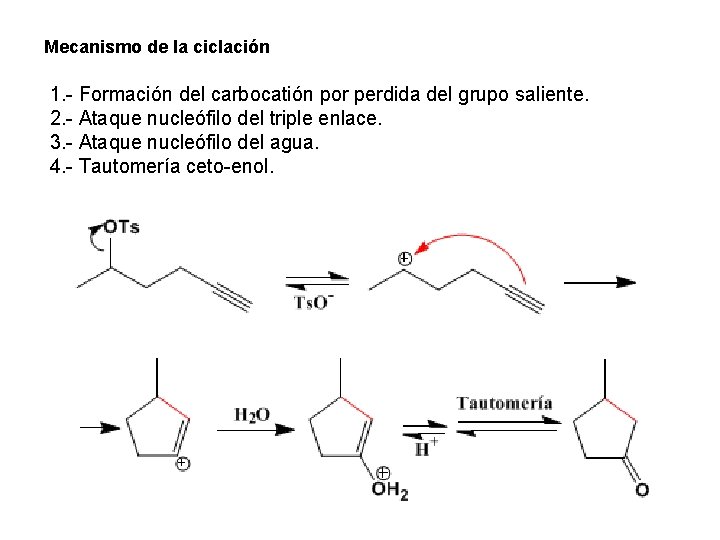
Mecanismo de la ciclación 1. - Formación del carbocatión por perdida del grupo saliente. 2. - Ataque nucleófilo del triple enlace. 3. - Ataque nucleófilo del agua. 4. - Tautomería ceto-enol.

AROMATICOS

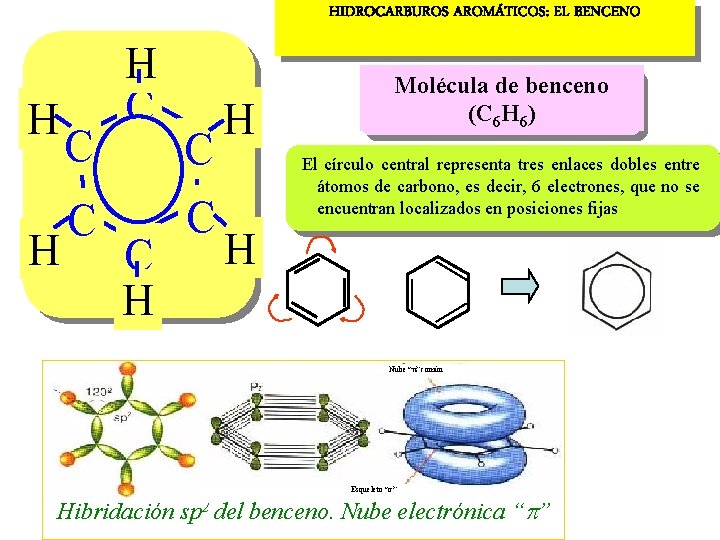
HIDROCARBUROS AROMÁTICOS: EL BENCENO H H C C H Molécula de benceno (C 6 H 6) El círculo central representa tres enlaces dobles entre átomos de carbono, es decir, 6 electrones, que no se encuentran localizados en posiciones fijas H Nube “ ” común Esqueleto “ ” Hibridación sp 2 del benceno. Nube electrónica “ ”

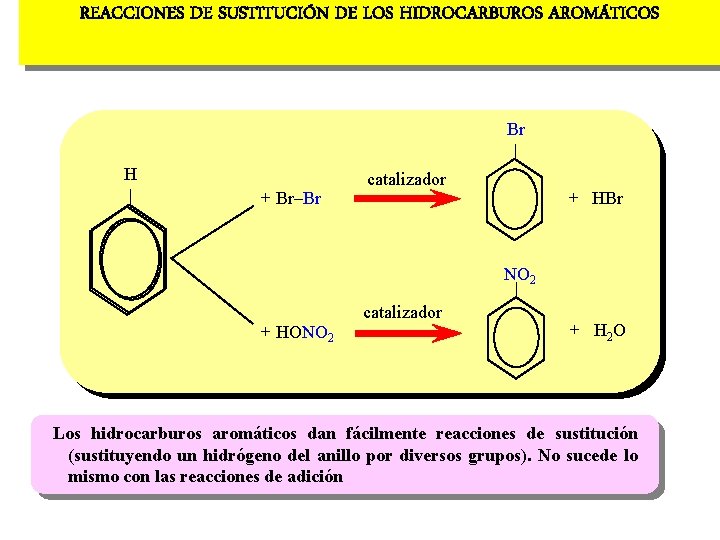
REACCIONES DE SUSTITUCIÓN DE LOS HIDROCARBUROS AROMÁTICOS Br | H | + Br-Br catalizador + HBr NO 2 + HONO 2 catalizador + H 2 O Los hidrocarburos aromáticos dan fácilmente reacciones de sustitución (sustituyendo un hidrógeno del anillo por diversos grupos). No sucede lo mismo con las reacciones de adición

1. Halogenación Benceno 2. Nitración Benceno 3. Sulfonación Benceno 4. Alquilación Benceno 5. Acilación Benceno 6. Benceno Grupos Activantes y Desactivantes 7. Sustitución Nucleófila Aromática (A-E) 8. Sustitución Nucleófila Aromática (E-A) 9. Posición Bencílica 10. Oxidación de Cadenas 11. Reducción de Birch 12. Transposición de Claisen 13. Sandmeyer y Schiemann 14. Acoplamiento Azóico

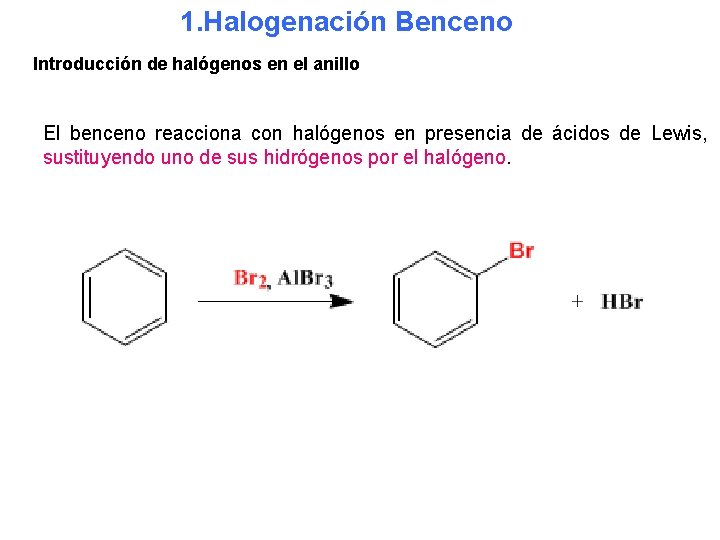
1. Halogenación Benceno Introducción de halógenos en el anillo El benceno reacciona con halógenos en presencia de ácidos de Lewis, sustituyendo uno de sus hidrógenos por el halógeno.

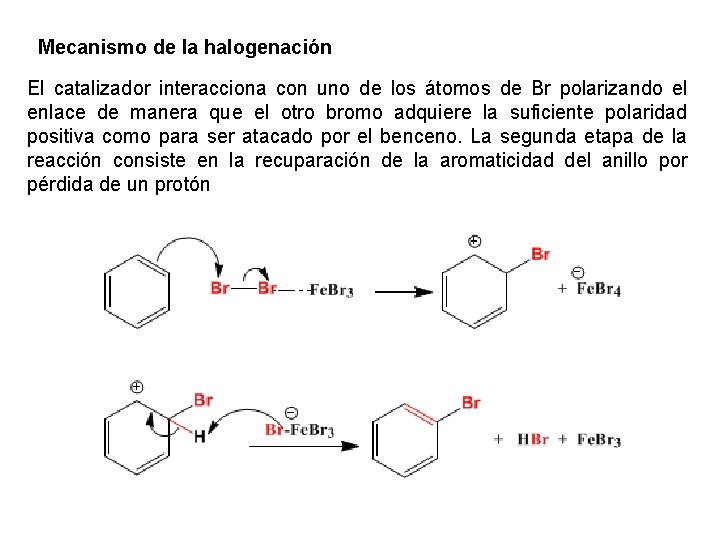
Mecanismo de la halogenación El catalizador interacciona con uno de los átomos de Br polarizando el enlace de manera que el otro bromo adquiere la suficiente polaridad positiva como para ser atacado por el benceno. La segunda etapa de la reacción consiste en la recuparación de la aromaticidad del anillo por pérdida de un protón

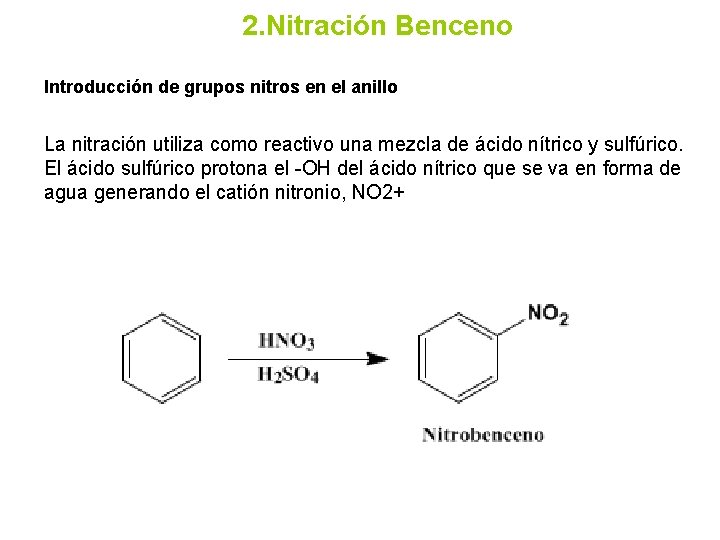
2. Nitración Benceno Introducción de grupos nitros en el anillo La nitración utiliza como reactivo una mezcla de ácido nítrico y sulfúrico. El ácido sulfúrico protona el -OH del ácido nítrico que se va en forma de agua generando el catión nitronio, NO 2+

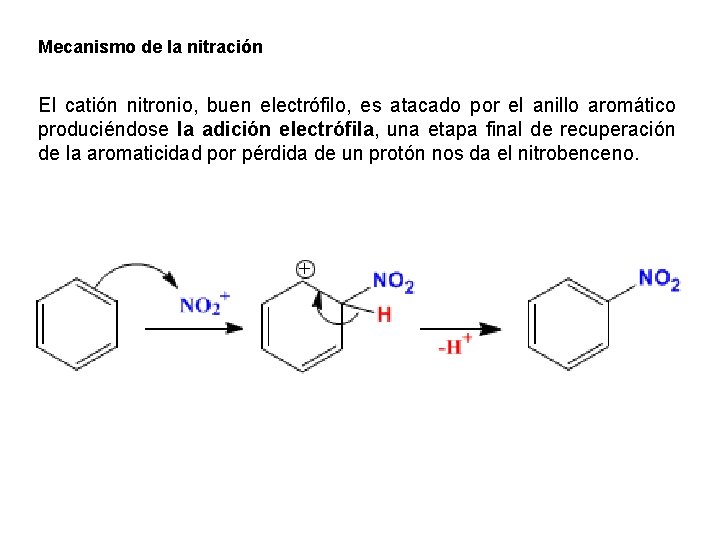
Mecanismo de la nitración El catión nitronio, buen electrófilo, es atacado por el anillo aromático produciéndose la adición electrófila, una etapa final de recuperación de la aromaticidad por pérdida de un protón nos da el nitrobenceno.

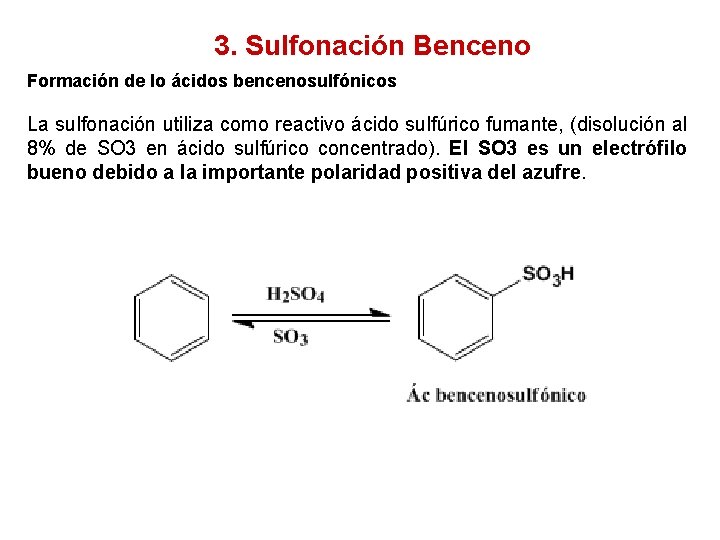
3. Sulfonación Benceno Formación de lo ácidos bencenosulfónicos La sulfonación utiliza como reactivo ácido sulfúrico fumante, (disolución al 8% de SO 3 en ácido sulfúrico concentrado). El SO 3 es un electrófilo bueno debido a la importante polaridad positiva del azufre.

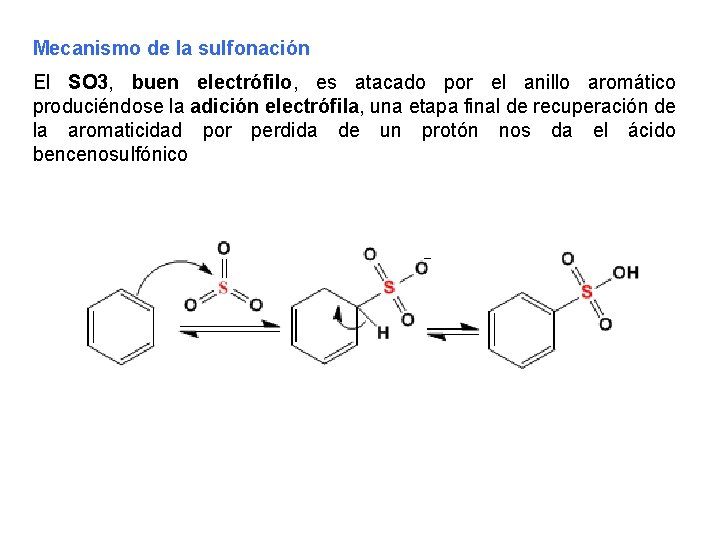
Mecanismo de la sulfonación El SO 3, buen electrófilo, es atacado por el anillo aromático produciéndose la adición electrófila, una etapa final de recuperación de la aromaticidad por perdida de un protón nos da el ácido bencenosulfónico

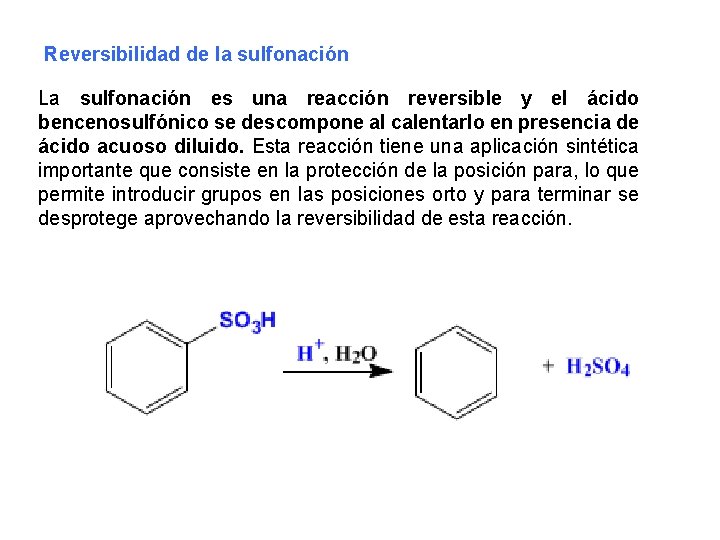
Reversibilidad de la sulfonación La sulfonación es una reacción reversible y el ácido bencenosulfónico se descompone al calentarlo en presencia de ácido acuoso diluido. Esta reacción tiene una aplicación sintética importante que consiste en la protección de la posición para, lo que permite introducir grupos en las posiciones orto y para terminar se desprotege aprovechando la reversibilidad de esta reacción.

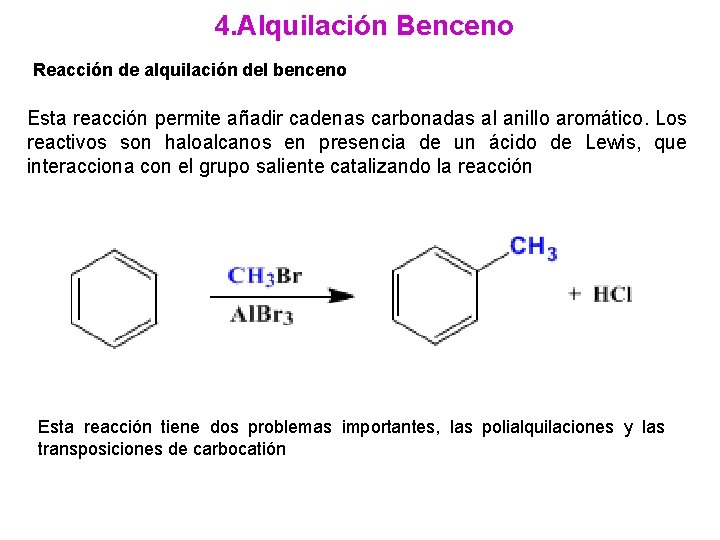
4. Alquilación Benceno Reacción de alquilación del benceno Esta reacción permite añadir cadenas carbonadas al anillo aromático. Los reactivos son haloalcanos en presencia de un ácido de Lewis, que interacciona con el grupo saliente catalizando la reacción Esta reacción tiene dos problemas importantes, las polialquilaciones y las transposiciones de carbocatión

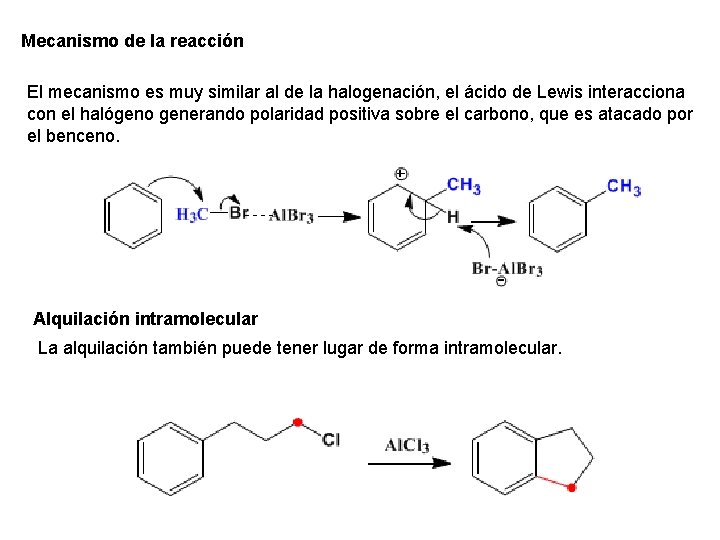
Mecanismo de la reacción El mecanismo es muy similar al de la halogenación, el ácido de Lewis interacciona con el halógeno generando polaridad positiva sobre el carbono, que es atacado por el benceno. Alquilación intramolecular La alquilación también puede tener lugar de forma intramolecular.

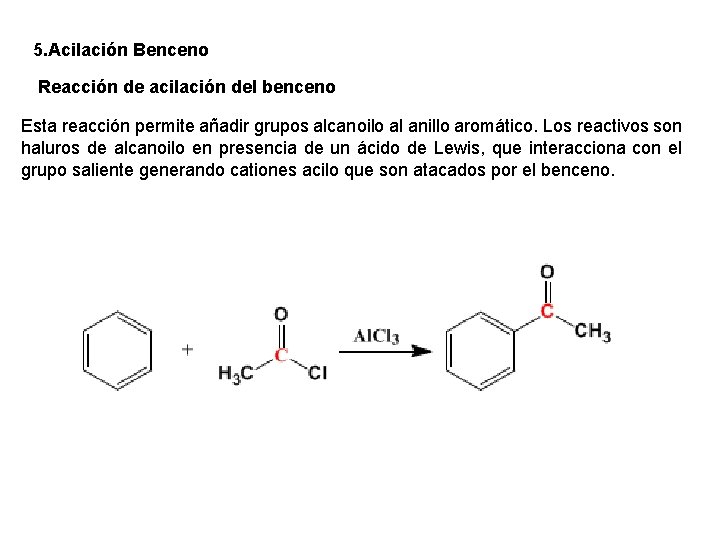
5. Acilación Benceno Reacción de acilación del benceno Esta reacción permite añadir grupos alcanoilo al anillo aromático. Los reactivos son haluros de alcanoilo en presencia de un ácido de Lewis, que interacciona con el grupo saliente generando cationes acilo que son atacados por el benceno.

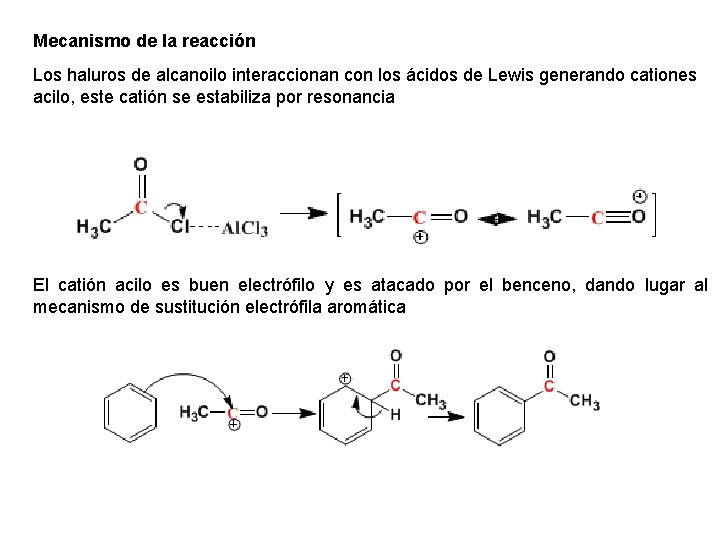
Mecanismo de la reacción Los haluros de alcanoilo interaccionan con los ácidos de Lewis generando cationes acilo, este catión se estabiliza por resonancia El catión acilo es buen electrófilo y es atacado por el benceno, dando lugar al mecanismo de sustitución electrófila aromática

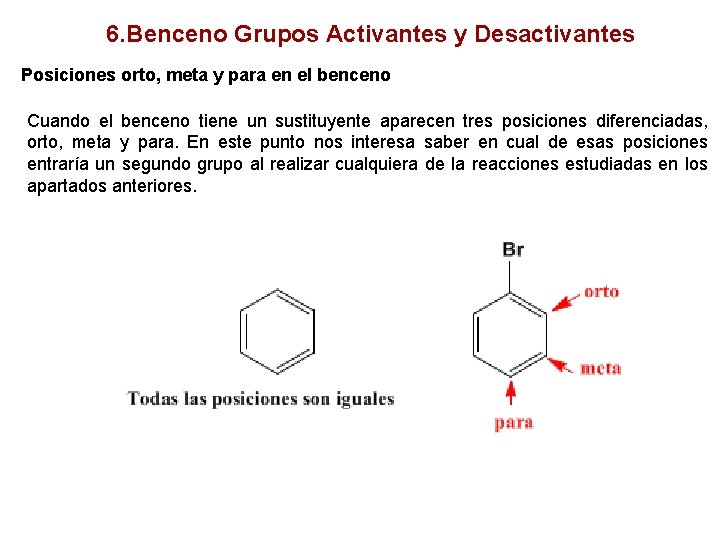
6. Benceno Grupos Activantes y Desactivantes Posiciones orto, meta y para en el benceno Cuando el benceno tiene un sustituyente aparecen tres posiciones diferenciadas, orto, meta y para. En este punto nos interesa saber en cual de esas posiciones entraría un segundo grupo al realizar cualquiera de la reacciones estudiadas en los apartados anteriores.

Clasificación de sustituyentes Los sustituyentes se pueden clasificar en cuatro grupos:

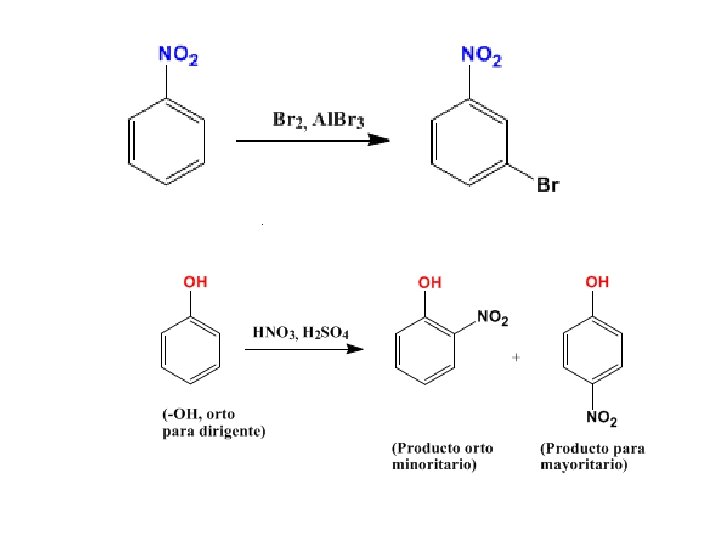
Algunos ejemplos Supongamos un benceno con un grupo nitro (NO 2) al que hacemos una halogenación, ¿Dónde entrará el bromo? . ¿Y si el benceno tiene un grupo hidroxi y hacemos una nitración?


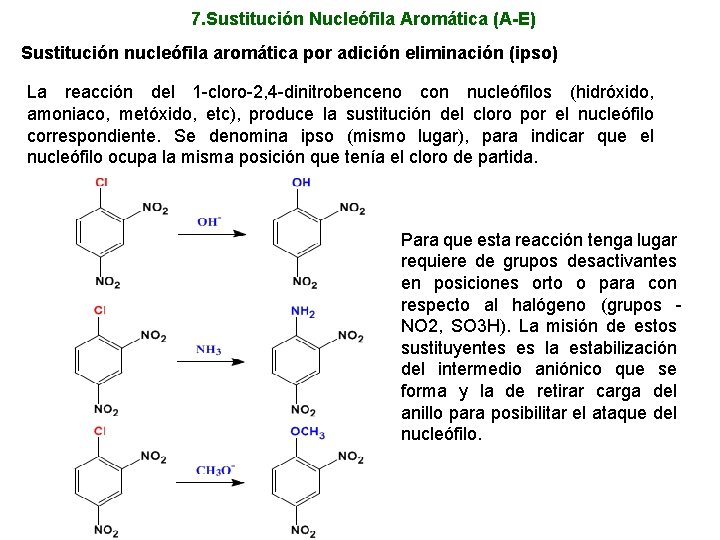
7. Sustitución Nucleófila Aromática (A-E) Sustitución nucleófila aromática por adición eliminación (ipso) La reacción del 1 -cloro-2, 4 -dinitrobenceno con nucleófilos (hidróxido, amoniaco, metóxido, etc), produce la sustitución del cloro por el nucleófilo correspondiente. Se denomina ipso (mismo lugar), para indicar que el nucleófilo ocupa la misma posición que tenía el cloro de partida. Para que esta reacción tenga lugar requiere de grupos desactivantes en posiciones orto o para con respecto al halógeno (grupos NO 2, SO 3 H). La misión de estos sustituyentes es la estabilización del intermedio aniónico que se forma y la de retirar carga del anillo para posibilitar el ataque del nucleófilo.

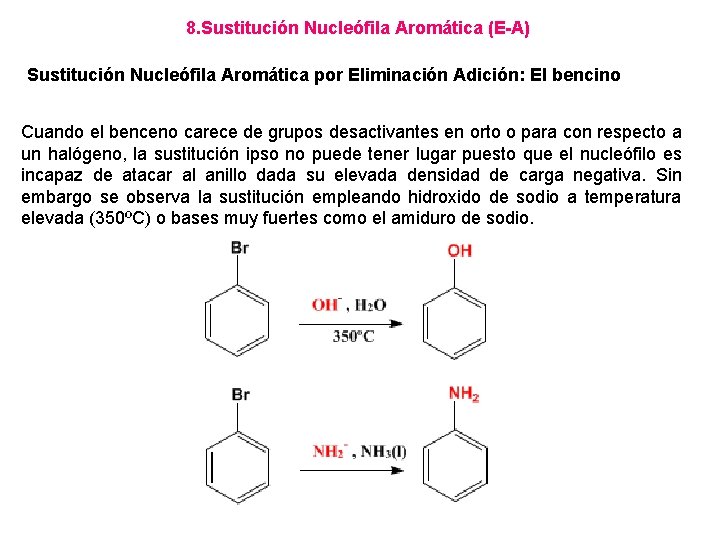
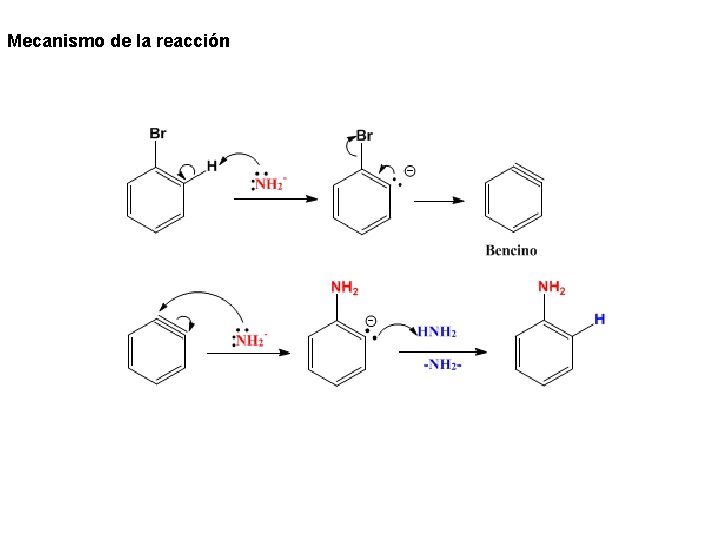
8. Sustitución Nucleófila Aromática (E-A) Sustitución Nucleófila Aromática por Eliminación Adición: El bencino Cuando el benceno carece de grupos desactivantes en orto o para con respecto a un halógeno, la sustitución ipso no puede tener lugar puesto que el nucleófilo es incapaz de atacar al anillo dada su elevada densidad de carga negativa. Sin embargo se observa la sustitución empleando hidroxido de sodio a temperatura elevada (350ºC) o bases muy fuertes como el amiduro de sodio.

Mecanismo de la reacción

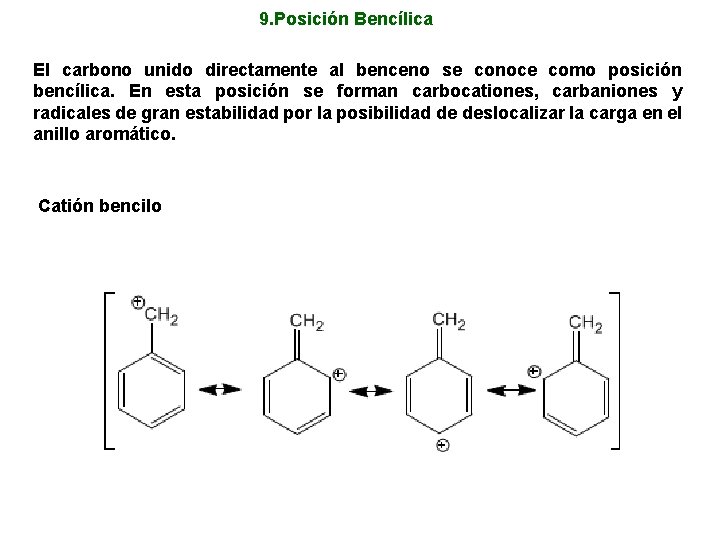
9. Posición Bencílica El carbono unido directamente al benceno se conoce como posición bencílica. En esta posición se forman carbocationes, carbaniones y radicales de gran estabilidad por la posibilidad de deslocalizar la carga en el anillo aromático. Catión bencilo

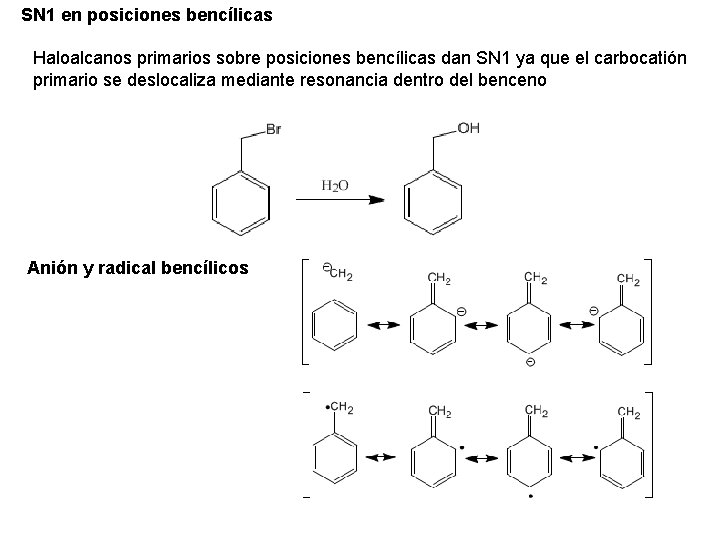
SN 1 en posiciones bencílicas Haloalcanos primarios sobre posiciones bencílicas dan SN 1 ya que el carbocatión primario se deslocaliza mediante resonancia dentro del benceno Anión y radical bencílicos

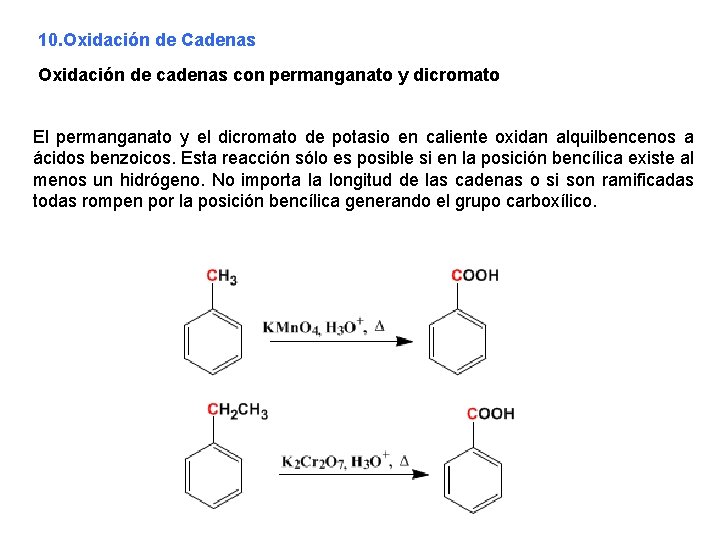
10. Oxidación de Cadenas Oxidación de cadenas con permanganato y dicromato El permanganato y el dicromato de potasio en caliente oxidan alquilbencenos a ácidos benzoicos. Esta reacción sólo es posible si en la posición bencílica existe al menos un hidrógeno. No importa la longitud de las cadenas o si son ramificadas todas rompen por la posición bencílica generando el grupo carboxílico.

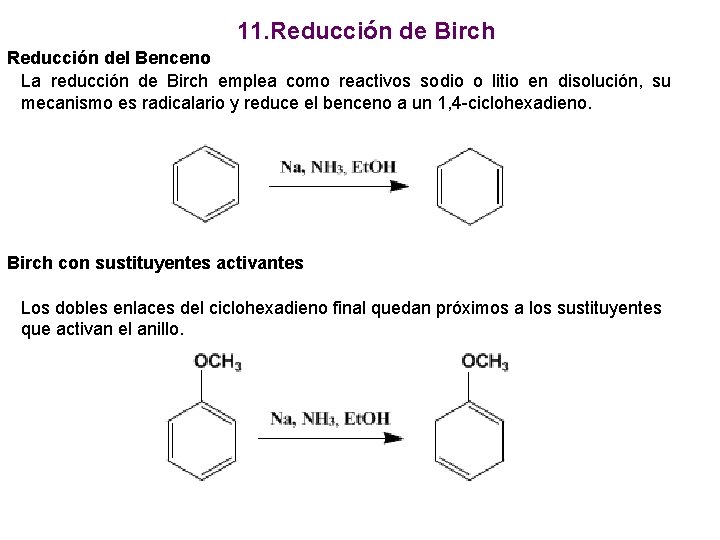
11. Reducción de Birch Reducción del Benceno La reducción de Birch emplea como reactivos sodio o litio en disolución, su mecanismo es radicalario y reduce el benceno a un 1, 4 -ciclohexadieno. Birch con sustituyentes activantes Los dobles enlaces del ciclohexadieno final quedan próximos a los sustituyentes que activan el anillo.

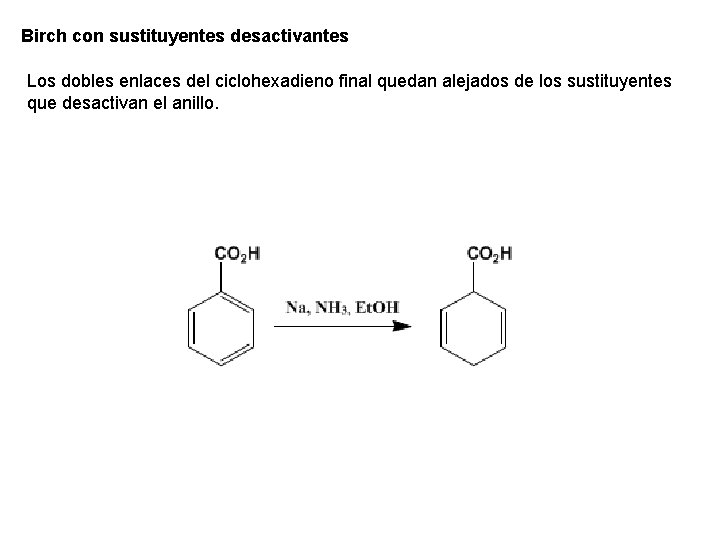
Birch con sustituyentes desactivantes Los dobles enlaces del ciclohexadieno final quedan alejados de los sustituyentes que desactivan el anillo.

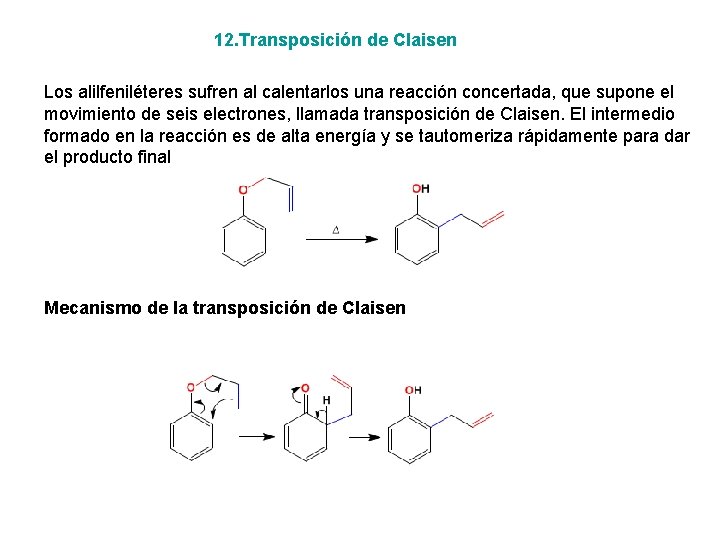
12. Transposición de Claisen Los alilfeniléteres sufren al calentarlos una reacción concertada, que supone el movimiento de seis electrones, llamada transposición de Claisen. El intermedio formado en la reacción es de alta energía y se tautomeriza rápidamente para dar el producto final Mecanismo de la transposición de Claisen

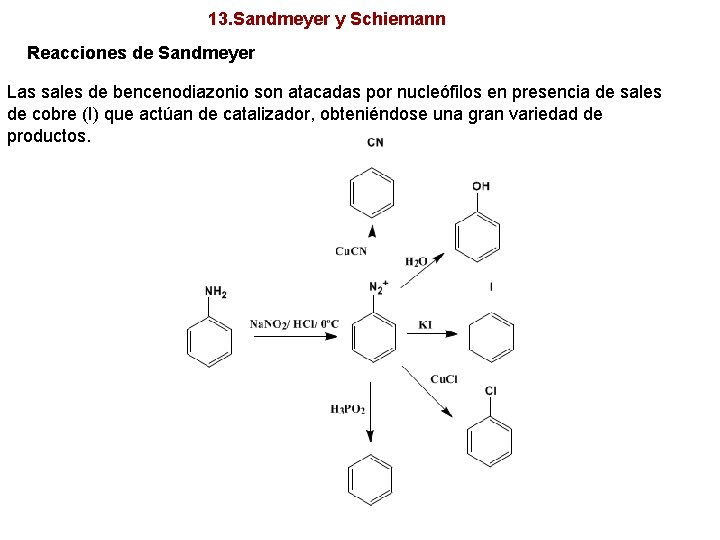
13. Sandmeyer y Schiemann Reacciones de Sandmeyer Las sales de bencenodiazonio son atacadas por nucleófilos en presencia de sales de cobre (I) que actúan de catalizador, obteniéndose una gran variedad de productos.

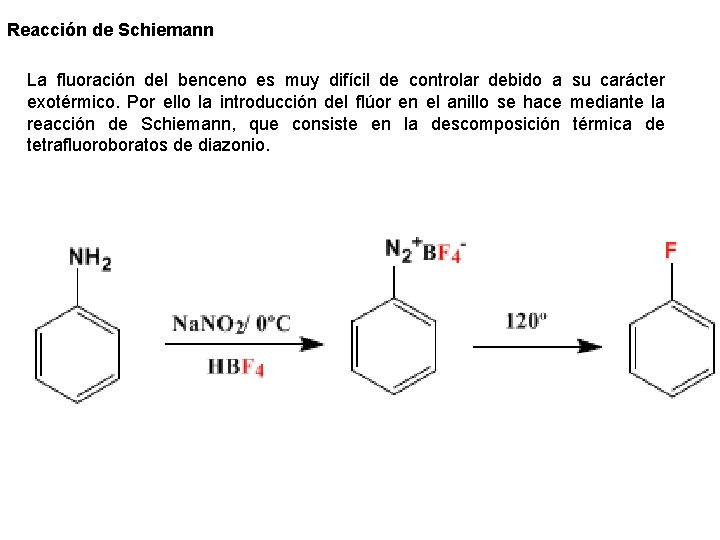
Reacción de Schiemann La fluoración del benceno es muy difícil de controlar debido a su carácter exotérmico. Por ello la introducción del flúor en el anillo se hace mediante la reacción de Schiemann, que consiste en la descomposición térmica de tetrafluoroboratos de diazonio.

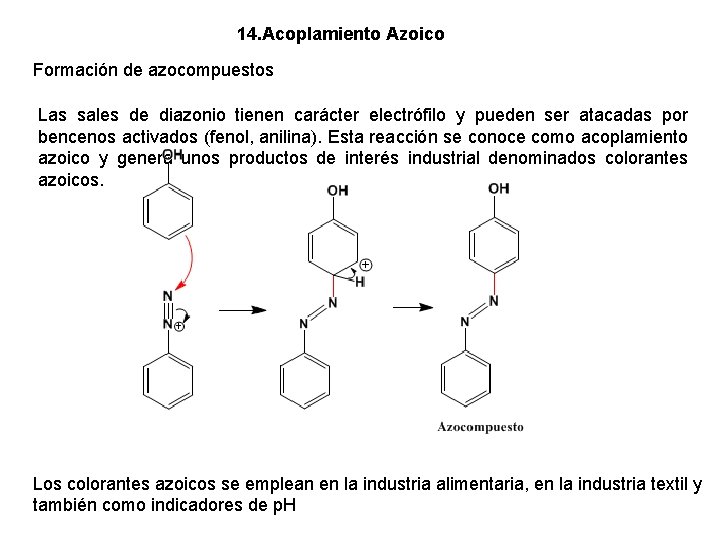
14. Acoplamiento Azoico Formación de azocompuestos Las sales de diazonio tienen carácter electrófilo y pueden ser atacadas por bencenos activados (fenol, anilina). Esta reacción se conoce como acoplamiento azoico y genera unos productos de interés industrial denominados colorantes azoicos. Los colorantes azoicos se emplean en la industria alimentaria, en la industria textil y también como indicadores de p. H
 Nombrar
Nombrar Halogenuros de alquilo ejercicios resueltos
Halogenuros de alquilo ejercicios resueltos Grupos funcionales
Grupos funcionales Característica de lípidos
Característica de lípidos Imagenes de compuestos organicos
Imagenes de compuestos organicos Preferencia grupos funcionales
Preferencia grupos funcionales Glucosa grupos funcionales
Glucosa grupos funcionales Caucho sintetico
Caucho sintetico Lpidos
Lpidos Polisacaridos glucogeno
Polisacaridos glucogeno Como saber el grupo funcional de un compuesto
Como saber el grupo funcional de un compuesto Nombre los siguientes alquenos
Nombre los siguientes alquenos Site:slidetodoc.com
Site:slidetodoc.com Prioridad de grupos funcionales en quimica organica
Prioridad de grupos funcionales en quimica organica Propilundecano
Propilundecano Ion fenoxido resonancia
Ion fenoxido resonancia Diferencia entre compuestos oxigenados y nitrogenados
Diferencia entre compuestos oxigenados y nitrogenados Alquilos
Alquilos Clasificacin de los animales
Clasificacin de los animales Clasificacin
Clasificacin Clasificacin
Clasificacin Clasificacion de los seres vivos ppt
Clasificacion de los seres vivos ppt Como se clasifica la deuda publica
Como se clasifica la deuda publica Clasificacin de los animales
Clasificacin de los animales Clasificacin
Clasificacin Marco legal de una empresa
Marco legal de una empresa Robert montal
Robert montal Clasificacin de las empresas
Clasificacin de las empresas Oxido reduccion ejemplos
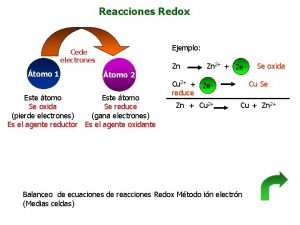
Oxido reduccion ejemplos Reacciones redox
Reacciones redox Cintica
Cintica Dalton gmez
Dalton gmez Reacciones químicas
Reacciones químicas Reaccion endotermica
Reaccion endotermica Reacciones redox
Reacciones redox Www.biologia.edu.ar
Www.biologia.edu.ar Reaccion de sustitucion
Reaccion de sustitucion Reacciones de neutralización ejemplos
Reacciones de neutralización ejemplos Reacciones supravitales
Reacciones supravitales Eacciones quimicas
Eacciones quimicas Estado estacionario ejemplos
Estado estacionario ejemplos Fisicia
Fisicia Reacciones contra el proyecto moderno
Reacciones contra el proyecto moderno Reaccion de descomposicion
Reaccion de descomposicion Redox os
Redox os Reaccion de condensacion
Reaccion de condensacion Saturada
Saturada Reaccion quimica equilibrada
Reaccion quimica equilibrada Pureza reacciones quimicas
Pureza reacciones quimicas Que son reacciones irreversibles
Que son reacciones irreversibles Catabolismo de los aminoácidos
Catabolismo de los aminoácidos Aminas secundarias ejemplos
Aminas secundarias ejemplos Semirreacciones redox ejemplos
Semirreacciones redox ejemplos La debilidad de las reacciones
La debilidad de las reacciones Propiedades de los compuestos covalentes
Propiedades de los compuestos covalentes Cuales son las reacciones del ciclo de krebs
Cuales son las reacciones del ciclo de krebs Reacciones de neutralización ejemplos
Reacciones de neutralización ejemplos Ecuacion quimica de la respiracion
Ecuacion quimica de la respiracion Ejemplo de descomposición química
Ejemplo de descomposición química Mol reacciones quimicas
Mol reacciones quimicas Aplicaciones de la electrolisis
Aplicaciones de la electrolisis Principios de trabajos virtuales
Principios de trabajos virtuales Teoria de arrhenius
Teoria de arrhenius Examen externo del cadáver
Examen externo del cadáver Reacciones de vinculo
Reacciones de vinculo Reacciones quimicas reversibles
Reacciones quimicas reversibles Alquenos tabla
Alquenos tabla Reacciones de adicion electrofilica
Reacciones de adicion electrofilica Proceso electrolitico
Proceso electrolitico Reaccion de sustitucion simple
Reaccion de sustitucion simple Exergónico
Exergónico Reacciones redox mapa conceptual
Reacciones redox mapa conceptual Reacciones quimicas
Reacciones quimicas Hoja amarilla digemid
Hoja amarilla digemid Nitrato de plata y yoduro de potasio reacción
Nitrato de plata y yoduro de potasio reacción Cuerpo suspendido
Cuerpo suspendido Frases del atomo
Frases del atomo Reacciones de hipersensibilidad
Reacciones de hipersensibilidad Hoja amarilla digemid
Hoja amarilla digemid Reacciones de orden cero
Reacciones de orden cero Que es la neutralizacion
Que es la neutralizacion Teoría de colisiones
Teoría de colisiones Formula kp
Formula kp 360
360 Síntesis de williamson
Síntesis de williamson Mapa conceptual de reacciones endotérmicas y exotérmicas
Mapa conceptual de reacciones endotérmicas y exotérmicas Balanceada
Balanceada Reacciones supravitales
Reacciones supravitales Ciclo alcanos alquenos y alquinos
Ciclo alcanos alquenos y alquinos Ciclobutano ejemplos
Ciclobutano ejemplos Trans-2-buteno estructura
Trans-2-buteno estructura Tabla de los alquenos
Tabla de los alquenos Serie homologa de los alcanos del 1 al 10
Serie homologa de los alcanos del 1 al 10 Propilmeteno
Propilmeteno Reaccion de alcanos
Reaccion de alcanos Reglas para nombrar alcanos ramificados
Reglas para nombrar alcanos ramificados Principales usos de los alcanos
Principales usos de los alcanos Combustion incompleta
Combustion incompleta Clasificaciones de los hidrocarburos
Clasificaciones de los hidrocarburos Nombrar alcanos
Nombrar alcanos Observe atentamente os hidrocarbonetos abaixo
Observe atentamente os hidrocarbonetos abaixo N-alcanos
N-alcanos Nomenclatura alcanos lineales
Nomenclatura alcanos lineales Propil metano
Propil metano Propiedades fisicas de los alcanos
Propiedades fisicas de los alcanos 3 etil 2 4 dimetilhexano
3 etil 2 4 dimetilhexano Fórmula desarrollada de los alcanos
Fórmula desarrollada de los alcanos Alcanos formula desarrollada
Alcanos formula desarrollada Que son los grupos financieros
Que son los grupos financieros