UNIDAD 10 AULA 360 REACCIONES QUMCAS 1 Las














- Slides: 15

UNIDAD 10 AULA 360 REACCIONES QUÍMCAS 1. Las reacciones químicas 2. Leyes de las reacciones químicas 3. Cantidad de sustancia 4. Tipos de reacciones químicas 5. Velocidad de reacción 6. Algunas reacciones importantes 7. Energía de las reacciones químicas 8. Estequiometría 4º ESO | UNIDAD 10 | FÍSICA Y QUÍMICA © GELV

REACCIONES QUÍMICAS AULA 360 1. Las reacciones químicas Una reacción química es un proceso por el que unas sustancias se transforman en otras diferentes. Este proceso lleva asociada una reorganización de los átomos de las sustancias que intervienen. Las reacciones químicas se representan mediante ecuaciones químicas. Una ecuación química es la representación de una reacción química mediante las fórmulas de las sustancias que intervienen en el proceso. Constan de dos miembros separados por una flecha, que indica el sentido en que se produce la reacción y que se lee «para dar» . 4º ESO | UNIDAD 10 | FÍSICA Y QUÍMICA © GELV

REACCIONES QUÍMICAS AULA 360 Ajuste de ecuaciones químicas Las ecuaciones químicas deben estar igualadas o ajustadas, es decir, el número de átomos de cada elemento químico debe ser igual en ambos miembros. Para ajustar una ecuación química se multiplican las fórmulas de las sustancias que intervienen por unos coeficientes, llamados coeficientes estequiométricos. La mayoría de las ecuaciones químicas se ajustan por el Método de tanteo. La ecuación de la combustión del propano es: C 3 H 8 + O 2 CO 2 + H 2 O Ajustada: C 3 H 8 + 5 O 2 4º ESO | UNIDAD 10 | FÍSICA Y QUÍMICA 3 CO 2 + 4 H 2 O © GELV

REACCIONES QUÍMICAS AULA 360 2. Leyes de las reacciones químicas Estas leyes están definidas a partir de las masas de las sustancias reaccionantes, son las denominadas leyes ponderales. La ley de la conservación de la masa o ley de Lavoisier indica que, en toda reacción química, la masa de las sustancias que reaccionan es igual a la masa de las sustancias que se forman. La ley de las proporciones definidas o ley de Proust postula que cuando dos o más elementos se combinan para formar un compuesto, la relación entre sus masas es constante: 4º ESO | UNIDAD 10 | FÍSICA Y QUÍMICA © GELV

REACCIONES QUÍMICAS. LEYES DE LAS REACCIONES QUÍMICAS AULA 360 La ley de las proporciones múltiples o ley de Dalton indica que las cantidades de un mismo elemento que se combinan con una cantidad fija de otro, para formar varios compuestos, están en una relación de números enteros sencillos. Leyes de los volúmenes de combinación • La ley de Gay-Lussac establece que cuando los gases se combinan para obtener compuestos también gaseosos, sus respectivos volúmenes guardan una proporción de números sencillos, siempre que se midan en iguales condiciones de presión y temperatura. • Avogadro estableció que volúmenes de gases diferentes, en las mismas condiciones de presión y temperatura, contienen igual número de moléculas. 4º ESO | UNIDAD 10 | FÍSICA Y QUÍMICA © GELV

REACCIONES QUÍMICAS AULA 360 3. Cantidad de sustancia La cantidad de sustancia es una magnitud fundamental del Sistema Internacional de unidades y su unidad es el mol. Un mol es la cantidad de sustancia que contiene el número de Avogadro (6, 022 · 1023) de partículas. Siempre se debe especificar de qué partículas se tratan: mol de átomos, mol de moléculas, mol de iones, mol de electrones, etc. Masa molar, M, es la masa de un mol de partículas. Su unidad es g/mol. La masa molecular es la suma de las masas atómicas de los átomos que constituyen la fórmula de un compuesto. La masa molar coincide con la masa molecular, pero expresada en gramos por mol. Para cualquier sustancia y cualquier masa, se puede escribir: 4º ESO | UNIDAD 10 | FÍSICA Y QUÍMICA © GELV

REACCIONES QUÍMICAS AULA 360 4. Tipos de reacciones químicas Debido a las diferentes agrupaciones que se producen entre los átomos de los reactivos y los productos existen varios tipos. Reacciones de síntesis o combinación Dos o más sustancias, bien sean elementos o compuestos, se unen para formar una sustancia nueva: Reacciones de descomposición Se forman dos o más sustancias a partir de un compuesto dado: Reacciones de sustitución Un elemento reemplaza a otro en un compuesto: 4º ESO | UNIDAD 10 | FÍSICA Y QUÍMICA © GELV

REACCIONES QUÍMICAS AULA 360 5. Velocidad de reacción La velocidad de reacción es la cantidad de sustancia que se forma o que desaparece en la unidad de tiempo. La velocidad de una reacción química depende de varios factores: • Naturaleza de los reactivos. La velocidad depende de la fortaleza de los enlaces de los reactivos. • Superficie de contacto. La velocidad será mayor cuanto mayor sea la superficie de contacto entre los reactivos, lo que se consigue con una mayor pulverización o en reacciones en disolución. • Concentración de los reactivos. La velocidad de una reacción aumenta al aumentar la concentración de los reactivos. • Temperatura. Por lo general, la velocidad de reacción aumenta con la temperatura. • Utilización de catalizadores. Los catalizadores son sustancias que, con una pequeña cantidad, aumentan o disminuyen la velocidad de una reacción. 4º ESO | UNIDAD 10 | FÍSICA Y QUÍMICA © GELV

REACCIONES QUÍMICAS AULA 360 6. Reacciones químicas importantes Reacciones ácido-base Ácido es una sustancia que en disolución acuosa cede iones hidrógeno, H+. Base es una sustancia que en disolución acuosa cede iones hidróxido, OH–. 4º ESO | UNIDAD 10 | FÍSICA Y QUÍMICA © GELV

REACCIONES QUÍMICAS IMPORTANTES AULA 360 Medida de la acidez. Concepto de p. H Para saber si una sustancia es un ácido o una base se utiliza una escala llamada escala de p. H cuyos valores están comprendidos entre 1 y 14, de modo que: • Disoluciones básicas: p. H > 7; el carácter básico es tanto mayor cuanto mayor es el valor del p. H. • Disoluciones neutras: p. H = 7; no tienen características ácidas ni básicas. • Disoluciones ácidas: p. H < 7; el carácter ácido es tanto más acusado cuanto menor es el valor del p. H. Para medir el p. H de una disolución se usan los indicadores, sustancias que añadidas en pequeñas cantidades a un ácido adquieren un color, y en una base toman otro. 4º ESO | UNIDAD 10 | FÍSICA Y QUÍMICA © GELV

REACCIONES QUÍMICAS IMPORTANTES AULA 360 Reacciones de neutralización Al mezclar una disolución de un ácido con otra de una base las propiedades de ambas sustancias se anulan o se neutralizan. La razón es que: Una reacción de neutralización es aquella en la que un ácido reacciona con una base para formar una sal y agua: Algunos ejemplos de este tipo de reacciones son: 4º ESO | UNIDAD 10 | FÍSICA Y QUÍMICA © GELV

REACCIONES QUÍMICAS IMPORTANTES AULA 360 Reacciones de oxidación-reducción En una reacción de oxidación-reducción, siempre hay una sustancia que se oxida, llamada reductor, y otra que se reduce, denominada oxidante. Reacción de oxidación: Reacción de reducción: Reacciones de oxidación-reducción La combustión es una reacción de oxidación rápida en la que se desprende calor y, frecuentemente, luz. Las combustiones se realizan en presencia de oxígeno y producen dióxido de carbono, agua y energía. 4º ESO | UNIDAD 10 | FÍSICA Y QUÍMICA © GELV

REACCIONES QUÍMICAS AULA 360 7. Energía de las reacciones químicas En una reacción exotérmica se desprende calor. Una reacción endotérmica necesita calor para producirse. El calor intercambiado en cualquiera de las reacciones anteriores se llama calor de reacción, q. 4º ESO | UNIDAD 10 | FÍSICA Y QUÍMICA © GELV

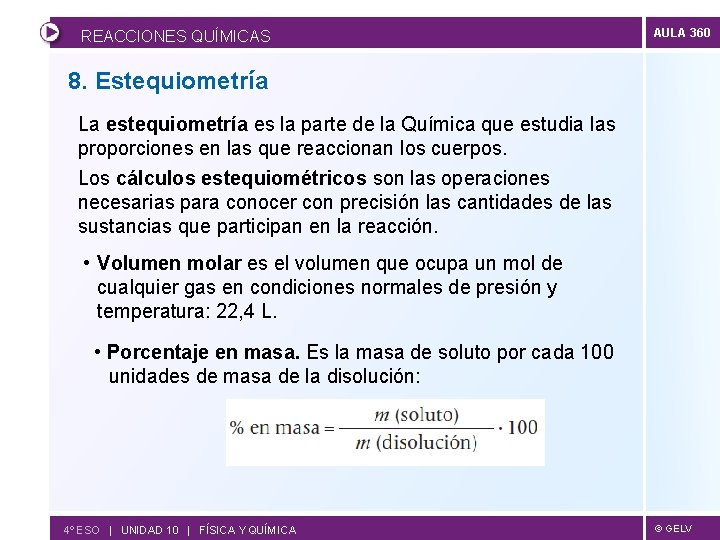
REACCIONES QUÍMICAS AULA 360 8. Estequiometría La estequiometría es la parte de la Química que estudia las proporciones en las que reaccionan los cuerpos. Los cálculos estequiométricos son las operaciones necesarias para conocer con precisión las cantidades de las sustancias que participan en la reacción. • Volumen molar es el volumen que ocupa un mol de cualquier gas en condiciones normales de presión y temperatura: 22, 4 L. • Porcentaje en masa. Es la masa de soluto por cada 100 unidades de masa de la disolución: 4º ESO | UNIDAD 10 | FÍSICA Y QUÍMICA © GELV

REACCIONES QUÍMICAS. ESTEQUIOMETRÍA AULA 360 • Porcentaje en volumen. Expresa el volumen de soluto por cada 100 unidades de volumen de la disolución. • Concentración en masa. Es la masa de soluto por cada litro de la disolución. Su unidad en el SI es kg/L, la misma que la densidad. • Molaridad, M, o concentración molar. Es el número de moles de soluto por cada litro de disolución. Su unidad en el SI es mol/L. 4º ESO | UNIDAD 10 | FÍSICA Y QUÍMICA © GELV
 Centenas
Centenas Cambios fisicos y quimicos
Cambios fisicos y quimicos Reacciones ireversibles ejemplos
Reacciones ireversibles ejemplos La debilidad de las reacciones
La debilidad de las reacciones Reacciones del ciclo de krebs
Reacciones del ciclo de krebs Agente reductor y oxidante
Agente reductor y oxidante Las reacciones endergónicas son aquellas que
Las reacciones endergónicas son aquellas que Que es el catabolismo
Que es el catabolismo Apoyo fijo movil y empotrado
Apoyo fijo movil y empotrado Reacciones químicas
Reacciones químicas Mol reacciones quimicas
Mol reacciones quimicas Mg elemento
Mg elemento Halogenación del propano
Halogenación del propano Cambio de temperatura química
Cambio de temperatura química Reacciones de los alquenos
Reacciones de los alquenos Síntesis de williamson
Síntesis de williamson




























