SEMANA 4 clase 4 REACCIN Y ECUACIN QUMICA

















- Slides: 22

SEMANA # 4 (clase # 4) REACCIÓN Y ECUACIÓN QUÍMICA Profesora Licda. QB Lucrecia C. de Leiva Unidad Didáctica de Química 2015 1

Reacción Química • Es un cambio ó fenómeno químico en donde se observan manifestaciones que evidencian que los átomos de una sustancia se transforman en una o más sustancias nuevas, con propiedades diferentes. • Ej: El hierro en contacto con el oxígeno del aire se oxida y produce óxido color rojo café. • Fe + O 2 → Fe 2 O 3 2

Ecuación Química • Describe la reacción química por medio de Fórmulas Químicas que representan a los Reactivos y los Productos donde se observa que los átomos se conservan. • Una ecuación química debe de cumplir la ley de Conservación de la Materia, por lo que se debe balancear (igual # de átomos en R y P). • Fe + O 2 Fe 2 O 3 • Ya balanceada: 4 Fe + 3 O 2 2 Fe 2 O 3 3

Partes y símbolos de un Ecuación Química • Reactivos (átomos ó compuestos que reaccionarán) • Productos (átomos ó compuestos que se formaron) • Catalizador (altera la velocidad de reacción, no es R ni P). Se coloca encima de la flecha. • Se utilizan →, ↔, +, # como coeficientes y # como subíndices ), estado físico (s), (l), (g) ó ↑, (ac), ∆, catalizador sobre la flecha. 4

Manifestaciones de las reacciones (se perciben por los sentidos) • Cambio de color • Cambio de temperatura • Formación o desprendimiento de gas ó burbujas • Formación de un sólido ó precipitado • Cambio de p. H • Liberación de olor 5

Tipos de Reacciones • Reacción de Síntesis ó Combinación A + B → AB 2 Mg(s) + O 2(g) → 2 Mg. O(s) H 2(g)+ Br 2(g) → 2 HBr(g) Ca. O(s) + CO 2 (g) → Ca. CO 3 (s) 6

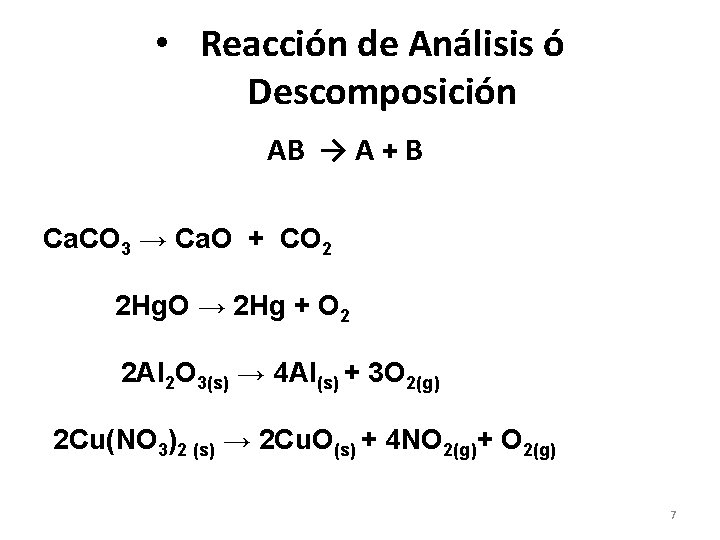
• Reacción de Análisis ó Descomposición AB → A + B Ca. CO 3 → Ca. O + CO 2 2 Hg. O → 2 Hg + O 2 2 Al 2 O 3(s) → 4 Al(s) + 3 O 2(g) 2 Cu(NO 3)2 (s) → 2 Cu. O(s) + 4 NO 2(g)+ O 2(g) 7

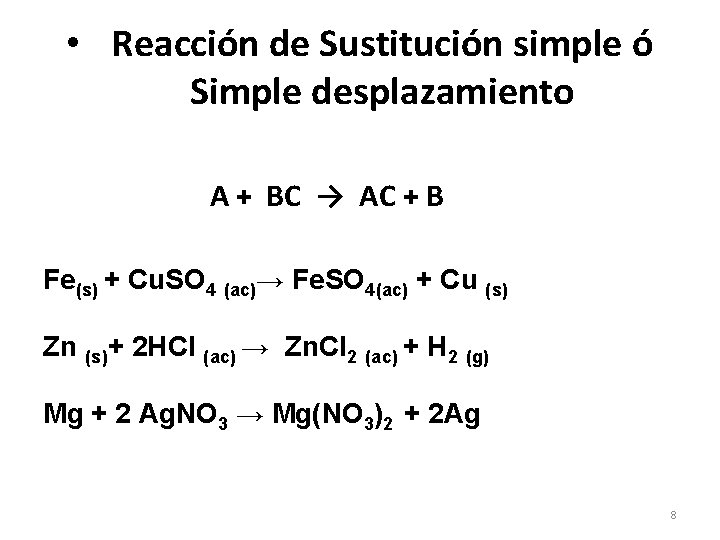
• Reacción de Sustitución simple ó Simple desplazamiento A + BC → AC + B Fe(s) + Cu. SO 4 (ac)→ Fe. SO 4(ac) + Cu (s) Zn (s)+ 2 HCl (ac) → Zn. Cl 2 (ac) + H 2 (g) Mg + 2 Ag. NO 3 → Mg(NO 3)2 + 2 Ag 8

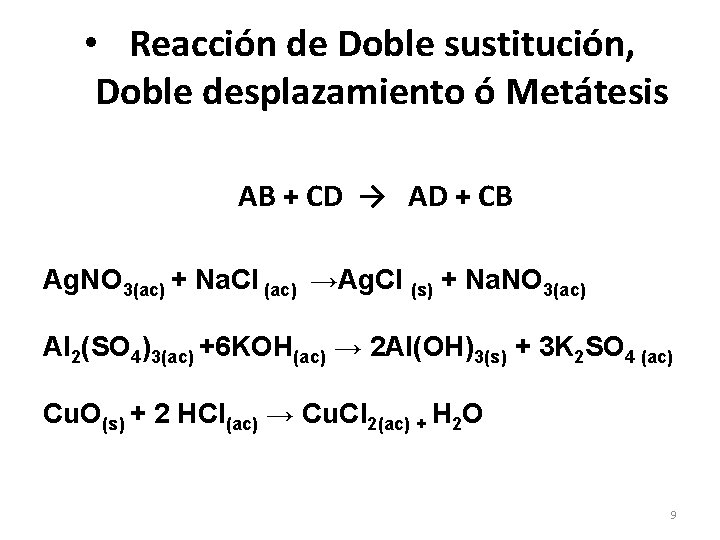
• Reacción de Doble sustitución, Doble desplazamiento ó Metátesis AB + CD → AD + CB Ag. NO 3(ac) + Na. Cl (ac) →Ag. Cl (s) + Na. NO 3(ac) Al 2(SO 4)3(ac) +6 KOH(ac) → 2 Al(OH)3(s) + 3 K 2 SO 4 (ac) Cu. O(s) + 2 HCl(ac) → Cu. Cl 2(ac) + H 2 O 9

• Reacción de Neutralización ACIDO + BASE → AGUA + SAL HCl (ac) + Na. OH (ac) → H 2 O + Na. Cl (ac) H 2 SO 4 (ac) + 2 KOH (ac) K 2 SO 4 (ac) + 2 H 2 O • Reacción de Combustión (compuestos con C, H, O que se queman) CH 4 (g) + 2 O 2 (g) CO 2 (g) + 2 H 2 O (g) + Energía C 2 H 5 OH(l) + O 2(g) 2 CO 2 (g) + 2 H 2 O(g) + Energía 10

• Reacción Endotérmica (necesita energía, en los reactivos, ∆, Kcal, enfría) H 2(g) + ½ O 2(g) + 283 Kcal → H 2 O (l) H 2(g) + ½ O 2(g) → H 2 O (l) △H =+283 Kca • Reacción Exotérmica (libera energía en los productos, ∆, Kcal, se calienta) CH 4(g) + 2 O 2(g) → CO 2(g)+ 2 H 2(g) + 192 Kcal CH 4(g) + 2 O 2(g) → CO 2(g)+2 H 2(g) △H=-192 Kcal 11

• Reacción Irreversible (se realiza solo en una dirección) A → B (Todas las que vimos) • Reacción Reversible (se realiza en dos direcciones) Directa A → B A ⇄B Inversa A ← B CS 2 (g) + 4 H 2 (g) ⇄ CH 4 (g) + 2 H 2 S (g) 12

Balanceo de Ecuaciones • Procedimiento donde se escriben coeficientes (# enteros delante de las fórmulas de los símbolos ó compuestos) para igualar el # total de átomos ó moléculas en cada lado de la ecuación (Reactivos = Productos) y cumplir la Ley de Conservación de la Materia. • NO SE CAMBIAN LOS SUBÍNDICES. • Utilizaremos los métodos de TANTEO y REDOX 13

Balanceo por Tanteo No balanceada Fe + O 2 Fe 2 O 3 • Colocar coeficientes que igualen el # de átomos en los Reactivos y en los Productos en este orden: 1º Metales, 2º Nometales, 3º Hidrógenos, 4º Oxígenos Balanceada 4 Fe + 3 O 2 2 Fe 2 O 3 (coeficiente de reactivos 4 y 3, de productos 2) 14

Ejercicios 1) Na. OH + H 2 S → Na 2 S + H 2 O 2) 3) 4) 5) 6) 7) 8) KCl. O 3 → KCl + O 2 Mg(s) + N 2 (g) → Mg 3 N 2(s) Ag. NO 3+ Ba. Cl 2 → Ag. Cl+ Ba(NO 3)2 Al + H 2 SO 4 → Al 2(SO 4)3 + H 2 Cu(NO 3)2 +Na 2 S → Cu. S+Na. NO 3 CH 4 + O 2 → H 2 O + CO 2 Ba. Cl 2 + K 2 CO 3 → Ba. CO 3 + KCl 15

Número ó Estado de Oxidación • Es un número entero positivo ó negativo que se le asigna a cada átomo de un compuesto, ión ó elemento. Indica cuantos electrones gana, pierde ó comparten los átomo al enlazarse y formar un compuesto. • Al asignar # de oxidación, no se debe guiar con la tabla periódica, sino con estas reglas. 16

Reglas para asignar números de oxidación 1. Elementos libres (no formando compuesto) ó diatómicos, # de oxid. = 0 Ej: H 2 (H= 0) Cl 2 (Cl= 0) Zn (Zn= 0) Ag (Ag= 0) 2. El H en compuestos, # de oxid. = +1 (excepto en HM, hidruros = -1, no en programa). Ej: H 2 S (H 2+1 S-2) NH 3 (N-3 H 3+1) 3. El O en compuestos, # de oxid. =-2 (excepto en H 2 O 2 peróxidos = -1, no en programa). Ej: CO 2 (C+4 O-22) SO 3 (S+6 O-23) 17

4. Elementos con # de oxidación únicos. columna IA # oxid= +1; IIA # oxid= +2; IIIA # oxid= +3 5. La suma de todos los números de oxidación de todos los átomos de un compuesto debe=0 Ej: H 3 BO 3 (H=+1 x 3=+3) (B=+3 x 1=+3) (O=-2 x 3=-6) (+3+3 -6= 0) 6. Para un ión monoatómico su # oxid=su carga Ej: Na+(Na=+1) Ca+2(Ca=+2) S-2(S=-2) Cl-(Cl=-1) 18

7. En un ión poliatómico, la suma de todos los # de oxidación de todos los átomos debe ser igual a la carga del ión. Ej: (PO 4)-3 (P=+5) (O=-2 x 4=-8); (+5 -8=-3) 8. Para compuestos binarios Xx. Yy, el subíndice x corresponde a Y. El subíndice +y corresponde a. X Ej: Fe 2 S 3 (Fe=+3 ; S=-2) PCl 5 (P=+5 ; Cl=-1) 19

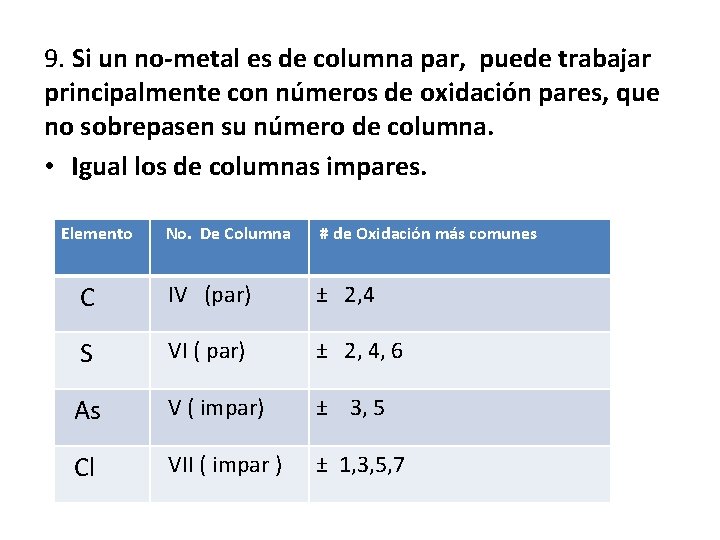
9. Si un no-metal es de columna par, puede trabajar principalmente con números de oxidación pares, que no sobrepasen su número de columna. • Igual los de columnas impares. Elemento No. De Columna # de Oxidación más comunes C IV (par) ± 2, 4 S VI ( par) ± 2, 4, 6 As V ( impar) ± 3, 5 Cl VII ( impar ) ± 1, 3, 5, 7 20

Ejemplos: • H 2 SO 4 H=+1 O=-2 S= +6 • H 2 SO 3 H=+1 O=-2 S= +4 • HCl. O 4 H=+1 O=-2 Cl=+7 • Ni 2(CO 3)3 Ni=+3 y todo el CO 3= -2 Entonces C=+4 O=-2 21

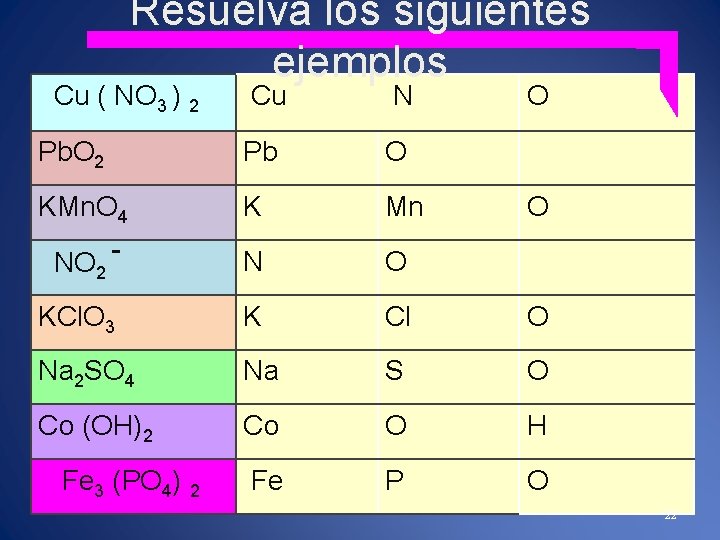
Resuelva los siguientes ejemplos Cu ( NO 3 ) 2 Cu N Pb. O 2 Pb O KMn. O 4 K Mn NO 2 - N O KCl. O 3 K Cl O Na 2 SO 4 Na S O Co (OH)2 Co O H Fe P O Fe 3 (PO 4) 2 O O 22