Ministerio de Salud Direccin General de Medicamentos Insumos


























- Slides: 33

Ministerio de Salud Dirección General de Medicamentos, Insumos y Drogas - Dirección General de Salud de las Personas FARMACOVIGILANCIA INTENSIVA A MEDICAMENTOS ANTITUBERCULOSOS QF. Gina Huaraj Garcia FARMACOEPIDEMIOLOGIA Y FARMACOVIGILANCIA – ESN DE PREVENCION Y CONTROL DE LA TUBERCULOSIS

Fases de desarrollo de un nuevo Medicamento Fase Sujeto No. part. Objetivo Preclínica Fase 0 Animales Variable Perfil farmacológico Toxicidad aguda (2 espec) Toxicidad a dosis repetida a corto y largo plazo (teratogenicidad. . ) Clínica Fase I Voluntarios sanos 25 -50 Farmacocinética y farmacodinamia Fase II Enfermos 100 a 250 Eficacia y seguridad a corto plazo, preliminar Fase III Enfermos 150/1000 Eficacia y Seguridad comparativa Fase IV Enfermos + de 1000 Estudios post comercialización (I, III)

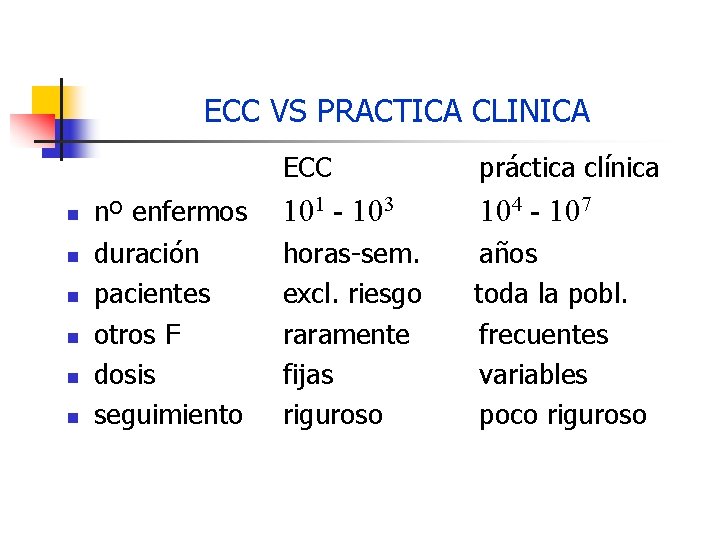
ECC VS PRACTICA CLINICA n n n ECC práctica clínica nº enfermos 101 - 103 104 - 107 duración pacientes otros F dosis seguimiento horas-sem. excl. riesgo raramente fijas riguroso años toda la pobl. frecuentes variables poco riguroso

ANTECEDENTES DE LA FARMACOVIGILANCIA “Dietilenglicol Nefrotoxicidad ” 1937: § 107 MUERTE POR ELIXIR DE SULFONAMIDA §SE CREA LA FDA 2001: OMS : MAS DE 500 MUERTES 2006: PANAMA : 43 MUERTES JARABE CLORURO AMONICO “TALIDOMIDA FOCOMELIA” Ø 1962: MAS DE 10 000 NIÑOS NACIDOS ØINICIO DE SIST. NOTIFIC. ESPONTANEA

Reacción adversa (Adverse Reaction) “Una respuesta a un medicamento que es nociva y no intencionada, y que se produce con las dosis utilizadas normalmente en el hombre”. VIGILANCIA DE LA SEGURIDAD DE LOS MEDICAMENTOS t. HE UPPSALA MONITORING CENTRE, 2001

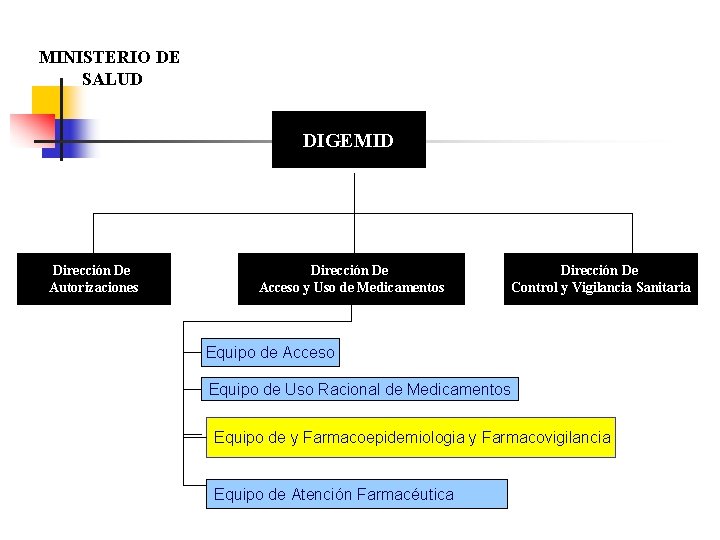
MINISTERIO DE SALUD DIGEMID Dirección De Autorizaciones Dirección De Acceso y Uso de Medicamentos Dirección De Control y Vigilancia Sanitaria Equipo de Acceso Equipo de Uso Racional de Medicamentos Equipo de y Farmacoepidemiologia y Farmacovigilancia Equipo de Atención Farmacéutica

Sistema Peruano de Farmacovigilancia n. Sistema de Notificación Espontánea n. Hoja Amarilla (profesionales/empresas) n. Base de Datos n. Sistema de Vigilancia Hospitalaria n. Implementación de la FCVG. en Hospitales de Lima y Provincia n Sistema de vigilancia a los medicamentos de las estrategias sanitarias nacionales: Malaria, VIH, TBC n. Medicamentos antimaláricos n. Medicamentos antirretrovirales n. Medicamentos antituberculosos

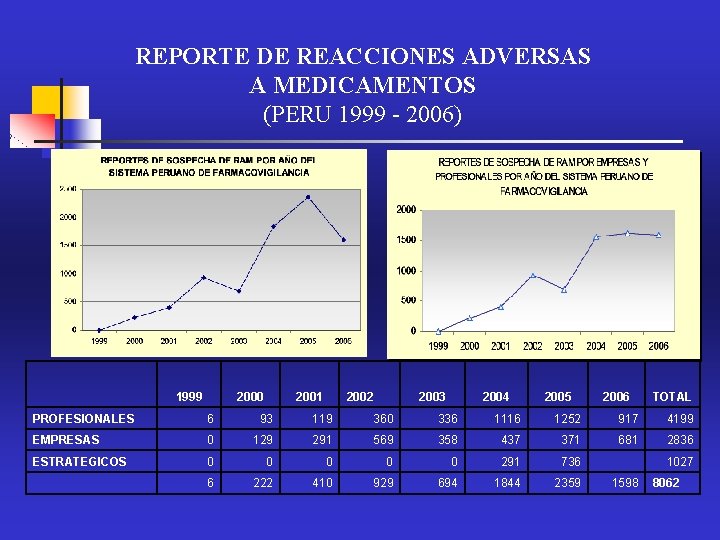
REPORTE DE REACCIONES ADVERSAS A MEDICAMENTOS (PERU 1999 - 2006) 1999 2000 2001 2002 2003 2004 2005 2006 TOTAL PROFESIONALES 6 93 119 360 336 1116 1252 917 4199 EMPRESAS 0 129 291 569 358 437 371 681 2836 ESTRATEGICOS 0 0 0 291 736 1027 6 222 410 929 694 1844 2359 1598 8062

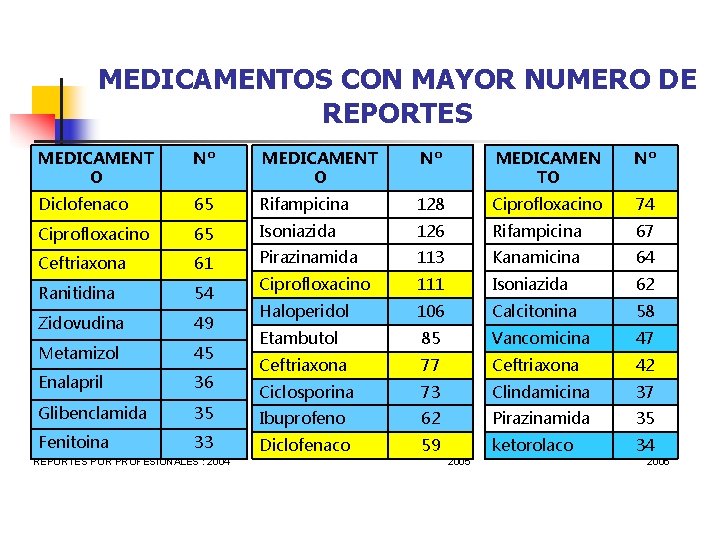
MEDICAMENTOS CON MAYOR NUMERO DE REPORTES MEDICAMENT O Nº MEDICAMEN TO Nº Diclofenaco 65 Rifampicina 128 Ciprofloxacino 74 Ciprofloxacino 65 Isoniazida 126 Rifampicina 67 Ceftriaxona 61 Pirazinamida 113 Kanamicina 64 Ranitidina 54 Ciprofloxacino 111 Isoniazida 62 Zidovudina 49 Haloperidol 106 Calcitonina 58 Metamizol 45 Etambutol 85 Vancomicina 47 Enalapril 36 Ceftriaxona 77 Ceftriaxona 42 Glibenclamida 35 Ciclosporina 73 Clindamicina 37 Ibuprofeno 62 Pirazinamida 35 Fenitoina 33 Diclofenaco 59 ketorolaco 34 REPORTES POR PROFESIONALES : 2004 2005 2006

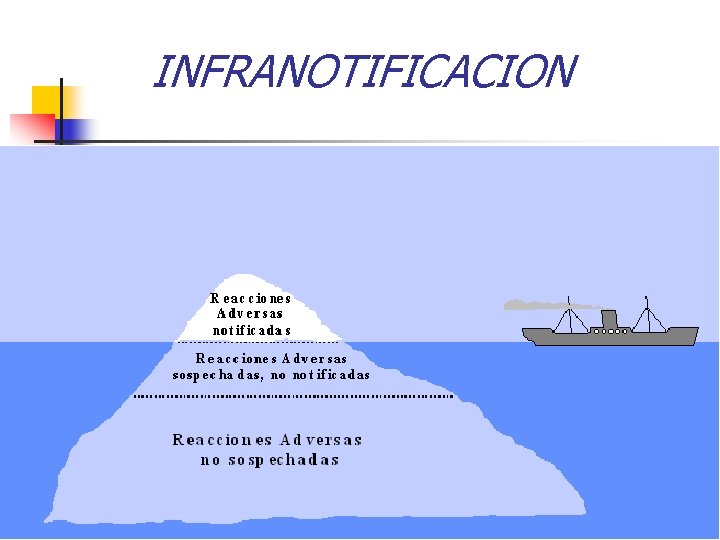
INFRANOTIFICACION

¿Porqué no se notifica? n Complacencia: La errónea creencia de que sólo se permite la comercialización de fármacos seguros n Temor: Miedo a sufrir una demanda por parte del paciente n Culpabilidad: por el daño que el tratamiento ha causado al paciente n Ambición: Recoger y publicar casos personalmente n Ignorancia: de la existencia del programa n Timidez: Miedo a hacer el ridículo por notificar simples sospechas. n Letargia: una mezcla de falta de tiempo, falta de formatos y otras excusas Siete pecados capitales del potencial notificador, según Inman

Farmacovigilancia Intensiva a Antituberculosos Objetivo General : Identificar las reacciones adversas a medicamentos de las ESN de manera sistemática, y su relación con los factores predisponentes, a fin de contribuir al uso seguro de los medicamentos utilizados en la ESNP Y CTB del Ministerio de Salud.

Farmacovigilancia Intensiva a Antituberculosos Ø Objetivos Específicos: ü Detección temprana de las reacciones adversas e interacciones especialmente las graves, desconocidas o infrecuentes causadas por los medicamentos antituberculosos y concomitantes. ü Detección de aumento de frecuencia de reacciones adversas (conocidas) ü Identificación de factores de riesgo y de los posibles mecanismos subyacentes de las reacciones adversas ü Estimación de los aspectos cuantitativos de la relación beneficio/riesgo ü Difusión de la información necesaria para mejorar la regulación y prescripción de medicamentos

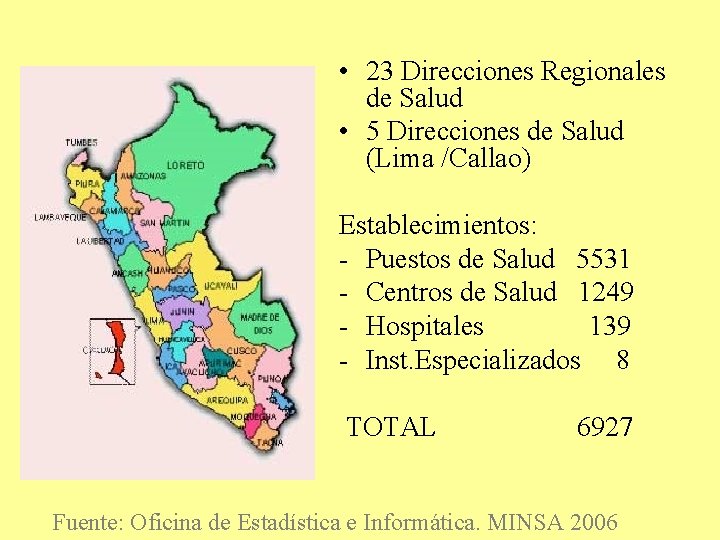
• 23 Direcciones Regionales de Salud • 5 Direcciones de Salud (Lima /Callao) Establecimientos: - Puestos de Salud 5531 - Centros de Salud 1249 - Hospitales 139 - Inst. Especializados 8 TOTAL 6927 Fuente: Oficina de Estadística e Informática. MINSA 2006

“El Perú tiene el 5% de la población de la Región de las Américas, sin embargo aporta el 25% del total de casos de tuberculosis por año. En el Perú, la carga de tuberculosis se concentra en el ámbito de las 5 Direcciones de Salud de Lima y Callao, donde se encuentra un tercio de la población del país y donde se registran más de la mitad de los casos de tuberculosis a nivel nacional 1” 1 Ministerio de Salud. Construyendo alianzas estratégicas para detener la tuberculosis: la experiencia peruana. Dirección General de Salud de las Personas. Lima – Ministerio de Salud del Perú; 2006. Páginas 70 -89.

INGRESO DE CASOS DE TB MDR A TRATAMIENTO 1997 -2006 3500 3000 2760 No. de casos 2500 2002 1500 1000 500 0 74 y = 16, 431 x 2 + 154, 83 x - 77, 548 R 2 = 0, 9782 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 Fuente: MINSA/DGSP/Estrategia Sanitaria Nacional de Prevención y Control de la Tuberculosis

PACIENTES EN TRATAMIENTO DE TB MDR DE ACUERDO A ESQUEMA Fuente: MINSA/DGSP/Estrategia Sanitaria Nacional de Prevención y Control de la Tuberculosis

MINISTERIO DE SALUD DIGEMID-DEAUM DGSP-ESNP Y CTB FICHA DE REPORTE DE SOSPECHA DE REACCIONES ADVERSAS A MEDICAMENTOS ANTITUBERCULOSOS Norma Técnica de Salud para el Control de la Tuberculosis. RM Nº 383 -2006 MINSA (25 abr-06)

Famacovigilancia Intensiva a Medicamentos Antituberculosos http: //www. minsa. gob. pe/normaslegales/2006/RM 383 -2006. pdf

MINISTERIO DE SALUD DIGEMID-DEAUM DGSP-ESNP Y CTB TRABAJO COORDINADO QUE FORTALECERA LAS CAPACIDADES TÉCNICAS A NIVEL DESCENTRALIZADO EN MATERIA DE FARMACOVIGILANCIA Y MEJORARA EL ACCESO A MEDICAMENTOS ANTITUBERCULOSOS.






NOTIFICACION DE REACCIONES ADVERSAS ü ü ü La notificación de RAFA es confidencial y de carácter obligatorio Los profesionales de salud del establecimiento que detecten la RAFA son los responsables de reportarlas a la ESN-PCTB de la DISA o DIRESA quienes se encargarán de enviar la información a la unidad técnica La identificación de la RAFA debe realizarse de manera sistemática cada vez que el paciente acude a recibir su tratamiento y de presentarse deberá registrarse en la tarjeta de administración y seguimiento colocando (+), de no presentarse (-).

NOTIFICACION DE REACCIONES ADVERSAS ü ü ü Identificada la RAFA, proceder al correcto llenado del reporte de sospecha de reacciones adversas a medicamentos antituberculosos (ver anexo 22) el cual debe ser enviado por conducto regular en los casos que no se cuente con sistema informático y por vía electrónica en caso que se cuente con dicho recurso. Los reportes RAFA graves deben ser enviados a la unidad técnica en un plazo de 72 horas y las no graves se enviarán conjuntamente con el informe operacional. La unidad técnica consolidará todos los reportes en el sistema informático RAFA para su análisis

¿Qué notificar? ü Las RA que provoquen desenlace mortal, pongan en peligro la vida del paciente, produzcan ingreso hospitalario o lo prolonguen, produzcan anomalías congénitas o procesos malignos; aunque sean bien conocidas y estén ya descritas en la literatura. ü Las RA que requieren tratamientos adicionales y/o ameritan suspensión del tratamiento ü Las Reacciones raras o desconocidas, aunque sean leves y que no están descritas en la literatura. ü Las interacciones medicamentosas que conduzcan tanto a problemas de seguridad como de pérdida de efectividad.

Farmacovigilancia Intensiva a Antituberculosos ü ü ü Indicadores: Frecuencia de RAM antituberculosos % de RAM por gravedad: No serias, Serias y Graves Análisis por grupo etáreo, sexo, procedencia, grupo ATC, RAM por org. y sist. , asociación antituberculoso - RAM

MINISTERIO DE SALUD DIGEMID-DEAUM DGSP-ESNP Y CTB El TRABAJO COORDINADO FORTALECERA LAS CAPACIDADES TÉCNICAS A NIVEL DESCENTRALIZADO EN MATERIA DE FARMACOVIGILANCIA Y MEJORARA EL ACCESO A MEDICAMENTOS ANTITUBERCULOSOS.

DIA MUNDIAL DE LA LUCHA CONTRA LA TUBERCULOSIS

DIA MUNDIAL DE LA LUCHA CONTRA LA TUBERCULOSIS

GRACIAS farmacovigilancia@digemid. minsa. gob. pe ghuaraj@digemid. minsa. gob. pe
 Cual es el rol del ministerio de salud
Cual es el rol del ministerio de salud Ministerio de salud nicaragua
Ministerio de salud nicaragua Ministerio de salud
Ministerio de salud Ministerio de salud
Ministerio de salud Imagen ministerio de salud
Imagen ministerio de salud Ministerio de salud
Ministerio de salud Rid ministerio de salud
Rid ministerio de salud Pnmcs
Pnmcs Personas que atendemos personas
Personas que atendemos personas Ministerio de salud
Ministerio de salud Ministerio de salud colombia
Ministerio de salud colombia Rif del ministerio de salud
Rif del ministerio de salud Ministerio de salud colombia
Ministerio de salud colombia Estacion unipodal
Estacion unipodal Seguimiento nominal
Seguimiento nominal Insumos para restaurantes
Insumos para restaurantes Produccin
Produccin Insumos y actividades
Insumos y actividades Cuáles son los insumos para relievar
Cuáles son los insumos para relievar Direccin
Direccin Direccin
Direccin Direccin
Direccin Direccin
Direccin United postal stationery society
United postal stationery society Salleras sanmartí definicion de salud
Salleras sanmartí definicion de salud Ley general de salud
Ley general de salud Riesgos laborales
Riesgos laborales Kardex de medicamentos
Kardex de medicamentos Reacciones adversas a medicamentos antituberculosos
Reacciones adversas a medicamentos antituberculosos Indicaciones de levosimendan
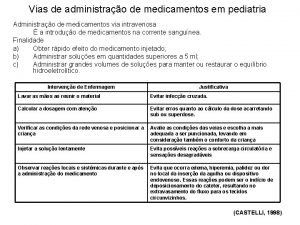
Indicaciones de levosimendan Vias de administração de medicamentos
Vias de administração de medicamentos Merco pharma medicamentos especiais
Merco pharma medicamentos especiais Etiquetas de medicamentos
Etiquetas de medicamentos Uae fondo nacional de estupefacientes
Uae fondo nacional de estupefacientes