Alcanos alquenos y alquinos Alcanos Principales usos de



















- Slides: 35

Alcanos, alquenos y alquinos

Alcanos


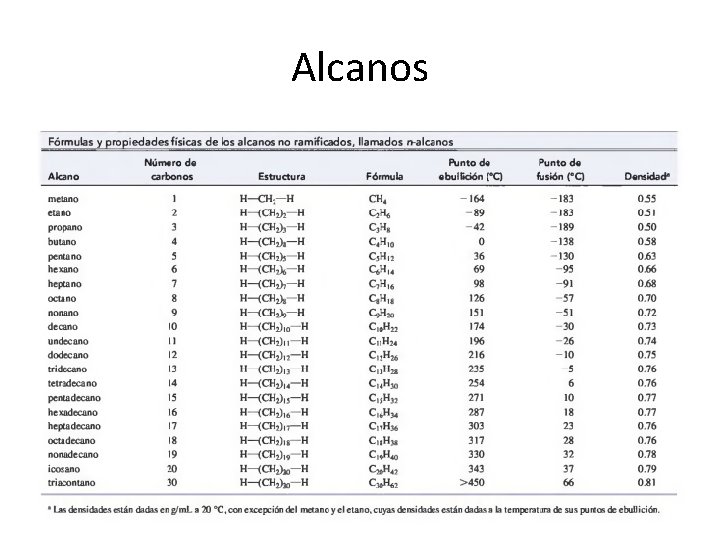
Principales usos de los alcanos C-1 -C 2 El metano y el etano son gases a temperatura ambiente y presión atmosférica. Son difíciles de licuar, por lo que generalmente se manejan como gases comprimidos. Sin embargo, después de enfriarlos hasta temperaturas criogénicas (muy bajas) se vuelven líquidos. El gas natural licuado, constituido principalmente de metano, puede transportarse más fácilmente en camiones refrigerados tipo cisterna, que como gas comprimido. C 3 - C 4 El propano y el butano también son gases a temperatura y presión ambiente, pero se licúan fácilmente a esta temperatura y a presiones moderadas. Estos gases, con frecuencia obtenidos junto con el petróleo líquido, se almacenan en cilindros a baja presión, y es lo que conocemos como gas licuado de petróleo (GLP). El propano y el butano son buenos combustibles, tanto para calefacción como para motores de combustión interna. El propano y el butano han reemplazado de forma importante a los Freones como propelentes en las latas de aerosoles. A diferencia de los alcanos, los propelentes Freon®, compuestos por clorofluorocarbonos, dañan la capa de ozono que protege la Tierra. C 5 -C 8 Los siguientes cuatro alcanos son líquidos volátiles que fluyen libremente. Los isó meros del pentano, hexano, heptano y octano son los compuestos principales de la gasolina. Su volatilidad es muy importante para este uso, debido a que los sistemas de inyección simplemente arrojan un chorro de gasolina en la válvula de admisión de aire mientras éste entra. Si la gasolina no se evaporara con facilidad, llegarían gotas al cilindro. La combustión de gotas no es tan eficiente como en el caso del vapor, por lo que el motor produciría humo por combustión incompleta y duraría poco.

Además de ser volátil, la gasolina debe resistir la combustión explosiva, potencialmente dañina, conocida como detonación. Las propiedades antidetonantes de la gasolina se miden por el número de octano, el cual se asigna comparando la gasolina con una mezcla de n heptano (mal detonante) e isooctano (2, 2, 4 trimetilpentano, que no tiende a detonar). C 9—C 16 Desde los nonanos (C 9) hasta los hexadecanos (C 16) son líquidos parcialmente viscosos con puntos de ebullición más elevados. Estos alcanos se utilizan en el queroseno, combustible para aviones y diesel. El queroseno, de estos combustibles el de punto de ebullición más bajo, alguna vez fue abundante, pero ahora es difícil de encontrar; es menos volátil que la gasolina y tiene menos tendencia a formar mezclas explosivas. El queroseno se utilizaba en lámparas y calentadores, los cuales usaban mechas para permitir la combustión de esta mezcla de hidrocarburos pesados. El combustible para aviones es parecido al queroseno, pero es mucho más refinado y huele menos. C -16 y superiores Los alcanos con más de 16 átomos de carbono se utilizan con mayor frecuencia como lubricantes y combustibles para calefacción. A éstos algunas veces se les llama “minerales” combustibles porque provienen del petróleo, al cual en alguna época se le consideraba un mineral. La “cera” de parafina no es una verdadera cera, sino una mezcla purificada de alcanos de alta masa molecular con puntos de fusión muy superiores a la temperatura ambiente. Las ceras reales son ésteres de cadena larga.

Los alcanos se derivan principalmente del petróleo y de sus subproductos. El petróleo, en ocasiones llamado crudo, se extrae de los pozos que llegan a los yacimientos que contienen restos de plantas prehistóricas. El primer paso en la refinación de petróleo es una cuidadosa destilación fraccionada. Los productos de esa destilación no son alcanos puros, sino mezclas de alcanos útiles con diversos puntos de ebullición. Después de la destilación, el craqueo catalítico convierte algunas de las fracciones menos valiosas en productos más útiles. El craqueo catalítico involucra el calentamiento de los alcanos en presencia de materiales que catalizan la división de moléculas grandes para obtener unas más pequeñas. El craqueo se utiliza con frecuencia para convertir fracciones con puntos de ebullición más elevados en mezclas de alcanos que pueden combinarse con gasolina.

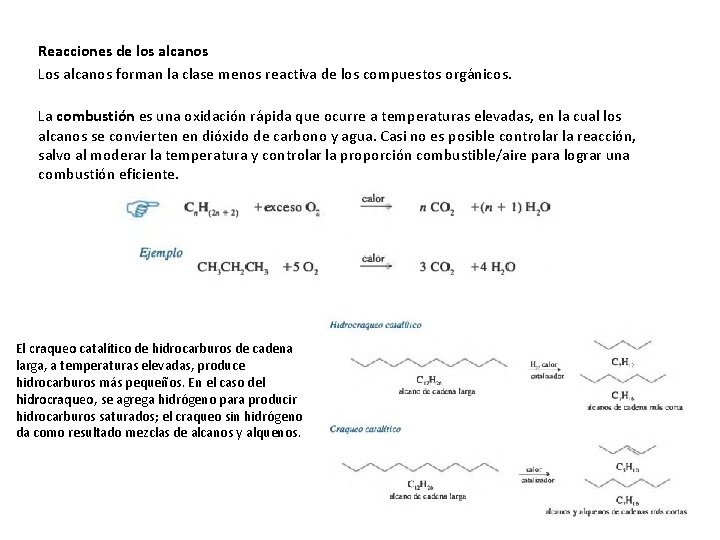
Reacciones de los alcanos Los alcanos forman la clase menos reactiva de los compuestos orgánicos. La combustión es una oxidación rápida que ocurre a temperaturas elevadas, en la cual los alcanos se convierten en dióxido de carbono y agua. Casi no es posible controlar la reacción, salvo al moderar la temperatura y controlar la proporción combustible/aire para lograr una combustión eficiente. El craqueo catalítico de hidrocarburos de cadena larga, a temperaturas elevadas, produce hidrocarburos más pequeños. En el caso del hidrocraqueo, se agrega hidrógeno para producir hidrocarburos saturados; el craqueo sin hidrógeno da como resultado mezclas de alcanos y alquenos.

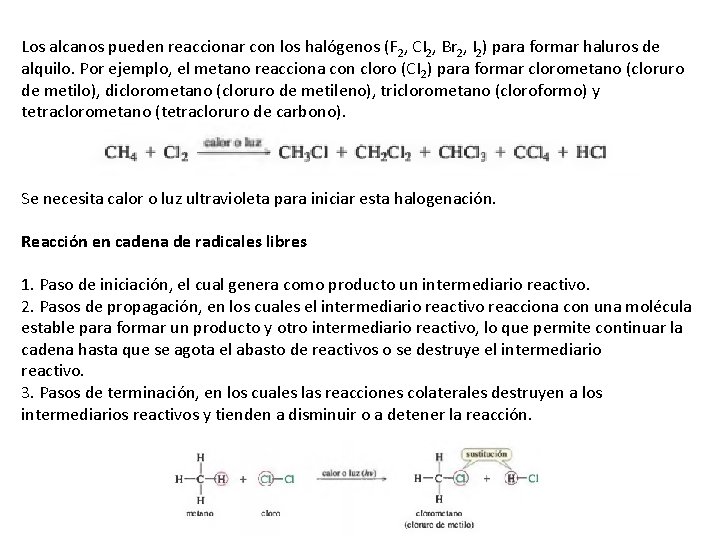
Los alcanos pueden reaccionar con los halógenos (F 2, CI 2, Br 2, I 2) para formar haluros de alquilo. Por ejemplo, el metano reacciona con cloro (CI 2) para formar clorometano (cloruro de metilo), diclorometano (cloruro de metileno), triclorometano (cloroformo) y tetraclorometano (tetracloruro de carbono). Se necesita calor o luz ultravioleta para iniciar esta halogenación. Reacción en cadena de radicales libres 1. Paso de iniciación, el cual genera como producto un intermediario reactivo. 2. Pasos de propagación, en los cuales el intermediario reactivo reacciona con una molécula estable para formar un producto y otro intermediario reactivo, lo que permite continuar la cadena hasta que se agota el abasto de reactivos o se destruye el intermediario reactivo. 3. Pasos de terminación, en los cuales las reacciones colaterales destruyen a los intermediarios reactivos y tienden a disminuir o a detener la reacción.

• Paso de iniciación: generación de radicales. La separación de una molécula de CI 2 es un paso de iniciación que produce dos átomos de cloro altamente activos. Un átomo de cloro es un ejemplo de un intermediario reactivo, una especie con un tiempo de vida media muy corta que nunca está presente en grandes concentraciones, ya que reacciona tan rápidamente como se forma. Cada átomo Cl* tiene un nú mero impar de electrones de valencia (siete), uno de los cuales está desapareado. Este electrón desapareado se conoce como electrón impar o electrón radical. A las especies con electrones desapareados se les llama radicales o radicales libres. Los radicales son deficientes en electrones, porque carecen de un octeto. El electrón impar se combina rápidamente con un electrón de otro átomo para completar un octeto y formar un enlace. • Paso de propagación: el primer paso de propagación comienza con un radical libre (el átomo de cloro), y produce otro radical libre (el radical metilo). La regeneración de un radical libre es característica de un paso de propagación de una reacción en cadena. La reacción puede continuar porque se produce otro intermediario reactivo. En el segundo paso de propagación, el radial metilo reacciona con una molécula de cloro para formar clorometano. El electrón impar del radical metilo se combina con uno de los dos electrones del enlace Cl— Cl para formar el enlace Cl— CH 3 y el átomo de cloro se queda con el electrón impar.

• Reacciones de terminación: si algo sucede para que se consuman algunos de los radicales libres intermediarios sin generar otros nuevos, la reacción en cadena disminuirá o se detendrá. Dicha reacción colateral se conoce como reacción de terminación (o terminal): un paso que produce menos intermediarios reactivos (radicales libres) de los que consume. Las siguientes son algunas de las reacciones de terminación posibles en el caso de la cloración del metano.

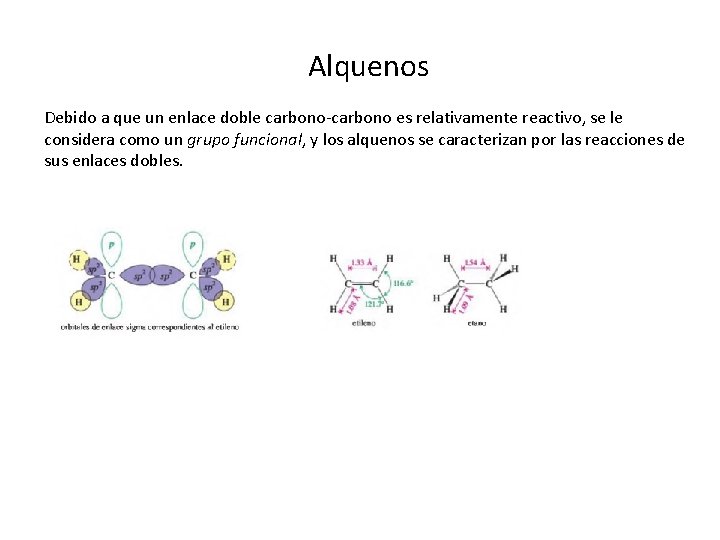
Alquenos Debido a que un enlace doble carbono es relativamente reactivo, se le considera como un grupo funcional, y los alquenos se caracterizan por las reacciones de sus enlaces dobles.

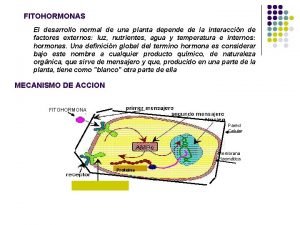
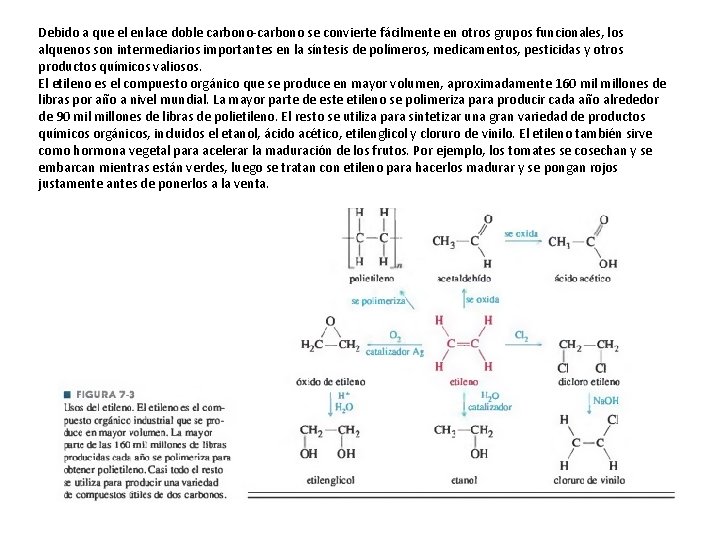
Debido a que el enlace doble carbono se convierte fácilmente en otros grupos funcionales, los alquenos son intermediarios importantes en la síntesis de polímeros, medicamentos, pesticidas y otros productos químicos valiosos. El etileno es el compuesto orgánico que se produce en mayor volumen, aproximadamente 160 millones de libras por año a nivel mundial. La mayor parte de este etileno se polimeriza para producir cada año alrededor de 90 millones de libras de polietileno. El resto se utiliza para sintetizar una gran variedad de productos químicos orgánicos, incluidos el etanol, ácido acético, etilenglicol y cloruro de vinilo. El etileno también sirve como hormona vegetal para acelerar la maduración de los frutos. Por ejemplo, los tomates se cosechan y se embarcan mientras están verdes, luego se tratan con etileno para hacerlos madurar y se pongan rojos justamente antes de ponerlos a la venta.

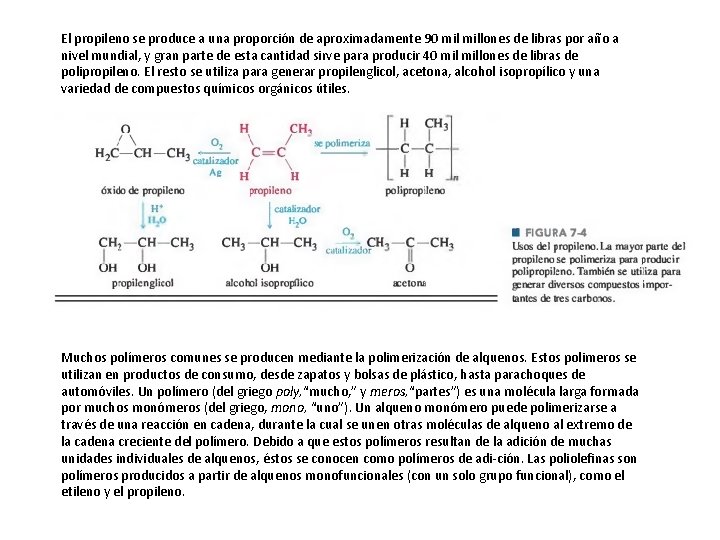
El propileno se produce a una proporción de aproximadamente 90 millones de libras por año a nivel mundial, y gran parte de esta cantidad sirve para producir 40 millones de libras de polipropileno. El resto se utiliza para generar propilenglicol, acetona, alcohol isopropílico y una variedad de compuestos químicos orgánicos útiles. Muchos polímeros comunes se producen mediante la polimerización de alquenos. Estos polimeros se utilizan en productos de consumo, desde zapatos y bolsas de plástico, hasta parachoques de automóviles. Un polímero (del griego poly, “mucho, ” y meros, “partes”) es una molécula larga formada por muchos monómeros (del griego, mono, “uno”). Un alqueno monómero puede polimerizarse a través de una reacción en cadena, durante la cual se unen otras moléculas de alqueno al extremo de la cadena creciente del polímero. Debido a que estos polímeros resultan de la adición de muchas unidades individuales de alquenos, éstos se conocen como polímeros de adi ción. Las poliolefinas son polímeros producidos a partir de alquenos monofuncionales (con un solo grupo funcional), como el etileno y el propileno.


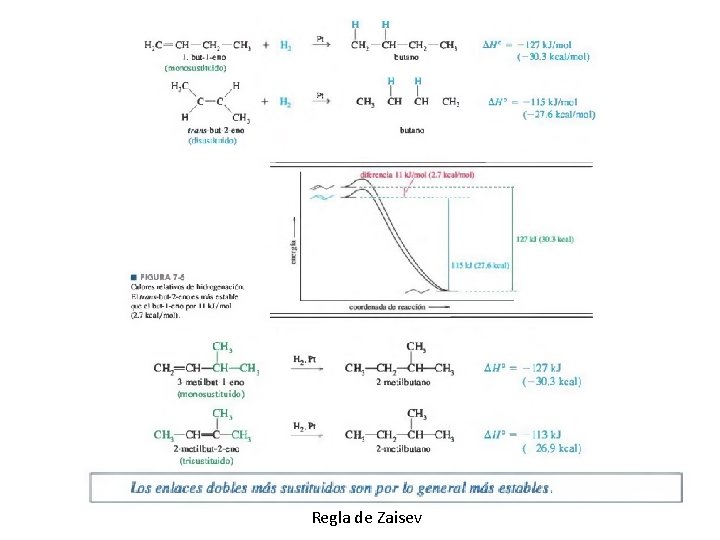
Regla de Zaisev


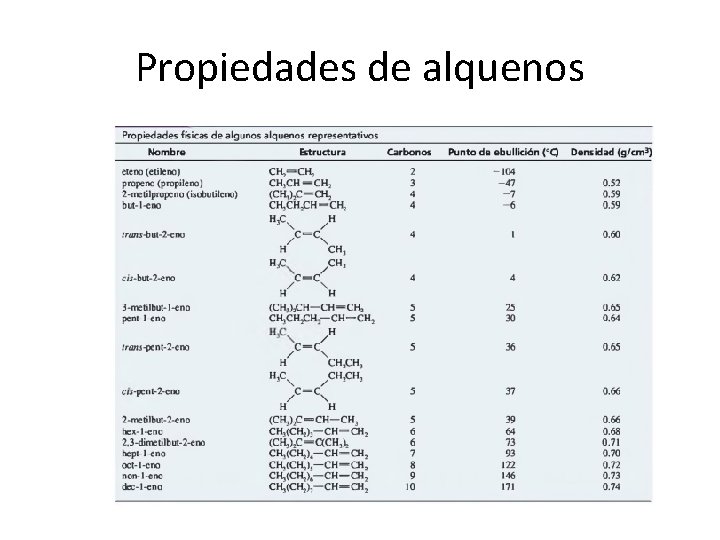
Propiedades de alquenos

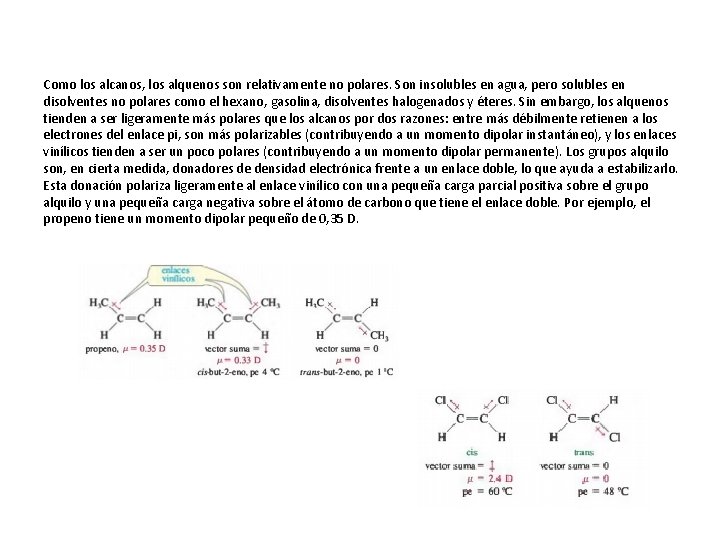
Como los alcanos, los alquenos son relativamente no polares. Son insolubles en agua, pero solubles en disolventes no polares como el hexano, gasolina, disolventes halogenados y éteres. Sin embargo, los alquenos tienden a ser ligeramente más polares que los alcanos por dos razones: entre más débilmente retienen a los electrones del enlace pi, son más polarizables (contribuyendo a un momento dipolar instantáneo), y los enlaces vinílicos tienden a ser un poco polares (contribuyendo a un momento dipolar permanente). Los grupos alquilo son, en cierta medida, donadores de densidad electrónica frente a un enlace doble, lo que ayuda a estabilizarlo. Esta donación polariza ligeramente al enlace vinílico con una pequeña carga parcial positiva sobre el grupo alquilo y una pequeña carga negativa sobre el átomo de carbono que tiene el enlace doble. Por ejemplo, el propeno tiene un momento dipolar pequeño de 0, 35 D.

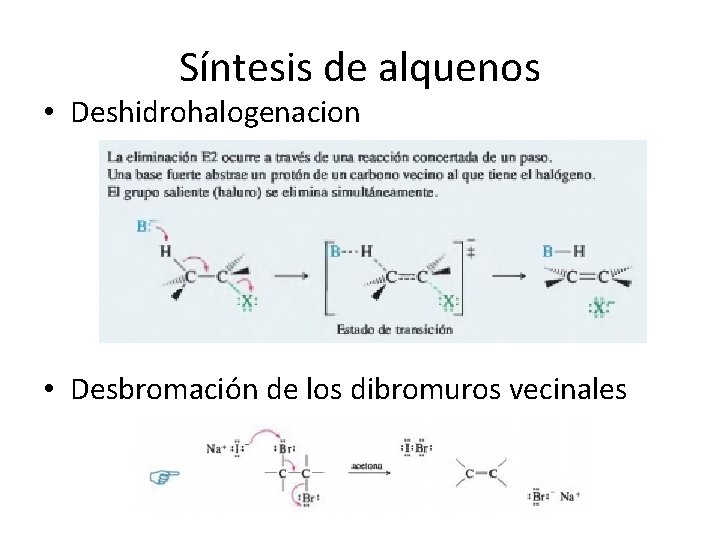
Síntesis de alquenos • Deshidrohalogenacion • Desbromación de los dibromuros vecinales

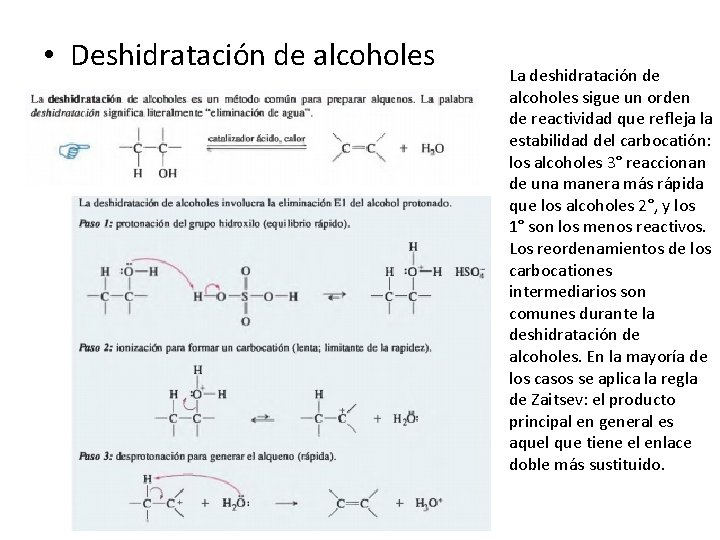
• Deshidratación de alcoholes La deshidratación de alcoholes sigue un orden de reactividad que refleja la estabilidad del carbocatión: los alcoholes 3° reaccionan de una manera más rápida que los alcoholes 2°, y los 1° son los menos reactivos. Los reordenamientos de los carbocationes intermediarios son comunes durante la deshidratación de alcoholes. En la mayoría de los casos se aplica la regla de Zaitsev: el producto principal en general es aquel que tiene el enlace doble más sustituido.

• Craqueo catalítico de los alcanos. La forma más económica de producir alquenos a gran escala es mediante el craqueo catalítico del petróleo: calentamiento de una mezcla de alcanos en presencia de un catalizador (por lo general de aluminosilicatos). Los alquenos se forman por medio de la fragmentación de enlaces para generar un alqueno y un alcano más corto.

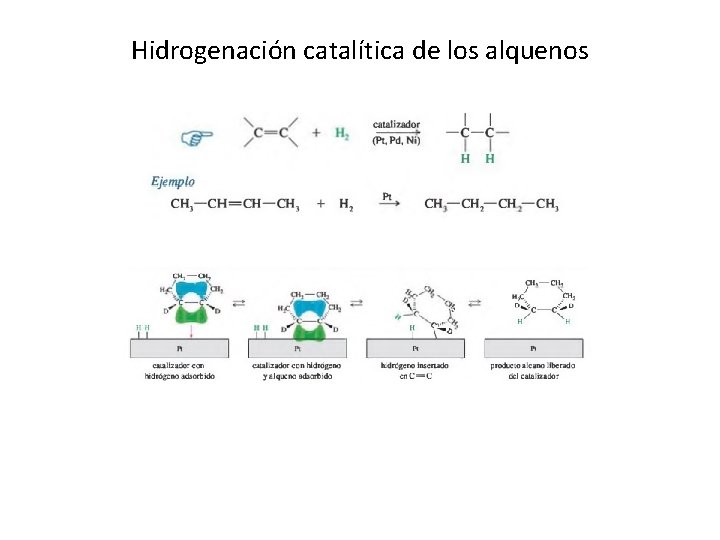
Reacciones de los alquenos Debido a que los enlaces sencillos (sigma) son más estables que los enlaces pi, las reacciones más comunes de los enlaces dobles transforman el enlace pi en uno sigma. Por ejemplo, la hidrogenación catalítica convierte el enlace pi C = C y el enlace sigma H — H en dos enlaces sigma C— H Nucleófilo (amante de núcleos): es una especie que reacciona cediendo un par de electrones libres a otra especie. Puede ser un anión o una molécula neutra con un par de electrones libres. Electrófilo (amante de los electrones): es una especie química atraída hacia zonas ricas en electrones. Participa en una reacción aceptando un par de electrones y formando un enlace con un nucleófilo. La mayoría de los electrófilos están cargados positivamente, tienen un átomo que lleva una carga positiva parcial.

Adición electrofílica


Adición de haluros de hidrogeno a alquenos


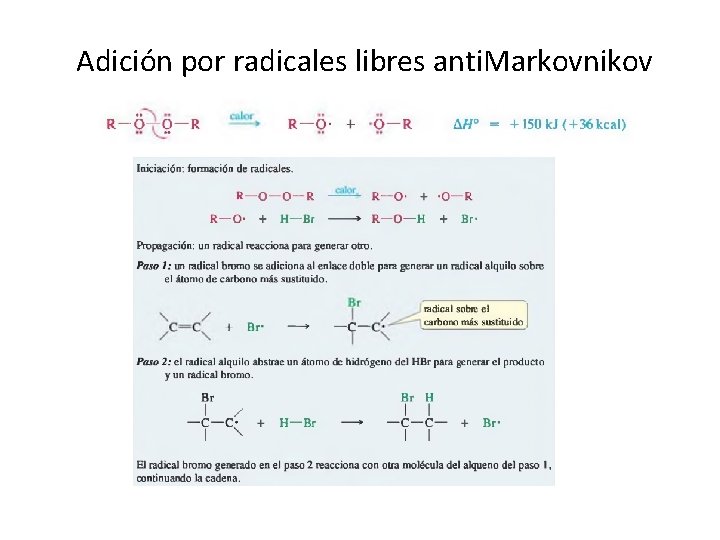
Adición por radicales libres anti. Markovnikov


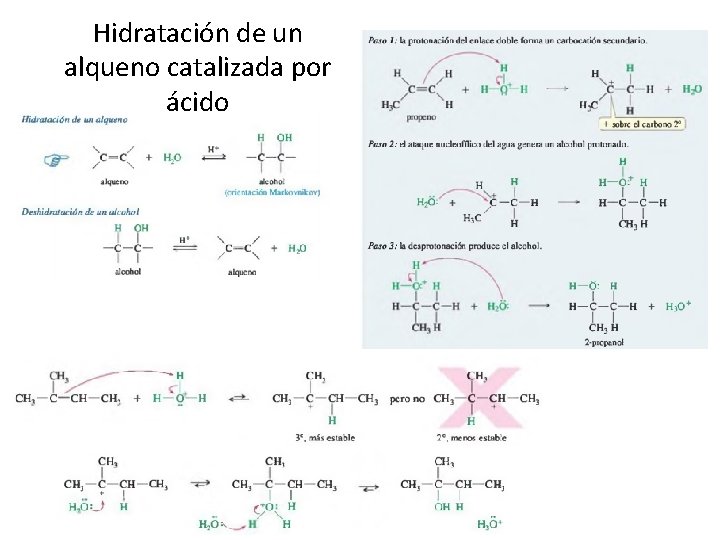
Hidratación de un alqueno catalizada por ácido

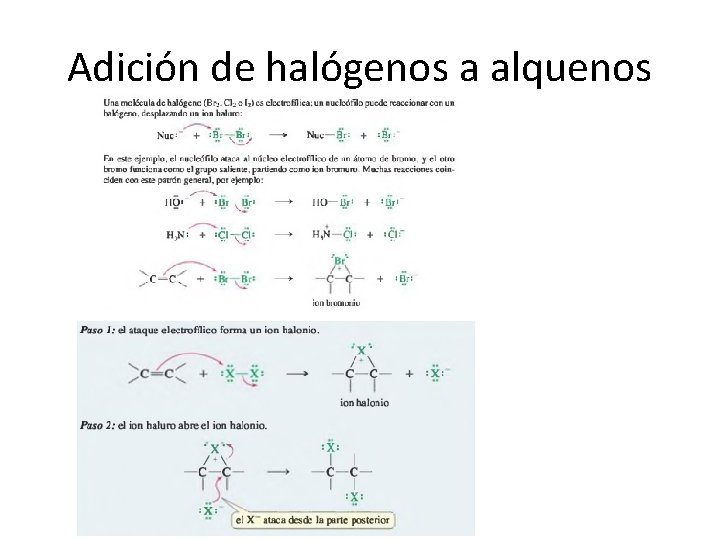
Adición de halógenos a alquenos

Hidrogenación catalítica de los alquenos

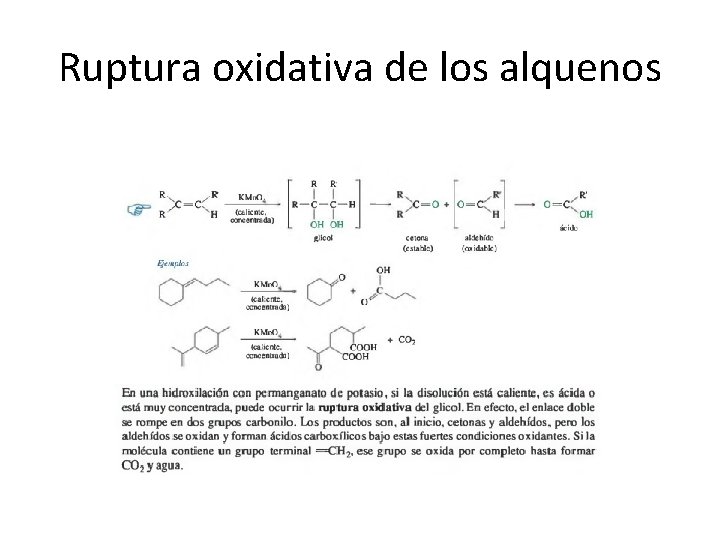
Ruptura oxidativa de los alquenos

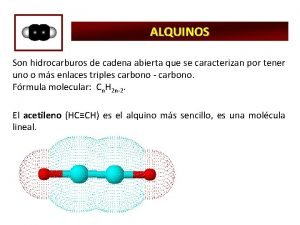
Alquinos El acetileno es, por mucho, el alquino comercial más importante. Éste es una materia prima importante, pero su principal función es como combustible de sopletes de acetileno/oxígeno. El acetileno es un gas incoloro con un olor muy desagradable, el cual arde en presencia de aire con una flama amarilla negruzca. Sin embargo, cuando la flama es alimentada con oxígeno puro, el color se vuelve azul claro, y su temperatura aumenta de manera drástica.


 6 6 dimetil 4 nonino
6 6 dimetil 4 nonino Características de los alcanos, alquenos y alquinos
Características de los alcanos, alquenos y alquinos Usos de los alquenos
Usos de los alquenos Tabla alquinos
Tabla alquinos Hidrocarburos insaturados alquenos y alquinos
Hidrocarburos insaturados alquenos y alquinos Hidrocarburos insaturados alquenos y alquinos
Hidrocarburos insaturados alquenos y alquinos Deshidrohalogenación de alquinos
Deshidrohalogenación de alquinos Ion acetiluro
Ion acetiluro Ciclo alquinos
Ciclo alquinos Nombre los siguientes alquenos
Nombre los siguientes alquenos Propiedades quimicas de los alquinos
Propiedades quimicas de los alquinos Qué significa el prefijo iso
Qué significa el prefijo iso Propiedades quimica del carbono
Propiedades quimica del carbono Grupos funcionales
Grupos funcionales Etino hibridacion sp
Etino hibridacion sp Alquinos características
Alquinos características Pentadiino
Pentadiino Esqueleto hidrocarbonado
Esqueleto hidrocarbonado Quimica organica
Quimica organica Fluoracion del benceno
Fluoracion del benceno Buteno
Buteno Epoxidacion de alquenos
Epoxidacion de alquenos Hidrocarburos
Hidrocarburos Nomenclatura e z alquenos
Nomenclatura e z alquenos Eteres
Eteres Nomenclatura e z alquenos
Nomenclatura e z alquenos Ch3-ch-ch2-ch3
Ch3-ch-ch2-ch3 Que es una halohidrina
Que es una halohidrina Oxidacion de alcoholes a cetonas
Oxidacion de alcoholes a cetonas Espermina usos
Espermina usos Usos umcs punkt logowania
Usos umcs punkt logowania Uso de past perfect
Uso de past perfect Usos del used to
Usos del used to Conjugaciones del vervo ir
Conjugaciones del vervo ir Usos de las preposiciones
Usos de las preposiciones Lektorat uam rejestracja
Lektorat uam rejestracja