Reacciones de los alquenos DR CARLOS ANTONIO RIUS






- Slides: 50

Reacciones de los alquenos DR. CARLOS ANTONIO RIUS ALONSO DEPTO. DE QUIMICA ORGANICA FACULTAD DE QUIMICA UNAM SEPTIEMBRE 2007

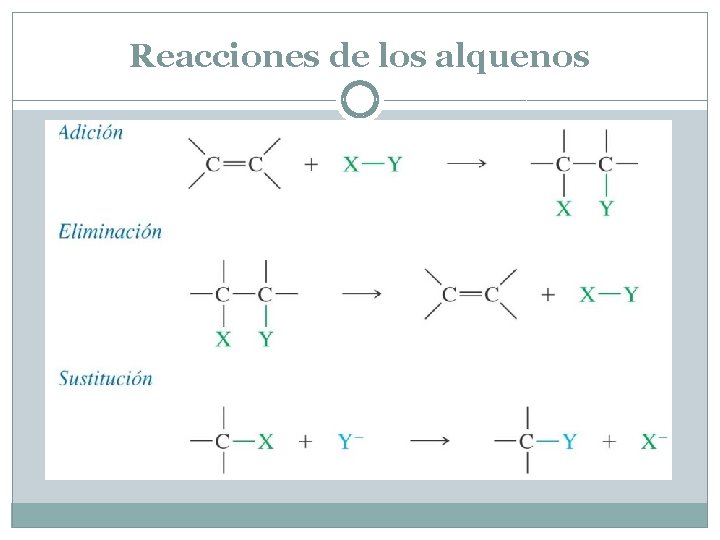
Reacciones de los alquenos. La hidrogenación de un alqueno es un ejemplo de adición, uno de los tres tipos más importantes que ya hemos estudiado: adición, sustitución y eliminación. En una adición dos moléculas se combinan para formar un solo producto. Cuando un alqueno experimenta una reacción de adición, dos grupos se añaden a los átomos de carbono del doble enlace y los carbonos se convierten en saturados. En muchos aspectos, la adición es la reacción opuesta a la eliminación, en la que una molécula se separa en dos fragmentos o moléculas más pequeñas. En una sustitución, un fragmento reemplaza a otro en una molécula. Las reacciones que sufren los alquenos pertenecen a uno de los tres tipos siguientes: adición, eliminación y sustitución.

Reacciones de los alquenos

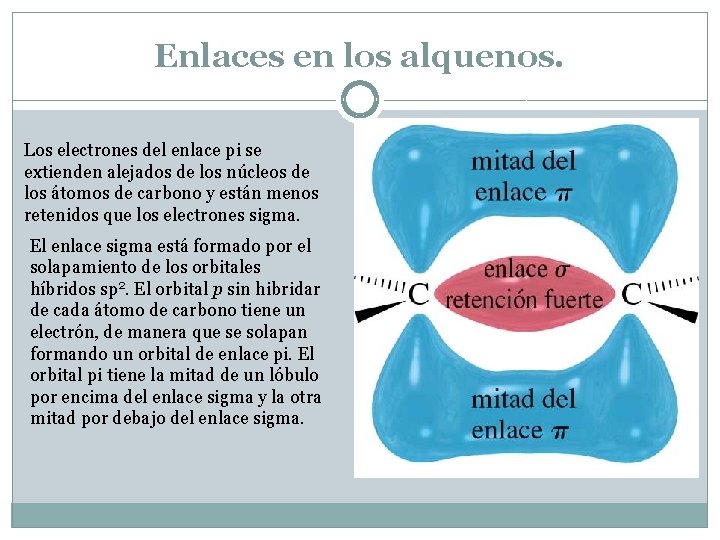
Enlaces en los alquenos. Los electrones del enlace pi se extienden alejados de los núcleos de los átomos de carbono y están menos retenidos que los electrones sigma. El enlace sigma está formado por el solapamiento de los orbitales híbridos sp 2. El orbital p sin hibridar de cada átomo de carbono tiene un electrón, de manera que se solapan formando un orbital de enlace pi. El orbital pi tiene la mitad de un lóbulo por encima del enlace sigma y la otra mitad por debajo del enlace sigma.

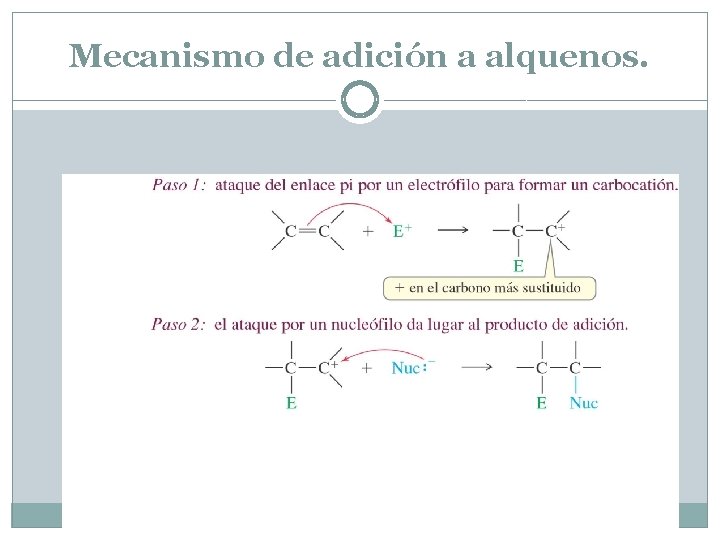
Mecanismo de adición a alquenos. En la mayoría de las adiciones, un nucleófilo ataca al carbocatión (como en el segundo paso de la reacción SN 1), formando un producto de adición estable. En el producto, el electrófilo y el nucleófilo están unidos a los átomos de carbono que estaban conectados por el doble enlace. La reacción esquemática siguiente utiliza E+ como electrófilo y Nuc: - como nucleófilo. Los electrones pi no se retienen tan fuertemente como los electrones sigma, por lo que pueden estar atraídos por un electrófilo. En el primer paso del mecanismo los electrones pi atacan a un electrófilo formando un enlace electrófilo-carbono. La formación del nuevo enlace rompe el doble enlace y crea un carbocatión. En el segundo paso de la reacción de adición, un nucleófilo presente en la solución se añadirá al carbocatión para dar el producto.

Mecanismo de adición a alquenos.

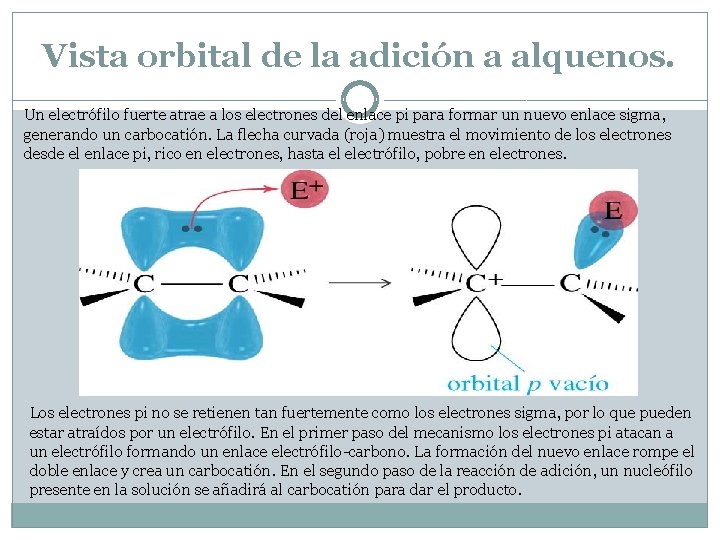
Vista orbital de la adición a alquenos. Un electrófilo fuerte atrae a los electrones del enlace pi para formar un nuevo enlace sigma, generando un carbocatión. La flecha curvada (roja) muestra el movimiento de los electrones desde el enlace pi, rico en electrones, hasta el electrófilo, pobre en electrones. Los electrones pi no se retienen tan fuertemente como los electrones sigma, por lo que pueden estar atraídos por un electrófilo. En el primer paso del mecanismo los electrones pi atacan a un electrófilo formando un enlace electrófilo-carbono. La formación del nuevo enlace rompe el doble enlace y crea un carbocatión. En el segundo paso de la reacción de adición, un nucleófilo presente en la solución se añadirá al carbocatión para dar el producto.

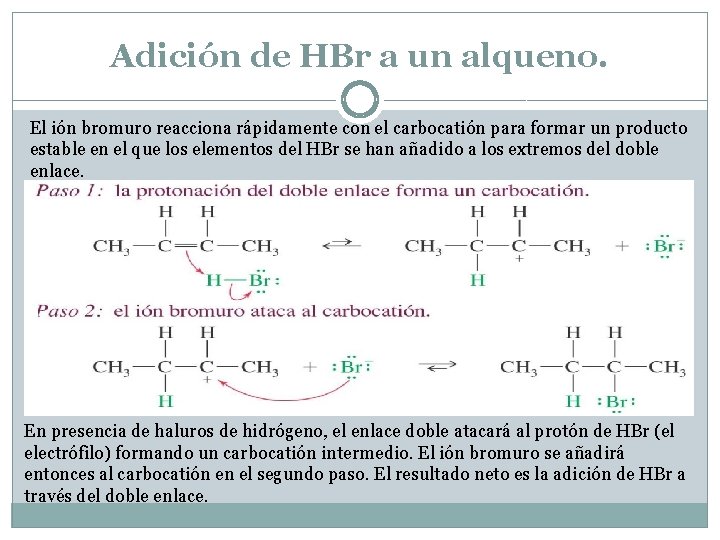
Adición de HBr a un alqueno. El ión bromuro reacciona rápidamente con el carbocatión para formar un producto estable en el que los elementos del HBr se han añadido a los extremos del doble enlace. En presencia de haluros de hidrógeno, el enlace doble atacará al protón de HBr (el electrófilo) formando un carbocatión intermedio. El ión bromuro se añadirá entonces al carbocatión en el segundo paso. El resultado neto es la adición de HBr a través del doble enlace.

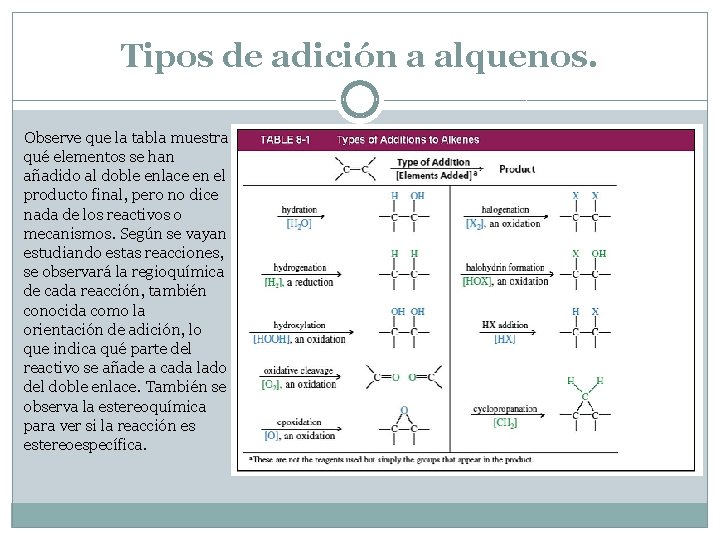
Tipos de adición a alquenos. Observe que la tabla muestra qué elementos se han añadido al doble enlace en el producto final, pero no dice nada de los reactivos o mecanismos. Según se vayan estudiando estas reacciones, se observará la regioquímica de cada reacción, también conocida como la orientación de adición, lo que indica qué parte del reactivo se añade a cada lado del doble enlace. También se observa la estereoquímica para ver si la reacción es estereoespecífica.

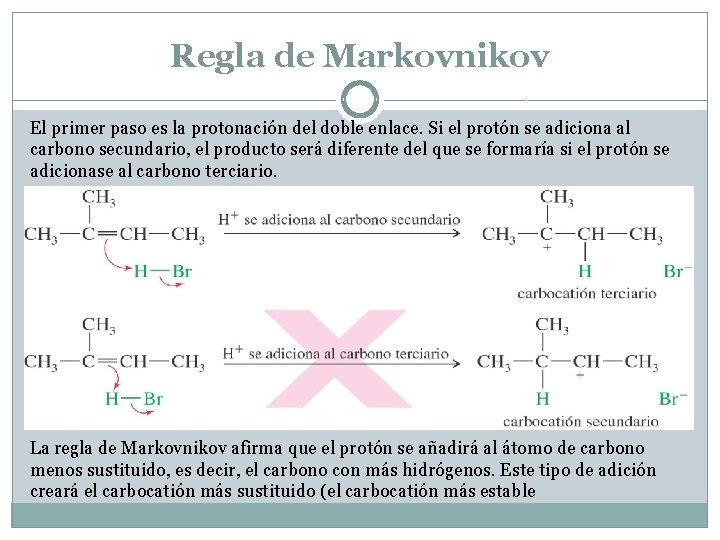
Regla de Markovnikov El primer paso es la protonación del doble enlace. Si el protón se adiciona al carbono secundario, el producto será diferente del que se formaría si el protón se adicionase al carbono terciario. La regla de Markovnikov afirma que el protón se añadirá al átomo de carbono menos sustituido, es decir, el carbono con más hidrógenos. Este tipo de adición creará el carbocatión más sustituido (el carbocatión más estable

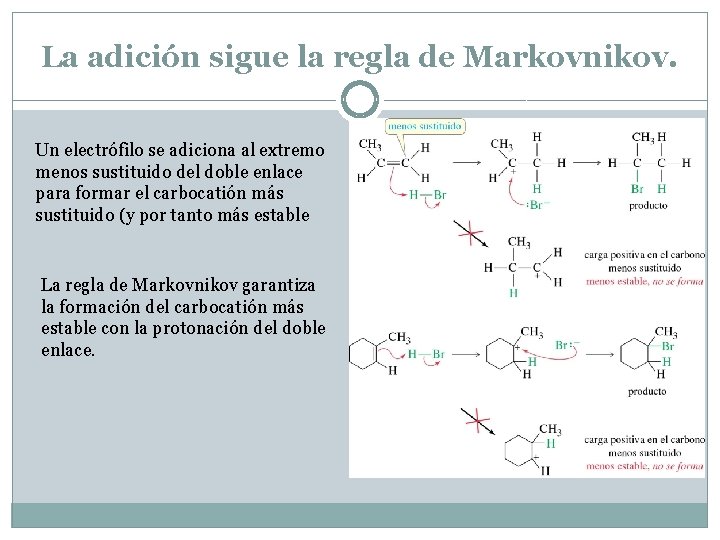
La adición sigue la regla de Markovnikov. Un electrófilo se adiciona al extremo menos sustituido del doble enlace para formar el carbocatión más sustituido (y por tanto más estable La regla de Markovnikov garantiza la formación del carbocatión más estable con la protonación del doble enlace.

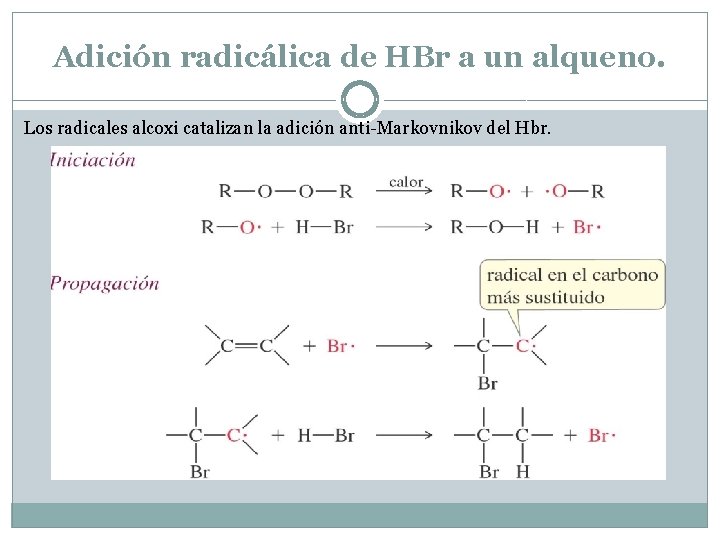
Adición radicalaria de HBr a un alqueno. En el mecanismo radical, la adición del radical libre de Br se produce en primer lugar, añadiéndose al carbono menos sustituido para producir un radical estable. El radical formado en el primer paso reaccionará con una segunda molécula de HBr y abstraerá un radical de hidrógeno para dar el producto anti-Markovnikov. Esta reacción sólo funciones para HBr en presencia de peróxidos. HCl y HI se añadirán según la regla de Markovnikov en presencia de peróxidos.

Adición radicálica de HBr a un alqueno. Los radicales alcoxi catalizan la adición anti-Markovnikov del Hbr.

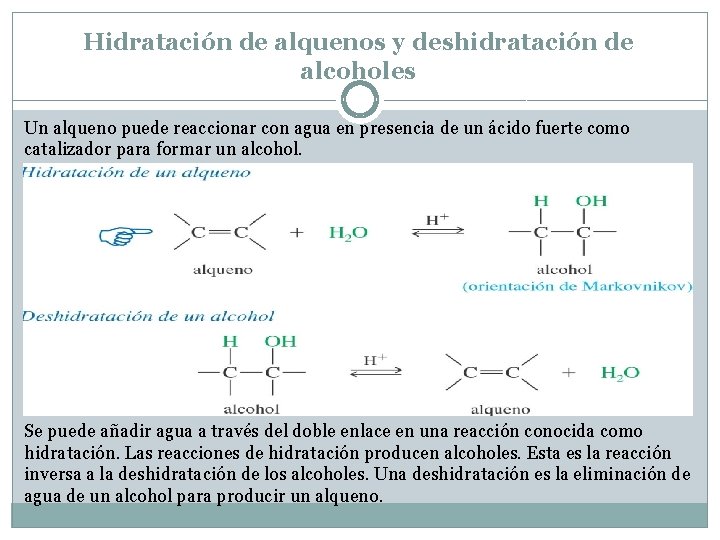
Hidratación de alquenos y deshidratación de alcoholes Un alqueno puede reaccionar con agua en presencia de un ácido fuerte como catalizador para formar un alcohol. Se puede añadir agua a través del doble enlace en una reacción conocida como hidratación. Las reacciones de hidratación producen alcoholes. Esta es la reacción inversa a la deshidratación de los alcoholes. Una deshidratación es la eliminación de agua de un alcohol para producir un alqueno.

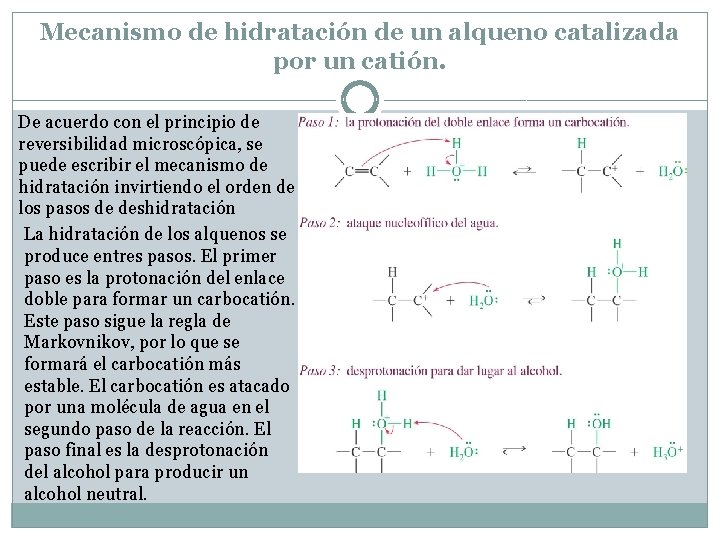
Mecanismo de hidratación de un alqueno catalizada por un catión. De acuerdo con el principio de reversibilidad microscópica, se puede escribir el mecanismo de hidratación invirtiendo el orden de los pasos de deshidratación La hidratación de los alquenos se produce entres pasos. El primer paso es la protonación del enlace doble para formar un carbocatión. Este paso sigue la regla de Markovnikov, por lo que se formará el carbocatión más estable. El carbocatión es atacado por una molécula de agua en el segundo paso de la reacción. El paso final es la desprotonación del alcohol para producir un alcohol neutral.

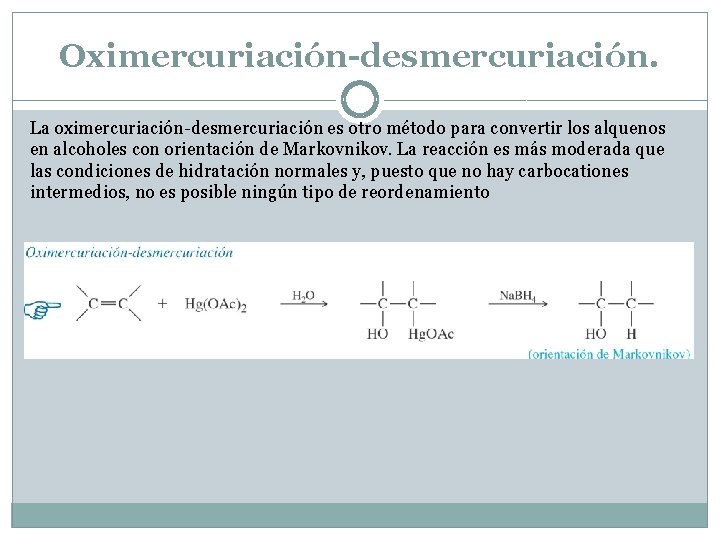
Oximercuriación-desmercuriación. La oximercuriación-desmercuriación es otro método para convertir los alquenos en alcoholes con orientación de Markovnikov. La reacción es más moderada que las condiciones de hidratación normales y, puesto que no hay carbocationes intermedios, no es posible ningún tipo de reordenamiento

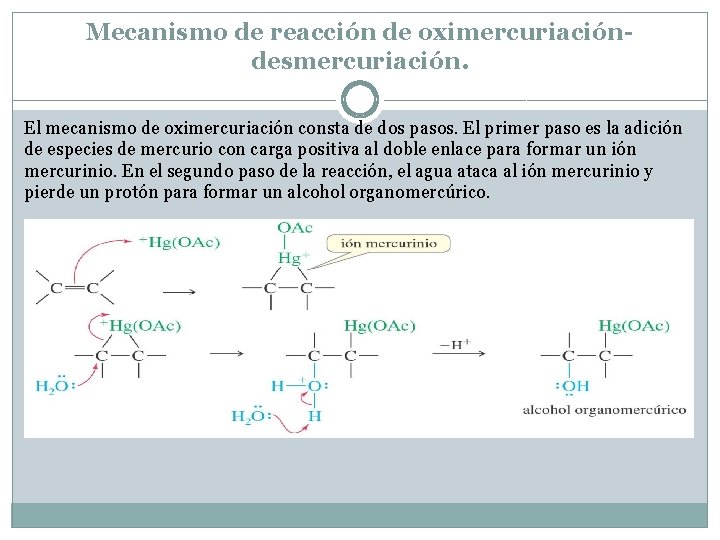
Mecanismo de reacción de oximercuriacióndesmercuriación. El mecanismo de oximercuriación consta de dos pasos. El primer paso es la adición de especies de mercurio con carga positiva al doble enlace para formar un ión mercurinio. En el segundo paso de la reacción, el agua ataca al ión mercurinio y pierde un protón para formar un alcohol organomercúrico.

Reacción de desmercuriación El segundo paso es la desmercuriación para eliminar el mercurio. El borohidruro de sodio (Na. BH 4, un agente reductor) reemplaza el fragmento de acetato de mercurio por hidrógeno. La reacción de oximercuriación-desmercuriación da lugar al producto Markovnikov con el grupo hidroxi en el carbono más sustituido.

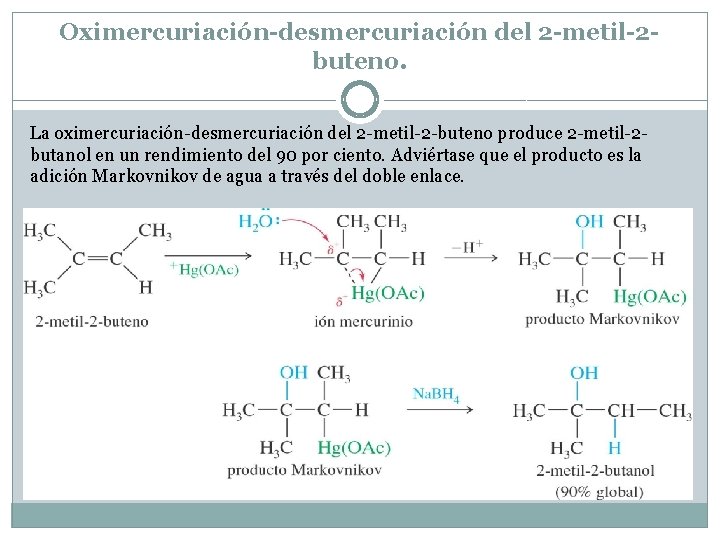
Oximercuriación-desmercuriación del 2 -metil-2 buteno. La oximercuriación-desmercuriación del 2 -metil-2 -buteno produce 2 -metil-2 butanol en un rendimiento del 90 por ciento. Adviértase que el producto es la adición Markovnikov de agua a través del doble enlace.

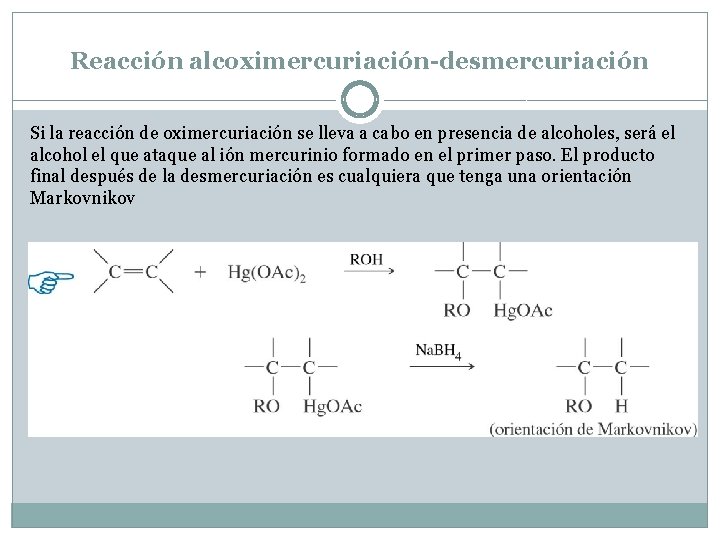
Reacción alcoximercuriación-desmercuriación Si la reacción de oximercuriación se lleva a cabo en presencia de alcoholes, será el alcohol el que ataque al ión mercurinio formado en el primer paso. El producto final después de la desmercuriación es cualquiera que tenga una orientación Markovnikov

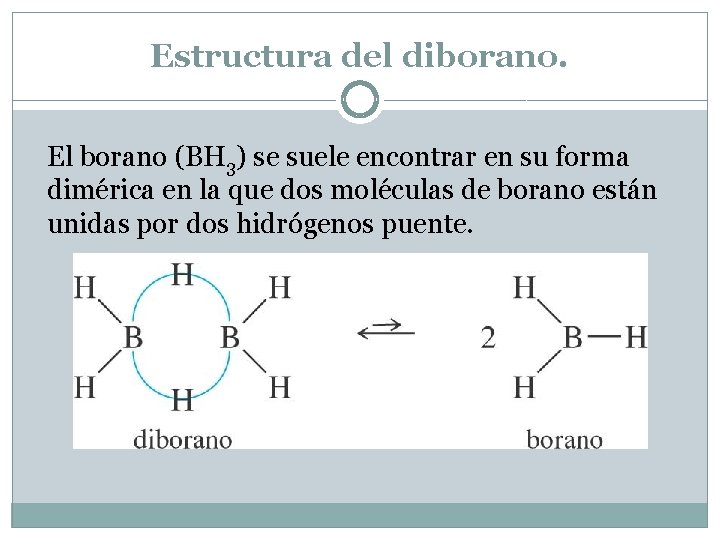
Estructura del diborano. El borano (BH 3) se suele encontrar en su forma dimérica en la que dos moléculas de borano están unidas por dos hidrógenos puente.

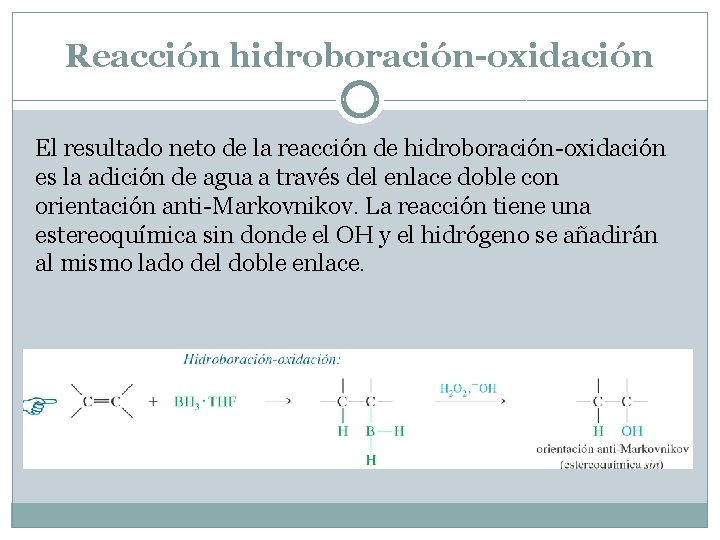
Reacción hidroboración-oxidación El resultado neto de la reacción de hidroboración-oxidación es la adición de agua a través del enlace doble con orientación anti-Markovnikov. La reacción tiene una estereoquímica sin donde el OH y el hidrógeno se añadirán al mismo lado del doble enlace.

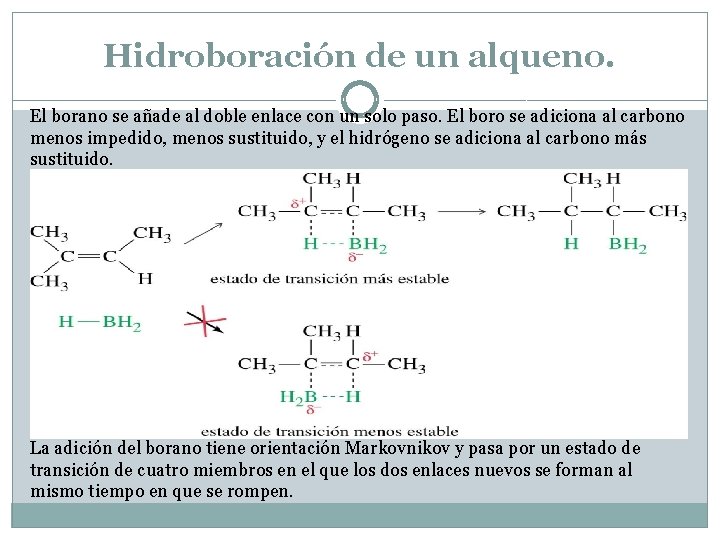
Hidroboración de un alqueno. El borano se añade al doble enlace con un solo paso. El boro se adiciona al carbono menos impedido, menos sustituido, y el hidrógeno se adiciona al carbono más sustituido. La adición del borano tiene orientación Markovnikov y pasa por un estado de transición de cuatro miembros en el que los dos enlaces nuevos se forman al mismo tiempo en que se rompen.

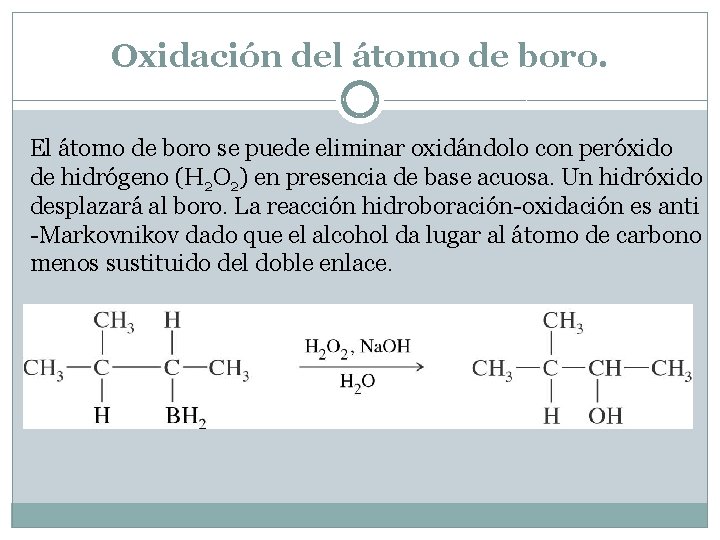
Oxidación del átomo de boro. El átomo de boro se puede eliminar oxidándolo con peróxido de hidrógeno (H 2 O 2) en presencia de base acuosa. Un hidróxido desplazará al boro. La reacción hidroboración-oxidación es anti -Markovnikov dado que el alcohol da lugar al átomo de carbono menos sustituido del doble enlace.

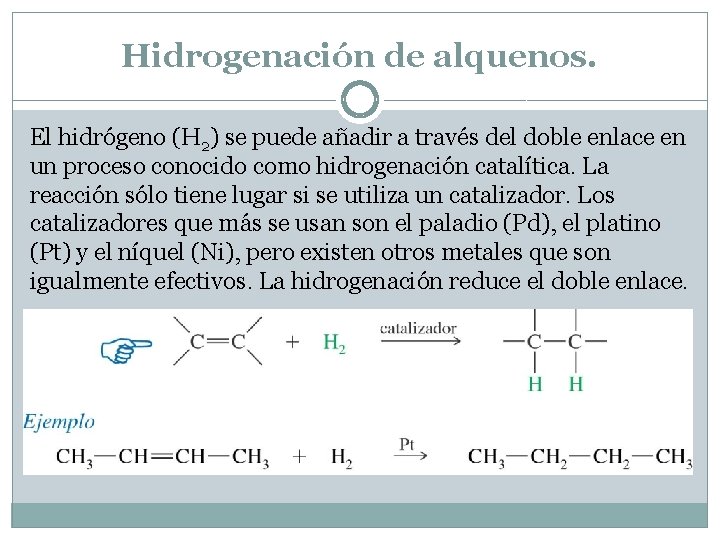
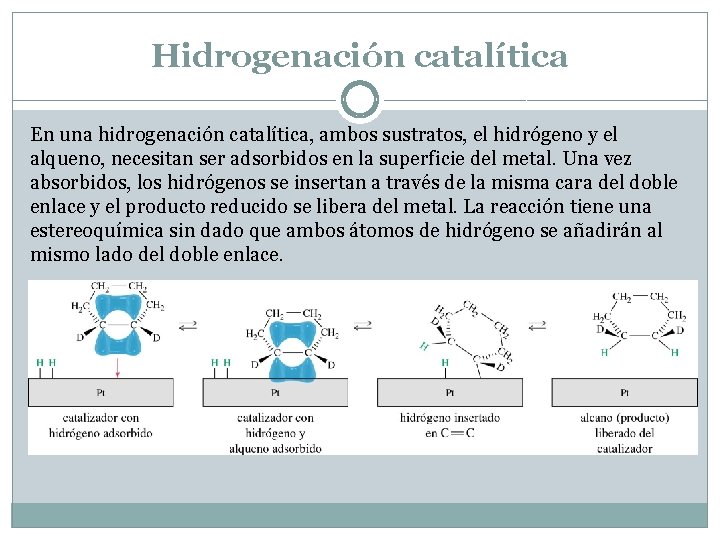
Hidrogenación de alquenos. El hidrógeno (H 2) se puede añadir a través del doble enlace en un proceso conocido como hidrogenación catalítica. La reacción sólo tiene lugar si se utiliza un catalizador. Los catalizadores que más se usan son el paladio (Pd), el platino (Pt) y el níquel (Ni), pero existen otros metales que son igualmente efectivos. La hidrogenación reduce el doble enlace.

Hidrogenación catalítica En una hidrogenación catalítica, ambos sustratos, el hidrógeno y el alqueno, necesitan ser adsorbidos en la superficie del metal. Una vez absorbidos, los hidrógenos se insertan a través de la misma cara del doble enlace y el producto reducido se libera del metal. La reacción tiene una estereoquímica sin dado que ambos átomos de hidrógeno se añadirán al mismo lado del doble enlace.

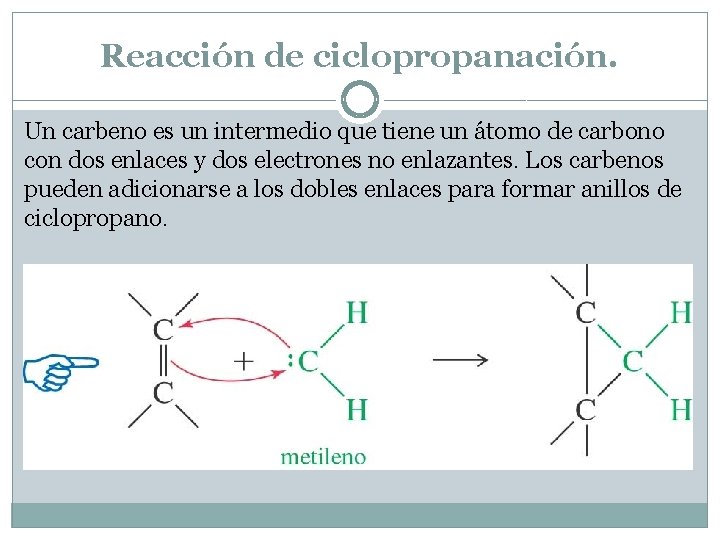
Reacción de ciclopropanación. Un carbeno es un intermedio que tiene un átomo de carbono con dos enlaces y dos electrones no enlazantes. Los carbenos pueden adicionarse a los dobles enlaces para formar anillos de ciclopropano.

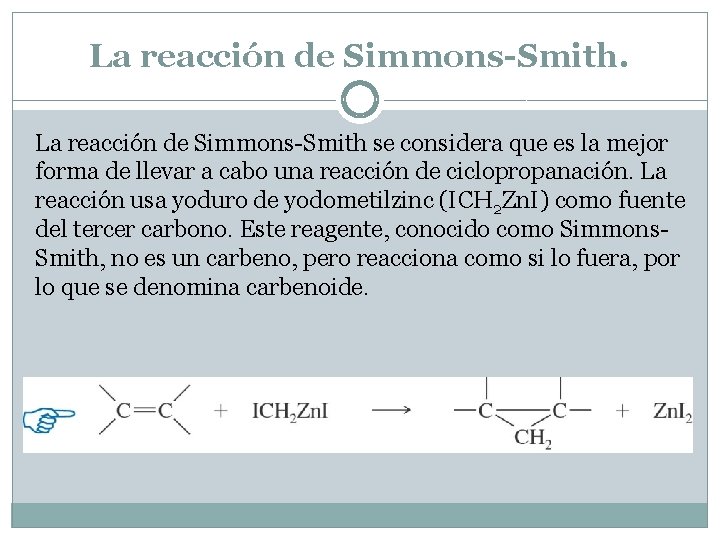
La reacción de Simmons-Smith se considera que es la mejor forma de llevar a cabo una reacción de ciclopropanación. La reacción usa yoduro de yodometilzinc (ICH 2 Zn. I) como fuente del tercer carbono. Este reagente, conocido como Simmons. Smith, no es un carbeno, pero reacciona como si lo fuera, por lo que se denomina carbenoide.

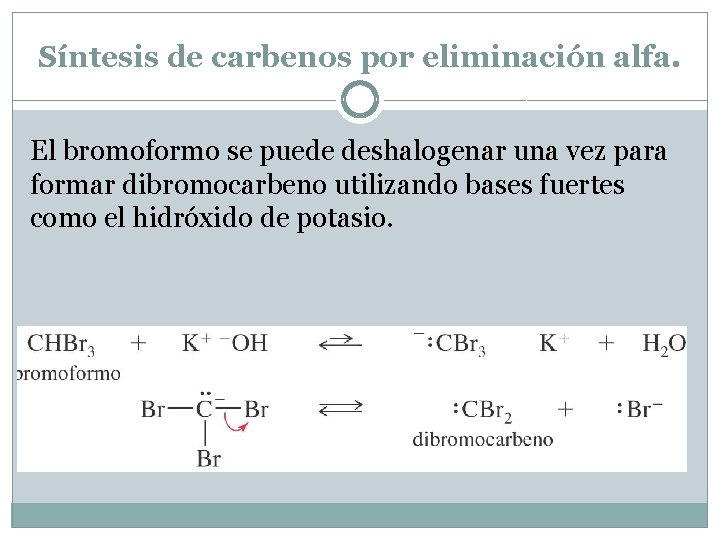
Síntesis de carbenos por eliminación alfa. El bromoformo se puede deshalogenar una vez para formar dibromocarbeno utilizando bases fuertes como el hidróxido de potasio.

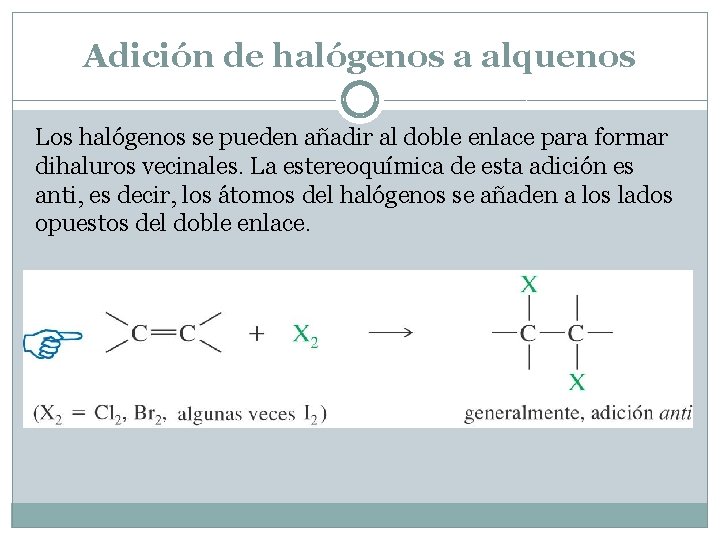
Adición de halógenos a alquenos Los halógenos se pueden añadir al doble enlace para formar dihaluros vecinales. La estereoquímica de esta adición es anti, es decir, los átomos del halógenos se añaden a los lados opuestos del doble enlace.

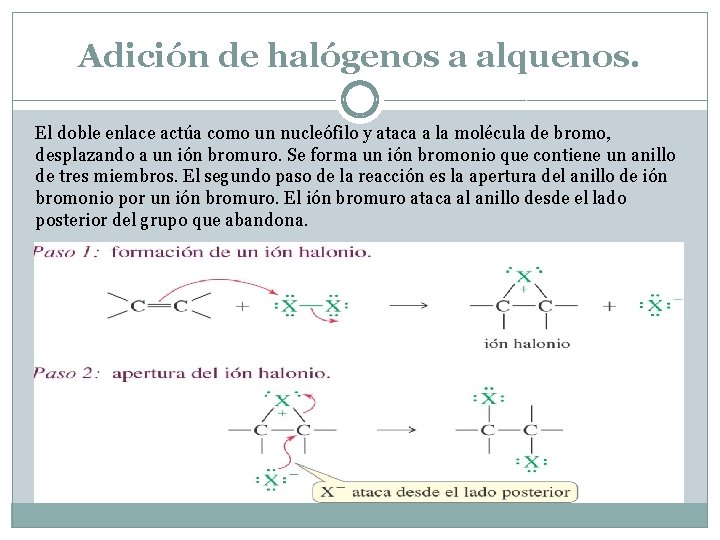
Adición de halógenos a alquenos. El doble enlace actúa como un nucleófilo y ataca a la molécula de bromo, desplazando a un ión bromuro. Se forma un ión bromonio que contiene un anillo de tres miembros. El segundo paso de la reacción es la apertura del anillo de ión bromonio por un ión bromuro. El ión bromuro ataca al anillo desde el lado posterior del grupo que abandona.

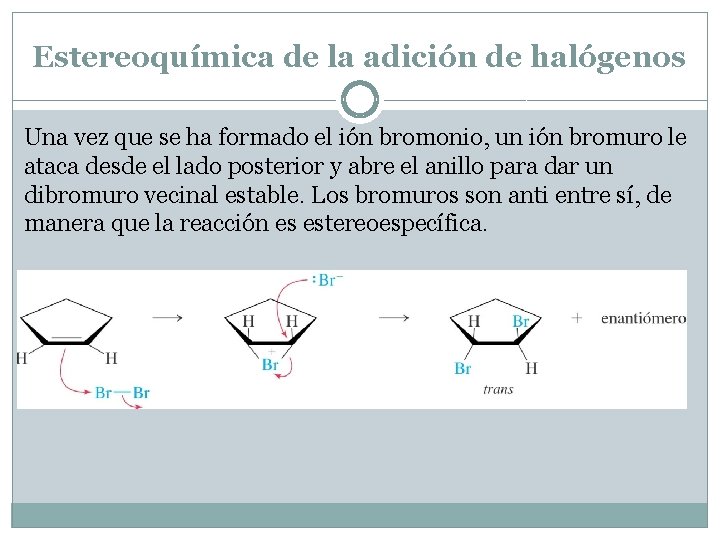
Estereoquímica de la adición de halógenos Una vez que se ha formado el ión bromonio, un ión bromuro le ataca desde el lado posterior y abre el anillo para dar un dibromuro vecinal estable. Los bromuros son anti entre sí, de manera que la reacción es estereoespecífica.

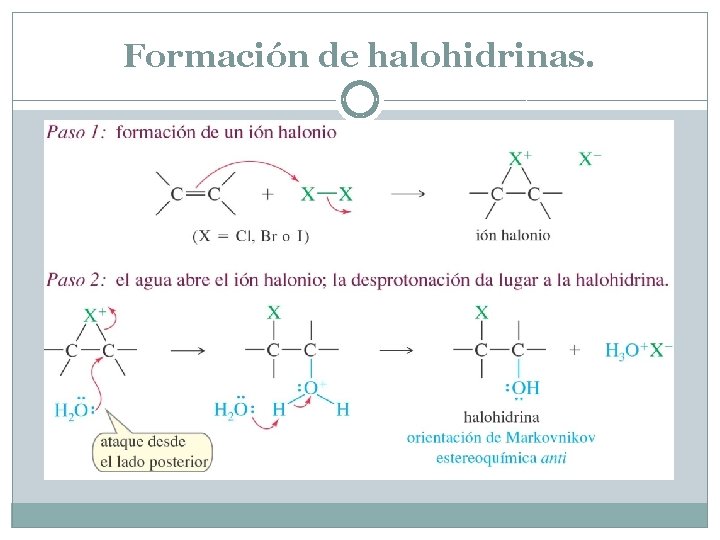
Formación de halohidrinas. Un alcohol con un halógeno en el átomo de carbono adyacente. En presencia de agua, los halógenos se añaden a los alquenos para formar halohidrinas. El halógeno se añade al alqueno para formar un ión halonio, que es fuertemente electrofílico. El agua actúa como nucleófilo para abrir el ión halonio y formar la halohidrina.

Formación de halohidrinas.

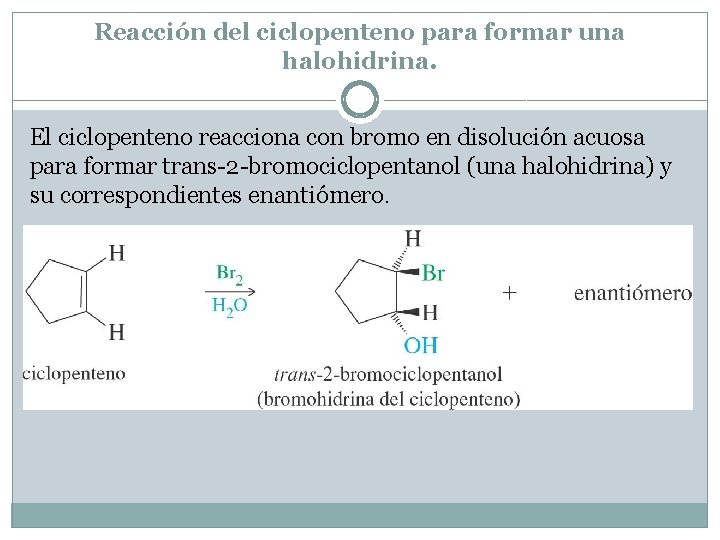
Reacción del ciclopenteno para formar una halohidrina. El ciclopenteno reacciona con bromo en disolución acuosa para formar trans-2 -bromociclopentanol (una halohidrina) y su correspondientes enantiómero.

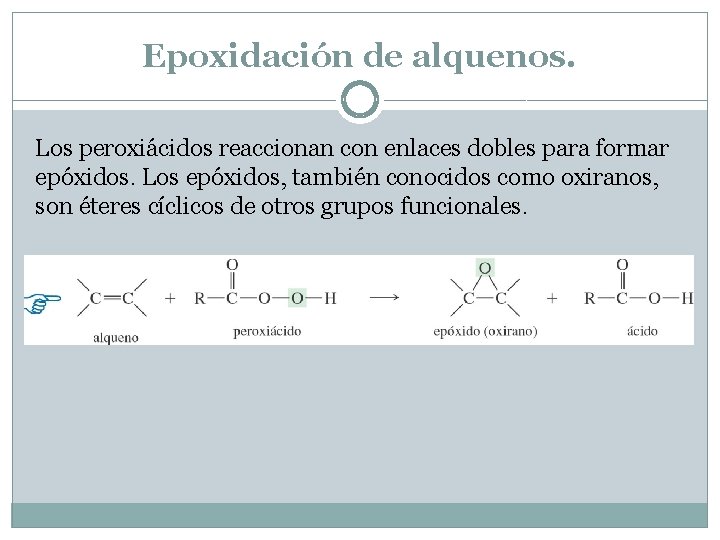
Epoxidación de alquenos. Los peroxiácidos reaccionan con enlaces dobles para formar epóxidos. Los epóxidos, también conocidos como oxiranos, son éteres cíclicos de otros grupos funcionales.

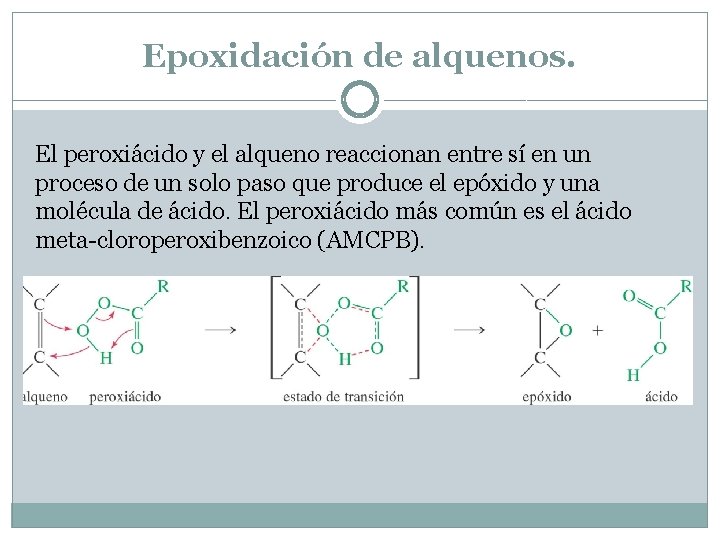
Epoxidación de alquenos. El peroxiácido y el alqueno reaccionan entre sí en un proceso de un solo paso que produce el epóxido y una molécula de ácido. El peroxiácido más común es el ácido meta-cloroperoxibenzoico (AMCPB).

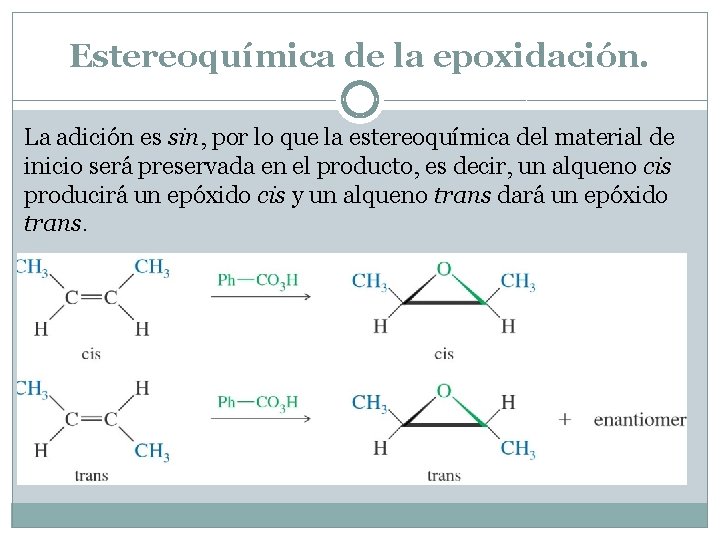
Estereoquímica de la epoxidación. La adición es sin, por lo que la estereoquímica del material de inicio será preservada en el producto, es decir, un alqueno cis producirá un epóxido cis y un alqueno trans dará un epóxido trans.

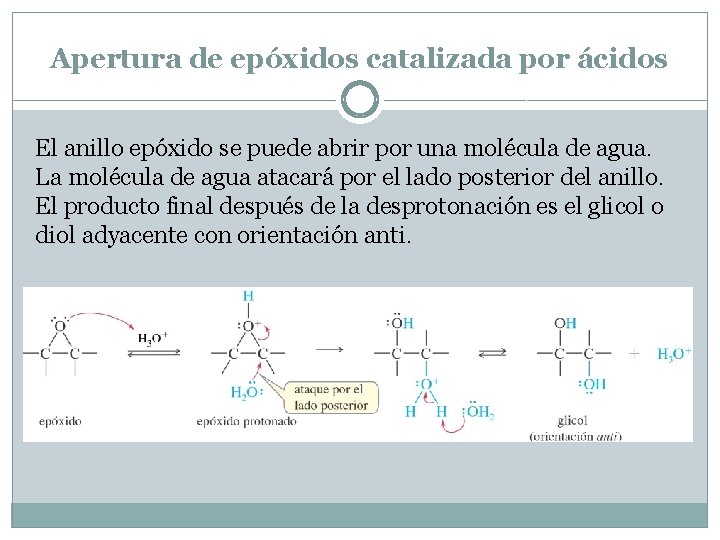
Apertura de epóxidos catalizada por ácidos El anillo epóxido se puede abrir por una molécula de agua. La molécula de agua atacará por el lado posterior del anillo. El producto final después de la desprotonación es el glicol o diol adyacente con orientación anti.

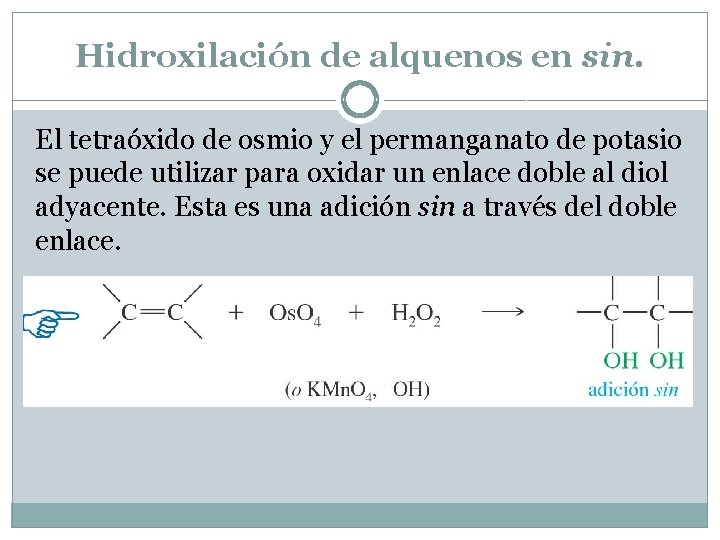
Hidroxilación de alquenos en sin. El tetraóxido de osmio y el permanganato de potasio se puede utilizar para oxidar un enlace doble al diol adyacente. Esta es una adición sin a través del doble enlace.

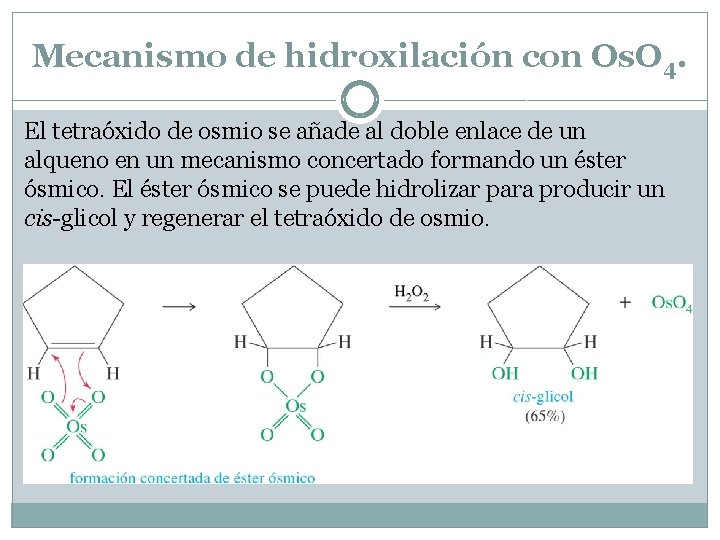
Mecanismo de hidroxilación con Os. O 4. El tetraóxido de osmio se añade al doble enlace de un alqueno en un mecanismo concertado formando un éster ósmico. El éster ósmico se puede hidrolizar para producir un cis-glicol y regenerar el tetraóxido de osmio.

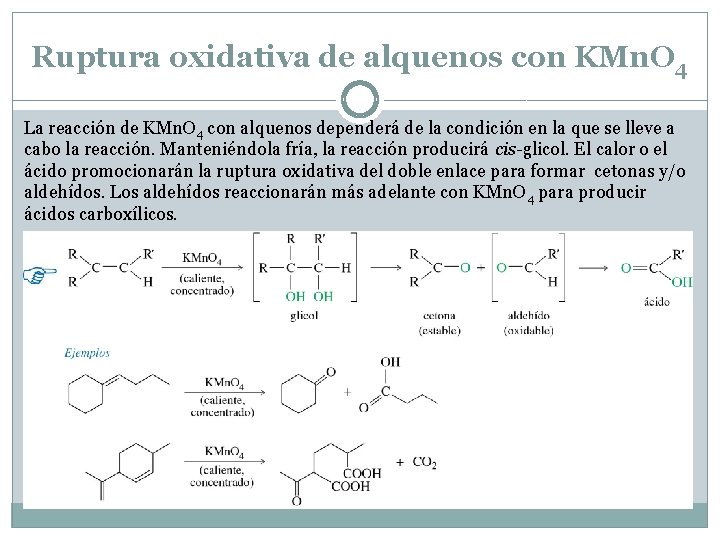
Ruptura oxidativa de alquenos con KMn. O 4 La reacción de KMn. O 4 con alquenos dependerá de la condición en la que se lleve a cabo la reacción. Manteniéndola fría, la reacción producirá cis-glicol. El calor o el ácido promocionarán la ruptura oxidativa del doble enlace para formar cetonas y/o aldehídos. Los aldehídos reaccionarán más adelante con KMn. O 4 para producir ácidos carboxílicos.

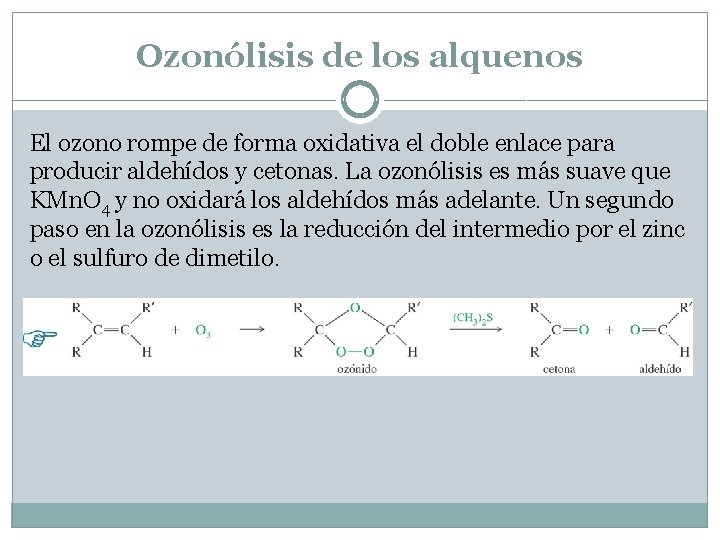
Ozonólisis de los alquenos El ozono rompe de forma oxidativa el doble enlace para producir aldehídos y cetonas. La ozonólisis es más suave que KMn. O 4 y no oxidará los aldehídos más adelante. Un segundo paso en la ozonólisis es la reducción del intermedio por el zinc o el sulfuro de dimetilo.

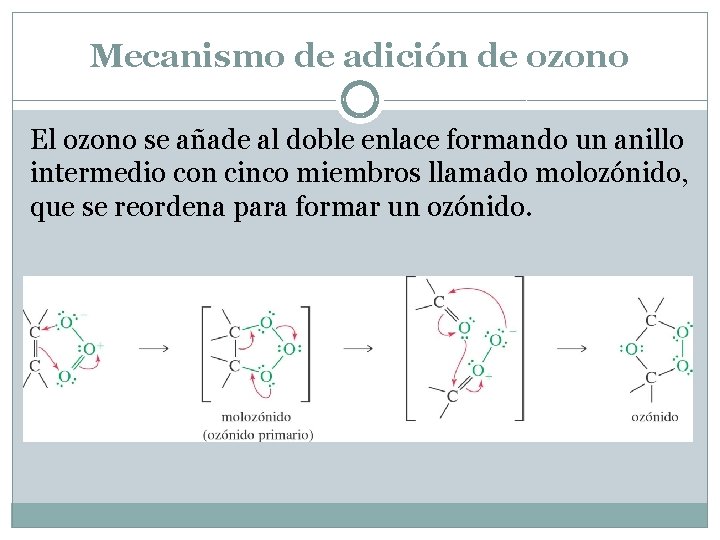
Mecanismo de adición de ozono El ozono se añade al doble enlace formando un anillo intermedio con cinco miembros llamado molozónido, que se reordena para formar un ozónido.

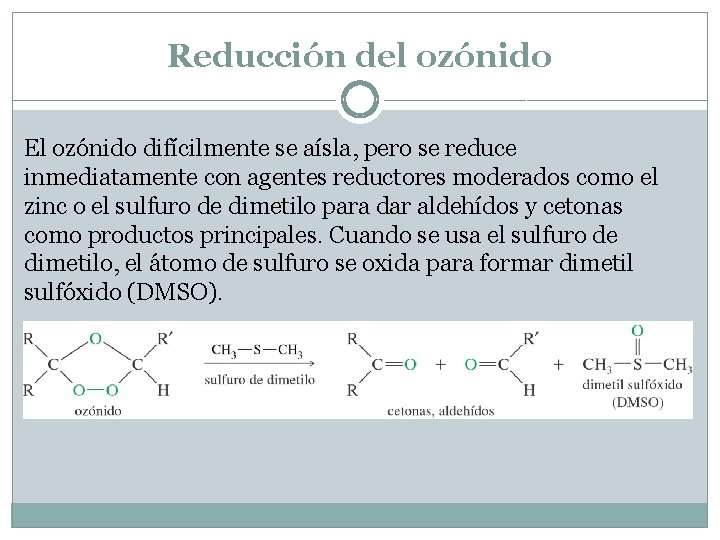
Reducción del ozónido El ozónido difícilmente se aísla, pero se reduce inmediatamente con agentes reductores moderados como el zinc o el sulfuro de dimetilo para dar aldehídos y cetonas como productos principales. Cuando se usa el sulfuro de dimetilo, el átomo de sulfuro se oxida para formar dimetil sulfóxido (DMSO).

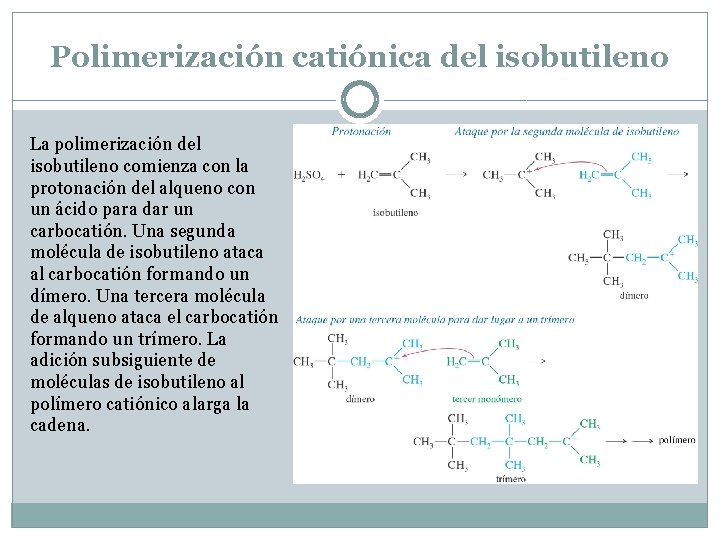
Polimerización catiónica del isobutileno La polimerización del isobutileno comienza con la protonación del alqueno con un ácido para dar un carbocatión. Una segunda molécula de isobutileno ataca al carbocatión formando un dímero. Una tercera molécula de alqueno ataca el carbocatión formando un trímero. La adición subsiguiente de moléculas de isobutileno al polímero catiónico alarga la cadena.

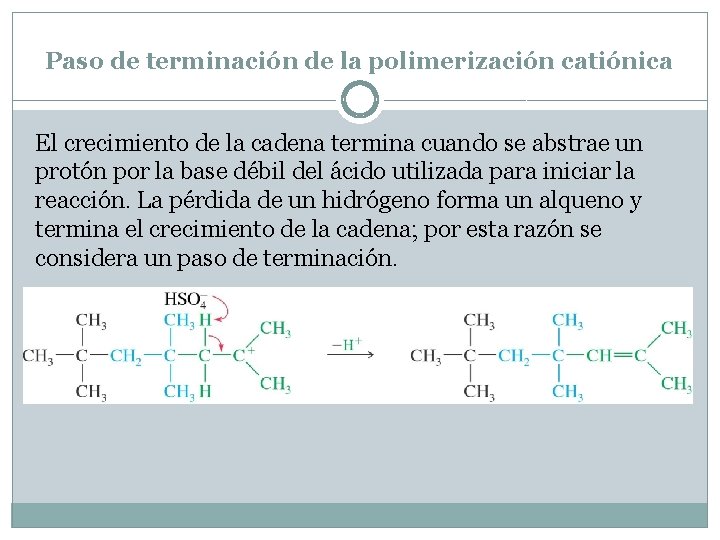
Paso de terminación de la polimerización catiónica El crecimiento de la cadena termina cuando se abstrae un protón por la base débil del ácido utilizada para iniciar la reacción. La pérdida de un hidrógeno forma un alqueno y termina el crecimiento de la cadena; por esta razón se considera un paso de terminación.

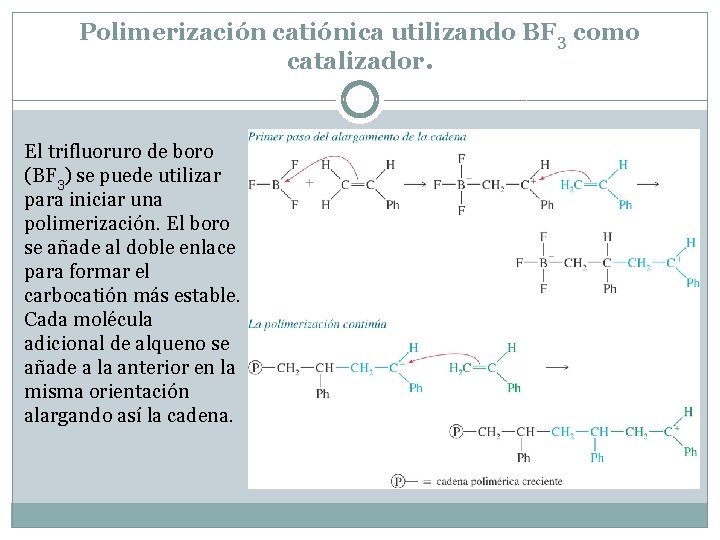
Polimerización catiónica utilizando BF 3 como catalizador. El trifluoruro de boro (BF 3) se puede utilizar para iniciar una polimerización. El boro se añade al doble enlace para formar el carbocatión más estable. Cada molécula adicional de alqueno se añade a la anterior en la misma orientación alargando así la cadena.

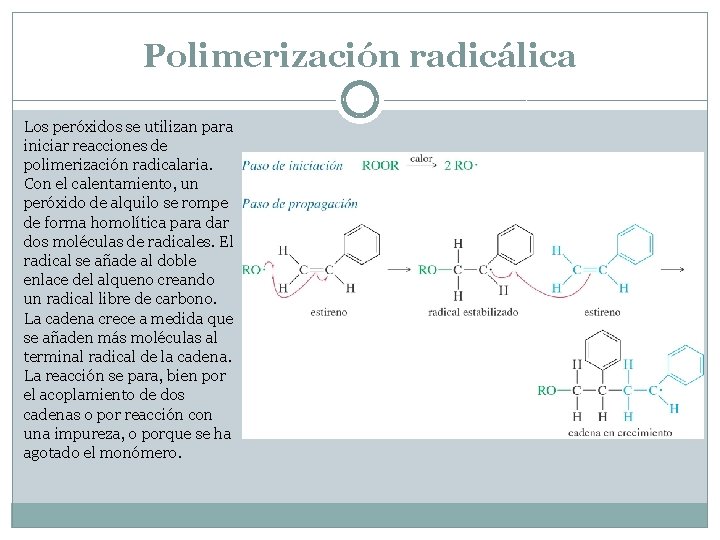
Polimerización radicálica Los peróxidos se utilizan para iniciar reacciones de polimerización radicalaria. Con el calentamiento, un peróxido de alquilo se rompe de forma homolítica para dar dos moléculas de radicales. El radical se añade al doble enlace del alqueno creando un radical libre de carbono. La cadena crece a medida que se añaden más moléculas al terminal radical de la cadena. La reacción se para, bien por el acoplamiento de dos cadenas o por reacción con una impureza, o porque se ha agotado el monómero.

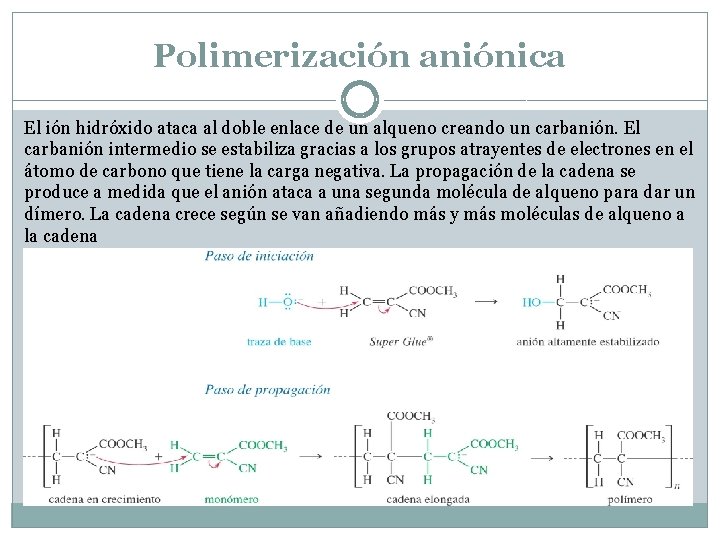
Polimerización aniónica El ión hidróxido ataca al doble enlace de un alqueno creando un carbanión. El carbanión intermedio se estabiliza gracias a los grupos atrayentes de electrones en el átomo de carbono que tiene la carga negativa. La propagación de la cadena se produce a medida que el anión ataca a una segunda molécula de alqueno para dar un dímero. La cadena crece según se van añadiendo más y más moléculas de alqueno a la cadena
 Identicos
Identicos Carlos antonio rius alonso
Carlos antonio rius alonso Cual es el grupo funcional de los alquinos
Cual es el grupo funcional de los alquinos Epoxidacion de alquenos
Epoxidacion de alquenos Carlos rius
Carlos rius Climes calids
Climes calids Alquinos reglas de nomenclatura
Alquinos reglas de nomenclatura Ciclo alcanos alquenos y alquinos
Ciclo alcanos alquenos y alquinos Características de los alcanos, alquenos y alquinos
Características de los alcanos, alquenos y alquinos Generalidades de los hidrocarburos
Generalidades de los hidrocarburos Usos de los alquenos
Usos de los alquenos Alquenos
Alquenos Radicales quimica
Radicales quimica Qumica
Qumica Antônio luiz seabra
Antônio luiz seabra Banco itaú paraguay antonio carlos dos santos
Banco itaú paraguay antonio carlos dos santos Clínica dr carlos scardovelli
Clínica dr carlos scardovelli Como elaborar projetos de pesquisa gil
Como elaborar projetos de pesquisa gil Reaccion de condensacion
Reaccion de condensacion Radical alquilo
Radical alquilo Reacción de simmons–smith
Reacción de simmons–smith Cy2bh
Cy2bh Nomenclatura e z alquenos
Nomenclatura e z alquenos Amina secundaria
Amina secundaria Nomenclatura e z alquenos
Nomenclatura e z alquenos Reaccion de esterificacion
Reaccion de esterificacion Eteres
Eteres Tipos de hidrocarburos
Tipos de hidrocarburos Estructura de alquenos
Estructura de alquenos Hidrocarburos insaturados alquenos y alquinos
Hidrocarburos insaturados alquenos y alquinos Alqueno lineal
Alqueno lineal Fsica
Fsica Reacciones químicas
Reacciones químicas Mol reacciones quimicas
Mol reacciones quimicas Reacciones quimicas en la vida cotidiana
Reacciones quimicas en la vida cotidiana Tipos de reacciones químicas ejemplos
Tipos de reacciones químicas ejemplos Que es la reaccion irreversible
Que es la reaccion irreversible Fisicia
Fisicia Reacciones de combustión
Reacciones de combustión Endotermica
Endotermica Ley de proust ejemplos en la vida cotidiana
Ley de proust ejemplos en la vida cotidiana Pureza reacciones quimicas
Pureza reacciones quimicas Reacciones de vinculo
Reacciones de vinculo Equilibrios homogéneos
Equilibrios homogéneos Eacciones quimicas
Eacciones quimicas Anapletorico
Anapletorico 360
360 Reacciones acopladas
Reacciones acopladas Serie de actividad de los metales
Serie de actividad de los metales Reacciones redox mapa conceptual
Reacciones redox mapa conceptual Reacciones oxido reduccion ejemplos
Reacciones oxido reduccion ejemplos


































































