REACCIN Y ECUACIN QUIMICA SEMANA No 4 1




















- Slides: 32

REACCIÓN Y ECUACIÓN QUIMICA SEMANA No. 4 1 Licenciada Sofía Tobías

Reacción Química Proceso en el cual se produce un cambio químico, es decir se consume una o más sustancias a medida que se forman una o más sustancias nuevas. 2

MANIFESTACIONES DE UNA REACCIÓN QUÍm. ICA Las reacciones químicas se manifiestan en alguna de estas formas: • emisión de gases • efervescencia • cambios de color • emisión de luz • elevación de la temperatura • formación de nuevas sustancias • formación de un sólido 3

La respiración y la digestión de los alimentos son ejemplos importantes de reacciones químicas; por lo tanto el cuerpo humano se considera como un laboratorio químico. El estudio de las reacciones químicas ha permitido a los científicos transformar los productos naturales y obtener toda clase de sustancias, tales como: fibras sintéticas, plásticos, insecticidas y detergentes, las cuáles son de gran utilidad en nuestra vida. 4

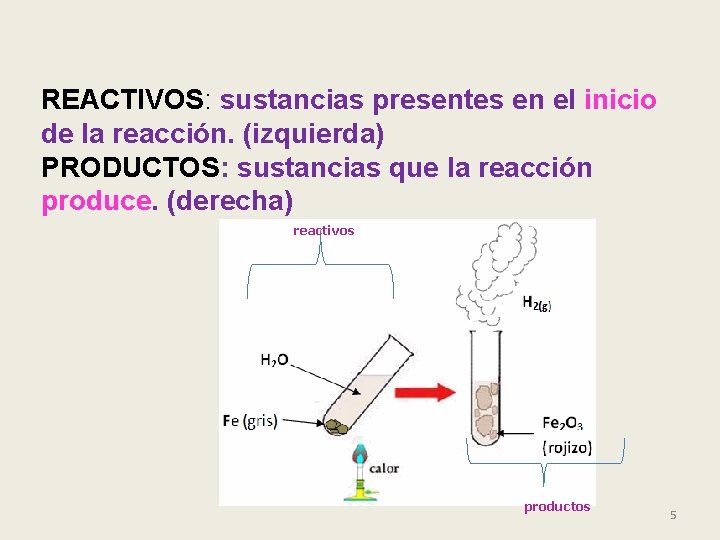
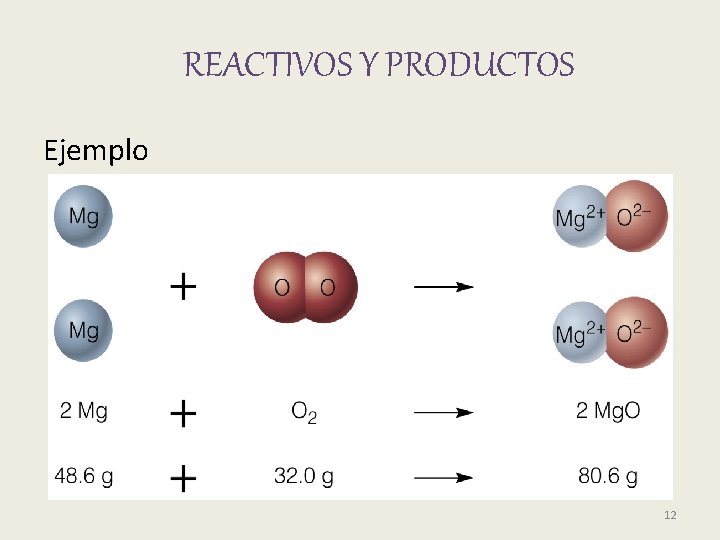
REACTIVOS: sustancias presentes en el inicio de la reacción. (izquierda) PRODUCTOS: sustancias que la reacción produce. (derecha) reactivos productos 5

6

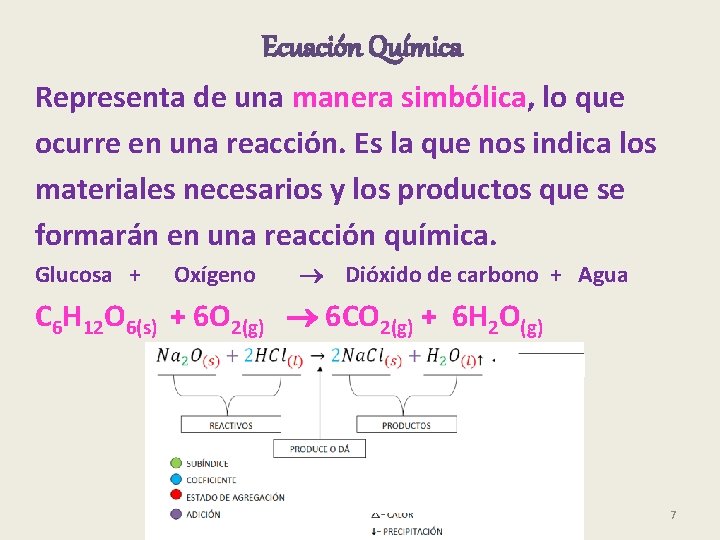
Ecuación Química Representa de una manera simbólica, lo que ocurre en una reacción. Es la que nos indica los materiales necesarios y los productos que se formarán en una reacción química. Glucosa + Oxígeno Dióxido de carbono + Agua C 6 H 12 O 6(s) + 6 O 2(g) 6 CO 2(g) + 6 H 2 O(g) 7

8

Símbolos de las ecuaciones: SIMBOLO SIGNIFICADO (g) gas (s) sólido (l) líquido (ac) acuosos Mn. O 2 Catalizador Reversible Gas liberado Irreversible (Reacciona para formar productos) Precipitado 65°C Los reactivos se calientan Calor de reacción 9

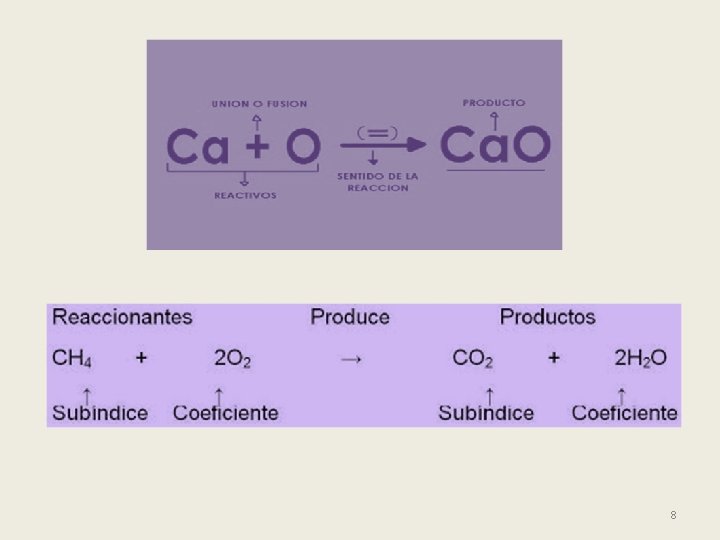
BALANCEO DE ECUACIONES En una ecuación química balanceada la cantidad de átomos de cada elemento representados como reactivos y productos tiene que ser el mismo. Cada ecuación indica las proporciones de masa y el no. de partículas. 10

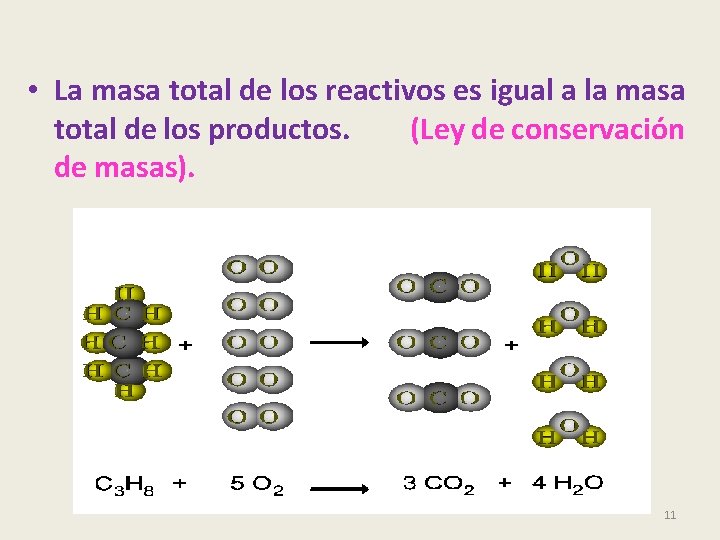
• La masa total de los reactivos es igual a la masa total de los productos. (Ley de conservación de masas). 11

REACTIVOS Y PRODUCTOS Ejemplo 12

13

Clasificación de las reacciones A. Según la forma en que se combinan o descomponen los reactivos: 1. Reacciones de Combustión: Los compuestos que contienen Carbono, Hidrógeno y Oxígeno arden con el aire (consumiendo Oxígeno) y forman CO 2 +H 2 O +energía. CH 4 + 2 O 2 CO 2 + 2 H 2 O + energía 14

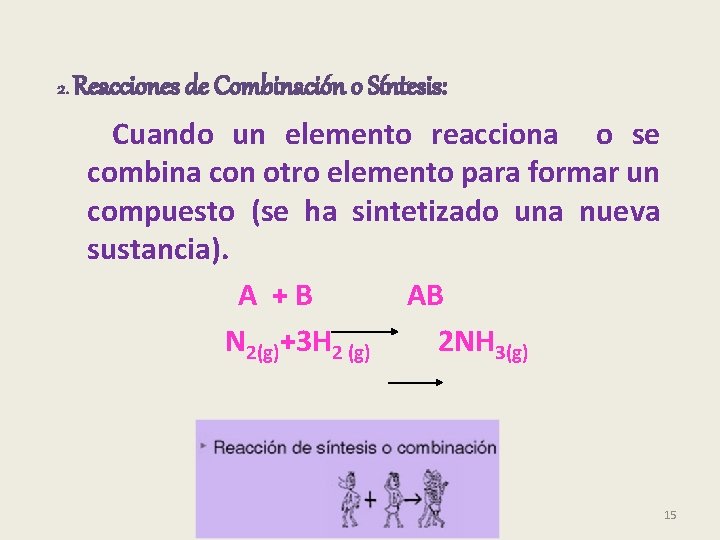
2. Reacciones de Combinación o Síntesis: Cuando un elemento reacciona o se combina con otro elemento para formar un compuesto (se ha sintetizado una nueva sustancia). A + B AB N 2(g)+3 H 2 (g) 2 NH 3(g) 15

3. Reacciones de descomposición: Son aquellas en las que un solo compuesto simbolizado AB se descompone en dos o más sustancias sencillas. AB A + B 2 H 2 O(l) 2 H 2(g) + O 2(g) (electrólisis) 16

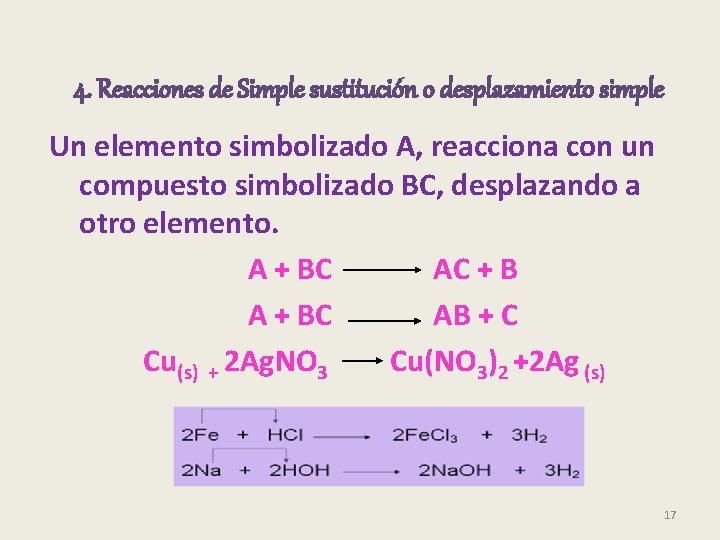
4. Reacciones de Simple sustitución o desplazamiento simple Un elemento simbolizado A, reacciona con un compuesto simbolizado BC, desplazando a otro elemento. A + BC AC + B A + BC AB + C Cu(s) + 2 Ag. NO 3 Cu(NO 3)2 +2 Ag (s) 17

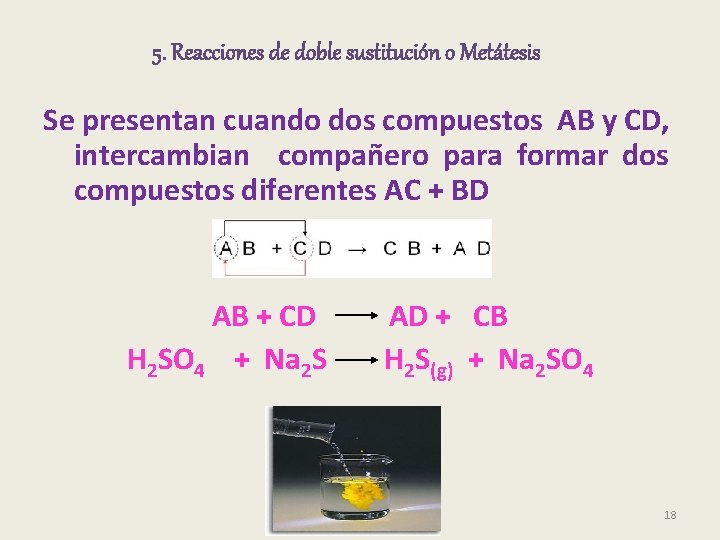
5. Reacciones de doble sustitución o Metátesis Se presentan cuando dos compuestos AB y CD, intercambian compañero para formar dos compuestos diferentes AC + BD AB + CD AD + CB H 2 SO 4 + Na 2 S H 2 S(g) + Na 2 SO 4 18

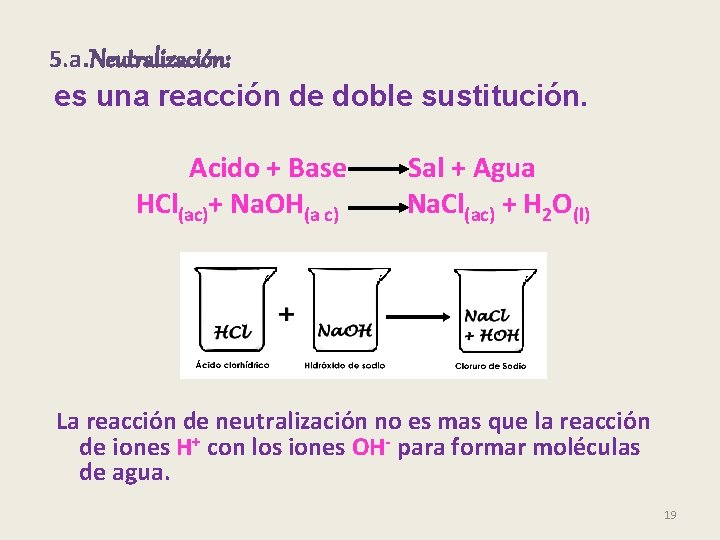
5. a. Neutralización: es una reacción de doble sustitución. Acido + Base Sal + Agua HCl(ac)+ Na. OH(a c) Na. Cl(ac) + H 2 O(l) La reacción de neutralización no es mas que la reacción de iones H+ con los iones OH- para formar moléculas de agua. 19

B. Reacciones clasificadas por el flujo de calor: 1. Exotérmicas: la reacción desprende calor al ambiente (combustión de metano). La energía de los reactivos es mayor que la de los productos. ∆H es – (negativa) ∆H= es la diferencia entre la energía de rompimiento de enlaces en reactivos y de formación de enlaces en productos. (∆H= H - H ) productos reactivos CH 4(g) + 2 O 2(g) → CO 2(g) + H 2 O(g)+ Calor (Δ) 2 Al + Fe 2 O 3 2 Fe + Al 2 O 3 + 850 KJ ∆H= -850 KJ 20

2. Endotérmicas: el sistema reaccionante absorbe el calor del ambiente (fusión del hielo). La energía de reactivos es menor que la de productos, absorbe calor. También puede ser necesario aplicar calor para que se lleve a cabo la reacción. 2 H 2 O + 137 Kcal 2 H 2 + O 2 ∆H= +137 Kcal 21

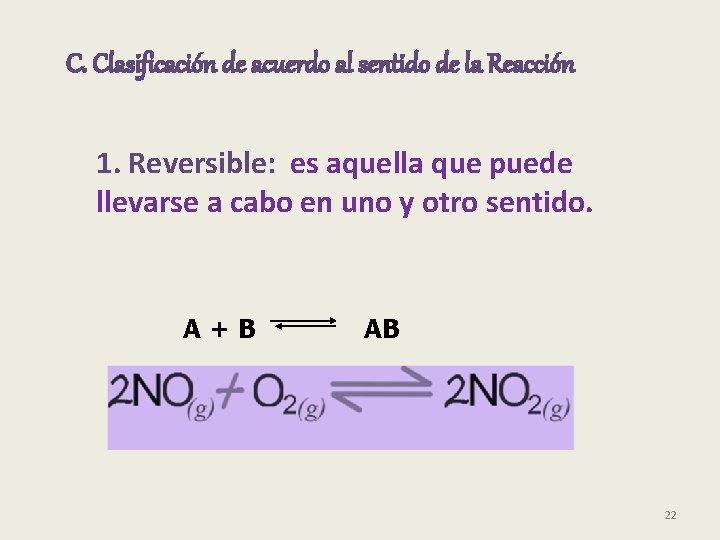
C. Clasificación de acuerdo al sentido de la Reacción 1. Reversible: es aquella que puede llevarse a cabo en uno y otro sentido. A+B AB 22

2. Irreversible: es aquella reacción química que puede llevarse a cabo en un solo sentido. Ej. 23

NÚMERO DE OXIDACIÓN También llamado Estado de Oxidación. Es el NÚMERO que se asigna a cada tipo de átomo o ión o a un elemento con base a un conjunto de reglas. El NÚMERO de Oxidación representa el NÚMERO de electrones que la especie gana, pierde o comparte. 24

Reglas para asignar el número de oxidación: 1. A Todo elemento no combinado o unido consigo mismo se le asigna “cero” Ej. 2. Hidrógeno: cuando encuentra combinado K Mg O 2 Hse 2 se le asigna +1 a excepción de los hidruros (metal + hidrógeno) donde se le asigna -1. 25

3. Oxígeno combinado: se le asigna -2, exceptuando peróxidos, a éstos se le asigna -1. 4. Metales de grupos “A” : al combinarse presentan principalmente: I A +1 II A + 2 III A +3 Excepto Ta: +1 y +3 26

5. La suma de los numeros de oxidación debe ser cero para un compuesto. Se asigna # oxidación positivo al elemento menos electronegativo y negativo al mas electronegativo. Ej. de cargas totales. 27

6. Para partículas iónicas: a. Monoatómicas: el número de oxidación es igual a su carga. Na+ +1 Mg+2 +2 Cl- -1 b. Poliatómicas: la suma de los números de oxidación debe ser igual a la carga del ión. SO 4 -2 -2 PO 4 -3 -3 Ejercicios: K 2 Cr 2 O 7 Cl. O 3 - 28

BALANCEO DE UNA ECUACIÒN QUÌMICA 1. Escribir la reacción con las fórmulas correctas de reactivos y productos. 2. Contar los átomos de cada elemento en los reactivos y productos. 3. Utilizar coeficientes para balancear cada elemento. 4. Verificar la ecuación final para confirmar quedó balanceada. 29

PROCEDIMIENTO SUGERIDO PARA BALANCEAR ECUACIONES POR TANTEO 1. Metales 2. No metales 3. Hidrógeno 4. Oxígeno • Cuando sea necesario buscar mínimo común múltiplo. • No empezar por el elemento que esté solo. • combustión: 1. Carbono 2. Hidrógeno 3. Oxígeno • Iones poli atómicos: balancear como unidades individuales, cuando esté una sola vez de cada lado. 30

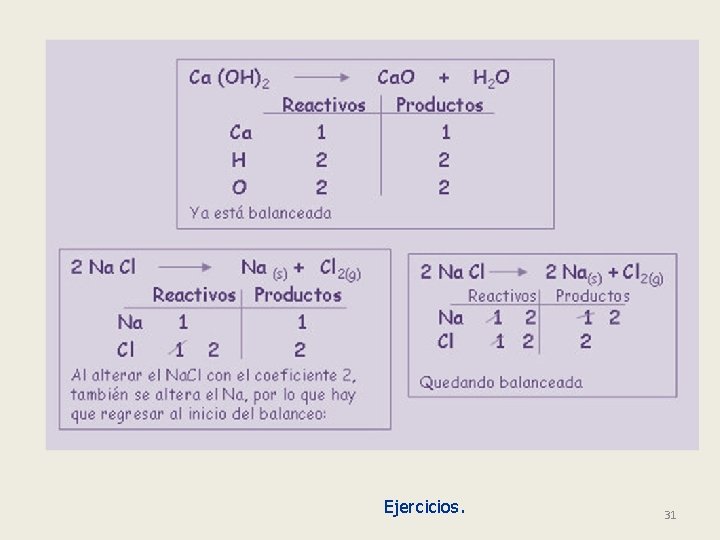
Ejercicios. 31

FIN 32
 Reaccin
Reaccin Reaccin
Reaccin Reaccin
Reaccin Ecuacin
Ecuacin Ecuacin
Ecuacin Ejemplo de ecuación lineal
Ejemplo de ecuación lineal Ecuacin
Ecuacin Termino lineal de una ecuacion
Termino lineal de una ecuacion Sistemas escalonados
Sistemas escalonados Cuadrtica
Cuadrtica Ecuacin
Ecuacin ¿adónde vas los fines de semana?
¿adónde vas los fines de semana? Semana espanhola acordo individual
Semana espanhola acordo individual Que semana estamos del tiempo ordinario
Que semana estamos del tiempo ordinario Embrion cuarta semana
Embrion cuarta semana Que hice el fin de semana
Que hice el fin de semana Is weather imperfect or preterite
Is weather imperfect or preterite Objetivo da semana da arte moderna
Objetivo da semana da arte moderna Deuteronomio 4 13
Deuteronomio 4 13 Lamina de la cuaresma
Lamina de la cuaresma Esta semana en amores
Esta semana en amores Nosotros ______ ganar.
Nosotros ______ ganar. Bienvenidos a una nueva semana
Bienvenidos a una nueva semana Sulu sou
Sulu sou A semana da arte moderna
A semana da arte moderna Lunes martes miercoles jueves viernes
Lunes martes miercoles jueves viernes Parasha de la semana mesianica
Parasha de la semana mesianica Semana 36 de embarazo
Semana 36 de embarazo Cronograma de la semana
Cronograma de la semana Los das
Los das No primeiro dia da semana maria madalena
No primeiro dia da semana maria madalena Esta semana en amores
Esta semana en amores Menudo fin de semana valladolid
Menudo fin de semana valladolid