REACCION Y ECUACIN QUIMICA SEMANA No 4 1






















- Slides: 26

REACCION Y ECUACIÓN QUIMICA SEMANA No. 4 1

Reacción Química: Proceso en el cual se produce un cambio químico, es decir se consume una o más sustancias a medida que se forman una o más sustancias nuevas. 2

Reactivos: Sustancias presentes en el inicio de la reacción. Productos: Las sustancias que la reacción produce. REACTIVOS PRODUCTOS 3

Ecuación Química Representa de una manera simbólica, lo que ocurre en una reacción. Glucosa + Oxígeno Dióxido de carbono+ Agua C 6 H 12 O 6(s) + 6 O 2(g) 6 CO 2(g) + 6 H 2 O(g) 4

Símbolos de las reacciones: (g)= gas (s)=sólido (l)=líquido (ac)=acuoso Catalizador: Mn. O 2 Reversible Gas liberado Irreversible Precipitado Calor para reaccionar Calor de reacción 65°C 5

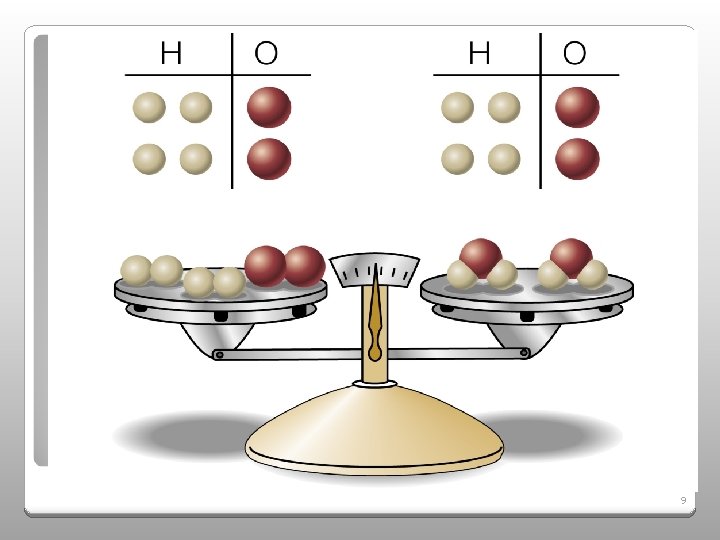
BALANCEO DE ECUACIONES En una ecuación química balanceada la cantidad de átomos de cada elemento representados como reactivos y productos tiene que ser el mismo. Utilizaremos moles (6. 022 x 1023 partículas unitarias en un mol) 6

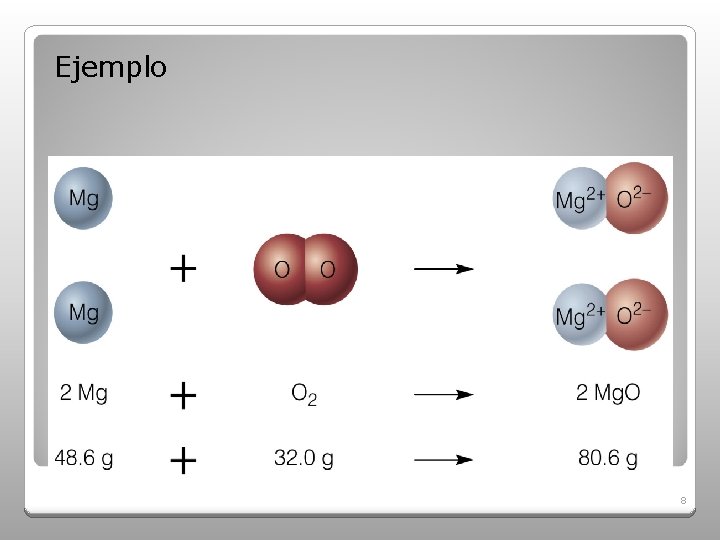
Cada ecuación indica las proporciones de masa y el no. de partículas. La masa total de los reactivos es igual a la masa total de los productos. (Ley de conservación de masas). 7

Ejemplo REACTIVOS Y PRODUCTOS 8

9

Procedimiento Sugerido para balancear ecuaciones por tanteo. 1. Metales 2. No metales 3. Hidrógeno 4. Oxígeno Ejercicios. -Cuando sea necesario buscar mínimo común multiplo. -No empezar por el elemento que esté solo. -combustión: 1. C 2. H 3. O -Iones poliatómicos: como unidades individuales, cuando esté una sola vez de cada lado. 10

Clasificación de las reacciones A. Según la forma en que se combinan o descomponen los reactivos. Reacciones de Combustión: Los compuestos que contienen Carbono, Hidrógeno y Oxígeno arden con el aire (consumiendo Oxígeno) y forman CO 2 +H 2 O +energía. CH 4 + 2 O 2 CO 2 + 2 H 2 O + energìa 11

Reacciones de Combinación o Síntesis Cuando un elemento reacciona o se combina con otro elemento para formar un compuesto (se ha sintetizado una nueva sustancia). A +B N 2(g) +3 H 2 (g) AB 2 NH 3(g) 12

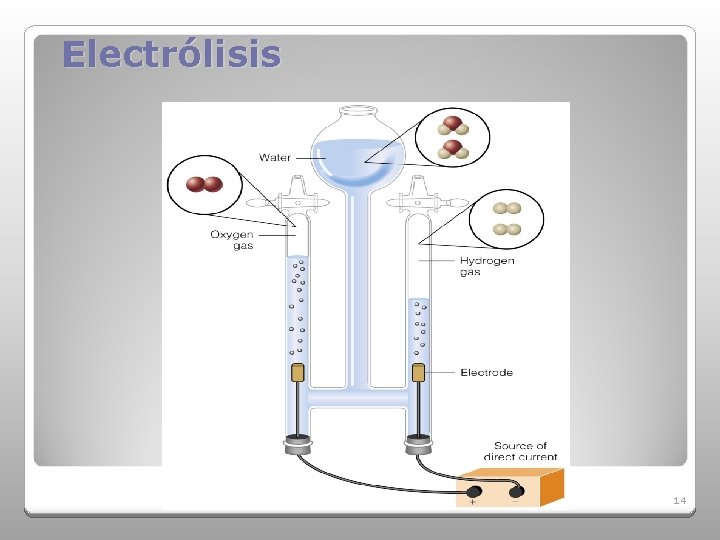
Reacciones de descomposición: Son aquellas en las que un solo compuesto simbolizado AB se descompone en dos o más sustancias sencillas. AB 2 H 2 O(l) A + B 2 H 2(g) + O 2(g) (electrólisis) 13

Electrólisis 14

• Reacciones de Simple sustitución o desplazamiento simple Un elemento simbolizado A, reacciona con un compuesto simbolizado BC, desplazando a otro elemento. A + BC AC + B A + BC AB + C Cu(s) + 2 Ag. NO 3 Cu(NO 3)2 +2 Ag (s) 15

• Reacciones de doble sustitución (metátesis) Se presentan cuando dos compuestos AB y CD, intercambian compañero para formar dos compuestos diferentes AC + BD Ej. AB + CD AD + BC H 2 SO 4 + Na 2 S H 2 S(g) + Na 2 SO 4 16

Neutralización: es una reacción de doble sustitución. Acido + Base HCl(ac)+ Na. OH(ac) Sal + Agua Na. Cl(ac) + H 2 O(l) La reacción de neutralización es la reacción de Iones H+ con los iones OH para formar moléculas covalentes estables de agua. 17

B. Reacciones clasificadas por el flujo de calor: Exotérmicas: la reacción desprende calor al ambiente. Combustión de Metano. Aumenta la temperatura del ambiente + (Entalpía) Ej. CH 4(g) +2 O 2(g) CO 2(g) + H 2 O(g)+ Calor 18

Endotérmicas: El sistema reaccionante absorbe el calor del ambiente. Ej. Fusión del Hielo Aplicación de calor al efectuar la reacción. 19

C. Clasificación de acuerdo al sentido de la Reacción a. Reversible: es aquella que puede llevarse a cabo en uno y otro sentido. Se dice que las reacciones están en equilibrio. A+ B AB 20

b. Irreversible: es aquella reacción química que puede llevarse a cabo en un solo sentido. Ej. A B 21

NÚMERO DE OXIDACIÓN También llamado Estado de Oxidación. Es el NÚMERO que se asigna a cada tipo de átomo o ión o a un elemento con base a un conjunto de reglas. El NÚMERO De Oxidación representa el NÚMERO de electrones que la especie gana, pierde o comparte. Iones monoatómicos: Na+ Mg+2 Cl Iones poliatómicos: 22

Reglas para asignar número de Oxidación 1. Todo elemento no combinado o unido consigo mismo, se le asigna número de oxidación de cero. Ej. K, Fe, H 2, O 2. 2. El H cuando se encuentra combinado se le asigna +1, a excepción de los hidruros (Metal + H) se le asigna -1. 23

3. Al O combinado se le asigna -2, exceptuando peróxidos, se le asigna -1. 4. Los metales de familias A al combinarse presentan principalmente: IA +1 IIA +2 IIIA +3(excepto Ta +1 y+3). 5. La suma de los numeros de oxidación debe ser cero para un compuesto. (Se asigna # oxidación positivo al elemento menos electronegativo y negativo al mas electronegativo. Ej. de cargas totales. 24

6. Para partículas iónicas: a. Monoatómicas: el número de oxidación es igual a su carga. b. Iones poliatómicos: la suma de los números de oxidación debe ser igual a la carga del ión. Ejercicios: K 2 Cr 2 O 7 Cl. O 325

26
 Proteasas
Proteasas Fes química
Fes química Cambio de temperatura química
Cambio de temperatura química Que es una reacción química
Que es una reacción química Reacciones quimicas fisicas
Reacciones quimicas fisicas Leyes de reacciones quimicas
Leyes de reacciones quimicas Clasificacion de reacciones quimicas
Clasificacion de reacciones quimicas Hidróxido de magnesio
Hidróxido de magnesio Reacción química
Reacción química Dot significado
Dot significado Reaccion quimica equilibrada
Reaccion quimica equilibrada Ecuacin
Ecuacin Ecuaciones lineales
Ecuaciones lineales Ecuacin
Ecuacin Termino lineal de una ecuacion
Termino lineal de una ecuacion Sistema de ecuaciones incompatible
Sistema de ecuaciones incompatible Completar trinomio cuadrado perfecto
Completar trinomio cuadrado perfecto Ecuacin
Ecuacin Sistemas escalonados
Sistemas escalonados Administracion y sociedad ambiente externo
Administracion y sociedad ambiente externo Accion reaccion
Accion reaccion En que consiste la ley de accion y reaccion
En que consiste la ley de accion y reaccion Keq quimica
Keq quimica Cociente de ritis
Cociente de ritis Distancia de reacción
Distancia de reacción Halogenación del propano
Halogenación del propano Reacción en cadena de la polimerasa
Reacción en cadena de la polimerasa