REACCIONES QUIMICAS SENCILLAS Por Reacciones Quimicas Ing Alma

























- Slides: 26

REACCIONES QUIMICAS SENCILLAS �Por : Reacciones Quimicas �Ing. Alma Gutierrez �Docente de la Asignatura Por: Alma Gutierrez

Reacciones Quimicas �Son interacciones de sustancias quimicas que dan origen a un cambio. �Ecuacion Quimica: Forma abreviada de expresar por escrito una reaccion quimica por medio de simbolos , formulas y los coeficientes estequiometricos que balancean la ecuacion. Por: Alma Gutierrez

Terminos Usados en Ecuaciones Quimicas �En el lado izquierdo de la ecuacion, se escriben los reactivos �En el lado derecho de la ecuacion se escriben los productos �Los reactivos se separan de los productos por medio de una flecha �Cada uno de l 0 s reactivos y productos se separan con un signo + Por: Alma Gutierrez

Simbolos usados �Gas = g �Liquido = l �Acuoso = ac �Solido = (s) Por: Alma Gutierrez

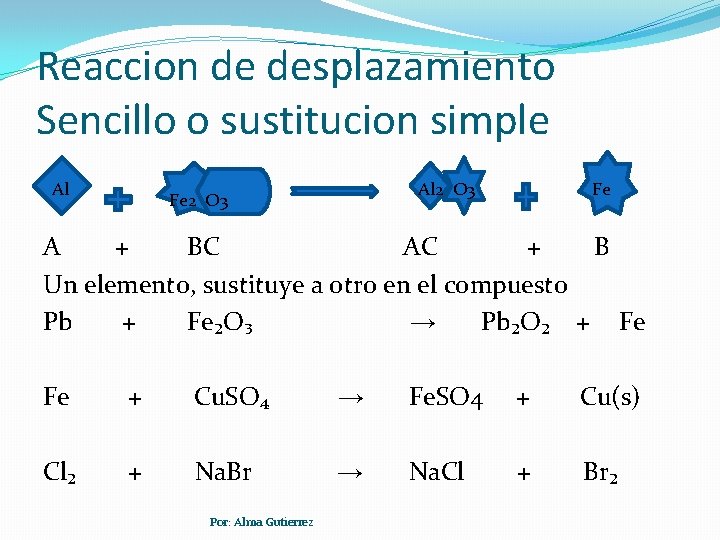
Reaccion de desplazamiento Sencillo o sustitucion simple Al Al 2 O 3 Fe A + BC AC + B Un elemento, sustituye a otro en el compuesto Pb + Fe₂O₃ → Pb₂O₂ + Fe Fe + Cu. SO₄ → Fe. SO 4 + Cu(s) Cl₂ + Na. Br → Na. Cl + Br₂ Por: Alma Gutierrez

Rx �Reacciones de síntesis o combinación. �Es la combinación de dos sustancias para formar una tercera. El modelo general de este �tipo de reacción es de la forma �A + B → C Por: Alma Gutierrez

Reaccion de Sintesis o combinacion �Combinación de dos sustancias para formar una tercera. Ejemplo: � sustancia A + sustancia B produce (→) sustancia C A+B C �Na + Cl₂ → Na. Cl �Ca. O + Si. O₂ → Ca. Si. O₃ Por: Alma Gutierrez

Reacciones de combinacion o sintesis �Oxígeno + Metal → Oxido Básico O 2 + K → K₂O �Oxígeno + No metal → Oxido ácido O 2 + Cl₂ → Cl₂O₃ �Oxido Básico + Agua → Base (Hidróxido) K₂O + H₂O → KOH �Oxido ácido + Agua → Oxoácido Cl₂O₅ + H₂O → HCl. O₃ �Hidrógeno + No metal → Acido hidrácido H₂ + S → H₂S �Metal + No metal → Sal Fe + S → Fe. S Por: Alma Gutierrez A+B produce C

2. Reaccion de Descomposicion: Un compuesto se descompone en dos o mas B A PCl₅ KCl. O₃ Ca. CO₃ Ag₂O NH₄NO₃ C → PCl₃ + Cl₂ → KCl + O₂ → Ca. O + CO₂ → Ag + O₂ → N₂O(g) + H₂O(g) (explosiva) Por: Alma Gutierrez

Reaccion de desplazamiento doble Dos sustancias AB + CD AD + CB Pb. Cl₂ + Li₂SO₄ → Pb. SO₄ + Li. Cl �Ba. Cl₂ + H₂SO₄ → HCl Por: Alma Gutierrez + Ba. SO₄

Reaccion de Combustion �CH₄ + 2 O₂ → CO₂ �C₆H₁₂O₆ + O₂ → CO₂ �C₂H₂ + O₂ → CO₂ Por: Alma Gutierrez + 2 H₂O + H₂O

Reacciones de Neutralizacion Vinagre con polvo de horrnear HC₂H₃O₂ + Na. HCO₃→ Na. C₂H₃O₂+ CO₂ + H₂O �Reacción de neutralización: Ácido + Base → Sal + Agua HCl + Na. OH → Na. CI + H 2 O neutralización del ácido clorhídrico por los antiácidos: son mezclas de hidróxido de magnesio e hidróxido de Aluminio: � HCl + Mg(OH)2 → Mg. Cl 2 + H 2 O �HCl + Al(OH)3 → AICl 3 + H 2 O Por: Alma Gutierrez

Balancee las Rx. Neutralizacion �H 2 SO 4 + 2 KOH → K 2 SO 4 + 2 H 2 O � Sulfato de potasio �H 2 SO 4 + KOH → KHSO 4 + H 2 O � Sulfato ácido de potasio � 2 HNO 3 + Cu(OH)2 → Cu (NO 3)2 + 2 H 2 O � Nitrato cúprico �HNO 3 + Cu. OH → Cu. NO 3 + H 2 O � Nitrato cuproso Por: Alma Gutierrez

Reacciones de Precipitacion �H 2 SO 4 + Ba. Cl 2 → Ba. SO 4 ↓ + HCl �HCl + Ag. NO 3 → Ag. Cl ↓ + HNO 3 �Na. Cl + Ag. NO 3 → Ag. Cl ↓ + Na. NO 3 �Pb(N 03)2 + KI → KNO 3 + Pbl 2 ↓ Por: Alma Gutierrez

Tarea 1: Clasifica Como: reaccion de sintesis, descomposicion, desplazamiento sencillo, desplazamiento doble, combustion, precipitacion o neutralizacion? Fe + O₂ → Fe. O Al + Cl₂ Ba. Cl₂ + Na₂SO₄ Mg Cu. SO₄ + Al. Cl₃ → Por: Alma Gutierrez → Ba. SO₄ → + Mg. SO₄ Na. Cl + Cu

Tarea 2 Ejercicios Balancee las siguientes reacciones quimicas: �H 2 SO 4 + Na → Na 2 SO 4 + H 2 �H 2 SO 4 + Cu → Cu. SO 4 + H 2 �Cu. SO 4 + Fe → Fe. SO 4 + Cu Por: Alma Gutierrez

Tarea 3 Escribe las ecuaciones : 1. Sodio metalico + gas cloro → cloruro de sodio 2. Gas propano + oxigeno →dioxido de carbono + vapor de agua + energia. 3. Zinc metalico + acido clorhidrico → cloruro de zinc en solucion + hidrogeno. 4. El magnesio metalico y el agua se combinan para formar hidroxido de magnesio solido y gas hidrogeno 5. Solucion de peroxido de hidrogeno se combina con plomo (II) solido para formar sulfato de plomo (II) solido y agua liquida. Por: Alma Gutierrez

Balanceo de Ecuaciones Quimicas Metodo: Tanteo: 1. Consiste en observar en la ecuacion, que en los reactivos tenga el mismo numero de elementos que en los productos. 2. Si el punto 1, se cumple, esta balanceada; es decir, se cumple la ley de la conservacion de la materia. 3. Si el punto 1, no se cumple, escriba un numero pequeno entero, adelante de la formula y empiece a balancear, agregando numeros hasta balancear la ecuacion. Por: Alma Gutierrez

Pasos para balancear una ecuacion: 1. Escriba correctamente las formulas quimicas 2. Empieza balanceando los elementos que estan unidos a otros y deja por ultimo los elementos que estan solos, los oxigenos y los hidrogenos. Ejemplo: Fe + O 2 → Fe. O Empezamos a balancear el O₂ en ambos lados de la ecuacion. Por: Alma Gutierrez

…Balanceo tanteo �Ca. F 2 + H 2 SO 4 �K + H 2 O → → Ca. SO 4 + HF KOH + H 2 Balancear cada ecuación anterior, utilizando el método de tanteo Por: Alma Gutierrez

Reacciones Redox �S e definen en terminos de cambios en los numeros de oxidacion. Ejemplo: �Na + Cl₂ Na⁺ + Cl⁻ En esta Reaccion: - Oxidacion: El Na; ( sodio), transfiere un e⁻ al atomo de cloro, y el numero de oxidacion del sodio, cambia de cero, a +1; por tanto, pierde un electron, se oxida y produce la reduccion del otro atomo actuando como agente reductor. - Reduccion: El Cl; (cloro), acepta un e⁻ y cambia de Cl a Cl⁻; su numero de oxidacioncambia de cero a -1 Por: Alma Gutierrez

Continuacion. . Redox �Redox: son reacciones de oxidacion reduccion: � El numero de oxidacion de un elemento en los reactivos es diferente al numero de oxidacion de este mismo elemento en los productos. � K 2 Cr 2 O 7 + H 2 O + S → SO 2 + KOH + Cr 2 O 3 Por: Alma Gutierrez

Pasos: 1. Escribir los números de oxidación de todas las especies, observar cuáles son las que cambian y Escribir la hemirreaccion de oxidación y de reducción de la siguiente manera: Cr+6 → Cr+3 Reducción S 0 → S+4 Oxidación -4 -3 -2 -1 0 1 2 3 4 5 Si en la reaccion, el numero de oxidacion aumenta, es una oxidacion; si disminuye, es una reduccion Por: Alma Gutierrez

…Balanceo Redox � 2. Balancear los atomos en las hemirreacciones Cr+6 → Cr+3 En este caso, esta balanceada, pues solo hay un atomo en cada lado; asi que no se agrega coeficiente de balanceo S 0 → S+4 � 3. Agregar electrones en un lado, para igualar las cargas en ambos lados de la hemirreaccion. Cada e⁻ es = -1 Cr+6 + 3 e⁻ → Cr+3 3 e⁻ = -3 S 0 → S+4 + 4 e⁻ 4 e⁻ = -4 Por: Alma Gutierrez

… Balanceo Redox 4. Igualar los e⁻ en ambas hemirreacciones, multiplicando por un numero entero pequeño cada ecuación. 4 (Cr+6 + 3 e⁻ → Cr+3 ) 4 Cr⁺⁶ + 3 ( S 0 3 5. 12 e⁻ 4 Cr⁺ᵌ → S° S+4 + 4 e⁻) 3 S⁺⁴ + 12 e⁻ Hacer una sumatoria de las hemirreacciones S° 4 Cr⁺ᵌ + 3 S⁺⁴ + 12 e⁻ 6. Cancelar terminos comunes y Escribir la ecuacion original con sus respectivos coeficientes balanceados 4 K 2 Cr 2 O 7 + H 2 O + 3 S → 3 SO 2 + 8 KOH + 4 Cr 2 O 3 4 Cr⁺⁶ + 12 e⁻ + 3 6. El H y el O se balancean agregando agua: por cada oxigeno en exceso en un lado de la ecuacion, se agrega 1 agua en el lado contrario y 2 hidronos en el otro lado. Por: Alma Gutierrez

Reacciones Quimicas Importantes en medicina y medio ambiente �Cada Grupo, Expone, tres reacciones Quimicas importantes en la contaminacion y descontaminacion Por: Alma Gutierrez
 Reacción de precipitación
Reacción de precipitación Csanádi imre alma
Csanádi imre alma Mg elemento
Mg elemento Reacciones quimicas
Reacciones quimicas Endotermica
Endotermica Hidróxido de magnesio
Hidróxido de magnesio Reacciones de combustión
Reacciones de combustión Cambio de temperatura química
Cambio de temperatura química Saturada
Saturada Cambios fisicos y quimicos
Cambios fisicos y quimicos Reacciones químicas
Reacciones químicas Ecuacion ionica total y neta
Ecuacion ionica total y neta Síntesis de williamson
Síntesis de williamson Reaccion de combinacion
Reaccion de combinacion Pureza reacciones quimicas
Pureza reacciones quimicas Mol reacciones quimicas
Mol reacciones quimicas Precipitacion reaccion quimica
Precipitacion reaccion quimica Reacciones quimicas reversibles
Reacciones quimicas reversibles Fisicia
Fisicia Atomicidad
Atomicidad Mol reacciones quimicas
Mol reacciones quimicas Oxoácidos nomenclatura
Oxoácidos nomenclatura 5 ejemplos de tareas
5 ejemplos de tareas Palabras de amor sencillas y tiernas
Palabras de amor sencillas y tiernas örtük model alma nedir
örtük model alma nedir Por los senderos del alma
Por los senderos del alma Reacciones de adicion electrofilica
Reacciones de adicion electrofilica
















































