Ecuaciones qumicas y Reacciones http www unit 5





































- Slides: 78

Ecuaciones químicas y Reacciones http: //www. unit 5. org/chemistry/Equations. html

Esquema de la conferencia - ecuaciones químicas Y reacciones Esquema de la conferencia - ecuaciones y reaccion el estudiante observa el esquema preguntas del libro de textos Esquema de la conferencia - ecuaciones y reaccion preguntas del libro de textos Llaves texto http: //www. unit 5. org/chemistry/Equations. html

Reacciones químicas Usted debe poder a ØClasificar las reacciones por el tipo. ØEscribir una ecuación molecular equilibrada, ecuación iónica completa, y una ecuación iónica neta. ØReacciones de la oxidación-reducción del balance. ØPredecir si un precipitado forma con las reglas de la solubilidad. ØPredecir los productos de las reacciones dadas los nombres químicos del reactivo.

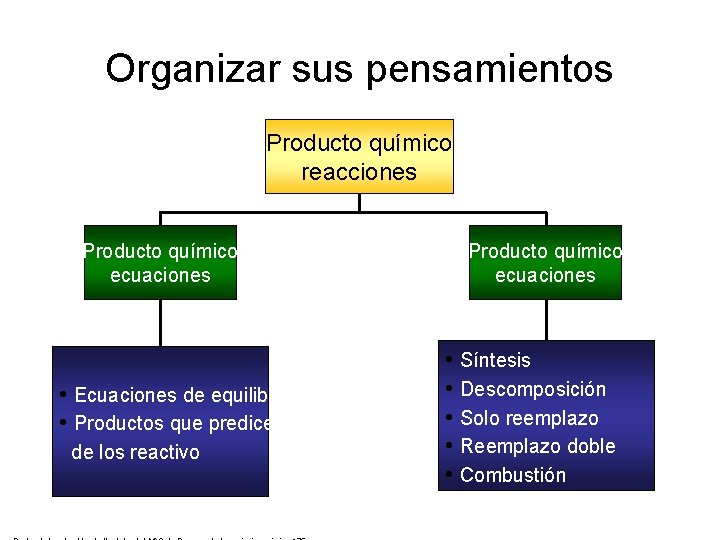
Organizar sus pensamientos Producto químico reacciones Producto químico ecuaciones • Ecuaciones de equilibrio • Productos que predicen de los reactivo Producto químico ecuaciones • Síntesis • Descomposición • Solo reemplazo • Reemplazo doble • Combustión

Descripción de una reacción química Indicaciones de una reacción química Evolución del calor, de la luz, y/o del sonido Producción de un gas Formación de un precipitado Cambio del color

Muestras de reacciones químicas Hay cinco muestras principales que indican que ha ocurrido una reacción química: cambiar en color entrada lanzamiento cambiar en olor producción de nuevoentrada o lanzamiento difícil invertir gases o vapor de la energía

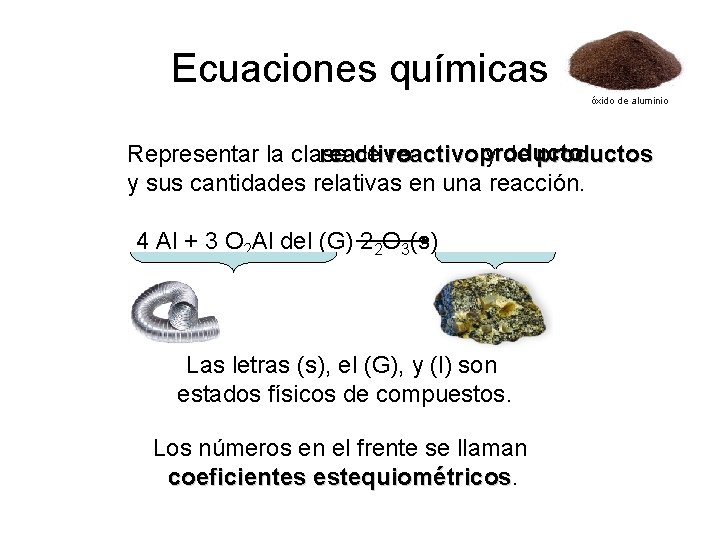
Ecuaciones químicas óxido de aluminio Representar la clase de reactivo y de productos reactivoproductos y sus cantidades relativas en una reacción. 4 Al + 3 O 2 Al del (G) 22 O 3(s) Las letras (s), el (G), y (l) son estados físicos de compuestos. Los números en el frente se llaman coeficientes estequiométricos

Ecuaciones químicas 4 Al + 3 O 2 Al del (G) 22 O 3(s) óxido de aluminio papel de lija Al de 4 g + 3 g O 2 Al de g de la producción 22 O 3 Esta ecuación significa: mos del Al + 3 O 2 moléculas de la producción 2 de las moléculas del A o 4 topos del Al + 3 O 2 topos de la producción 2 de los topos del Al 2 O 3 4 mol de Al@27 g/mol 3 mol de O 2@32 g/mol 108 g + 96 g = 204 g 2 mol de Al 2 O 3@102 g/mol

Ecuaciones químicas Porque los mismos átomos están presentes en una reacción al principio (reactivo) y en el extremo (productos), la cantidad de materia en un sistema no cambia. La ley de la conservación de la materia 100% Producto químico Fábrica Tela de Kotz el 20% el 80%

Ecuaciones químicas Debido a el principio de la conservación de la materia, materia Una ecuación debe ser equilibrada Debe tener el mismo número de átomos de la misma clase en ambos lados. Lavoisier, 1788

Características de ecuaciones químicas • La ecuación debe representar sabido hechos. La ecuación debe contener el correcto fórmulas para los reactivo y los productos. La ley de la conservación de la masa debe satisfacerse.

Ecuaciones químicas • Reactivo - las sustancias que existen antes de a el cambio químico (o la reacción) ocurre. Productos - las nuevas sustancias se forman que durante los cambios químicos. La ECUACIÓN QUÍMICA indica los reactivo y productos de una reacción. PRODUCTOS del REACTIVO

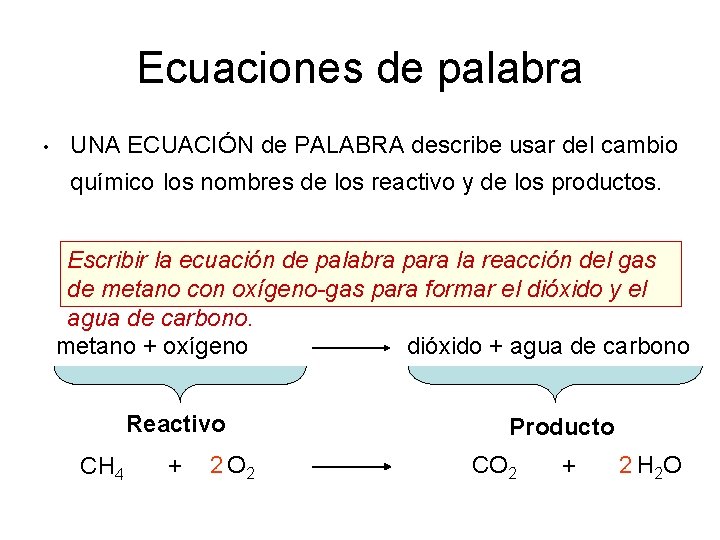
Ecuaciones de palabra • UNA ECUACIÓN de PALABRA describe usar del cambio químico los nombres de los reactivo y de los productos. Escribir la ecuación de palabra para la reacción del gas de metano con oxígeno-gas para formar el dióxido y el agua de carbono. dióxido + agua de carbono metano + oxígeno Reactivo CH 4 + 2 O 2 Producto CO 2 + 2 H 2 O

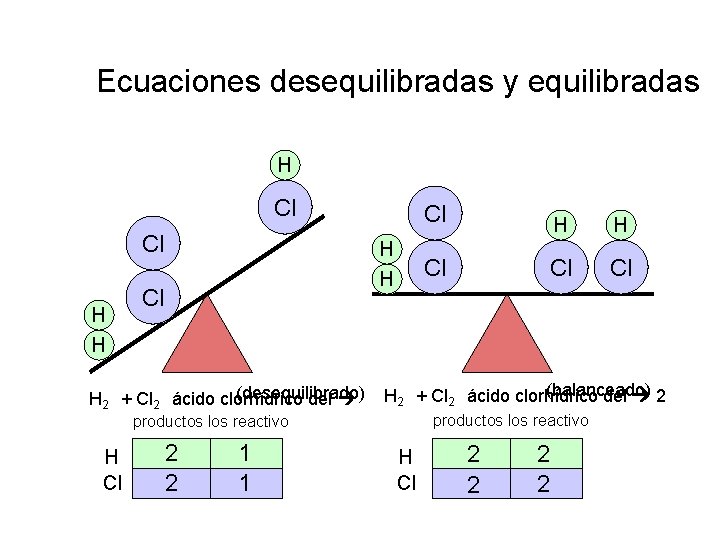
Ecuaciones desequilibradas y equilibradas H Cl Cl H H Cl Cl Cl (balanceado) (desequilibrado) 2 H 2 + Cl 2 ácido clorhídrico del productos los reactivo H Cl 2 2 1 1 H Cl 2 2

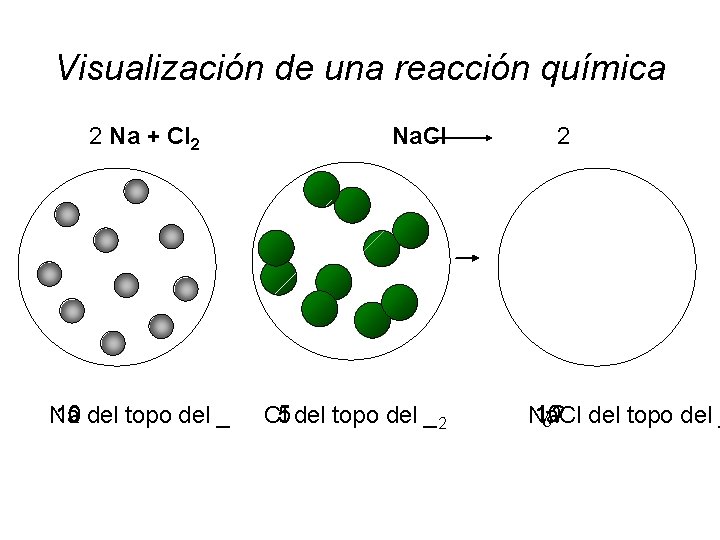
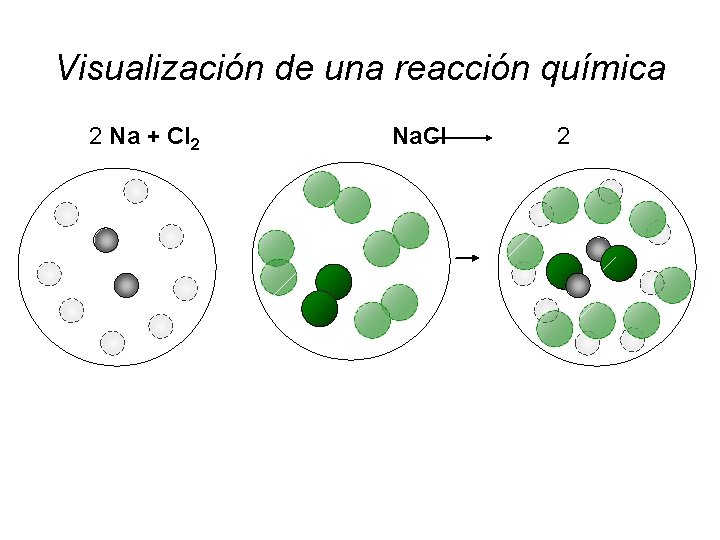
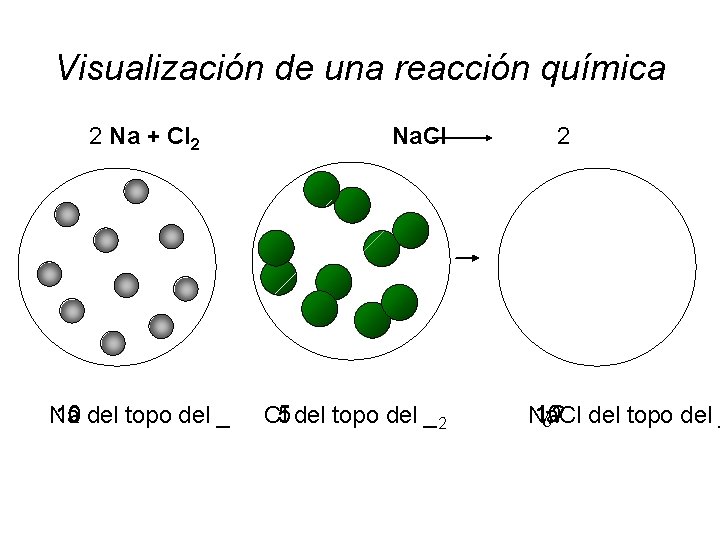
Visualización de una reacción química 2 Na + Cl 2 Na. Cl 10 Na del topo del _ 5 Cl del topo del _ 2 2 ¿? 10 Na. Cl del topo del _

Visualización de una reacción química 2 Na + Cl 2 Na. Cl 2

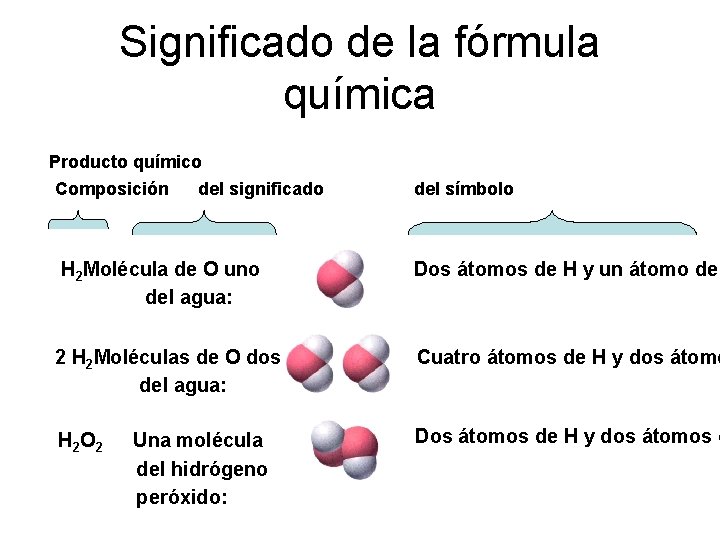
Significado de la fórmula química Producto químico Composición del significado del símbolo H 2 Molécula de O uno del agua: Dos átomos de H y un átomo de 2 H 2 Moléculas de O dos del agua: Cuatro átomos de H y dos átomo H 2 O 2 Una molécula del hidrógeno peróxido: Dos átomos de H y dos átomos d

Ecuaciones químicas de equilibrio Ecuación equilibrada - una en de el cual el número los átomos de cada elemento como reactivo son iguales a número de átomos de ese elemento como producto Cuál es la relación entre la conservación de la masa y el hecho de que una ecuación equilibrada tenga siempre iguales ¿número de átomos de cada elemento en ambos lados de una ecuación Determinar si la ecuación siguiente es equilibrada. 2 Na + H 2 2 de O Na. OH + H 2 2 Na + 2 H 2 2 de O Na. OH + H 2

Ecuaciones químicas de equilibrio • Escribir una ecuación de palabra para la reacción. Escribir las fórmulas correctas para todos los reactivo y productos. Determinar los coeficientes que hacen balance de la ecuación.

Ecuaciones químicas de equilibrio Otros ejemplos NINGUÌ� N (g) + O 2 NO del (G)2(G) ¿se balancea? ¿Se balancea esto? NINGUÌ� N (g) + O (g) NO del 2(G ¿Es esta AUTORIZACIÓN? NINGUÌ� N (g) + ½ O 2 NO del ¿Se balancea esto? ¿Es esta AUTORIZACIÓN?

Ecuaciones químicas de equilibrio Un aspecto importante a recordar 2 NINGUÌ� N (g) + O 2 2 NO del (G)2(G) Los 2 a la izquierda de NINGUÌ� N (g) y NO 2 el (G) refiere al número de las moléculas presentes en la ecuación equilibrada. Es un “multiplicador” para cada átomo en la molécula. El subíndice 2 en O 2 (G) y NO 2 el (G) refiere al número de los átomos de este tipo que están presentes en cada las moléculas (o compuesto iónico).

Pautas para balancear ecuaciones químicas ¿ 1) iones poliatómicos primeros ? 2) incluso/impar(hacer todos incluso) 3) H 22 H-OH contra. Magnesio de O (OH)2 4) los solos elementos duran Ejemplo: átomos de oxígeno de la necesidad 13 “” 13 Multiplicarse por O 2 = 13 2 13 3 X + O 2 2 Y + Z 2 13 2 3 X + O 2 2 Y + Z 2 6 X + 13 O 2 4 Y + 2 Z

¿? 2 (NH 4)3 PO 4 + magnesio (OH) 3 + 6 NH 2 magnesio del 3(PO 4 )2 4 OH fosfato del amonio hidróxido de magnesio fosfato del magnesio hidróxido de amonio NH 41+ OH 1 Ahora usted intento… 2 Al. Cl 3 + Li 23 CO 3 Al del 2(CO 3)3 + Cl. Li 6

Escribir una ecuación equilibrada para la reacción entre la clorina y bromuro del sodio para producir el cloruro del bromo y sódico. 1) escribe una ecuación de palabra para la reacción. bromo del bromuro de la clorina + del sodio + cloruro sódic 2) escribe las fórmulas correctas para todos los reactivo y productos. Cl 2 + Br del Na. Br 2 + Na. Cl 3) determina los coeficientes que hacen el equilibrio de la ecuación. Cl 2 de + Br del 2 Na. Br 2 + Na. Cl 2

Escribir la ecuación equilibrada para la reacción en medio cloruro de aluminio del sulfato y de calcio para formar un blanco precipitado del sulfato de calcio. 1) escribe una ecuación de palabra para la reacción. ¿? + cloruro de aluminio sulfato de calcio de aluminio del cloruro del sulfato + de calcio 2) escribe las fórmulas correctas para todos los reactivo y productos. Al 2(TAN 4)3 + Ca. Cl 2 Ca. SO 4 + Al. Cl 3 3) determina los coeficientes que hacen el equilibrio de la ecuación. Al 2(TAN 4)3 + 3 Ca. Cl 2 3 Ca. SO 4 + 2 Al. Cl 3

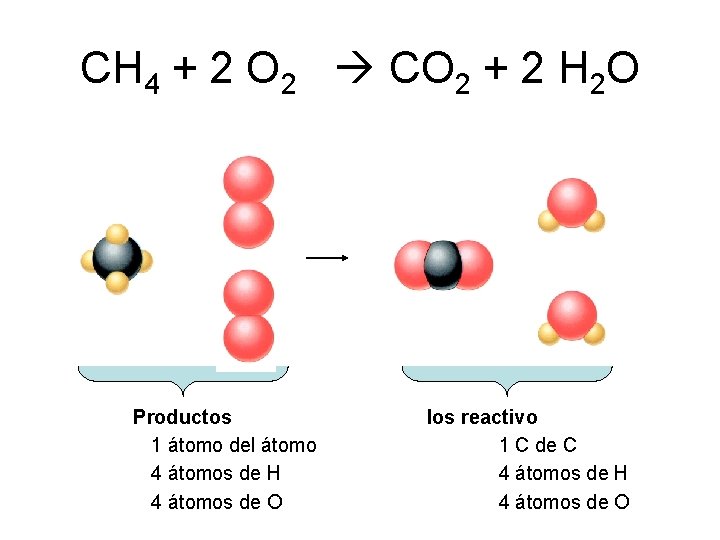
CH 4 + 2 O 2 CO 2 + 2 H 2 O Productos 1 átomo del átomo 4 átomos de H 4 átomos de O los reactivo 1 C de C 4 átomos de H 4 átomos de O

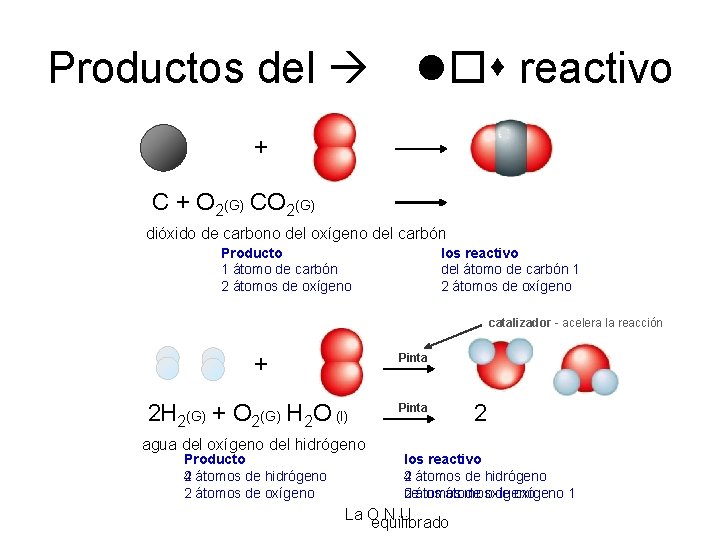
Productos del reactivo + C + O 2(G) CO 2(G) dióxido de carbono del oxígeno del carbón Producto 1 átomo de carbón 2 átomos de oxígeno los reactivo del átomo de carbón 1 2 átomos de oxígeno catalizador - acelera la reacción + Pinta H 2 2(G) + O 2(G) H 2 O (l) agua del oxígeno del hidrógeno Producto 2 átomos de hidrógeno 4 átomos de hidrógeno 2 átomos de oxígeno Pinta 2 los reactivo 2 átomos de hidrógeno 4 átomos de hidrógeno de los átomos de oxígeno 1 2 átomos de oxígeno La O. N. U equilibrado

Demostrando fases adentro Ecuaciones químicas H 2 O (l) H 2 O (g) Fase sólida - la sustancia es relativamente rígida y tiene a volumen y forma definidos. Na. Cl Fase líquida - la sustancia tiene un volumen definido, pero es capaz de desformar fluyendo. H 2 O (l) Fase gaseosa - la sustancia no tiene ninguÌ� n volumen definido o formar, y demuestra poca respuesta a la gravedad. Cl 2(G)

Símbolos adicionales usados en ecuaciones químicas (s) “Rinde”; indica el resultado de la reacción Utilizado para indicar una reacción reversible Un reactivo o un producto en el de estado sólido; también utilizado para indicar un precipitado Alternativa a (s), pero utilizado para indicar solamente un precipitado (l) (aq) (G) Un reactivo o un producto en el estado líquido Un reactivo o un producto en una solución acuosa (disuelto en agua) Un reactivo o un producto en el estado gaseoso

Símbolos adicionales usados en ecuaciones químicas D Alternativa al (G), pero utilizado para indicar solamente un producto gaseoso Los reactivo son heated Presión en la cual se realiza la reacción, en este caso 2 atmósferas La presión en la cual se realiza la reacción excede normal presión atmosférica o 0 o. C C Temperatura en la cual se realiza la reacción, en este caso 0 Fórmula del catalizador, en este caso óxido del manganeso Mn. O 2 (iv), utilizado para alterar el índice de la reacción

Ecuaciones iónicas de la solubilidad NH 4 NO 3 (s) ---> NH 4+1 (aq) + NO 3 -1 (aq) Cubrir las respuestas, trabajar el problema, después comprobar la respuesta. 1. Disolver el nitrato de amonio: 2. Precipitar el hidróxido cúprico: 3. Disolver el tiocianato del cromo: Cu+2 (aq) + 2 OH-1 (aq) ---> Cu (OH)2 (s) Cr (SCN)3 (s) ---> Cr+3 (aq) + 3 SCN-1 (aq) 4. Precipitar el arseniato de plomo: 3 Pb+2 (aq) + 2 As. O 4 -3 (aq) ---> Pb 3(As. O 4)2 (s) 5. Disolver el permanganato del silicio: 6. Precipitar el fosfato del cinc: Si (Mn. O 4)4 (s) ---> Si+4 (aq) + 4 Mn. O 4 -1 (aq) 3 Zn+2 (aq) + 2 PO 4 -3 (aq) ---> Zn 3(PO 4)2 (s)

Tipos de reacciones químicas Reacción de la síntesis (combinación) AB de A + de B Reacción de la descomposición AB A + B Areacción del Solo-reemplazo A + A. C. CA + B compuesto elemento Breacción del Doble-reemplazo AB + ANUNCIO + CB CD del compuesto Reacción de la neutralización compuesto HX + de BOH BX + HOH ácido base sal agua CH + O 2 CO 2 + H 2 O Reacción de la combustión (de un hidrocarburo) Polimerización Polímero = monómero +… la serie de actividad para predecir Bagua, gas, o precipitado de la fuerza impulsora… Autilizar

Tipos de reacciones químicas Reacción de la síntesis (combinación) AB de A + de B Reacción de la descomposición AB A + B Areacción del Solo-reemplazo A + A. C. CA + B Breacción del Doble-reemplazo AB + ANUNCIO + CB CD del HX + de BOH BX + HOH Reacción de la neutralización CH + O 2 CO 2 + H 2 O Reacción de la combustión (de un hidrocarburo) Polimerización Autilizar Polímero = monómero +… la serie de actividad para predecir Bagua, gas, o precipitado de la fuerza impulsora…

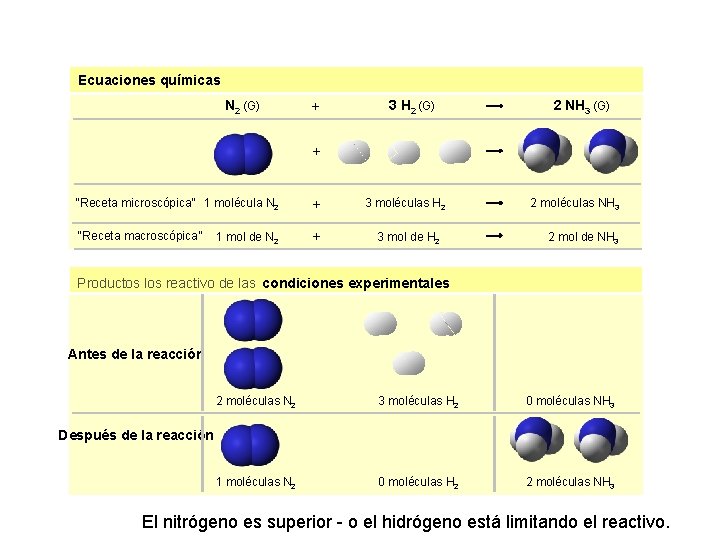
Ecuaciones químicas N 2 (G) + 3 H 2 (G) 2 NH 3 (G) + “Receta microscópica” 1 molécula N 2 + 3 moléculas H 2 “Receta macroscópica” + 3 mol de H 2 1 mol de N 2 2 moléculas NH 3 2 mol de NH 3 Productos los reactivo de las condiciones experimentales Antes de la reacción 1 mol de N 2 + 3 mol de H 2 2 mol de NH 3 2 moléculas N 2 3 moléculas H 2 0 moléculas NH 3 1 moléculas N 2 0 moléculas H 2 2 moléculas NH 3 Después de la reacción El nitrógeno es superior - o el hidrógeno está limitando el reactivo.

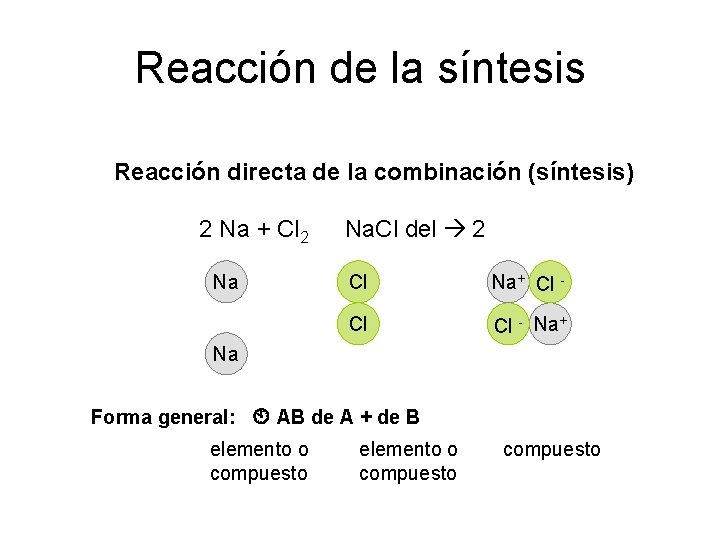
Reacción de la síntesis Reacción directa de la combinación (síntesis) 2 Na + Cl 2 Na. Cl del 2 Na Cl Cl Na Forma general: AB de A + de B elemento o compuesto

Reacción de la síntesis Reacción directa de la combinación (síntesis) 2 Na + Cl 2 Na. Cl del 2 Na Cl Na+ Cl - Cl Cl - Na+ Na Forma general: AB de A + de B elemento o compuesto

Formación de un sólido: Ag. Cl Ag. NO 3(aq) + KNO del KCl (aq)3 (aq) + Ag. Cl

cloruro del plomo (ii) + yoduro de potasio K 1+ Pb 2+ Cl 1 Cl Pb 2 + I 1 I K © de los derechos reservados Pearson 2007 Benjamin Cummings. Todos los derechos reservados. cloruro del potasio + yoduro del plomo ( Pb 2+ Cl 1 KCl (aq) K 1+ + I 1 Pb. I 2 (ppt)

cloruro del plomo (ii) + yoduro de potasio K 1+ Pb 2+ Cl 1 Cl Pb 2 + I 1 I K © de los derechos reservados Pearson 2007 Benjamin Cummings. Todos los derechos reservados. cloruro del potasio + yoduro del plomo ( Pb 2+ Cl 1 KCl (aq) K 1+ + I 1 Pb. I 2 (ppt)

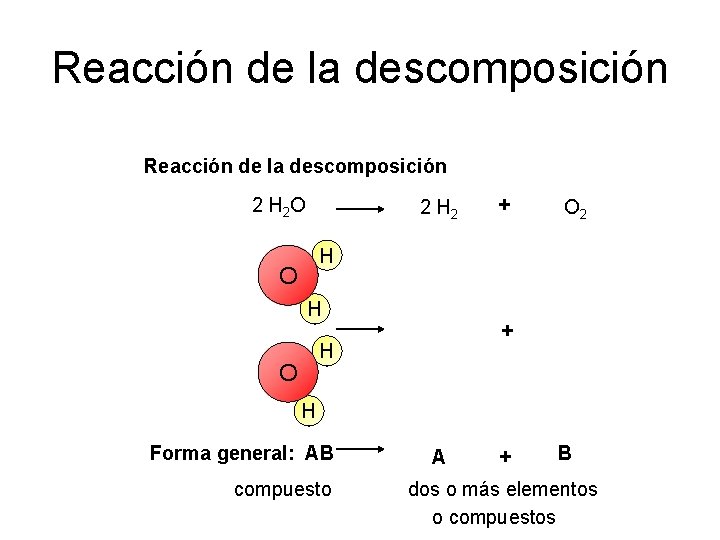
Reacción de la descomposición 2 H 2 O 2 H 2 + O 2 H O H + H O H Forma general: AB compuesto A + B dos o más elementos o compuestos

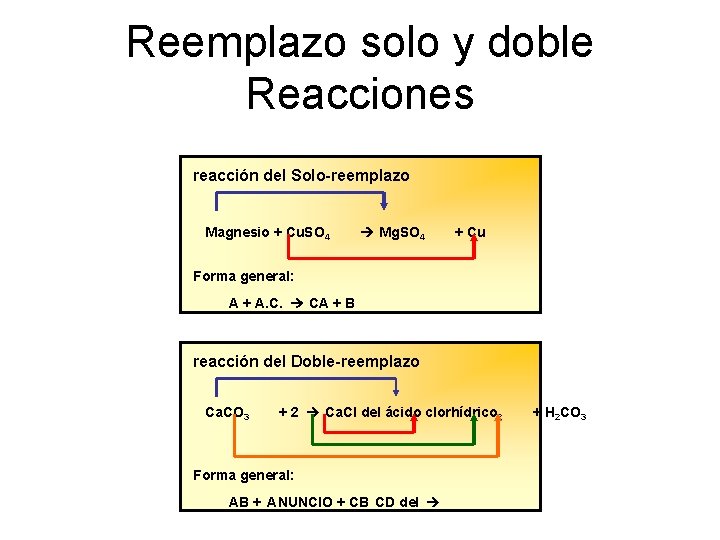
Reemplazo solo y doble Reacciones reacción del Solo-reemplazo Mg. SO + Cu Magnesio + Cu. SO 4 4 Forma general: A + A. C. CA + B reacción del Doble-reemplazo + 2 Ca. Cl del ácido clorhídrico + H CO Ca. CO 3 Forma general: AB + ANUNCIO + CB CD del 2 2 3

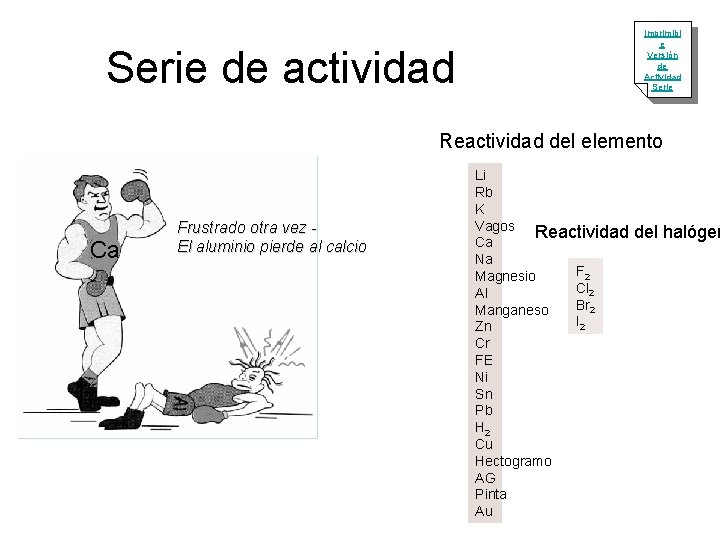
Serie de actividad Imprimibl e Versión de Actividad Serie Reactividad del elemento Ca Frustrado otra vez El aluminio pierde al calcio Li Rb K Vagos Reactividad del halógen Ca Na F 2 Magnesio Cl 2 Al Br 2 Manganeso I 2 Zn Cr FE Ni Sn Pb H 2 Cu Hectogramo AG Pinta Au

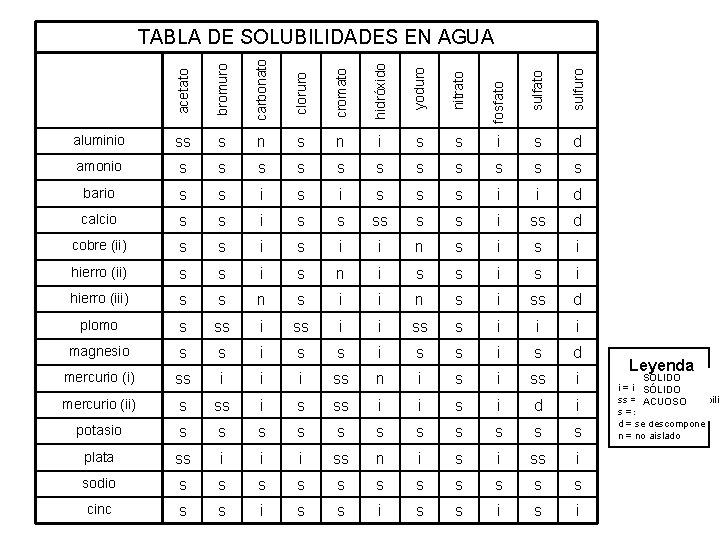
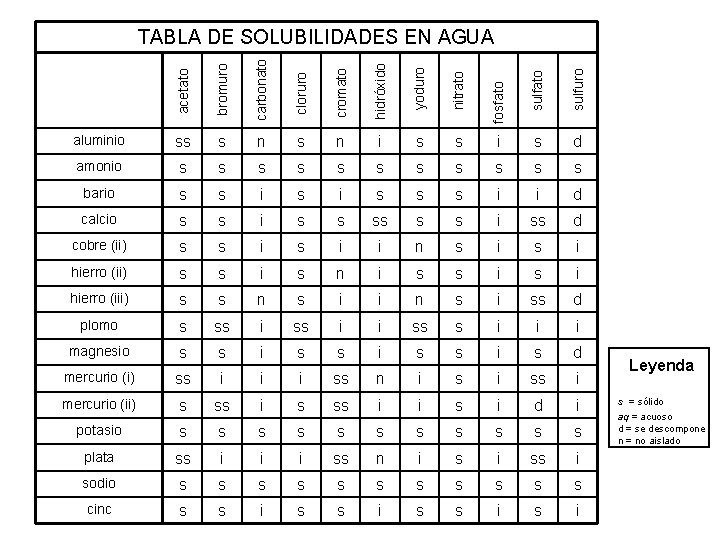
bromuro carbonato cloruro cromato hidróxido yoduro nitrato sulfuro aluminio ss s n i s s i s d amonio s s s bario s s i s s s i i d calcio s s i ss d cobre (ii) s s i i n s i hierro (ii) s s i s n i s s i hierro (iii) s s n s i i n s i ss d plomo s ss i i ss s i i i magnesio s s i s d mercurio (i) ss i i i ss n i ss i mercurio (ii) s ss i i s i d i potasio s s s plata ss i i i ss n i ss i sodio s s s cinc s s i fosfato acetato TABLA DE SOLUBILIDADES EN AGUA Leyenda SÓLIDO i = insoluble SÓLIDO ss = levemente solubilid ACUOSO s = solubilidad d = se descompone n = no aislado

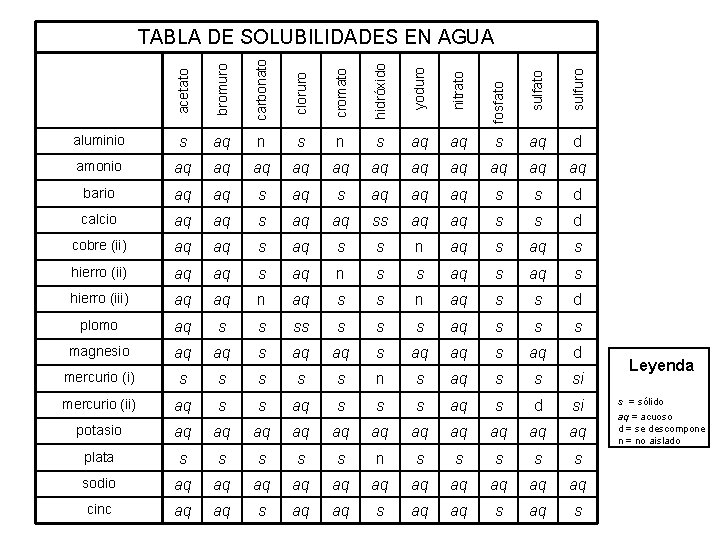
bromuro carbonato cloruro cromato hidróxido yoduro nitrato sulfuro aluminio s aq n s aq aq s aq d amonio aq aq aq bario aq aq s aq aq aq s s d calcio aq aq ss aq aq s s d cobre (ii) aq aq s s n aq s hierro (ii) aq aq s aq n s s aq s hierro (iii) aq aq n aq s s d plomo aq s s s s aq s s s magnesio aq aq s aq d mercurio (i) s s s n s aq s s si mercurio (ii) aq s s s aq s d si potasio aq aq aq plata s s s n s s sodio aq aq aq cinc aq aq s fosfato acetato TABLA DE SOLUBILIDADES EN AGUA Leyenda s = sólido aq = acuoso d = se descompone n = no aislado

bromuro carbonato cloruro cromato hidróxido yoduro nitrato sulfuro aluminio ss s n i s s i s d amonio s s s bario s s i s s s i i d calcio s s i ss d cobre (ii) s s i i n s i hierro (ii) s s i s n i s s i hierro (iii) s s n s i i n s i ss d plomo s ss i i ss s i i i magnesio s s i s d mercurio (i) ss i i i ss n i ss i mercurio (ii) s ss i i s i d i potasio s s s plata ss i i i ss n i ss i sodio s s s cinc s s i fosfato acetato TABLA DE SOLUBILIDADES EN AGUA Leyenda s = sólido aq = acuoso d = se descompone n = no aislado

Reglas de la solubilidad 1. La mayoría de los nitratos son solubles. 2. La mayoría de las sales que contienen el ion y el ion de amonio, NH del grupo I 4+, se 3. La mayoría del cloruro, del bromuro, y de las sales del yoduro son solubles, excepto y hectogramo 22+. 4. La mayoría de las sales del sulfato son solubles, excepto Ba. SO 4, Pb. SO 4, Hectogram 5. La mayoría de los hidróxidos exceptúan el grupo 1 y los vagos (el OH)2, Senior (OH) solamente levemente solubilidad. 6. La mayoría de los sulfuros, de los carbonatos, de los cromatos, y de los fosfatos está soluble. Ohn-Sabatello, Morlan, Knoespel, agilización a 5 que se preparan para la examinación 2006, página 91 de la química del AP

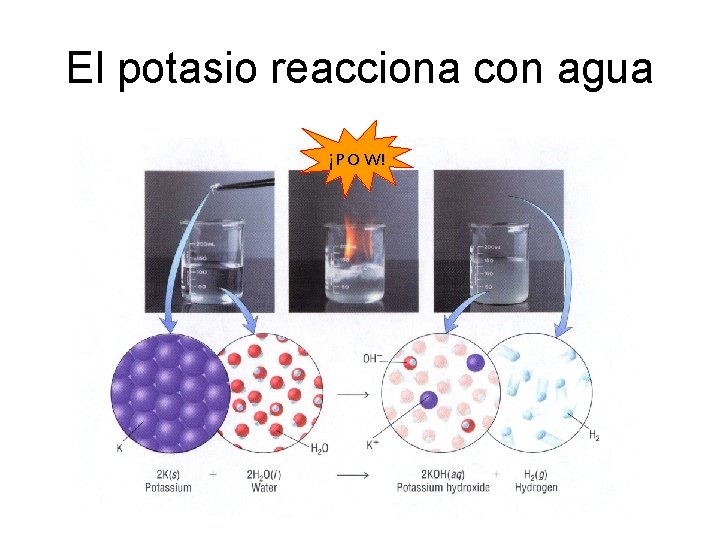
El potasio reacciona con agua ¡P O W!

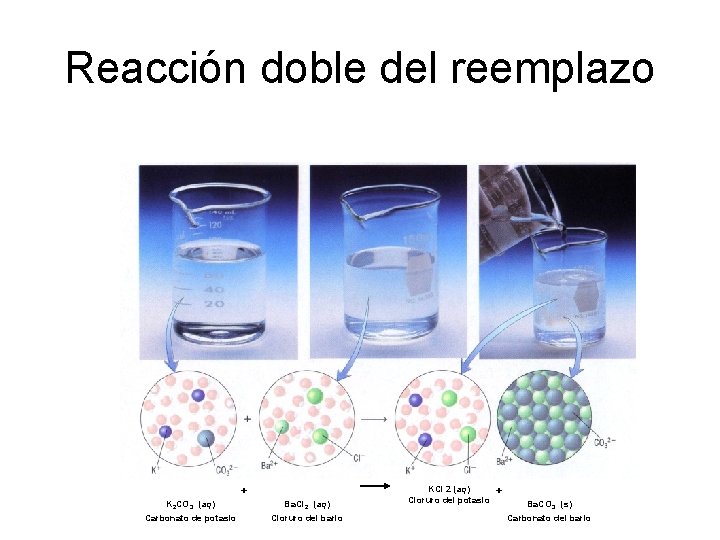
Reacción doble del reemplazo + K 2 CO 3 (aq) Ba. Cl 2 (aq) Carbonato de potasio Cloruro del bario KCl 2 (aq) Cloruro del potasio + Ba. CO 3 (s) Carbonato del bario

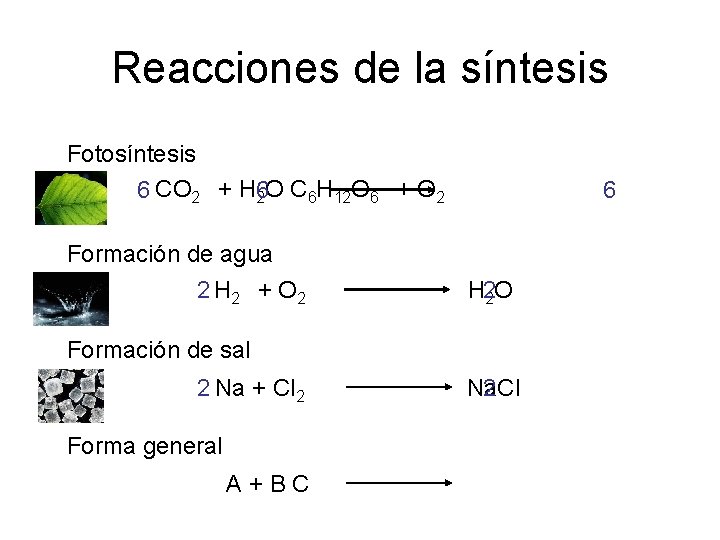
Reacciones de la síntesis Fotosíntesis 6 CO 2 + H 6 2 O C 6 H 12 O 6 + O 2 Formación de agua 2 H 2 + O 2 H 22 O Formación de sal 2 Na + Cl 2 Na. Cl 2 Forma general A + B C 6

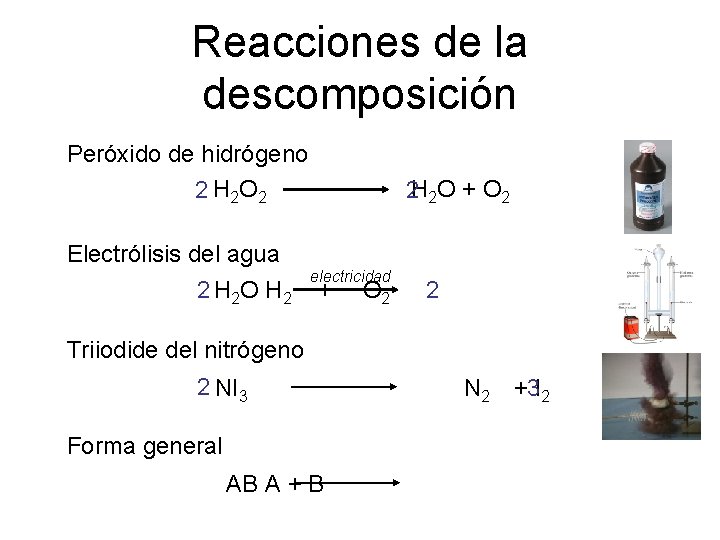
Reacciones de la descomposición Peróxido de hidrógeno 2 2 O + O 2 2 H 2 O 2 H Electrólisis del agua electricidad 2 H 2 O H 2 + O 2 2 Triiodide del nitrógeno 2 NI 3 N 2 + I 32 Forma general AB A + B

Predecir si ocurren estas reacciones 3 Magnesio + Al. Cl 2 3 2 3 2 Al + Mg. Cl SÍ, el magnesio es más reactivo que el aluminio. ¿Puede el magnesio substituir el aluminio? Serie de actividad Al + Mg. Cl 2 Ninguna reacción NO, aluminio es menos reactivo que el magnesio. ¿Puede el aluminio substituir el magnesio? Serie de actividad Por lo tanto, ninguna reacción ocurrirá. Mg. Cl 2 + Al ¿ Pedido de reactivo NO HACE Ninguna reacción determinar cómo reaccionan. La pregunta que debemos hacer es puede el solo elemento substituir sus contrapartes?

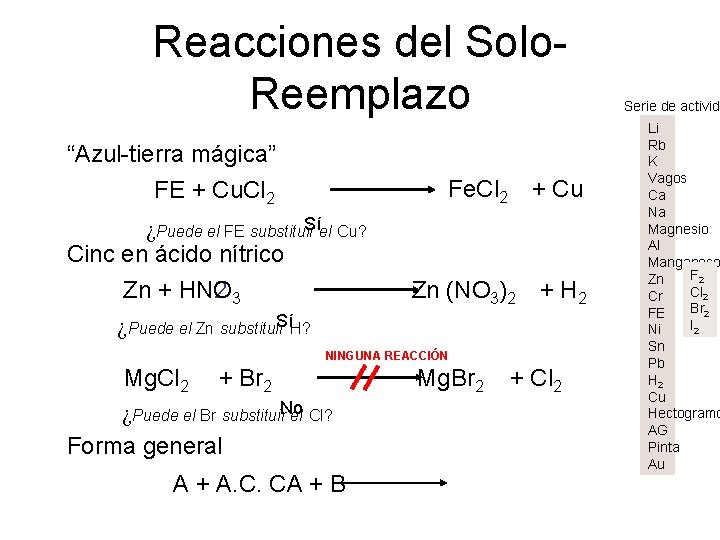
Reacciones del Solo. Reemplazo “Azul-tierra mágica” FE + Cu. Cl Fe. Cl 2 + Cu 2 ¿Puede el FE substituir. Síel Cu? Cinc en ácido nítrico 23 Zn (NO Zn + HNO 3)2 + H 2 ¿Puede el Zn substituir. Sí H? NINGUNA REACCIÓN Mg. Br Mg. Cl 2 + Br 2 2 + Cl 2 ¿Puede el Br substituir. No el Cl? Forma general A + A. C. CA + B Serie de activida Li Rb K Vagos Ca Na Magnesio Al Manganeso F 2 Zn Cl 2 Cr Br 2 FE I 2 Ni Sn Pb H 2 Cu Hectogramo AG Pinta Au

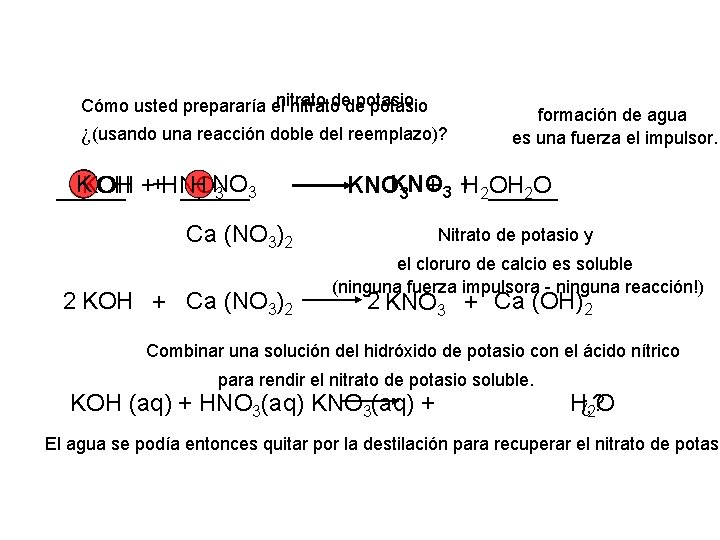
nitrato de potasio Cómo usted prepararía el nitrato de potasio ¿(usando una reacción doble del reemplazo)? formación de agua es una fuerza el impulsor. + _______ + OH 2 O K NO KOH + HNO KNOKNO H OH _______ 3 3 H 2_______ 3 3 + Ca (NO 3)2 2 KOH + Ca (NO 3)2 Nitrato de potasio y el cloruro de calcio es soluble (ninguna fuerza impulsora - ninguna reacción!) 2 KNO 3 + Ca (OH)2 Combinar una solución del hidróxido de potasio con el ácido nítrico para rendir el nitrato de potasio soluble. KOH (aq) + HNO 3(aq) KNO 3(aq) + H¿? 2 O El agua se podía entonces quitar por la destilación para recuperar el nitrato de potasi

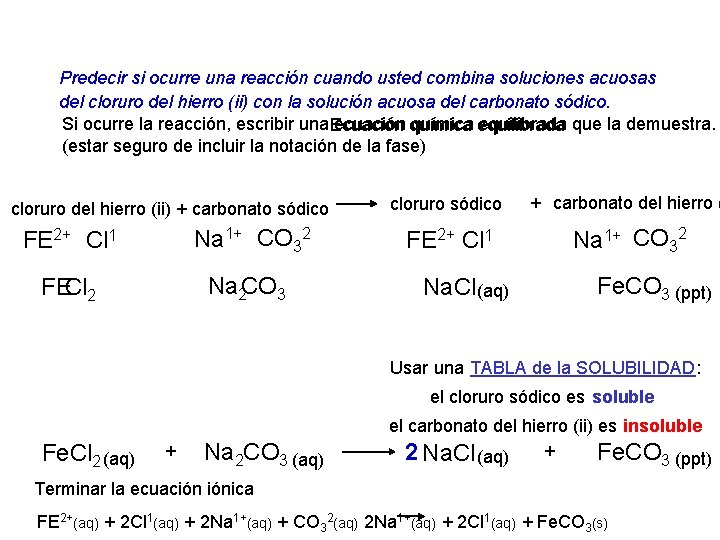
Predecir si ocurre una reacción cuando usted combina soluciones acuosas del cloruro del hierro (ii) con la solución acuosa del carbonato sódico. Si ocurre la reacción, escribir una ecuación química equilibrada que la demuestra. Ecuación química equilibrada (estar seguro de incluir la notación de la fase) cloruro del hierro (ii) + carbonato sódico FE 2+ Cl 1 Na 1+ CO 32 Cl FE 2 CO Na 2 3 cloruro sódico + carbonato del hierro ( FE 2+ Cl 1 Na 1+ CO 32 Na. Cl (aq) Fe. CO 3 (ppt) Usar una TABLA de la SOLUBILIDAD: el cloruro sódico es soluble Fe. Cl 2 (aq) + Na 2 CO 3 (aq) el carbonato del hierro (ii) es insoluble 2 Na. Cl (aq) + Fe. CO 3 (ppt) Terminar la ecuación iónica FE 2+(aq) + 2 Cl 1(aq) + 2 Na 1+(aq) + CO 32(aq) 2 Na 1+(aq) + 2 Cl 1(aq) + Fe. CO 3(s)

Visualización de una reacción química 2 Na + Cl 2 Na. Cl 10 Na del topo del _ 5 Cl del topo del _ 2 2 ¿? 10 Na. Cl del topo del _

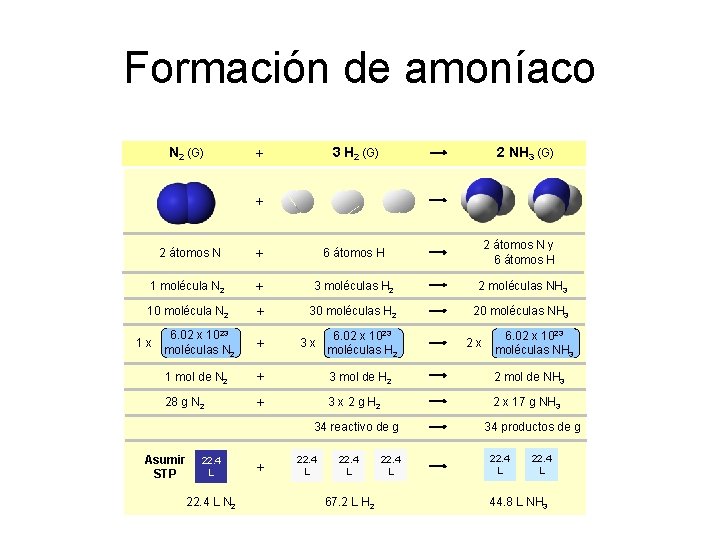
Formación de amoníaco N 2 (G) 3 H 2 (G) + 2 NH 3 (G) + 2 átomos N + 6 átomos H 2 átomos N y 6 átomos H 1 molécula N 2 + 3 moléculas H 2 2 moléculas NH 3 10 molécula N 2 + 30 moléculas H 2 20 moléculas NH 3 1 x 6. 02 x 1023 moléculas N 2 + 1 mol de N 2 + 3 mol de H 2 2 mol de NH 3 28 g N 2 + 3 x 2 g H 2 2 x 17 g NH 3 3 x 6. 02 x 1023 moléculas H 2 34 reactivo de g Asumir STP 22. 4 L N 2 + 22. 4 L 67. 2 L H 2 22. 4 L 2 x 6. 02 x 1023 moléculas NH 3 34 productos de g 22. 4 L 44. 8 L NH 3

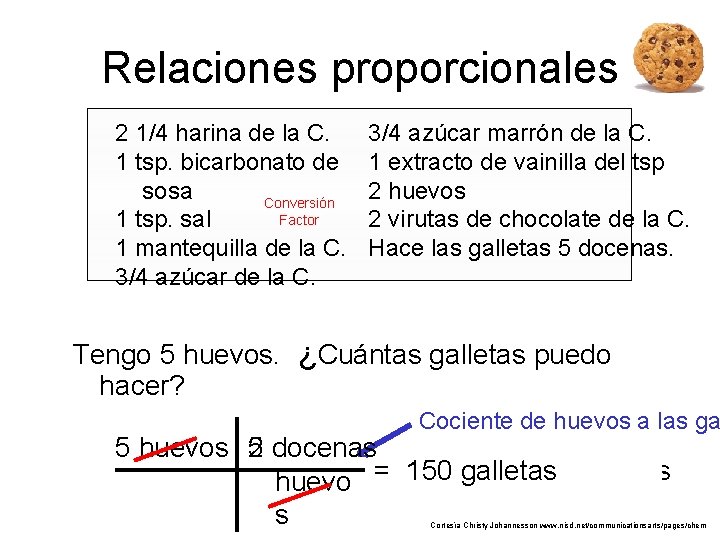
Relaciones proporcionales 2 1/4 harina de la C. 1 tsp. bicarbonato de sosa Conversión Factor 1 tsp. sal 1 mantequilla de la C. 3/4 azúcar de la C. 3/4 azúcar marrón de la C. 1 extracto de vainilla del tsp 2 huevos 2 virutas de chocolate de la C. Hace las galletas 5 docenas. Tengo 5 huevos. ¿Cuántas galletas puedo hacer? Cociente de huevos a las ga 5 docenas 5 huevos 2 150 galletas huevo = galletas 12. 5 docenas s Cortesía Christy Johannesson www. nisd. net/communicationsarts/pages/chem

Relaciones proporcionales • Estequiometría - relaciones totales entre las sustancias en un producto químico reacción - de acuerdo con el cociente de topo • Cociente de topo - indicado por coeficientes en una ecuación equilibrada 2 magnesio + O 2 Mg. O de Cortesía Christy Johannesson www. nisd. net/communicationsarts/pages/chem

Pasos de la estequiometría 1. Escribir una ecuación equilibrada. 2. Identificar sabido y desconocido. 3. Alinearse los factores de conversión. - Cociente de topos del � topos – topos del � topos - Cociente de topo Masa molar - gramos del � topos - Molarity litros soln del � topos - Volumen molar gas de los litros del � topos ¡Paso de la base en todos los problemas d 4. Comprobar la respuesta. Cortesía Christy Johannesson www. nisd. net/communicationsarts/pages/chem

Volumen molar en STP 1 mol de un gas=22. 4 L en STP Temperatura estándar y presión 0°C y 1 atmósfera Cortesía Christy Johannesson www. nisd. net/communicationsarts/pages/chem

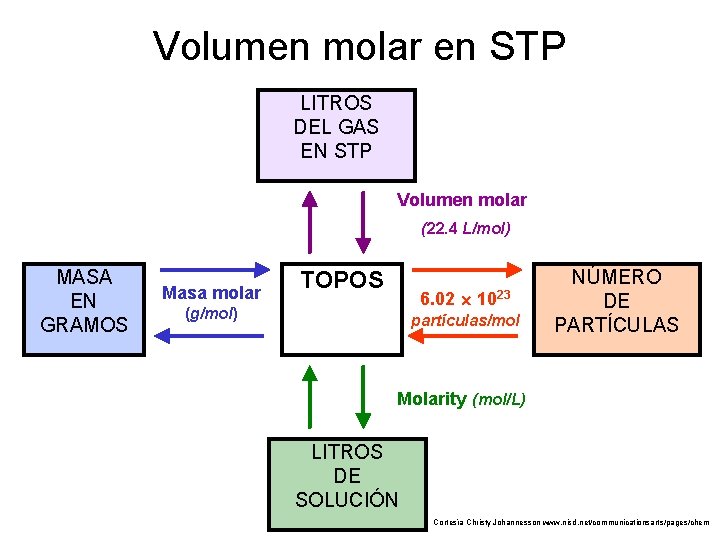
Volumen molar en STP LITROS DEL GAS EN STP Volumen molar (22. 4 L/mol) MASA EN GRAMOS Masa molar TOPOS 6. 02 (g/mol) 1023 partículas/mol NÚMERO DE PARTÍCULAS Molarity (mol/L) LITROS DE SOLUCIÓN Cortesía Christy Johannesson www. nisd. net/communicationsarts/pages/chem

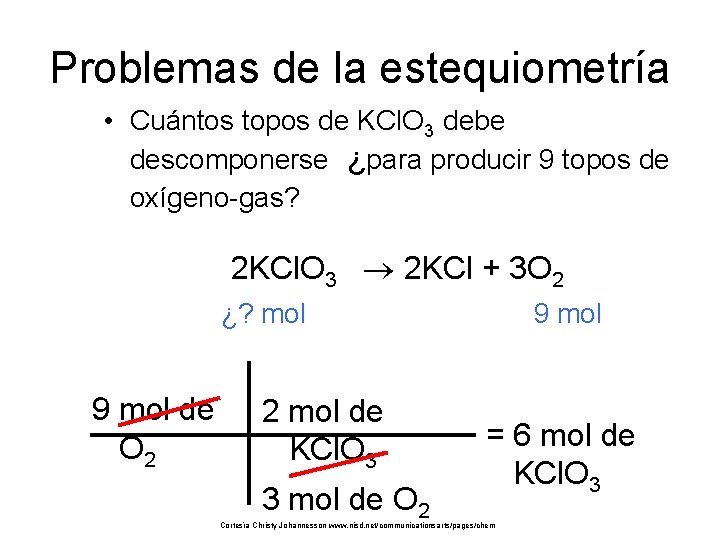
Problemas de la estequiometría • Cuántos topos de KCl. O 3 debe descomponerse ¿para producir 9 topos de oxígeno-gas? 2 KCl. O 3 2 KCl + 3 O 2 ¿? mol 9 mol de O 2 2 mol de KCl. O 3 3 mol de O 2 9 mol = 6 mol de KCl. O 3 Cortesía Christy Johannesson www. nisd. net/communicationsarts/pages/chem

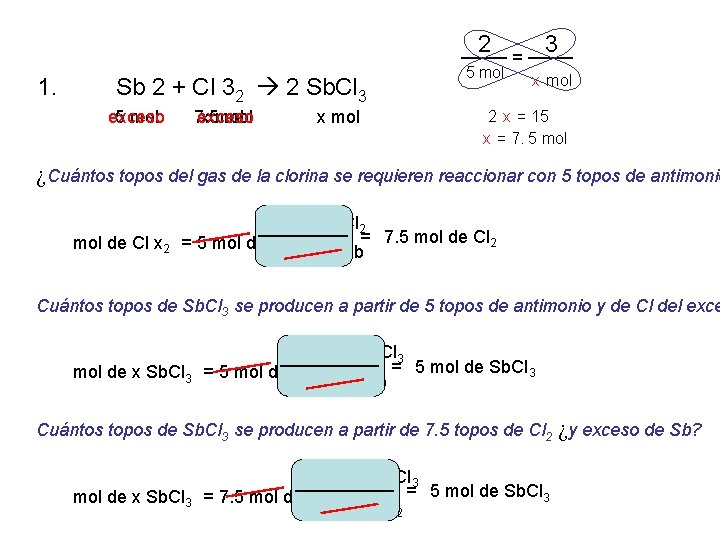
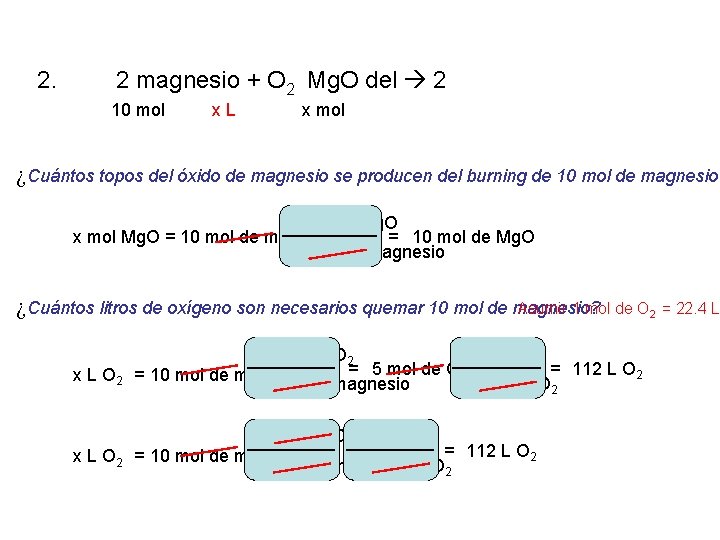
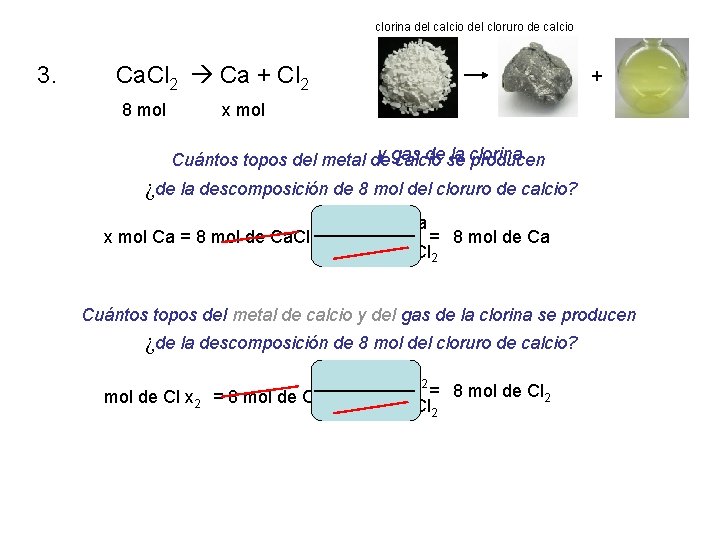
1. Sb 2 + Cl 32 2 Sb. Cl 3 2. 2 magnesio + O 2 Mg. O del 2 Ca. Cl 2 Ca + Cl 2 2 Na. Cl. O 3 2 Na. Cl + 3 O 2 3. 4. 5. 6. 7. FE + 2 Fe. Cl del ácido clorhídrico 2 + H 2 Cu. O + H 2 Cu del + H 2 O Al 2 + 3 H 2 TAN 4 Al del 2(TAN 4)3 + 3 H 2

2 1. Sb 2 + Cl 32 2 Sb. Cl 3 exceso 5 mol 7. 5 mol exceso x mol 5 mol = 3 x mol 2 x = 15 x = 7. 5 mol ¿Cuántos topos del gas de la clorina se requieren reaccionar con 5 topos de antimonio 3 mol de Cl 2 = 7. 5 mol de Cl 2 mol de Cl x 2 = 5 mol de Sb 2 mol de Sb Cuántos topos de Sb. Cl 3 se producen a partir de 5 topos de antimonio y de Cl del exce 2 mol de Sb. Cl 3 = 5 mol de Sb. Cl 3 mol de x Sb. Cl 3 = 5 mol de Sb 2 mol de Sb Cuántos topos de Sb. Cl 3 se producen a partir de 7. 5 topos de Cl 2 ¿y exceso de Sb? 2 mol de Sb. Cl 3 = 5 mol de Sb. Cl 3 mol de x Sb. Cl 3 = 7. 5 mol de Cl 2 3 mol de Cl 2

2. 2 magnesio + O 2 Mg. O del 2 10 mol x L x mol ¿Cuántos topos del óxido de magnesio se producen del burning de 10 mol de magnesio? 2 mol de Mg. O x mol Mg. O = 10 mol de magnesio = 10 mol de Mg. O 2 mol de magnesio ¿Cuántos litros de oxígeno son necesarios quemar 10 mol de magnesio? Asumir 1 mol de O 2 = 22. 4 L 1 mol de O 2 22. 4 L O 2 = 5 mol de O = 112 L O 2 2 x L O 2 = 10 mol de magnesio 2 mol de magnesio 1 mol de O 222. 4 L O 2 = 112 L O 2 x L O 2 = 10 mol de magnesio 2 mol de magnesio 1 mol de O 2

clorina del calcio del cloruro de calcio 3. Ca. Cl 2 Ca + Cl 2 8 mol + x mol y gas de se la clorina Cuántos topos del metal de calcio producen ¿de la descomposición de 8 mol del cloruro de calcio? x mol Ca = 8 mol de Ca. Cl 2 1 mol de Ca = 8 mol de Ca 1 mol de Ca. Cl 2 Cuántos topos del metal de calcio y del gas de la clorina se producen ¿de la descomposición de 8 mol del cloruro de calcio? 1 mol de Cl 2 = 8 mol de Cl 2 mol de Cl x 2 = 8 mol de Ca. Cl 2 1 mol de Ca. Cl 2

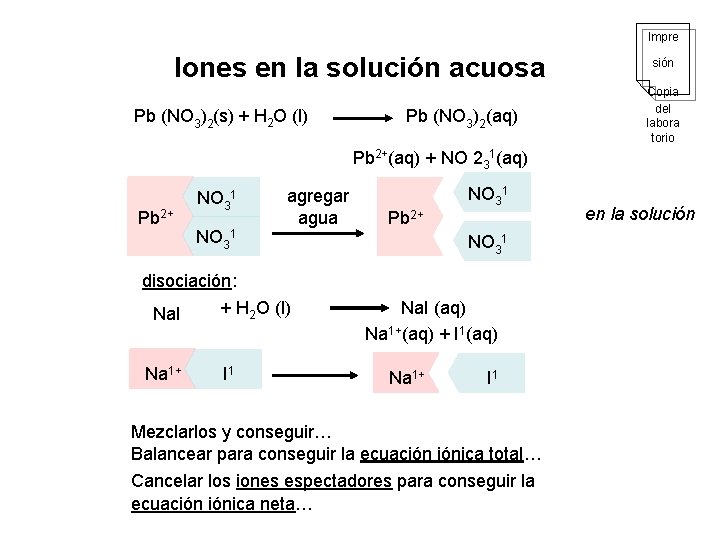
Impre Iones en la solución acuosa Pb (NO 3)2(s) + H 2 O (l) Pb (NO 3)2(aq) Copia sión del labora torio Pb 2+(aq) + NO 231(aq) Pb 2+ NO 31 agregar agua disociación: + H 2 O (l) Na. I Na 1+ I 1 Pb 2+ NO 31 Na. I (aq) Na 1+(aq) + I 1(aq) Na 1+ I 1 Mezclarlos y conseguir… Balancear para conseguir la ecuación iónica total… Cancelar los iones espectadores para conseguir la ecuación iónica neta… en la solución

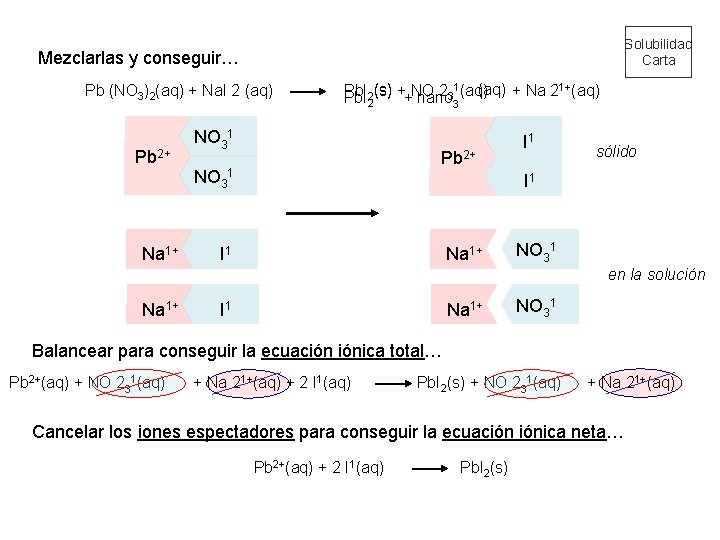
Solubilidad Carta Mezclarlas y conseguir… Pb (NO 3)2(aq) + Na. I 2 (aq) Pb 2+ Na 1+ 1 (aq) + Na 21+(aq) Pb. I 2(s) + NO 2 3 (aq) Pb. I + nano 2 3 NO 31 Pb 2+ NO 31 I 1 Na 1+ I 1 sólido I 1 NO 31 en la solución Na 1+ I 1 Na 1+ NO 31 Balancear para conseguir la ecuación iónica total… Pb 2+(aq) + NO 231(aq) + Na 21+(aq) + 2 I 1(aq) Pb. I 2(s) + NO 231(aq) + Na 21+(aq) Cancelar los iones espectadores para conseguir la ecuación iónica neta… Pb 2+(aq) + 2 I 1(aq) Pb. I 2(s)

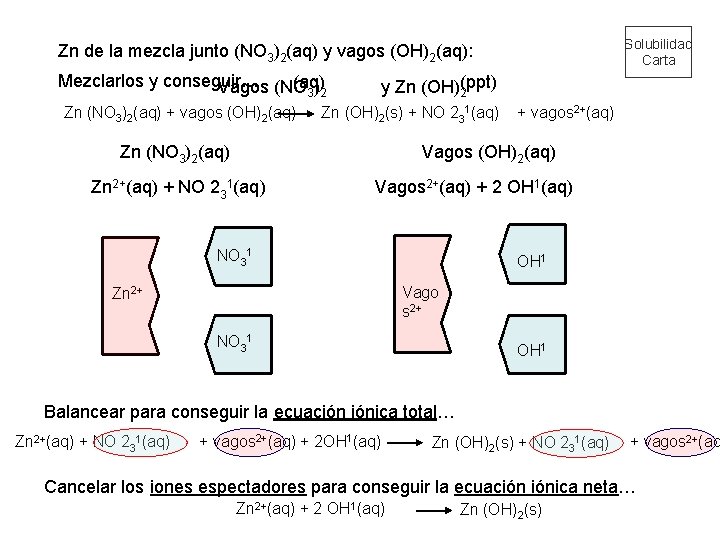
Solubilidad Carta Zn de la mezcla junto (NO 3)2(aq) y vagos (OH)2(aq): Mezclarlos y conseguir… (ppt) (aq) Vagos (NO 3)2 y Zn (OH)2 Zn (NO 3)2(aq) + vagos (OH)2(aq) Zn (OH)2(s) + NO 231(aq) Zn (NO 3)2(aq) + vagos 2+(aq) Vagos (OH)2(aq) Zn 2+(aq) + NO 231(aq) Vagos 2+(aq) + 2 OH 1(aq) OH 1 NO 31 Vago s 2+ Zn 2+ NO 31 OH 1 Balancear para conseguir la ecuación iónica total… Zn 2+(aq) + NO 231(aq) + vagos 2+(aq) + 2 OH 1(aq) Zn (OH)2(s) + NO 231(aq) + vagos 2+(aq Cancelar los iones espectadores para conseguir la ecuación iónica neta… Zn 2+(aq) + 2 OH 1(aq) Zn (OH)2(s)

¿? 2 (NH 4)3 PO 4 + magnesio (OH) 3 + 6 NH 2 magnesio del 3(PO 4 )2 4 OH fosfato del amonio hidróxido de magnesio fosfato del magnesio hidróxido de amonio NH 41+ OH 1 Ahora usted intento… 2 Al. Cl 3 + Li 23 CO 3 Al del 2(CO 3)3 + Cl. Li 6

Identificar los iones espectadores y escribir una ecuación iónica neta cuando un acuoso la solución del sulfato de aluminio se mezcla con el Al 3+ TAN 42 hidróxido de amonio acuoso. NH 41+ OH 1 aluminio amonio sulfato + del hidróxido Al 3+ OH 1 hidróxido de aluminio + NH 41+ TAN 42 sulfato del amonio (ppt) + 3 (NH (aq) Al 2(TAN 4)3(aq) + 6 NH 4 Al del 2 del OH (aq) (OH) 3 4)2 TAN 4 Al 23+(aq) + 3 TAN 42(aq) + 6 NH 41+(aq) + 6 OH 1 Al del 2 (del aq) (OH)3(ppt) + 6 NH 41+(aq) + 3 TAN 42(aq) “iones espectadores” Al 23+(aq) + 6 OH 1 Al del 2 (del aq) (OH)3(ppt) Ecuación iónica neta

Significado de coeficientes Na de 2 átomos 1 Cl de la molécula 2 Na. Cl de 2 moléculas 2 Na + Cl 2 Na. Cl 2 sodio de 2 g+ 1 clorina de g = cloruro sódico de 2 g 2 mol de sodio 1 mol de clorina 2 mol de cloruro sódico (1 mol de Cl 2) x (71 g/mol) (2 mol de Na. Cl) x (58. 5 g/mol) (2 mol de Na) x (23 g/mol) 46 g 71 g 117 g

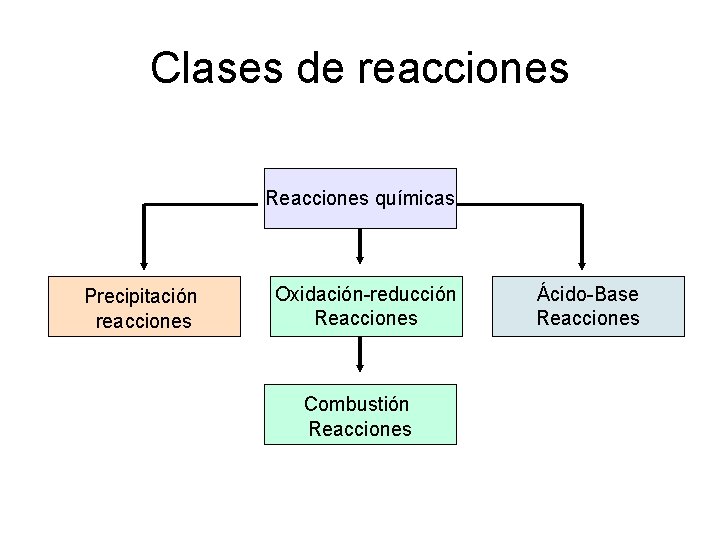
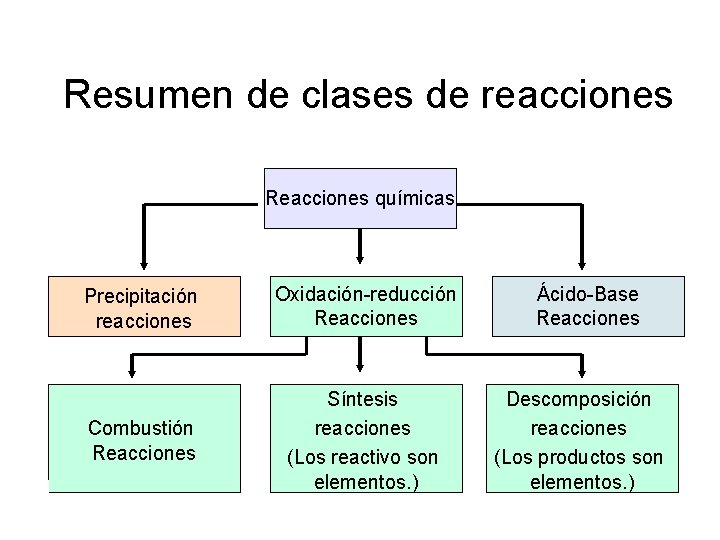
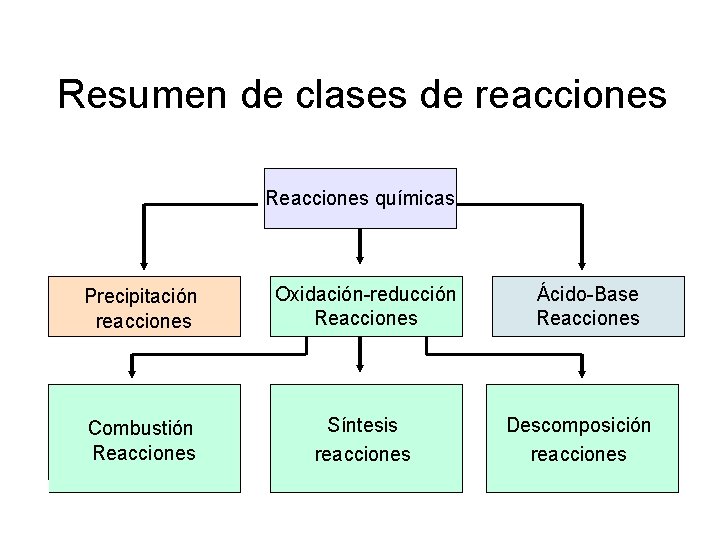
Clases de reacciones Reacciones químicas Precipitación reacciones Oxidación-reducción Reacciones Combustión Reacciones Ácido-Base Reacciones

Resumen de clases de reacciones Reacciones químicas Precipitación reacciones Oxidación-reducción Reacciones Ácido-Base Reacciones Combustión Reacciones Síntesis reacciones (Los reactivo son elementos. ) Descomposición reacciones (Los productos son elementos. )

Resumen de clases de reacciones Reacciones químicas Precipitación reacciones Oxidación-reducción Reacciones Ácido-Base Reacciones Combustión Reacciones Síntesis reacciones Descomposición reacciones

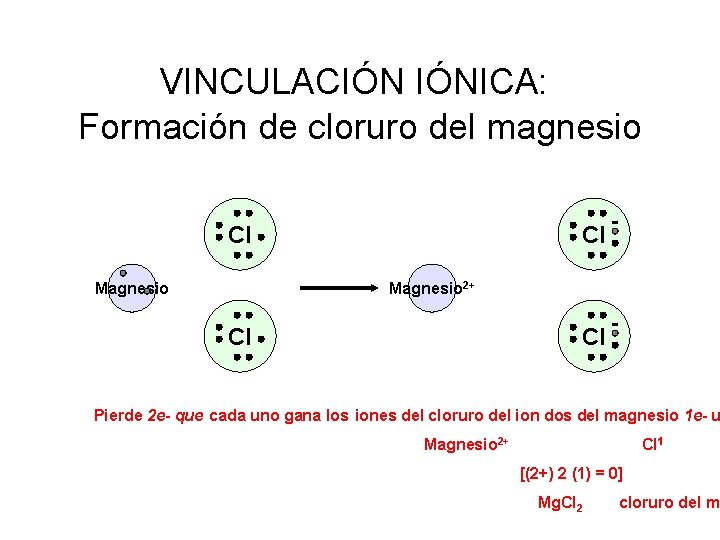
VINCULACIÓN IÓNICA: Formación de cloruro del magnesio Cl Magnesio 2+ Cl Cl Pierde 2 e- que cada uno gana los iones del cloruro del ion dos del magnesio 1 e- u Magnesio 2+ Cl 1 [(2+) 2 (1) = 0] Mg. Cl 2 cloruro del m

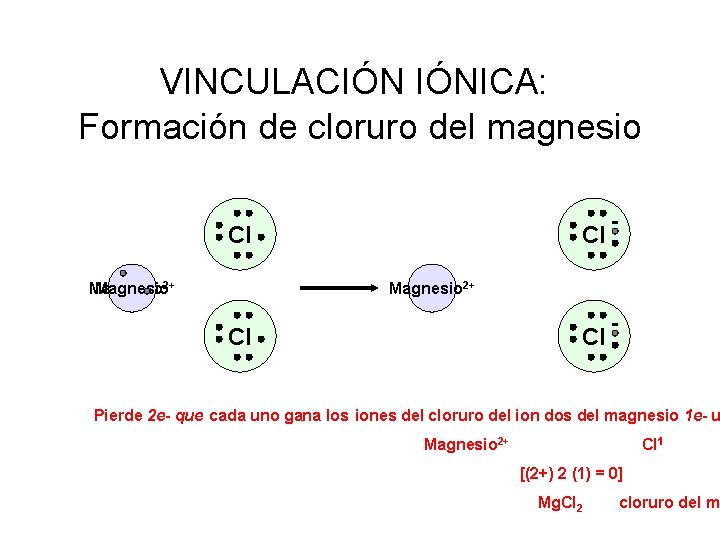
VINCULACIÓN IÓNICA: Formación de cloruro del magnesio Cl Magnesio 2+ Cl Cl Pierde 2 e- que cada uno gana los iones del cloruro del ion dos del magnesio 1 e- u Magnesio 2+ Cl 1 [(2+) 2 (1) = 0] Mg. Cl 2 cloruro del m

Recursos - ecuaciones químicas y reacciones Hoja de trabajo - vocabulario Hoja de trabajo - ecuaciones químicas de equilibrio Hoja de trabajo - ecuaciones de palabra químicas Hoja de trabajo - relaciones cuantitativas en quím. Eqns. Hoja de trabajo - ecuaciones químicas (párrafo) Hoja de trabajo - química de la vida real Hoja de trabajo - ecuaciones de equilibrio (visuales) Hoja de trabajo - Hoja de trabajo Laboratorio - iones en la solución Libro de textos - preguntas Esquema (genera
 Qumicas
Qumicas Unit 10, unit 10 review tests, unit 10 general test
Unit 10, unit 10 review tests, unit 10 general test Http //mbs.meb.gov.tr/ http //www.alantercihleri.com
Http //mbs.meb.gov.tr/ http //www.alantercihleri.com Http //siat.ung.ac.id atau http //pmb.ung.ac.id
Http //siat.ung.ac.id atau http //pmb.ung.ac.id Cuerpo suspendido
Cuerpo suspendido Reacciones químicas
Reacciones químicas Mol reacciones quimicas
Mol reacciones quimicas Ejercicios numero atomico y masico
Ejercicios numero atomico y masico Alcanos reacciones
Alcanos reacciones 5 reacciones endotérmicas
5 reacciones endotérmicas Ejemplos de reacciones irreversibles
Ejemplos de reacciones irreversibles Epoxidacion de alquenos
Epoxidacion de alquenos Alcoholes reacciones quimicas
Alcoholes reacciones quimicas Fisicia
Fisicia Combustion etanol
Combustion etanol Tipos de reacciones quimica
Tipos de reacciones quimica Leyes de las reacciones químicas
Leyes de las reacciones químicas Calculos estequiometrico
Calculos estequiometrico Reacciones de vinculo
Reacciones de vinculo Equilibrios homogéneos
Equilibrios homogéneos Eacciones quimicas
Eacciones quimicas Ciclo abcd
Ciclo abcd Reacciones de neutralización ejemplos
Reacciones de neutralización ejemplos Estado estacionario ejemplos
Estado estacionario ejemplos Serie de actividad de los metales
Serie de actividad de los metales Reaccion de oxidacion
Reaccion de oxidacion Oxido reduccion ejemplos
Oxido reduccion ejemplos Reacciones de los halogenuros de alquilo
Reacciones de los halogenuros de alquilo Teoria de arrhenius
Teoria de arrhenius Reacción ácido-base
Reacción ácido-base Reacciones de neutralización ejemplos
Reacciones de neutralización ejemplos La debilidad de las reacciones
La debilidad de las reacciones Reacciones anodicas y catodicas
Reacciones anodicas y catodicas Reacciones supravitales
Reacciones supravitales Redox os
Redox os Principio de desplazamientos virtuales
Principio de desplazamientos virtuales Hoja amarilla digemid
Hoja amarilla digemid Reacciones adversas a medicamentos antituberculosos
Reacciones adversas a medicamentos antituberculosos Teoría cinético molecular de los gases
Teoría cinético molecular de los gases Tipo de reacciones quimicas
Tipo de reacciones quimicas Reacciones quimicas reversibles
Reacciones quimicas reversibles Clasificacion de reacciones quimicas
Clasificacion de reacciones quimicas Reacciones supravitales
Reacciones supravitales Clasificación de enlace covalente
Clasificación de enlace covalente Reacciones quimicas
Reacciones quimicas Desnaturalizacion del dna
Desnaturalizacion del dna Numero de atomos de los elementos
Numero de atomos de los elementos Cadver
Cadver Qumica
Qumica Reacciones anapleroticas
Reacciones anapleroticas Amina terciaria ejemplos
Amina terciaria ejemplos Tipos de reacciones quimicas
Tipos de reacciones quimicas Electrófilo y nucleófilo
Electrófilo y nucleófilo Reacciones
Reacciones Las reacciones endergónicas son aquellas que
Las reacciones endergónicas son aquellas que Tipos de reacciones químicas ejemplos
Tipos de reacciones químicas ejemplos Ecuaciones químicas sencillas
Ecuaciones químicas sencillas Tabla de potencial redox
Tabla de potencial redox Reacciones de hipersensibilidad
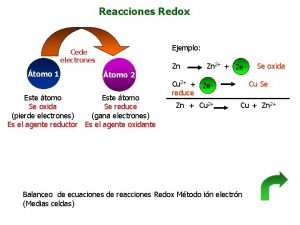
Reacciones de hipersensibilidad Reacciones redox
Reacciones redox Catabolismo de aminoacidos
Catabolismo de aminoacidos Reacciones de adicion electrofilica
Reacciones de adicion electrofilica Mapa conceptual de reacciones endotérmicas y exotérmicas
Mapa conceptual de reacciones endotérmicas y exotérmicas Reacciones contra el proyecto moderno
Reacciones contra el proyecto moderno Ecuacion quimica de sintesis
Ecuacion quimica de sintesis Ecuaciones de una sola variable
Ecuaciones de una sola variable Ecuaciones de primer grado santillana
Ecuaciones de primer grado santillana Ecuaciones diferenciales
Ecuaciones diferenciales Ecuaciones diferenciales homogeneas
Ecuaciones diferenciales homogeneas Objetivo especifico de ecuaciones
Objetivo especifico de ecuaciones Ecuaciones de primer grado
Ecuaciones de primer grado Ecuaciones algebraicas ejemplos
Ecuaciones algebraicas ejemplos Ecuaciones de suma y resta para primaria
Ecuaciones de suma y resta para primaria Sistema compatible indeterminado
Sistema compatible indeterminado Como construir un sistema de ecuaciones
Como construir un sistema de ecuaciones Resuelve gráficamente los sistemas de ecuaciones
Resuelve gráficamente los sistemas de ecuaciones Grafico mrur
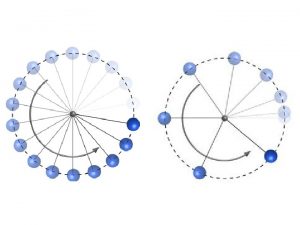
Grafico mrur Movimiento circular uniformemente variado (mcuv)
Movimiento circular uniformemente variado (mcuv) Frases de ecuaciones
Frases de ecuaciones