TEMA 9 1 REACCIONES QUMICAS 2 REACCIONES QUMICAS








































- Slides: 46

TEMA 9 1

REACCIONES QUÍMICAS 2

REACCIONES QUÍMICAS • EJEMPLOS DE CAMBIOS FÍSICOS • EJEMPLOS DE CAMBIOS QUÍMICOS 3

REACCIONES QUÍMICAS • • CAMBIOS FÍSICOS Mezclas Disoluciones Cambios de estado • CAMBIOS QUÍMICOS • Oxidación • Combustión 4

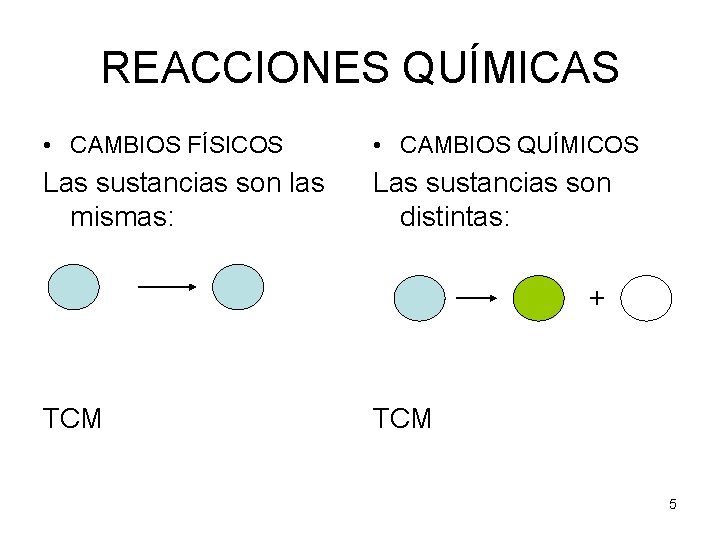
REACCIONES QUÍMICAS • CAMBIOS FÍSICOS • CAMBIOS QUÍMICOS Las sustancias son las mismas: Las sustancias son distintas: + TCM 5

REACCIONES QUÍMICAS • Proceso en el cual unas sustancias se transforman en otras. TCM • Proceso en el cual se rompen los enlaces de las sustancias reaccionantes y se forman los enlaces de los productos de la reacción. TAM 6

REACCIÓN QUÍMICA SEGÚN LA TEORÍA ATÓMICO MOLECULAR • H 2 + O 2 H 2 O • El número de átomos no es el mismo en reactivos que en productos por lo que la reacción será: 7

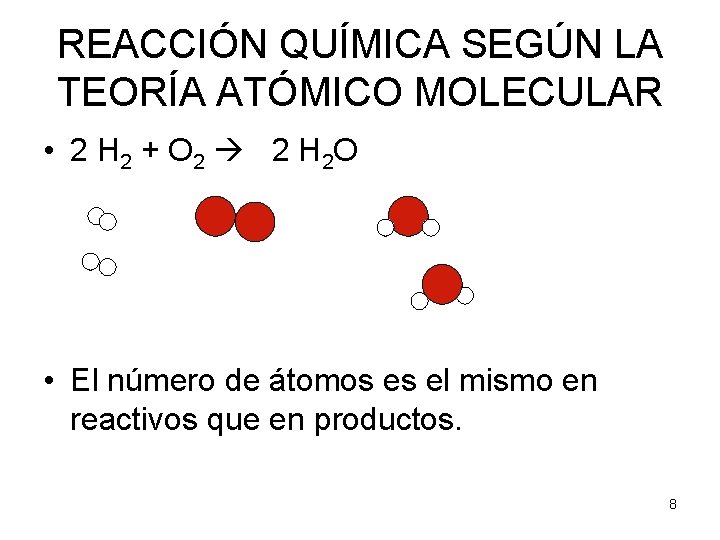
REACCIÓN QUÍMICA SEGÚN LA TEORÍA ATÓMICO MOLECULAR • 2 H 2 + O 2 2 H 2 O • El número de átomos es el mismo en reactivos que en productos. 8

REPRESENTACIÓN DE UNA RECCIÓN QUÍMICA. • ECUACIÓN QUÍMICA: es la representación de una reacción química. • Tiene: – – – Reactivos, reaccionantes, sustancias iniciales Productos, productos de la reacción Estado en el que se encuentran las sustancias Flecha Energía que se pone en juego en la reacción Coeficientes estequiométricos. 9

PRINCIPIO DE CONSERVACIÓN DE LA MASA EN LAS REACCIONES QUÍMICAS • LEY DE LAVOISIER: la masa de los reactivos es igual a la masa de los productos. • JUSTIFICACIÓN: los átomos que hay en los reactivos son los mismos que los que hay en los productos. 10

LEY DE LAVOISIER. EJERCICIOS. Carbono (s) + Oxígeno (g) Dióxido de carbono (g) 12 g 32 g Hidrógeno (g) + Cloro (g) cloruro de hidrógeno (g) 2 g 73 g Carbonato de calcio (s) dióxido de carbono (g) + óxido de calcio (s) 44 g 56 g 11

COEFICIENTES ESTEQUIOMÉTRICOS • Escribe y ajusta las reacciones siguientes: Carbono (s) + Oxígeno (g) Dióxido de carbono (g) Hidrógeno (g) + Cloro (g) cloruro de hidrógeno (g) Carbonato de calcio (s) dióxido de carbono (g) + óxido ce calcio (s) Ajusta las reacciones del ejercicio 18 de la página 229 de tu libro. 12

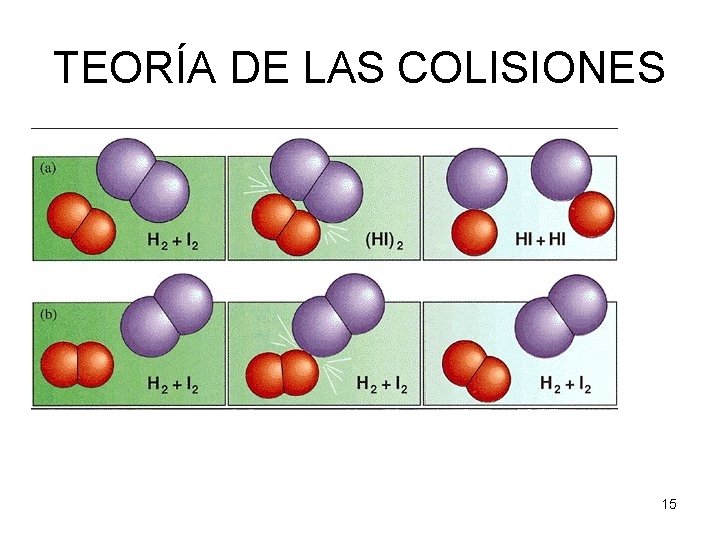
TEORÍA DE LAS COLISIONES • Explica cómo tiene lugar una reacción química. • Para que se rompan los enlaces de las sustancias iniciales se tiene que producir un choque eficaz: – Con la suficiente energía – Con la orientación adecuada • En ese choque se empiezan a romper los enlaces de los reactivos. • Se forma una sustancia intermedia llamada complejo activado. • Se terminan de romper los enlaces de los reactivos y se forman los enlaces de los productos de la reacción. 13

TEORÍA DE LAS COLISIONES 14

TEORÍA DE LAS COLISIONES 15

TEORÍA DE LAS COLISIONES 16

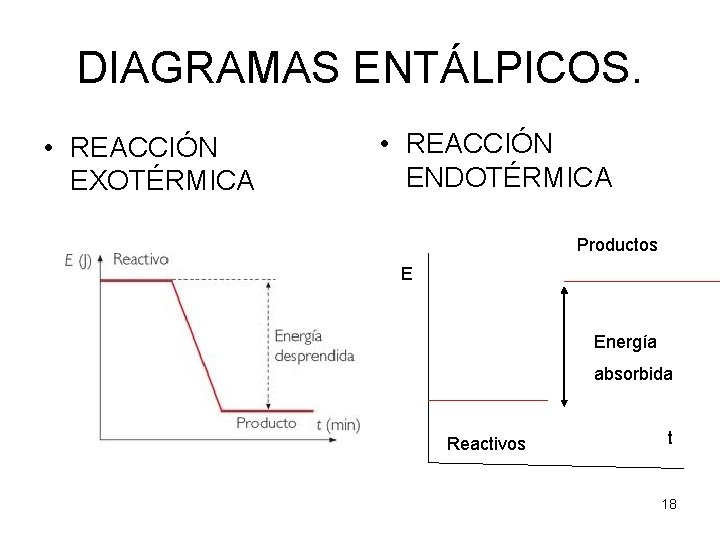
TIPOS DE REACCIONES: SEGÚN LA ENERGÍA QUE SE PONE EN JUEGO. • REACCIONES EXOTÉRMICAS: se desprende energía. • La energía de los productos es menor que la energía de los reactivos. • REACCIONES ENDOTÉRMICAS: se absorbe energía. • La energía de los productos en mayor que la energía de los reactivos. 17

DIAGRAMAS ENTÁLPICOS. • REACCIÓN EXOTÉRMICA • REACCIÓN ENDOTÉRMICA Productos E Energía absorbida Reactivos t 18

DIAGRAMAS ENTÁLPICOS. EJEMPLOS. • REACCIÓN EXOTÉRMICA • Cloro (g) + Hidrógeno (g) cloruro de hidrógeno (g) • REACCIÓN ENDOTÉRMICA • Agua (l) hidrógeno (g) + oxígeno (g) • • ESCRIBIR LA REACCIÓN Y DIBUJAR EL DIAGRAMA ENTÁLPICO 19

VELOCIDAD DE UNA REACCIÓN • Rapidez con la que los reactivos desaparecen. • Depende: – Temperatura – Concentración de los reactivos – Grado de división de los reactivos – Otros (naturaleza de los reactivos, presencia de catalizadores) 20

Temperatura • • + temperatura + velocidad de las partículas + choques + velocidad de la reacción 21

Concentración de los reactivos 22

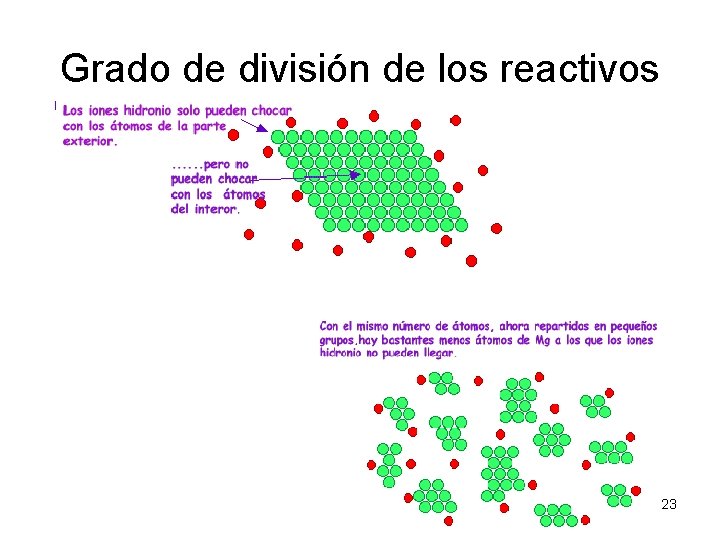
Grado de división de los reactivos 23

CANTIDAD DE SUSTANCIA 24

Cálculo de la masa de un átomo de Na • 11 protones x 1, 672 × 10− 27 kg • 11 electrones x 9, 11× 10 -31 Kg • 12 neutrones x 1, 675× 10− 27 kg • La masa de los átomos es muy pequeña 25

Patrón para determinar masas atómicas • • Patrón: átomo de 12 C Masa del átomo de 12 C = 12 u. Unidad: u o uma Definición: la doceava parte de la masa del 12 C “La masa del átomo de Na es 23 u, significa que es 23 veces mayor que la doceava parte de la masa del 12 C” 26

UNIDAD DE MASA ATÓMICA • Masa atómica: masa de un átomo en u. Está en la T. P. • Masa molecular: masa de una sustancia en u. Se calcula 27

Cantidad de sustancia • Definición: cantidad de átomos, moléculas o sustancia que hay. • Unidad: mol • En 1 mol de sustancia siempre hay el mismo número de partículas (6, 023 10 23 partículas) AVOGADRO. 28

Masa atómica y molecular • Masa atómica: la masa de 1 mol de átomos expresada en g. • M (H)= 1 g/mol; M (Na)= 23 g/mol • Se busca en la Tabla Periódica. • Masa molecular: la masa de 1 mol de moléculas (compuesto en general) expresada en g. • M(H 2 O) 1+ 1+ 16= 18 g/mol • Se calcula. 29

Cantidad de sustancia • 1 átomo de H, 1 u de H, 1 átomo de H • 1 mol de H, 1 g de H, 6, 023 10 23 átomos de H • 1 molécula de H 2, 2 u de H 2, 1 moléculas de H 2 • 1 mol de H 2, 2 g de H 2, 6, 023 10 23 moléculas de H 2 • 1 molécula de H 2 O, 18 u de H 2 O, 1 moléculas de H 2 O • 1 mol de H 2 O, 18 g de H 2 O, 6, 023 10 23 moléculas de H 2 O • EJERCICIOS 1, 2, 3, 4, 5, 22, 23 30

DISOLUCIONES 31

¿Qué es una disolución? • Es una mezcla homogénea, formada por 2 o más sustancias. • Según la TCM 32

Componentes de una disolución • Soluto: el que se encuentra en menor proporción. • Disolvente: el que se encuentra en mayor proporción. • Si uno de los componentes es agua será siempre el disolvente tenga la proporción que tenga. 33

Concentración de una disolución • Cantidad de soluto que hay en relación a la cantidad de disolvente o disolución. 34

Formas de expresar la concentración de una disolución: • % en masa: gramos de soluto en 100 gramos de disolución • % en volumen: m. L (L) de soluto en 100 m. L (L) de disolución • g/L: gramos de soluto en 1 L de disolución • M (molaridad): cantidad de sustancia de soluto (en moles) en 1 L de disolución M= n/V 35

Ejercicios de disoluciones: • Ejercicios del libro: 6, 7, 8, 27, 28, 29, 30 36

CÁLCULOS EN LAS REACCIONES QUÍMICAS 37

Ejercicios con reacciones químicas: 9, 10, 11, 12 38

TIPOS DE REACCIONES OXIDACIÓN COMBUSTIÓN ÁCIDO BASE 39

OXIDACIÓN • Fe + O 2 óxido de hierro (II) • Hierro + sulfato de cobre (II) sulfato de hierro (II) + cobre El hierro se oxida de hierro metálico a hierro con valencia 2. 40

COMBUSTIÓN • Reacción con el oxígeno. Da dióxido de carbono y agua. • Son reacciones exotérmicas • Ejemplos: • Metano (g) + O 2 (g) • Butano (g) + O 2 (g) • Gasolina (g) + O 2 (g) 41

ÁCIDO BASE • ÁCIDO: • Sabor agrio • Disuelven algunos metales desprendiendo hidrógeno • Disuelven el mármol desprendiendo CO 2 • Ej: ácido cítrico, ácido acético • BASE • Sabor amargo • Favorece la disolución de las grasas, productos de limpieza • Ej: amoniaco, hidróxido de sodio, “bicarbonato” 42

ÁCIDO BASE • EJEMPLOS DE ÁCIDOS • HCl: digestión • H 2 SO 4: materia prima industrial, responsable de la lluvia ácida • HNO 3: fabricar explosivos, responsable de la lluvia ácida • EJEMPLOS DE BASES • NH 3: productos de limpieza, fertilizantes • Na. OH: productos químicos, jabón, desatascar cañerías • Na. HCO 3: contrarresta la acidez de estómago, levadura de panadería. 43

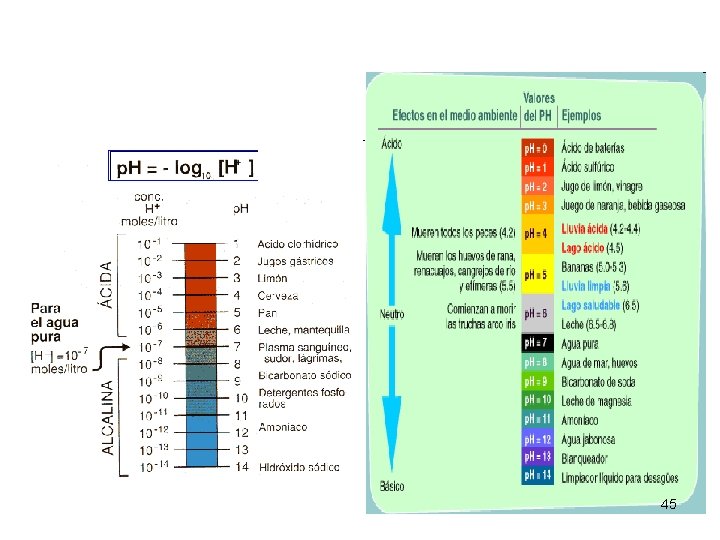
ÁCIDO BASE • La acidez se determina con el p. H • ÁCIDOS: p. H< 7 • BASE: p. H>7 44

45

REACCIÓN DE NEUTRALIZACIÓN • • ÁCIDO + BASE SAL + AGUA Reacciones exotérmicas Ejemplos: Ácido clorhídrico + hidróxido de sodio cloruro de sodio + agua • Ácido sulfúrico + hidróxido de calcio sulfato de calcio + agua 46
 Qumicas
Qumicas Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama Tema general y tema delimitado ejemplos
Tema general y tema delimitado ejemplos El tema y sub tema
El tema y sub tema Estructura de la entrevista
Estructura de la entrevista Konstruksifisme
Konstruksifisme Examen externo autopsia
Examen externo autopsia Mol reacciones quimicas
Mol reacciones quimicas Hoja amarilla digemid
Hoja amarilla digemid Doble sustitución ejemplos
Doble sustitución ejemplos Qumica
Qumica Reacciones de adicion electrofilica
Reacciones de adicion electrofilica Eacciones quimicas
Eacciones quimicas Reaccion de descomposicion
Reaccion de descomposicion Que es una reaccion irreversible
Que es una reaccion irreversible Reacciones quimicas de la glucosa
Reacciones quimicas de la glucosa Reacciones quimicas
Reacciones quimicas Teoría de colisiones
Teoría de colisiones Reacciones redox 2 bachillerato
Reacciones redox 2 bachillerato Reacciones de neutralización ejemplos
Reacciones de neutralización ejemplos Reacciones de hipersensibilidad
Reacciones de hipersensibilidad Pureza reacciones quimicas
Pureza reacciones quimicas Reacción química ejemplos
Reacción química ejemplos Representacion del fluor
Representacion del fluor Reacciones de orden cero
Reacciones de orden cero Teoria cinetica molecular
Teoria cinetica molecular La debilidad de las reacciones
La debilidad de las reacciones Desforilacion
Desforilacion Mapa conceptual de reacciones endotérmicas y exotérmicas
Mapa conceptual de reacciones endotérmicas y exotérmicas Reacción
Reacción Ruptura homolítica ejemplos
Ruptura homolítica ejemplos Epoxidacion de alquenos
Epoxidacion de alquenos Estructura primaria
Estructura primaria Apoyo fijo movil y empotrado
Apoyo fijo movil y empotrado Reacciones supravitales
Reacciones supravitales Trabajo virtual estructuras
Trabajo virtual estructuras Reacciones de neutralización ejemplos
Reacciones de neutralización ejemplos Reacciones redox mapa conceptual
Reacciones redox mapa conceptual Reacciones redox
Reacciones redox Reacciones de vinculo
Reacciones de vinculo Precipitacion reaccion quimica
Precipitacion reaccion quimica Radicales alquilo
Radicales alquilo Reacciones anapleroticas
Reacciones anapleroticas Tipo de reacciones quimicas
Tipo de reacciones quimicas Reacciones anodicas y catodicas
Reacciones anodicas y catodicas 360
360 Reacciones contra el proyecto moderno
Reacciones contra el proyecto moderno

































































