TEMA 4 LA MATERIA SE TRANSFORMA 1 TEORA
















- Slides: 24

TEMA 4 LA MATERIA SE TRANSFORMA

1. TEORÍA ATÓMICA DE LA MATERIA. El primero en utilizar el término de átomo fue Demócrito (filósofo griego, del año 500 a. de C. ), porque creía que los elementos estaban formados por pequeñas partículas indivisibles. De hecho, etimológicamente, la palabra "átomo" significa "indivisible" en griego.

2. MODELO ATÓMICO DE DALTON (1803). En 1803, Dalton demostró lo siguiente: La materia está formada por partículas indivisibles, indestructibles y extremadamente pequeñas, llamadas átomos. Los átomos de un mismo elemento son idénticos entre sí (igual masa y propiedades). Los átomos de elementos distintos tienen diferente masa y propiedades. Los compuestos están formados por la unión de átomos en proporciones constantes y simples.

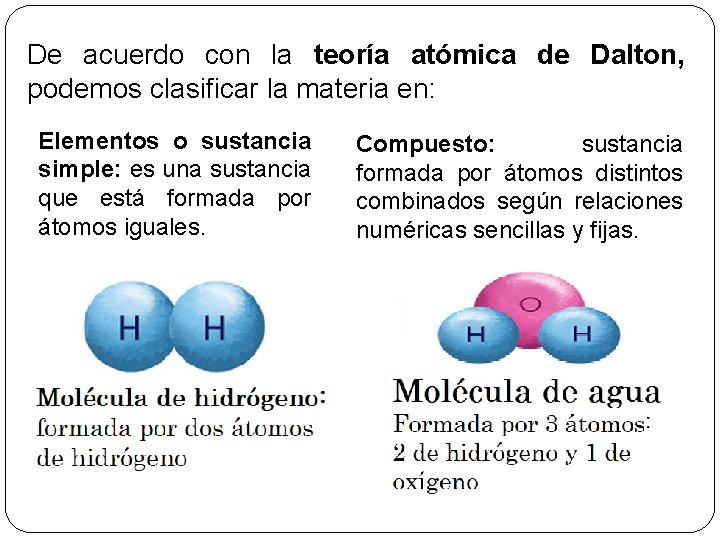
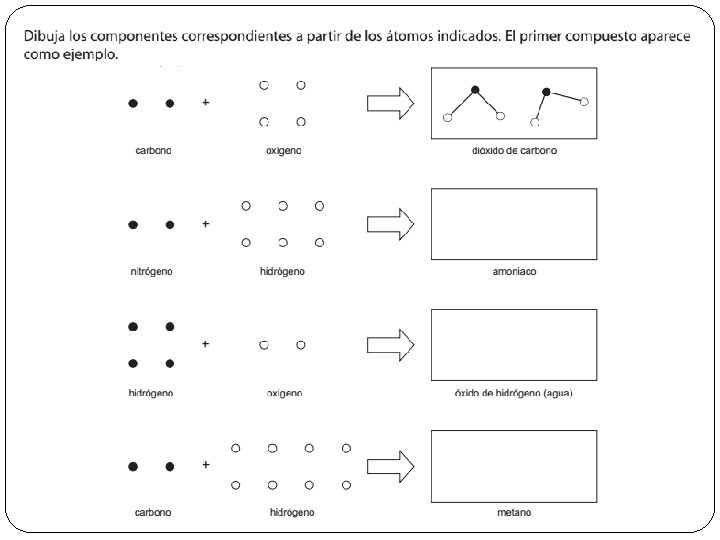
De acuerdo con la teoría atómica de Dalton, podemos clasificar la materia en: Elementos o sustancia simple: es una sustancia que está formada por átomos iguales. Compuesto: sustancia formada por átomos distintos combinados según relaciones numéricas sencillas y fijas.

Clasifica las siguientes sustancias puras en elementos y compuestos: Agua H 2 O Amoníaco NH 4 Hierro Fe Cloruro de sodio Plata Ag Oxígeno O 2 Na. Cl Dióxido de carbono CO 2 Cloro Cl

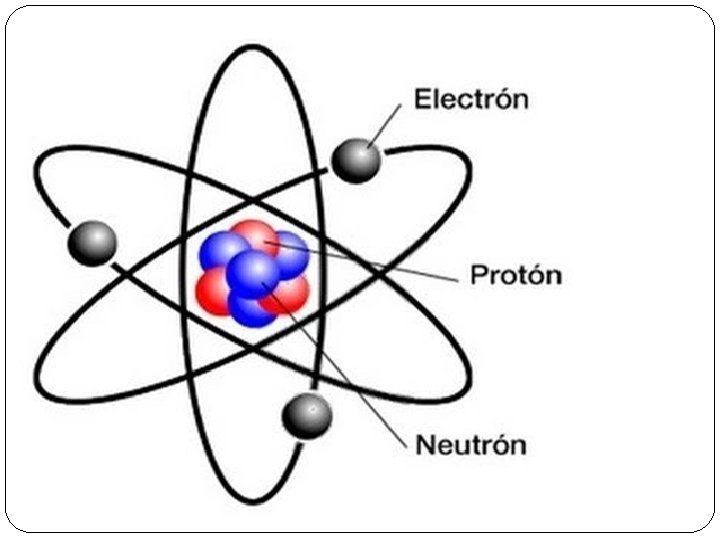
3. PARTES DEL ÁTOMO. Aunque la palabra átomo deriva del griego átomos, que significa ‘indivisible’, los átomos están formados por partículas aún más pequeñas, las partículas subatómicas. En general, los átomos están compuestos por tres tipos de partículas subatómicas: • Electrones, tienen carga negativa y se encuentran en la corteza del átomo. • Protones, tienen carga positiva y se encuentran en el núcleo. • Neutrones, no tienen carga eléctrica y también se


4. PROPIEDADES DEL ÁTOMO. Número atómico, se representa con la letra Z, indica la cantidad de protones que presenta un átomo, que es igual a la de electrones. Número másico, se representa con la letra A, y hace referencia a la suma

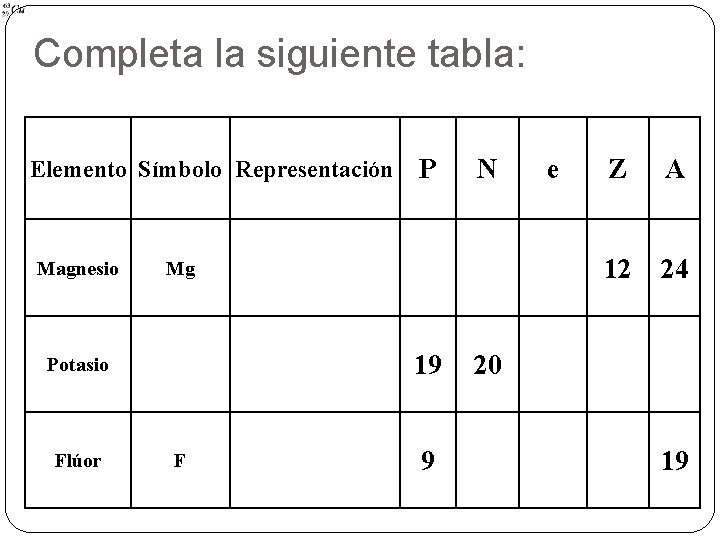
Completa la siguiente tabla: Elemento Símbolo Representación Magnesio N Mg 19 Potasio Flúor P F 9 e Z A 12 24 20 19

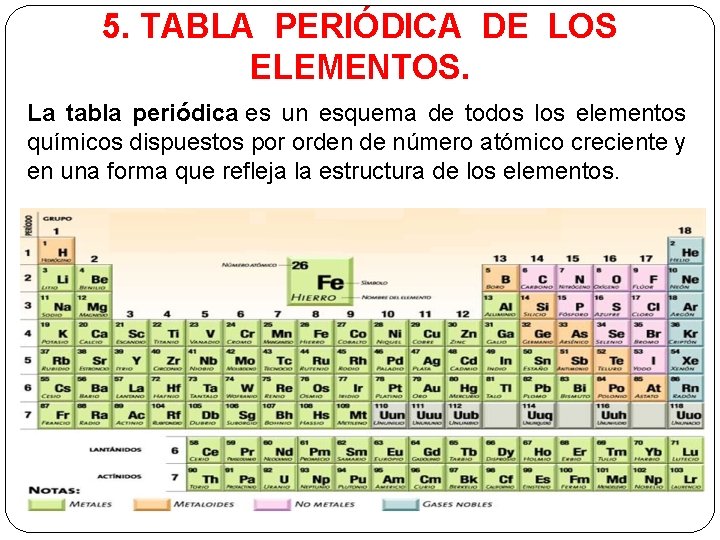
5. TABLA PERIÓDICA DE LOS ELEMENTOS. La tabla periódica es un esquema de todos los elementos químicos dispuestos por orden de número atómico creciente y en una forma que refleja la estructura de los elementos.





Deduce el número atómico y el número másico de un elemento que tiene 17 protones y 20 neutrones. ¿Cuál es su símbolo? Un átomo tiene 34 protones y 45 neutrones. Calcula su número atómico y su número másico. ¿Cómo representarías este átomo si es de Selenio? El número atómico de un átomo de cloro es 17 y su número másico 37. ¿Cuántos protones, neutrones y electrones tiene? ¿Cómo representarías este átomo? Si el átomo de calcio (Ca) tiene Z = 20 y A = 40, ¿cuántos protones, neutrones y electrones tiene? El número atómico de un átomo es 11 y el número másico es 23. ¿Cuántos neutrones y protones hay en su núcleo? ¿Cuántos electrones hay en su corteza? El átomo de carbono esta formado por 6 protones y 6 electrones. ¿Qué otra partícula se necesita para explicar

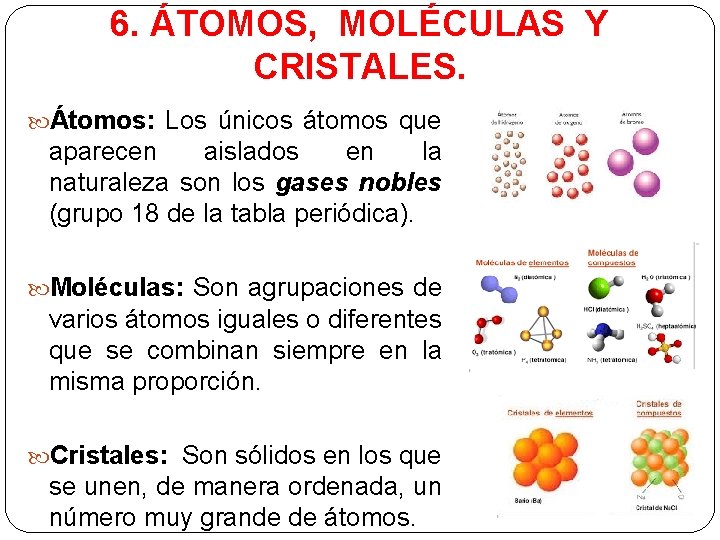
6. ÁTOMOS, MOLÉCULAS Y CRISTALES. Átomos: Los únicos átomos que aparecen aislados en la naturaleza son los gases nobles (grupo 18 de la tabla periódica). Moléculas: Son agrupaciones de varios átomos iguales o diferentes que se combinan siempre en la misma proporción. Cristales: Son sólidos en los que se unen, de manera ordenada, un número muy grande de átomos.

7. CAMBIOS FÍSICOS Y QUÍMICOS. En la naturaleza se producen continuamente cambios o transformaciones, que se podrían clasificar en dos tipos: Cambios físicos: Son todos aquellos en los que ninguna sustancia se transforma en otra diferente. Por ejemplo, cuando una sustancia se mueve, se le aplica una fuerza o se deforma. Cambios químicos: Son aquellos en los que unas sustancias se transforman en otras diferentes, con naturaleza y propiedades distintas. Por ejemplo,

Indica si los siguientes procesos o cambios en la materia son físicos o químicos.

8. LAS REACCIONES QUÍMICAS. Los cambios químicos reciben el nombre general de reacciones químicas. Una reacción química es un proceso en el que, a partir de unas sustancias iniciales, denominadas reactivos, se forman otras nuevas llamadas productos. Podríamos decir entonces que una reacción química consiste en una reorganización de átomos. Por tanto, los átomos que forman los productos son los mismos que formaban los reactivos. Por ejemplo, cuando quemamos gas natural en la cocina, los reactivos son el metano y el oxígeno, y los productos son dióxido de carbono y vapor de agua.

Las reacciones químicas suceden de forma natural en la vida diaria. Algunos ejemplos son: Fotosíntesis: Oxidación de los metales: Combustibles:


Ajuste de reacciones químicas Tomemos como ejemplo la reacción de oxidación del hierro. Vemos que no coinciden los átomos de reactivos y los de los productos.

Ajusta las ecuaciones químicas.

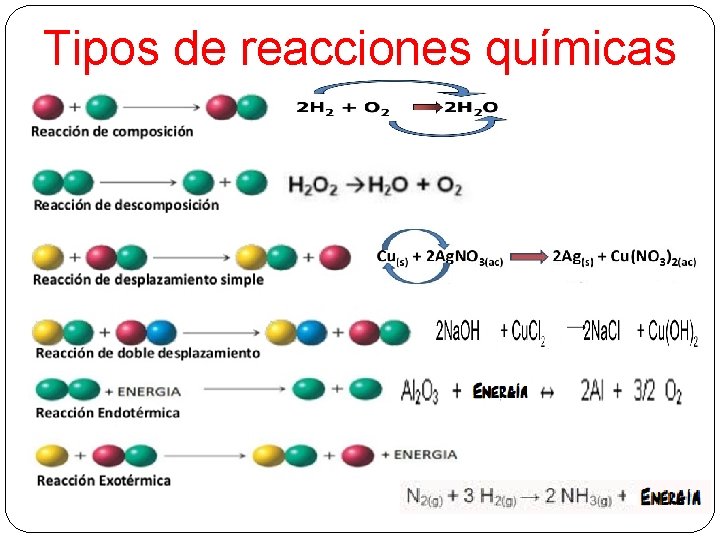
Tipos de reacciones químicas