NDICE REACCIONES QUMICAS NDICE REACCIONES QUMICAS v Transformaciones

































- Slides: 43

ÍNDICE REACCIONES QUÍMICAS

ÍNDICE REACCIONES QUÍMICAS v Transformaciones físicas y químicas v Reacción química v Ecuación química v Teoría de las reacciones químicas v Velocidad de las reacciones químicas v Energía de las reacciones químicas v Carácter cuantitativo de las reacciones químicas v Tipos de reacciones químicas v Vídeos v Ejercicios v. Apéndice: Materiales premiados CNICE páginas Web “Reacciones Químicas”

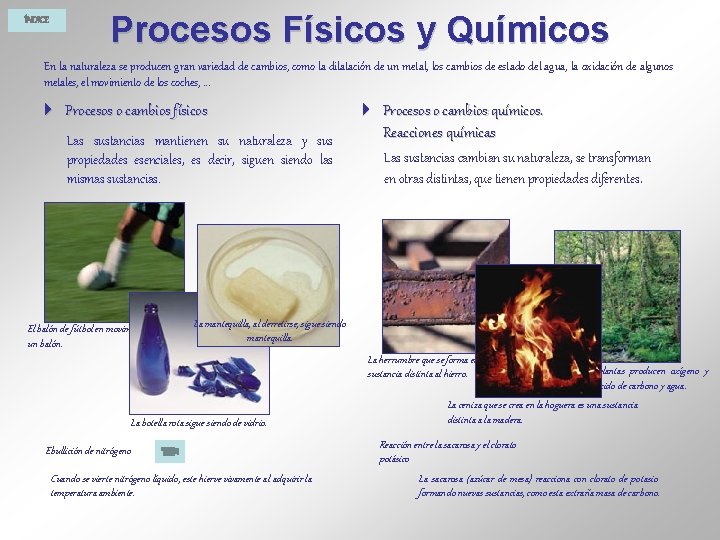
ÍNDICE Procesos Físicos y Químicos En la naturaleza se producen gran variedad de cambios, como la dilatación de un metal, los cambios de estado del agua, la oxidación de algunos metales, el movimiento de los coches, . . . 4 Procesos o cambios físicos Las sustancias mantienen su naturaleza y sus propiedades esenciales, es decir, siguen siendo las mismas sustancias. 4 Procesos o cambios químicos. Reacciones químicas Las sustancias cambian su naturaleza, se transforman en otras distintas, que tienen propiedades diferentes. El balón de fútbol en movimiento sigue siendo. La mantequilla, al derretirse, sigue siendo mantequilla. un balón. La herrumbre que se forma en la viga es una En la fotosíntesis, las plantas producen oxígeno y sustancia distinta al hierro. nutrientes a partir de dióxido de carbono y agua. La botella rota sigue siendo de vidrio. Ebullición de nitrógeno Cuando se vierte nitrógeno líquido, este hierve vivamente al adquirir la temperatura ambiente. La ceniza que se crea en la hoguera es una sustancia distinta a la madera. Reacción entre la sacarosa y el clorato potásico La sacarosa (azúcar de mesa) reacciona con clorato de potasio formando nuevas sustancias, como esta extraña masa de carbono.

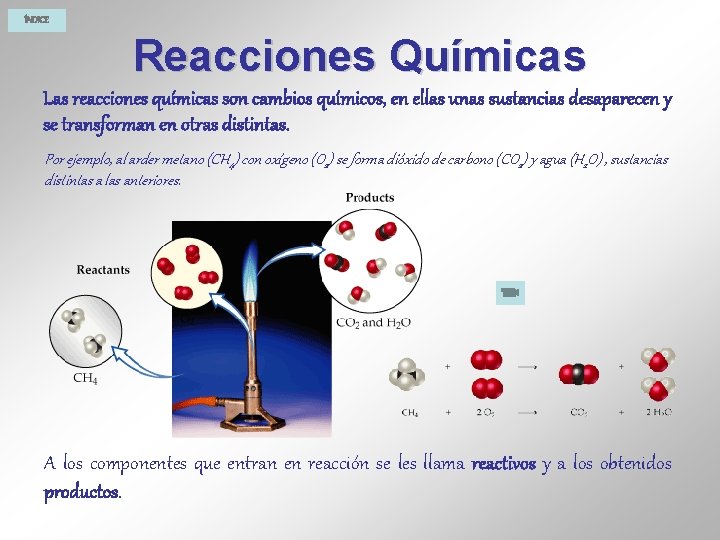
ÍNDICE Reacciones Químicas Las reacciones químicas son cambios químicos, en ellas unas sustancias desaparecen y se transforman en otras distintas. Por ejemplo, al arder metano (CH 4) con oxígeno (O 2) se forma dióxido de carbono (CO 2) y agua (H 2 O) , sustancias distintas a las anteriores. A los componentes que entran en reacción se les llama reactivos y a los obtenidos productos.

ÍNDICE Ecuaciones Químicas Una ecuación química es la representación escrita y abreviada de una reacción química. § A la izquierda se escriben las fórmulas de los reactivos (sustancias reaccionantes) § A la derecha se escriben las fórmulas de los productos (sustancias resultantes) § Separadas por una flecha. También pueden contener información sobre el estado físico de las sustancias y sobre las condiciones de la reacción. Ejemplo: Descomposición carbonato de calcio Ca. CO 3 (s) Δ Ca. O (s)+ CO 2 (g)

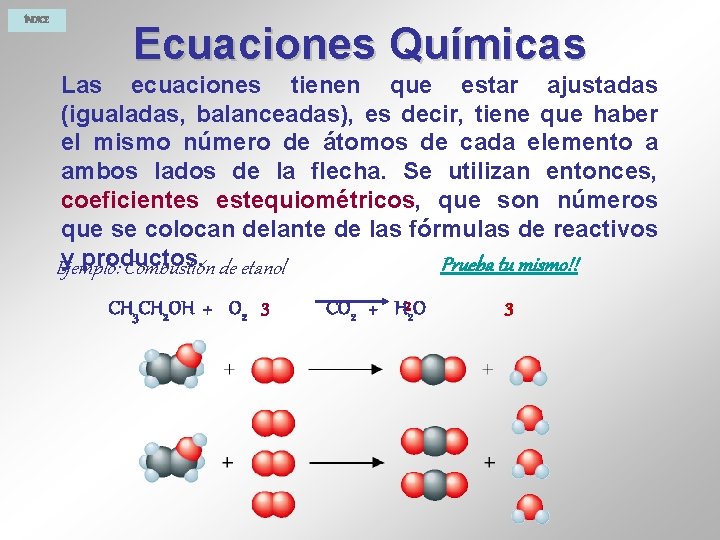
ÍNDICE Ecuaciones Químicas Las ecuaciones tienen que estar ajustadas (igualadas, balanceadas), es decir, tiene que haber el mismo número de átomos de cada elemento a ambos lados de la flecha. Se utilizan entonces, coeficientes estequiométricos, que son números que se colocan delante de las fórmulas de reactivos y productos. Prueba tu mismo!! Ejemplo: Combustión de etanol CH 3 CH 2 OH + O 2 3 CO 2 + H 22 O 3

ÍNDICE Ecuaciones Químicas Ejemplo: Combustión de trietilenglicol Ecuación Química: C 6 H 14 O 4 + O 152 → CO 2 +6 H 2 O 7 2 1. Ajustar C. 2. Ajustar H. 3. Ajustar O. 4. Multiplicar por dos 2 C 6 H 14 O 4 + 15 O 2 → 12 CO 2 + 14 H 2 O Comprobar todos los elementos.

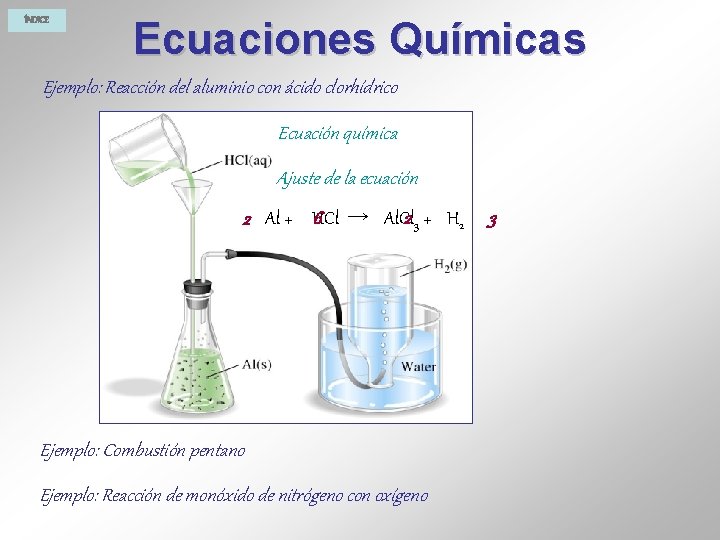
ÍNDICE Ecuaciones Químicas Ejemplo: Reacción del aluminio con ácido clorhídrico Ecuación química Ajuste de la ecuación 6 → Al. Cl 2 3 + H 2 2 Al + HCl Ejemplo: Combustión pentano Ejemplo: Reacción de monóxido de nitrógeno con oxígeno 3

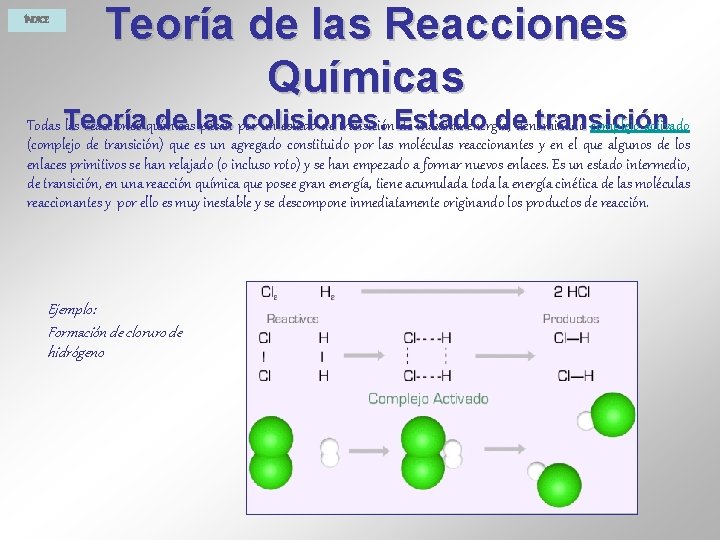
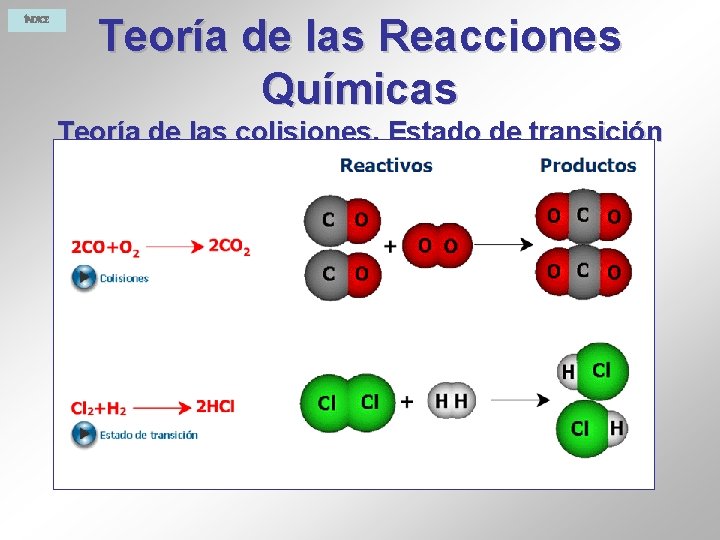
ÍNDICE Teoría de las Reacciones Químicas Teoría de las colisiones. Estado de transición Una reacción química supone la ruptura de ciertos enlaces de las moléculas de reactivos y la formación de otros nuevos, para dar lugar a las moléculas de productos. Ejemplo: Formación de cloruro de sodio Cuando se introduce un trozo de sodio caliente en el interior de un frasco que contiene gas cloro, se produce una violenta reacción en la que se forma una sustancia nueva, el cloruro de sodio. Esta reacción se puede expresar así:

ÍNDICE 2 Na + Cl 2 2 Na Cl

ÍNDICE Teoría de las Reacciones Químicas de las colisiones. dedenominado transición Todas Teoría las reacciones químicas pasan por un estado de transición. Estado de máxima energía, complejo activado (complejo de transición) que es un agregado constituido por las moléculas reaccionantes y en el que algunos de los enlaces primitivos se han relajado (o incluso roto) y se han empezado a formar nuevos enlaces. Es un estado intermedio, de transición, en una reacción química que posee gran energía, tiene acumulada toda la energía cinética de las moléculas reaccionantes y por ello es muy inestable y se descompone inmediatamente originando los productos de reacción. Ejemplo: Formación de cloruro de hidrógeno

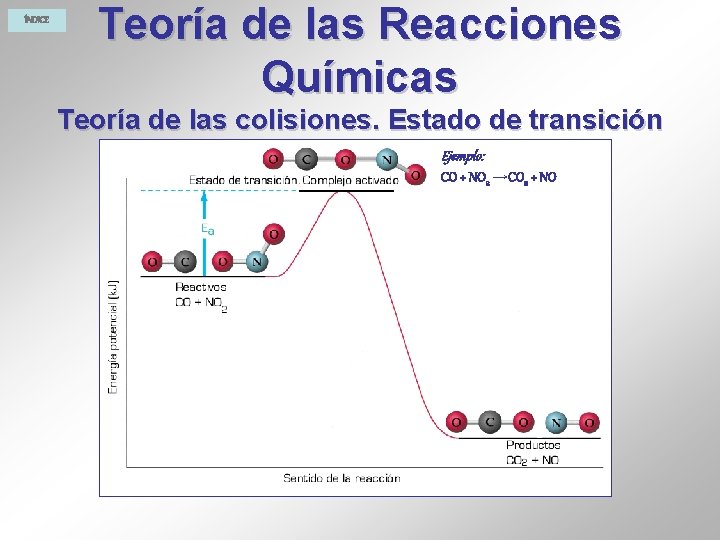
ÍNDICE Teoría de las Reacciones Químicas Teoría de las colisiones. Estado de transición Ejemplo: CO + NO 2 →CO 2 + NO

ÍNDICE Teoría de las Reacciones Químicas Teoría de las colisiones. Estado de transición

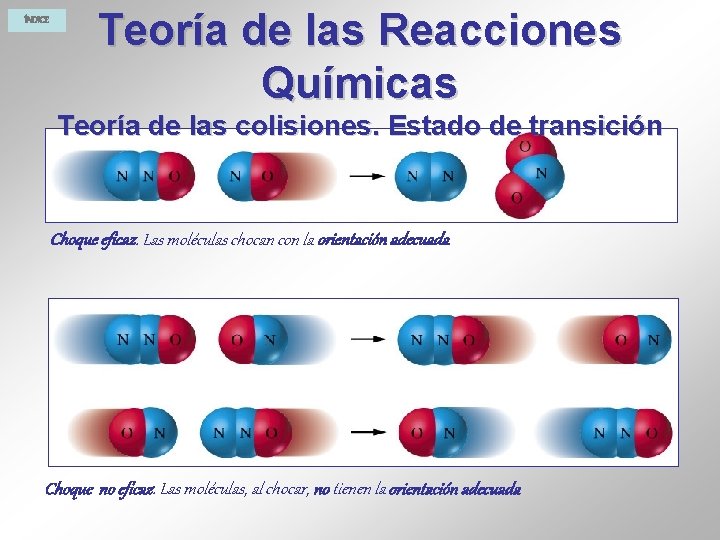
ÍNDICE Teoría de las Reacciones Químicas Teoría de activado, las colisiones. Estado de transición Para que se forme el complejo es necesario que las moléculas choquen. Pero puede ocurrir que dos moléculas choquen entre sí y no se produzca reacción alguna, entonces se dice que el choque no es eficaz o efectivo. Para que un choque entre moléculas sea eficaz o efectivo es necesario que cumpla dos condiciones: § Que las moléculas tengan energía cinética suficiente para romper o debilitar adecuadamente sus enlaces, es decir, para poder formar el complejo activado. Estas moléculas se llaman activadas. La energía cinética de las moléculas, aumenta al hacerlo la temperatura. Se denomina energía de activación a la energía que necesitan los reactivos para que puedan formar el complejo activado, es decir para que la reacción se produzca. Es la diferencia entre la energía del complejo activado y la suma de las entalpías de los reactivos. § Que las moléculas al chocar lo hagan con la orientación adecuada para que se puedan romper los enlaces moleculares. Cuando se cumplen estas condiciones se verifica la reacción entre las moléculas.

ÍNDICE Teoría de las Reacciones Químicas Teoría de las colisiones. Estado de transición Choque eficaz. Las moléculas chocan con la orientación adecuada Choque no eficaz. Las moléculas, al chocar, no tienen la orientación adecuada

ÍNDICE Teoría de las Reacciones Químicas Teoría de las colisiones. Estado de transición

ÍNDICE Carácter cuantitativo de las Reacciones Químicas Ley de conservación de la masa. Ley de Lavoisier (1743 -1794) En toda reacción química la masa total de las sustancias que reaccionan (reactivos) es igual a la masa total de las sustancias que se obtienen (productos). Ejemplo: Conservación de la masa en la reacción química entre el nitrato de plomo y el yoduro de potasio 2 IK + Pb(NO 3)2 Pb. I 2 + 2 KNO 3 Se prepara una disolución de nitrato de plomo en un vaso y otra de yoduro de potasio en otro. Se colocan en una balanza y se comprueba que entre las dos pesan 13, 21 g. Después se mezclan, observando que aparece una sustancia nueva (precipitado amarillo): el yoduro de plomo. Nuevamente se colocan en la balanza y se comprueba que pesan 13, 21 g. La masa no ha variado en el transcurso de la reacción. Ejemplos: Conservación de la masa en la reacción entre el azufre y el hierro : S + Fe Conservación de la masa en la reacción entre el fósforo y el cloro : 2 P + 5 Cl 2 Fe. S 2 Pb. Cl 5

ÍNDICE Carácter cuantitativo de las Reacciones Químicas Carácter cuantitativo de las reacciones químicas Puesto que en una ecuación química debe conservarse la masa y la carga, la ecuación química adquiere de este modo las características de una ecuación matemática. Una ecuación química no sólo indica las sustancias que se producen al reaccionar unas con otras, sino que también informa sobre las cantidades de estas sustancias. Es decir, es una expresión tanto cuantitativa, como cualitativa de una reacción química. Ejemplo: Reacción de formación de agua 2 H 2 + O 2 2 H 2 O Una ecuación química puede interpretarse tanto sobre una base molecular como molar. Al reaccionar dos moléculas de hidrógeno con una molécula de oxígeno, se forman dos moléculas de agua. Al reaccionar dos moles de hidrógeno con un mol de oxígeno, se forman dos moles de agua. Relaciones Estequiométricas

ÍNDICE Carácter cuantitativo de las Reacciones Químicas Ley de las proporciones definidas de Proust Cuando dos elementos se combinan para formar un compuesto, lo hacen siempre en una relación de masa constante. Ejemplo: 6 g de S + 10, 5 g de Fe 16, 5 g de Fe. S 6 g/10, 5 g = 1, 75. Por cada gramo de S se necesitan 1, 75 de Fe Ley de los volúmenes de combinación. Ley de Gay. Loussac En las reacciones entre gases, los volúmenes de reactivos y producto, medidos en las mismas condiciones de presión y temperatura, guardan entre sí relaciones numéricas sencillas.

ÍNDICE Carácter cuantitativo de las Reacciones Químicas Carácter cuantitativo de las reacciones químicas Ejemplo: Reacción de formación de NO: N 2 + O 2 2 NO Al reaccionar una molécula de nitrógeno con una molécula de oxígeno, se forman dos moléculas de NO. Al reaccionar un mol de nitrógeno con un mol de oxígeno, se forman dos moles de NO.

ÍNDICE Carácter cuantitativo de las Reacciones Químicas Cálculos basados en ecuaciones químicas Las ecuaciones químicas nos suministran la información necesaria para calcular cantidades de sustancias consumidas o producidas en las reacciones químicas. Para efectuar cálculos sobre una reacción, además de tenerla ajustada, ha de conocerse al menos la cantidad de una de las sustancias que intervienen en la reacción. Así pueden calcularse las cantidades, producidas o consumidas, de las demás sustancias. Relaciones Estequiométricas

ÍNDICE Tipos de Reacciones Químicas v Según la reorganización de los átomos: 4 Síntesis o combinación 4 Descomposición 4 Desplazamiento o sustitución 4 Doble descomposición o intercambio v Según el mecanismo: 4 Reacciones ácido-base. Neutralización 4 Reacciones de precipitación 4 Reacciones de oxidación-reducción 4 Reacciones de combustión

ÍNDICE Tipos reacciones Tipos de Reacciones según la Reorganización de los Átomos 4 Síntesis o combinación: Dos o más sustancias reaccionan para dar otra más compleja. A + B AB § Las reacciones entre dos no metales dan compuestos covalentes: N 2 + 3 H 2 2 NH 3 § Las reacciones entre un no metal y un metal dan sales: S + Fe Fe. S § Las reacciones entre un elemento y oxígeno producen óxidos: 2 Ca + O 2 2 Ca. O S + O 2 SO 2 § Las reacciones entre un óxido y agua producen hidróxidos: Ca. O + H 2 O Ca(OH)2 § Las reacciones entre un anhídrido y agua producen ácidos: SO 2 + H 2 O H 2 SO 3 § Las reacciones entre un óxido y un anhídrido dan sales: Ca. O + SO 2 Ca. SO 3

ÍNDICE Tipos de Reacciones según la Reorganización de los Átomos 4 Síntesis o combinación ÍNDICE Tipos reacciones

ÍNDICE Tipos reacciones Tipos de Reacciones según la Reorganización de los Átomos 4 Descomposición: Una sustancia se formando dos o más simples. AB A + B 2 KCl. O 3 descompone 2 KCl + 3 O 2 4 Desplazamiento o sustitución: Uno de los elementos de un compuesto es sustituido por otro elemento. AB + X AX + B § Algunos metales reaccionan con ciertos ácidos, reemplazando el hidrógeno y formando la sal correspondiente: Zn + H 2 SO 4 Zn. SO 4 + H 2 § Un metal puede ser desplazado de sus sales por otro metal más activo: Zn + Cu. SO 4 Zn. SO 4 + Cu 4 Doble descomposición o intercambio: Equivalen a una doble sustitución. AB + XY AX + BY ácido + base sal + agua HCl + Na. OH Na. Cl + H 2 O

ÍNDICE Tipos de Reacciones según la Reorganización de los Átomos 4 Desplazamiento o sustitución ÍNDICE Tipos reacciones

ÍNDICE Tipos de Reacciones según el Mecanismo ÍNDICE Tipos reacciones 4 Ácido-base. Neutralizaciones Un ácido reacciona con una base dando lugar a la formación de una sal y agua. En la reacción desaparecen simultáneamente las propiedades de ambos. Ejemplo: Neutralización del hidróxido de sodio con el ácido clorhídrico Na+ + OH- + Cl- + H+ → Cl- + Na+ + H 2 O Na. OH HCl Na. Cl Los iones Cl- y Na+ están presentes en la reacción pero no intervienen en ella, se les llama contraiones o iones espectadores. La neutralización consiste en la reacción entre los iones H+ de los ácidos y los iones OH- de las bases para dar moléculas de agua: H+ + OH- H 2 O Las propiedades del ácido, debidas al ion H+, quedan "neutralizadas" o anuladas por las del ion OH- y viceversa.

ÍNDICE Tipos reacciones Tipos de Reacciones según el Mecanismo NO 3 - Ag+ 4 Precipitación Una reacción de precipitación consiste en la formación de un compuesto insoluble, que recibe el nombre de precipitado cuando se mezclan dos disoluciones. La aparición de un precipitado está relaciona con la diferencia de solubilidad que presentan los reactivos y los productos de la reacción. Ag. I K+ I- Ejemplo: Al reaccionar nitrato de plata con yoduro de potasio, se obtiene un precipitado de yoduro de plata. Ag+ + NO 3 - + I- + K+ → Ag. I (s) + NO 3 - + K+ Ag. NO 3 (aq) KI (aq) solubilidad elevada Precipitado KNO 3 (aq) solubilidad baja solubilidad elevada Los iones nitrato y potasio permanecen el la disolución, sin intervenir en la reacción

ÍNDICE Tipos reacciones Tipos de Reacciones según el Mecanismo 4 Oxidación-Reducción (Redox) Consiste en la transferencia de electrones de una especie química, llamada agente reductor, a otra, llamada agente oxidante. Ejemplo: Cuando se introduce magnesio metálico en una disolución de sulfato de cobre, se produce una transferencia de electrones del magnesio a los iones cobre (II), formándose cobre metálico y iones magnesio (II) que pasan a formar parte de la disolución. Reducción: Cu 2+ + 2 e – → Cu Oxidación: Mg → Mg 2+ + 2 e – Cu 2+ + Mg → Cu + Ejemplo: Reducción: Ag+ + e – → Ag Oxidación: Cu → Cu 2+ + 2 e – Ag + + Cu → Ag + Cu 2+ Mg 2+ Cu 2+ Mg Cu

ÍNDICE Tipos reacciones Tipos de Reacciones según el Mecanismo 4 Combustión Es la reacción de una sustancia, llamada combustible, con oxígeno, al que se le llama comburente, en la reacción se forman dióxido de carbono y agua y se desprende gran cantidad de energía en forma de luz y calor Ejemplo: Combustión de propano C 3 H 8 + 5 O 2 → 3 CO 2 + 4 H 2 O

Velocidad de las Reacciones Químicas La velocidad de una reacción es la cantidad de sustancia formada o transformada por unidad de tiempo ÍNDICE No todas las reacciones transcurren con la misma velocidad. Algunas reacciones químicas se producen de forma casi instantánea y otrascurren lentamente. Por ejemplo, las explosiones y detonaciones son tan rápidas que resulta muy difícil medir su velocidad, sin embargo, el cemento necesita varios días para fraguar, es decir, para endurecer, es una reacción lenta. La velocidad de una reacción depende de: § La energía de activación de la reacción: si la energía de activación es alta la reacción será lenta y si es baja la reacción será rápida. § El número de choques eficaces entre las partículas que reaccionan (átomos, moléculas o iones): cuanto mayor sea el número de choques eficaces mayor será la velocidad de reacción.

Velocidad de las Reacciones Químicas Los factores que determinan la velocidad de reacción son: ÍNDICE § La naturaleza de los reactivos: determina cuál será la energía de activación de cada reacción. § La concentración de los reactivos: la velocidad de una reacción aumenta con la concentración de los reactivos ya que aumenta el número de choques. Para aumentar la concentración de un gas es necesario aumentar su presión. Para aumentar la concentración de una disolución habrá que aumentar la cantidad de soluto. § El estado físico de los reactivos: las reacciones entre gases y entre sustancias en disolución serán las más rápidas, pues las partículas se muevan con mayor libertad y velocidad, produciéndose un mayor número de colisiones entre ellas. Las reacciones de los sólidos con líquidos o gases no son generalmente muy rápidas, pero si el sólido está triturado o pulverizado, aumenta la velocidad de reacción, porque al aumentar la superficie de contacto entre del sólido con el líquido o el gas, también aumenta el número de choques. § La temperatura: la velocidad de reacción aumenta con la temperatura. Al aumentar temperatura, aumenta la energía cinética de las partículas (aumenta la velocidad con que se mueven), con lo que la probabilidad de que se produzcan choques eficaces es mayor. § Los catalizadores: son sustancias distintas de los reactivos y productos que modifican la velocidad de una reacción, recuperándose íntegramente cuando la reacción finaliza. Los catalizadores hacen que la reacción transcurra por un camino diferente en que la

ÍNDICE Energía en las Reacciones Químicas En las reacciones químicas se producen transformaciones de energía, además de materia. La energía interna de una sustancia es la suma de todas las energías de esa sustancia, debida a las posiciones y los movimientos de las partículas subatómicas, de los átomos y de las moléculas que la constituyen, y a las uniones de los átomos. En todas las reacciones químicas se produce una variación en la energía interna de las sustancias que intervienen. En el estado inicial los reactivos tienen una energía interna y en el estado final los productos tienen otra. La diferencia de energía entre ambos estados se absorbe (reacciones endoenergéticas) o se desprende en la reacción (reacciones exoenergéticas), Si el sistema químico disminuye su energía, la comunica al medio ambiente, y si la aumenta, es porque la ha absorbido de él. Atendiendo al intercambio de energía en forma de calor con el exterior, las reacciones se clasifican en: § Exotérmicas: desprenden energía en forma de calor. Ejemplo: Combustión de metano CH 4 + 2 O 2 CO 2 +2 H 2 O + 890 k. J La ecuación termoquímica indica que por cada mol de metano (16 g) quemado se liberan 890 k. J. § Endotérmicas: absorben energía en forma de calor. Ejemplo: Descomposición de óxido de mercurio 2 Hg. O + 181 k. J 2 Hg + O 2 La ecuación termoquímica indica que por cada dos moles de óxido de mercurio que se descomponen se absorben del medio 181 k. J

ÍNDICE Q u i m i o l u m i n i s c en c i a Algunas reacciones químicas exoenergéticas emiten en energía en forma de radiación luminosa.

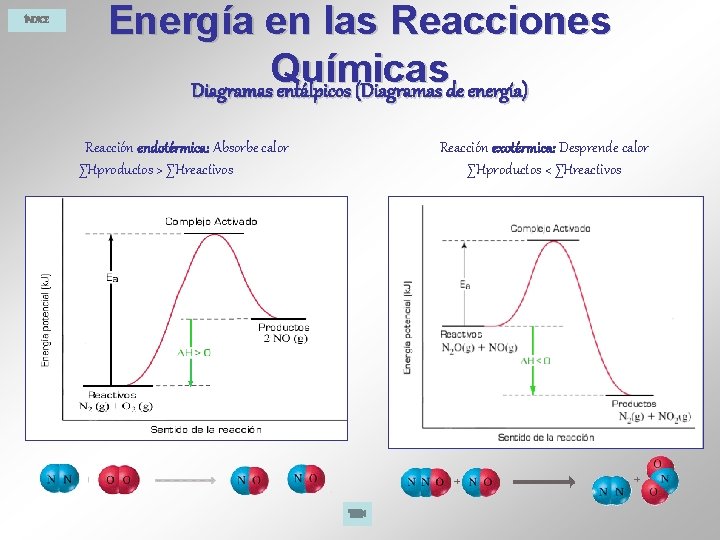
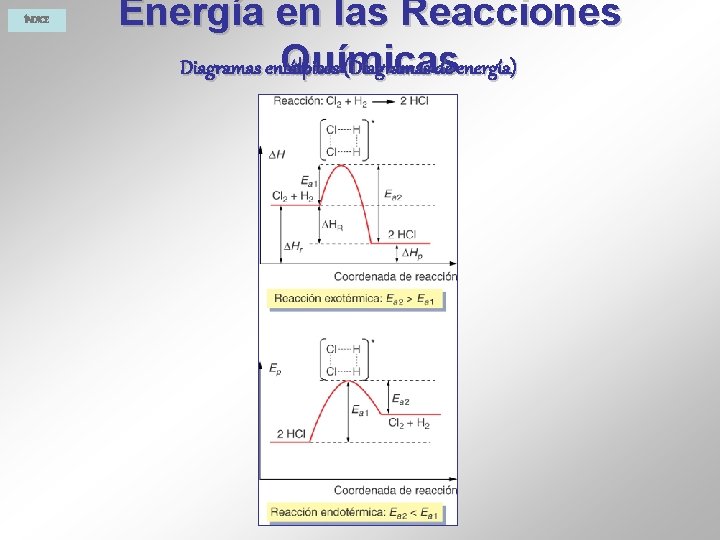
ÍNDICE Energía en las Reacciones Químicas Se denomina entalpía de reacción ( H) al calor absorbido o desprendido en una reacción química a presión constante. Es la diferencia entre la suma de las entalpías de los productos y la suma de las entalpías de los reactivos: ∑Hproductos - ∑Hreactivos. Reacción exotérmica: Desprende calor ∑Hproductos < ∑Hreactivos Reacción endotérmica: Absorbe calor ∑Hproductos > ∑Hreactivos

ÍNDICE Energía en las Reacciones Químicas EXOTÉRMICA ENDOTÉRMICA Al calentar la termita se produce una reacción fuertemente exotérmica. El aluminio reacciona con óxido de hierro (III), produciendo una lluvia de chispas de hierro fundido. La reacción entre sulfocianuro amónico e hidróxido de bario octahidratado es una reacción endotérmica. Absorbe una cantidad de calor del exterior del recipiente que produce la congelación del vapor de agua del aire. En una reacción exotérmica, la energía se pierde en forma de calor, la cantidad de calor perdida depende de la cantidad de reactivos disponible. En una reacción endotérmica, la energía se absorbe en forma de calor.

ÍNDICE Energía en las Reacciones Químicas Diagramas entálpicos (Diagramas de energía) Reacción endotérmica: Absorbe calor ∑Hproductos > ∑Hreactivos Reacción exotérmica: Desprende calor ∑Hproductos < ∑Hreactivos

ÍNDICE Energía en las Reacciones Químicas Diagramas entálpicos (Diagramas de energía)

ÍNDICE Tipos de Reacciones Químicas

ÍNDICE VIDEOS v. Reacción química y disolución v. Reacciones con oxígeno v. Formación cloruro de hidrógeno Reacción de sodio con agua v. Reacción de sodio y potasio con agua v. Formación amoniaco v. Formación de bromuro de aluminio Formación yoduro de hidrógeno v. Síntesis de Nylon v. Deshidratación de azúcar con ácido sulfúrico Formación bromuro de aluminio v. Bicarbonato con vinagre v. Con ojo químico (SM 16´)

ÍNDICE EJERCICIOS v Cambios químicos o físicos v Reactivos y productos v Ajuste de ecuaciones (1) v Ajuste de ecuaciones (2) v Ajuste de ecuaciones (3) v Tipos de reacciones químicas

ÍNDICE APÉNDICE fin

Apéndice ÍNDICE Materiales premiados CNICE “Las Reacciones Químicas” INTRO http: //concurso. cnice. mec. es/cnice 2005/35_las_reacciones_quimicas/curso/index. html
 Qumicas
Qumicas Adifusional
Adifusional Transformaciones rigidas
Transformaciones rigidas Transformaciones sustractivas
Transformaciones sustractivas Hallar
Hallar Colimador
Colimador Ndice
Ndice Ndice
Ndice Ndice
Ndice Ndice
Ndice Ndice
Ndice Ipc laspeyres
Ipc laspeyres Indoxitol composición
Indoxitol composición Ndice
Ndice Ndice
Ndice Tosilacion de alcoholes
Tosilacion de alcoholes Reacciones químicas
Reacciones químicas Como se clasifica el enlace covalente
Como se clasifica el enlace covalente Reacciones supravitales
Reacciones supravitales Reacciones adversas a medicamentos antituberculosos
Reacciones adversas a medicamentos antituberculosos Reacciones de hipersensibilidad
Reacciones de hipersensibilidad Estado de oxidacion
Estado de oxidacion Tipos de reacciones quimicas
Tipos de reacciones quimicas Dalton gmez
Dalton gmez Reaccion de precipitacion
Reaccion de precipitacion Reacción exotérmica representacion
Reacción exotérmica representacion Examen externo del cadáver
Examen externo del cadáver Reacciones quimicas reversibles
Reacciones quimicas reversibles Reacciones de neutralización ejemplos
Reacciones de neutralización ejemplos Aumento de entropia
Aumento de entropia Reacciones acopladas
Reacciones acopladas Significado de combustion
Significado de combustion Fisicia
Fisicia Reacciones quimicas
Reacciones quimicas Mol reacciones quimicas
Mol reacciones quimicas Reacciones adversas a medicamentos antituberculosos
Reacciones adversas a medicamentos antituberculosos Reacciones redox
Reacciones redox Reacciones de los halogenuros de alquilo
Reacciones de los halogenuros de alquilo Mapa conceptual de reacciones endotérmicas y exotérmicas
Mapa conceptual de reacciones endotérmicas y exotérmicas Calculos con reacciones quimicas
Calculos con reacciones quimicas Eacciones quimicas
Eacciones quimicas Que son reacciones irreversibles
Que son reacciones irreversibles Qumica
Qumica Clasificacion de reacciones quimicas
Clasificacion de reacciones quimicas






























































