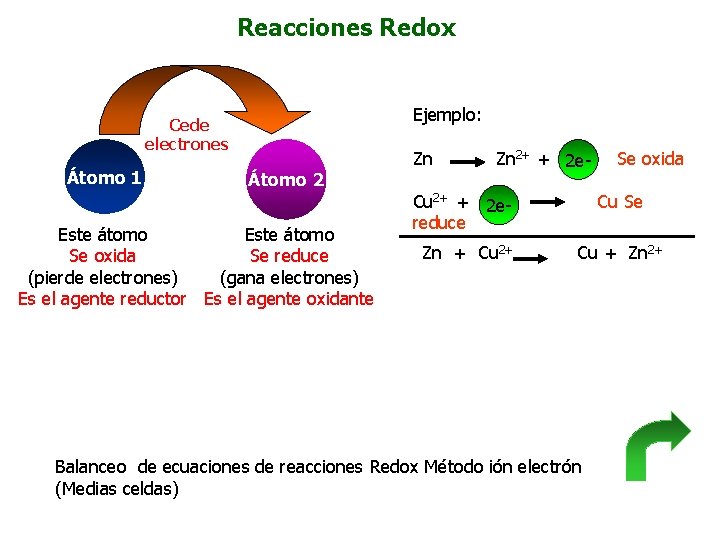
Reacciones Redox Ejemplo Cede electrones tomo 1 Zn






- Slides: 9

Reacciones Redox Ejemplo: Cede electrones Átomo 1 Zn Átomo 2 Este átomo Se oxida Se reduce (pierde electrones) (gana electrones) Es el agente reductor Es el agente oxidante Zn 2+ + 2 e- Cu 2+ + 2 ereduce Zn + Cu 2+ Se oxida Cu Se Cu + Zn 2+ Balanceo de ecuaciones de reacciones Redox Método ión electrón (Medias celdas)

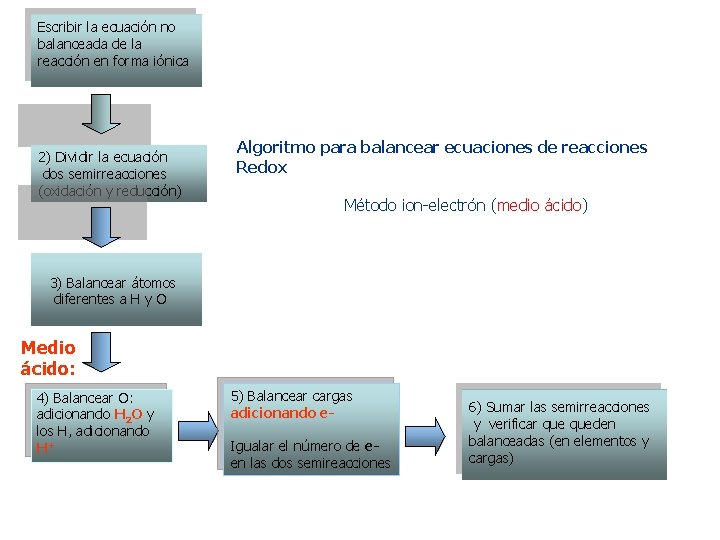
Escribir 1 la ecuación no balanceada de la ) reacción en forma iónica 2) Dividir la ecuación dos semirreacciones (oxidación y reducción) Algoritmo para balancear ecuaciones de reacciones Redox Método ion-electrón (medio ácido) 3) Balancear átomos diferentes a H y O Medio ácido: 4) Balancear O: adicionando H 2 O y los H, adicionando H+ 5) Balancear cargas adicionando e. Igualar el número de een las dos semireacciones 6) Sumar las semirreacciones y verificar queden balanceadas (en elementos y cargas)

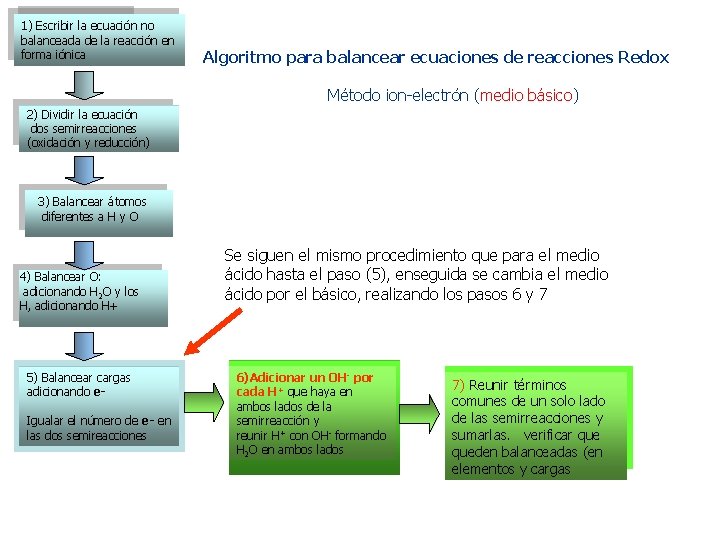
1) Escribir 1 la ecuación no balanceada de la reacción en ) forma iónica Algoritmo para balancear ecuaciones de reacciones Redox Método ion-electrón (medio básico) 2) Dividir la ecuación dos semirreacciones (oxidación y reducción) 3) Balancear átomos diferentes a H y O 4) Balancear O: adicionando H 2 O y los H, adicionando H+ 5) Balancear cargas adicionando e. Igualar el número de e- en las dos semireacciones Se siguen el mismo procedimiento que para el medio ácido hasta el paso (5), enseguida se cambia el medio ácido por el básico, realizando los pasos 6 y 7 6)Adicionar un OH- por cada H+ que haya en ambos lados de la semirreacción y reunir H+ con OH- formando H 2 O en ambos lados 7) Reunir términos comunes de un solo lado de las semirreacciones y sumarlas. verificar queden balanceadas (en elementos y cargas

Balancear la siguiente ecuación, en solución ácida: Paso # 1 Ecuación iónica: Cr 2 O 72 - + I (medio ácido) Cr 3+ + I 2 Paso #2: dividir la ecuación en dos medias reacciones: oxidación y reducción Cr 2 O 72 I- Cr 3+ I 2 [reducción] [oxidación] Paso #3: Balancea átomos Para la media reacción del Cr 2 O 72 -/Cr 3+ : a) Balancea átomos diferentes a O e H. Balancear los dos Cr’s de la izquiera colocando un dos como coeficiente a la derecha. Cr 2 O 72 - 2 Cr 3+

Paso 4. Balancea átomos de O adicionando moléculas de H 2 O , Adiciona 7 moléculas a la derecha para balancear 7 oxígenos: Cr 2 O 722 Cr 3+ + 7 H 2 O Balancea los átomos de H adicionando iones H+. Son dos átomos de H por molécula de agua, entonces necesitamos adicionar 14 hidrogenos a la izquierda: 14 H+ + Cr 2 O 722 Cr 3+ + 7 H 2 O Paso 5. Balancear cargas adicionando electrones. En el lado izquierdo tenemos una carga de +12 y del lado derecho de +6. Entonces tenemos que adicionar 6 electrones al lado derecho de la ecuación 6 e- + 14 H+ + Cr 2 O 72 - 2 Cr 3+ + 7 H 2 O Para la media reacción: I -/I 2 No se requiere balancear átomos que no sean: O ni H. Los átomos de Iodo se balancean colocando un 2 como coeficiente del lado izquierdo 2 I- I 2

Balancear cargas adicionando electrones. Para balancear las dos cargas negativas de la izquierda, adicionar 2 electrones a la derecha. 2 II 2 + 2 e- Igualar el número de electrones en las dos medias reacciones Multiplicar cada media reacción por algún entero que iguale el # e 3(2 I 6 I- I 2 + 2 e-) 3 I 2 + 6 e- Paso # 6 Sumar las medias reacciones, reuniendo términos comunes de un solo lado de la ecuación: 6 e- + 14 H+ + Cr 2 O 726 I - + 14 H+ + Cr 2 O 72 - 2 Cr 3+ + 7 H 2 O 3 I 2 + 6 e 3 I 2 + 7 H 2 O + 2 Cr 3+ Verificar : ¡reactivos(6 I, 14 H, 2 Cr, 7 O, carga 6+) = en productos!)

Balanceo reacciones Redox Solución Básica Balancear la siguiente ecuación de la reacción en solución básica. 1) Mn. O 4 -+ C 2 O 42 Mn. O 2 + CO 32 Seguimos los mismos pasos que para el medio ácido hasta el paso 5 2) Dividir le ecuación en dos medias reacciones: Mn. O 4 C 2 O 42 - Mn. O 2 CO 32 - 3) Balancear en la media reacción de reducción: No necesitamos a) Átomos que no sean O ni H b) Átomos de O con agua c) Átomo de H con H+ d) Mn. O 4 - Mn. O 2 + 2 H 2 O 4 H+ + Mn. O 4 - Mn. O 2 + 2 H 2 O Cargas con e- 3 e- + 4 H+ + Mn. O 4 - Mn. O 2 + 2 H 2 O

Balancear la media reacción de oxidación C 2 O 42 CO 32 Balancear: a) Átomos que no sean O ni H b) Átomos de O con agua c) Átomos de H con H+ d) Cargas con e- C 2 O 42 - 2 CO 32 - 2 H 2 O + C 2 O 42 - 2 CO 32 - + 4 H+ + 2 e- Multiplicar cada media-reacción por un coeficiente para igualar el número de electrones en las dos medias reacciones: oxidación = 2 e-, reducción = 3 e-, Entonces (oxid x 3 y red x 2 = 6 e-) oxid = 6 H 2 O + 3 C 2 O 42 red = 6 e- + 8 H+ + 2 Mn. O 4 - 6 CO 32 - + 12 H+ + 6 e 2 Mn. O 2 + 4 H 2 O

6) Cambiar el medio: Adicionado un OH- en ambos lados de la ecuación por cada H+ que se tenga 12 OH- + 6 H 2 O + 3 C 2 O 426 e- + 8 OH- + 8 H+ + 2 Mn. O 4 - 6 CO 32 - + 12 H+ + 12 OH- + 6 e 2 Mn. O 2 + 4 H 2 O + 8 OH- Ahora, del lado donde haya H+ y OH- reunirlos formando H 2 O : 12 OH- + 6 H 2 O + 3 C 2 O 426 e- + 8 H 2 O + 2 Mn. O 4 - Sumarlas y reunir términos comunes: 4 OH- + + 3 C 2 O 42 - + 2 Mn. O 4 - 6 CO 32 - + 12 H 2 O + 6 e 2 Mn. O 2 + 4 H 2 O + 8 OH- 6 CO 32 - + 2 Mn. O 2 + 2 H 2 O Checar: reactivos (2 Mn, 24 O, 6 C, 4 H, cargas: 12 -) = productos, ¡(igualados)!