SEMANA 4 REACCIN Y ECUACIN QUMICA 2021 1




















- Slides: 28

SEMANA 4 REACCIÓN Y ECUACIÓN QUÍMICA 2021 1

SEMANA 04 REACCIÓN Y ECUACIÓN QUÍMICA • Partes e interpretación de símbolos. • Manifestaciones de las reacciones. • Tipos de reacciones: - Combinación o Síntesis, Análisis o descomposición, Sustitución simple, Doble sustitución, Neutralización y Combustión - Exotérmicas y endotérmicas - Reversibles e irreversibles • Balanceo de ecuaciones por el método de tanteo. • Número de oxidación, reglas de asignación. Aplicación de los conceptos en la salud y el ambiente. Lecturas en libro de texto. La Química en la Salud: “Compresas frías y compresas calientes” LABORATORIO: REACCIONES QUÍMICAS 2

Reacción Química • Es un cambio ó fenómeno químico en donde los átomos de una sustancia se han transformado en una o más sustancias nuevas y con propiedades diferentes. • Generalmente se presentan manifestaciones. • Ejemplo: El hierro en contacto con el oxígeno del aire se oxida y produce como manifestación un óxido de color rojo café. • Esta reacción la podemos escribir utilizando las fórmulas químicas de los compuestos que reaccionan y de los que se producen. (El hierro puede formar dos tipos de óxidos) Fe + O 2 → Fe 2 O 3 y también Fe + O 2 → Fe. O 3

Ecuación Química • Es la reacción química que se encuentra Balanceada para que cumpla la Ley de la Conservación de la Materia. • Se balancea utilizando coeficientes que igualan la cantidad de átomos de los Reactivos con la cantidad de átomos de los Productos. Fe + O 2 Fe 2 O 3 (balanceada: 4 Fe + 3 O 2 2 Fe 2 O 3) Fe + O 2 → Fe. O (balanceada: 2 Fe + O 2 2 Fe. O) 4

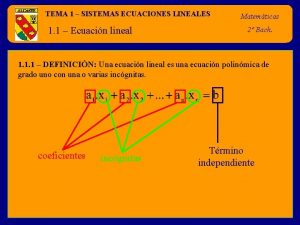
Partes y símbolos de un Ecuación Química • Reactivos: átomos ó compuestos que reaccionan. • Productos: átomos ó compuestos que se forman. • Catalizador (sustancia que altera la velocidad de reacción pero no reacciona. Se coloca encima de la flecha. • Se utilizan →, ↔, +, # o coeficientes antes de la fórmula, subíndices después del símbolo, estado físico entre paréntesis (s), (l), (g) ó ↑, (ac), precipitado , calor ∆, catalizador. 5

Manifestaciones de las reacciones (es lo que se percibe por los sentidos) • Cambio de color • Cambio de temperatura • Formación o desprendimiento de gas ó burbujas • Formación de un sólido ó precipitado • Cambio de p. H • Liberación de olor • Producción de energía lumínica 6

Tipos de Reacciones Reacción de Síntesis ó Combinación A + B → AB 2 Mg(s) + O 2(g) → 2 Mg. O(s) H 2(g)+ Br 2(g) → 2 HBr(g) Ca. O(s) + CO 2 (g) → Ca. CO 3 (s) 7

Reacción de Análisis ó Descomposición AB → A + B Ca. CO 3 (s) → Ca. O (s) + CO 2 (g) 2 Hg. O(s) → 2 Hg (l) + O 2 (g) 2 Al 2 O 3(s) → 4 Al(s) + 3 O 2(g) 2 Cu(NO 3)2 (s) → 2 Cu. O(s) + 4 NO 2(g)+ O 2(g) 8

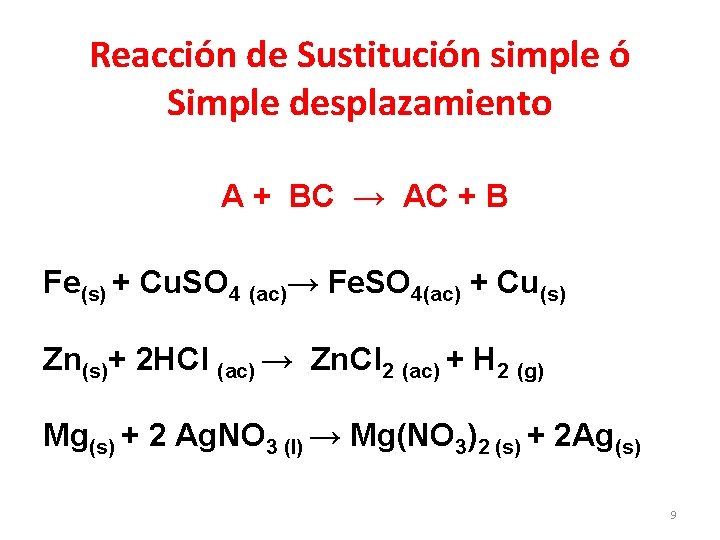
Reacción de Sustitución simple ó Simple desplazamiento A + BC → AC + B Fe(s) + Cu. SO 4 (ac)→ Fe. SO 4(ac) + Cu(s) Zn(s)+ 2 HCl (ac) → Zn. Cl 2 (ac) + H 2 (g) Mg(s) + 2 Ag. NO 3 (l) → Mg(NO 3)2 (s) + 2 Ag(s) 9

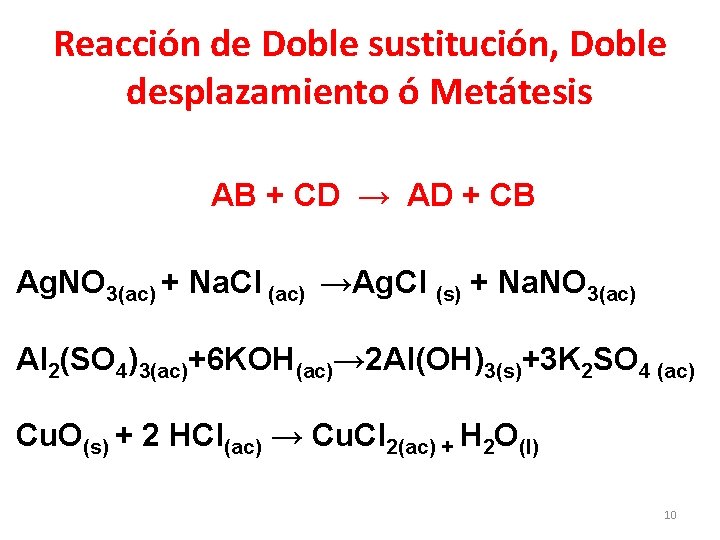
Reacción de Doble sustitución, Doble desplazamiento ó Metátesis AB + CD → AD + CB Ag. NO 3(ac) + Na. Cl (ac) →Ag. Cl (s) + Na. NO 3(ac) Al 2(SO 4)3(ac)+6 KOH(ac)→ 2 Al(OH)3(s)+3 K 2 SO 4 (ac) Cu. O(s) + 2 HCl(ac) → Cu. Cl 2(ac) + H 2 O(l) 10

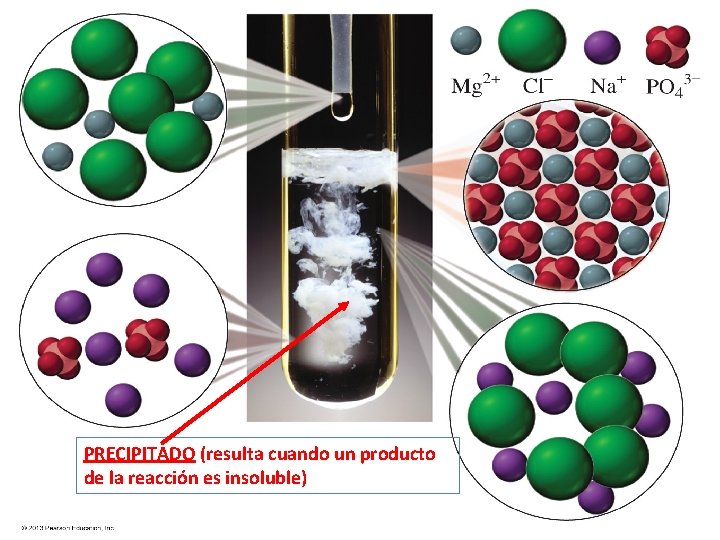
PRECIPITADO (resulta cuando un producto de la reacción es insoluble) 11

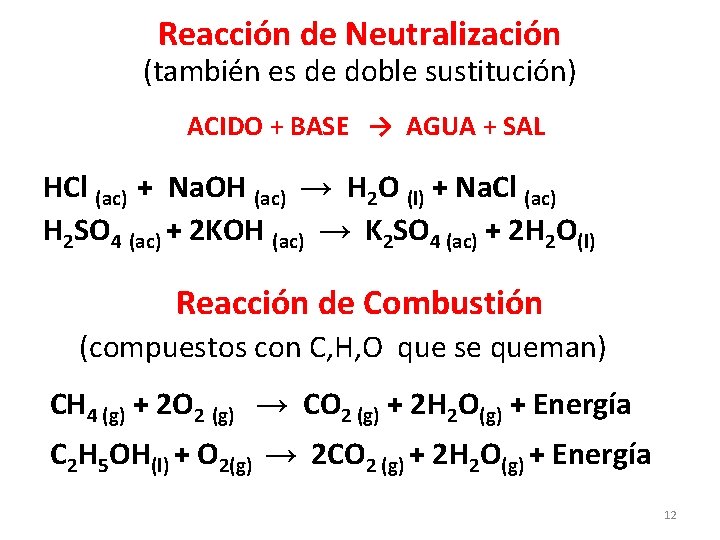
Reacción de Neutralización (también es de doble sustitución) ACIDO + BASE → AGUA + SAL HCl (ac) + Na. OH (ac) → H 2 O (l) + Na. Cl (ac) H 2 SO 4 (ac) + 2 KOH (ac) → K 2 SO 4 (ac) + 2 H 2 O(l) Reacción de Combustión (compuestos con C, H, O que se queman) CH 4 (g) + 2 O 2 (g) → CO 2 (g) + 2 H 2 O(g) + Energía C 2 H 5 OH(l) + O 2(g) → 2 CO 2 (g) + 2 H 2 O(g) + Energía 12


Reacción Endotérmica • Necesita energía y se representa en los reactivos con ∆, Kcal o Energía o con △H+ H 2(g) + ½ O 2(g) + ∆ → H 2 O H 2(g) + ½ O 2(g) + 283 Kcal → H 2 O (l) H 2(g) + ½ O 2(g) → H 2 O(l) △H =+283 Kcal 14

Reacción Exotérmica • Libera energía y se representa en los productos con ∆, Kcal o Energía o con △HCH 4(g) + 2 O 2(g) → CO 2(g)+ 2 H 2 O(g) + ∆ CH 4(g) + 2 O 2(g) → CO 2(g)+ 2 H 2 O(g) + 192 Kcal CH 4(g) + 2 O 2(g) → CO 2(g)+2 H 2 O(g) △H=192 Kcal 15

Reacción Irreversible Se realiza solo en una dirección. Directa A → B 2 Al 2 O 3(s) → 4 Al(s) + 3 O 2(g) Reacción Reversible Se realiza en dos direcciones. Directa A → B A⇄B Inversa A ← B CS 2 (g) + 4 H 2 (g) ⇄ CH 4 (g) + 2 H 2 S (g) 16

Balanceo de Ecuaciones • Procedimiento utilizado para igualar el # total de átomos ó moléculas presentes en los Reactivos y los Productos, para que se cumpla la Ley de la Conservación de la Materia. • Se balancea utilizando coeficientes que son # enteros que se escriben adelante de las fórmulas de los compuestos) NO SE DEBEN DE CAMBIAR LOS SUBÍNDICES DE LAS FÓRMULAS PARA BALANCEAR. • Utilizaremos los métodos de TANTEO y REDOX 17

Balanceo por Tanteo No balanceada Fe + O 2 Fe 2 O 3 • Se colocan coeficientes que igualen el # de átomos entre los Reactivos y los Productos. Se recomienda balancear siguiendo en este orden: 1º Metales 2º No metales 3º Hidrógenos 4º Oxígenos Balanceada 4 Fe + 3 O 2 2 Fe 2 O 3 • coeficientes de los reactivos 4 y 3 y del producto 2. (Si el coeficiente es 1, no se debe escribir). 18

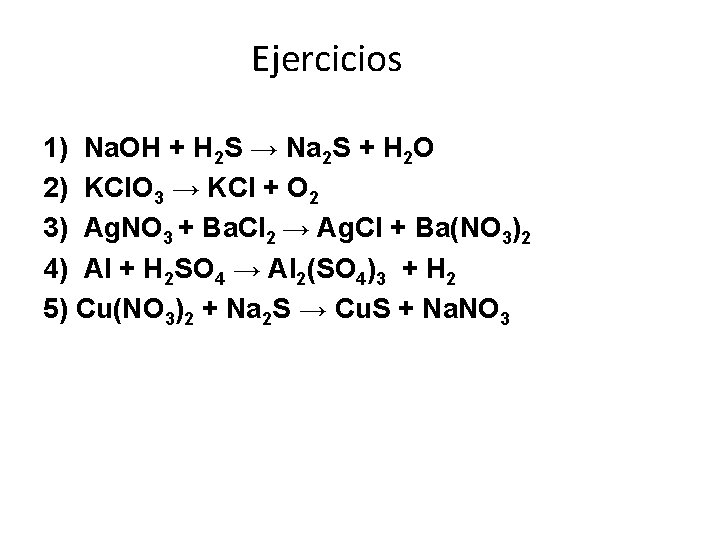
Ejercicios 1) Na. OH + H 2 S → Na 2 S + H 2 O 2) KCl. O 3 → KCl + O 2 3) Ag. NO 3 + Ba. Cl 2 → Ag. Cl + Ba(NO 3)2 4) Al + H 2 SO 4 → Al 2(SO 4)3 + H 2 5) Cu(NO 3)2 + Na 2 S → Cu. S + Na. NO 3 19

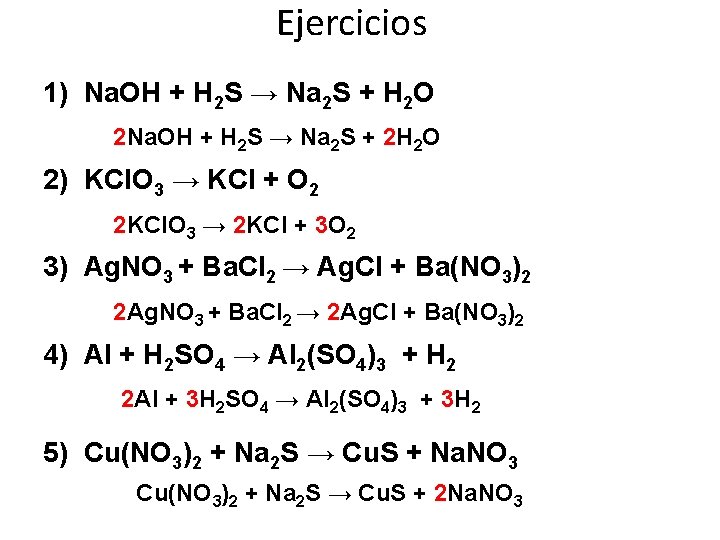
Ejercicios 1) Na. OH + H 2 S → Na 2 S + H 2 O 2 Na. OH + H 2 S → Na 2 S + 2 H 2 O 2) KCl. O 3 → KCl + O 2 2 KCl. O 3 → 2 KCl + 3 O 2 3) Ag. NO 3 + Ba. Cl 2 → Ag. Cl + Ba(NO 3)2 2 Ag. NO 3 + Ba. Cl 2 → 2 Ag. Cl + Ba(NO 3)2 4) Al + H 2 SO 4 → Al 2(SO 4)3 + H 2 2 Al + 3 H 2 SO 4 → Al 2(SO 4)3 + 3 H 2 5) Cu(NO 3)2 + Na 2 S → Cu. S + Na. NO 3 Cu(NO 3)2 + Na 2 S → Cu. S + 2 Na. NO 3 20

Número ó Estado de Oxidación • Es un número entero positivo ó negativo que se le asigna a cada átomo de un compuesto, ión ó elemento. • Este número indicará cuantos electrones ha ganado, perdido ó compartido ese átomo al formar parte de ese compuesto. • Para asignar los números de oxidación se siguen algunas reglas: 21

Reglas para asignar los números de oxidación de los átomos 1. Los elementos libres (que no forman compuestos) y los diatómicos, tienen # de oxidación = 0 Ej: H 2 (H= 0) Cl 2 (Cl= 0) Zn (Zn= 0) Ag (Ag= 0) 2. El Hidrogeno en compuestos, # de oxid. = +1 (excepto en (HM) hidruros = -1) Ej: H 2 S (H 2+1 S-2) NH 3 (N-3 H 3+1) 3. El Oxigeno en compuestos, # de oxid. =-2 (excepto en (H 2 O 2) peróxidos = -1) Ej: CO 2 (C+4 O-22) SO 3 (S+6 O-23) 22

4. Elementos con # de oxidación únicos. Los de columna IA # oxid= +1; IIA # oxid= +2; IIIA # oxid= +3 5. La suma de todos los números de oxidación de todos los átomos de un compuesto debe=0 Ej: H 3 BO 3 (H=+1 x 3=+3) (B=+3 x 1=+3) (O=-2 x 3=-6) (+3+3 -6= 0) 6. Para un ión monoatómico su # oxid=su carga Ej: Na+(Na=+1) Ca+2(Ca=+2) S-2(S=-2) Cl-(Cl=-1) 23

7. En un ión poliatómico, la suma de los # de oxidación de todos sus átomos debe ser igual a la carga del ión. Ej: (PO 4)-3 (P=+5) (O=-2 x 4=-8); (+5 -8=-3) 8. Para compuestos binarios Xx. Yy, el subíndice x es la carga de Y. El subíndice y es la carga de X Ej: Fe 2 S 3 (Fe=+3 ; S=-2) PCl 5 (P=+5 ; Cl=-1) Fe(NO 3)3 (Fe=+3) (O=-2 x 9=-18); (N=+5 x 3=+15) 24

9. Si un no-metal es de columna par, puede trabajar principalmente con # de oxidación pares, que no sean mayores a su número de columna. Si es de columna impar trabaja con # de oxidación impares que no sean mayores a su # de la columna. 25

Ejemplos de asignación de # de oxidación: H 2 SO 4 H=+1 O=-2 S= +6 H 2 SO 3 H=+1 O=-2 S= +4 HCl. O 4 H=+1 O=-2 Cl=+7 Ni 2(CO 3)3 Ni=+3 y todo el (CO 3)= -2 Entonces C=+4 O=-2 22226299229

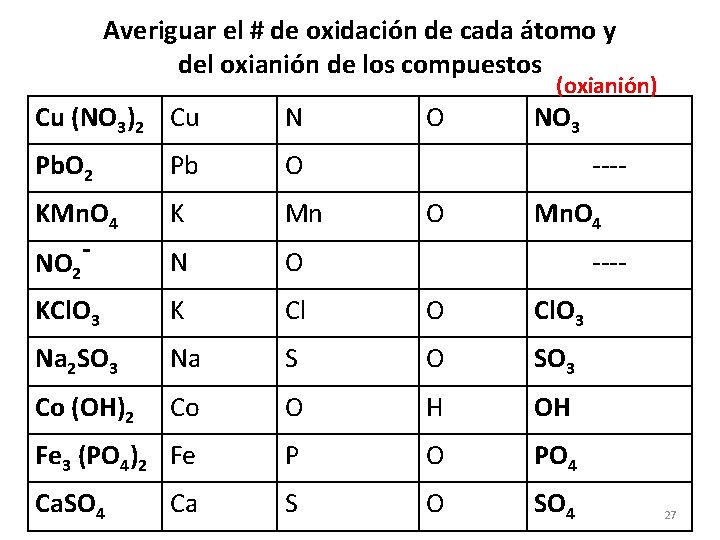
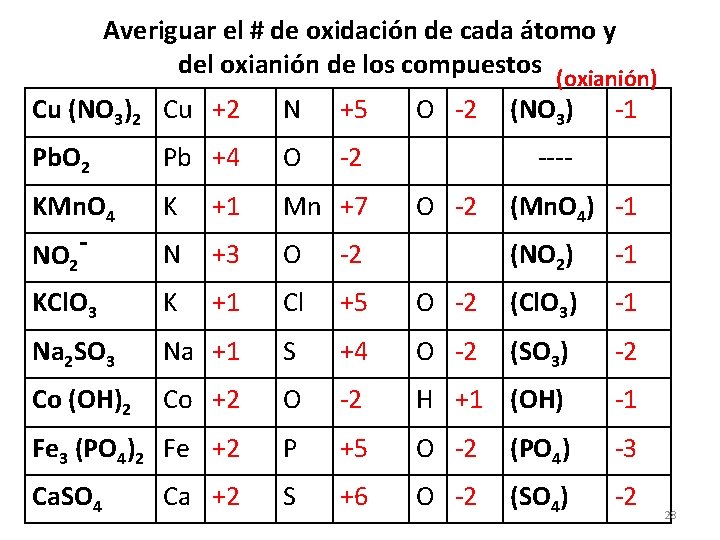
Averiguar el # de oxidación de cada átomo y del oxianión de los compuestos Cu (NO 3)2 Cu N Pb. O 2 Pb O KMn. O 4 NO - K Mn N O KCl. O 3 K Cl O Cl. O 3 Na 2 SO 3 Na S O SO 3 Co (OH)2 Co O H OH Fe 3 (PO 4)2 Fe P O PO 4 Ca. SO 4 S O SO 4 2 Ca O (oxianión) NO 3 ---O Mn. O 4 ---- 27

Averiguar el # de oxidación de cada átomo y del oxianión de los compuestos (oxianión) Cu (NO 3)2 Cu +2 N +5 Pb. O 2 Pb +4 O -2 KMn. O 4 NO K +1 Mn +7 N +3 O -2 KCl. O 3 K +1 Cl +5 Na 2 SO 3 Na +1 S Co (OH)2 Co +2 O -2 (NO 3) -1 ---O -2 (Mn. O 4) -1 (NO 2) -1 O -2 (Cl. O 3) -1 +4 O -2 (SO 3) -2 O -2 H +1 (OH) -1 Fe 3 (PO 4)2 Fe +2 P +5 O -2 (PO 4) -3 Ca. SO 4 S +6 O -2 (SO 4) -2 2 Ca +2 28
 Reaccin
Reaccin Reaccin
Reaccin Reaccin
Reaccin Ecuacin
Ecuacin Cuadrtica
Cuadrtica Ed
Ed Ecuacin
Ecuacin Ecuacin
Ecuacin Ejemplo de ecuación lineal
Ejemplo de ecuación lineal Sistema de ecuaciones incompatible
Sistema de ecuaciones incompatible Termino lineal
Termino lineal La semana 70
La semana 70 Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Quimica
Quimica Funcion quimica y grupo funcional
Funcion quimica y grupo funcional Qumica
Qumica Qumica
Qumica Reacciones de orden cero
Reacciones de orden cero Qumica
Qumica Cintica
Cintica Qumica
Qumica Qumica
Qumica Qumica
Qumica Geometria trigonal plana
Geometria trigonal plana Qumica
Qumica Etapas da gravimetria
Etapas da gravimetria