LE CYCLE CELLULAIRE III Contrle intra cellulaire des







































































- Slides: 110

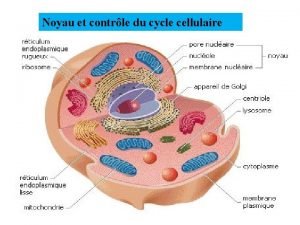
LE CYCLE CELLULAIRE

III Contrôle intra cellulaire des événements du cycle cellulaire

Objectif • Complexe Cdk cycline = facteur de déclenchement des événements du cycle – Comment ? – Dans le bon ordre – Une seule fois par cycle • Quatre événements – Réplication de l’ADN en phase S et blocage de la re réplication – Entrée en phase M – Séparation des chromatides – Sortie de la mitose 10/22/2021 3

Les trois grands acteurs 1. Complexe S Cdk = – Cycline A + Cdk 2 chez les vertébrés – Clb 5, 6 + Cdk 1 chez la levure 2. Complexe M Cdk = – Cycline B + Cdk 1 (ex Cdc 2 !) chez les vertébrés – Clb 1, 2, 3, 4 +Cdk 1 chez la levure 3. Anaphase Promoting Complexe (APC) 10/22/2021 4

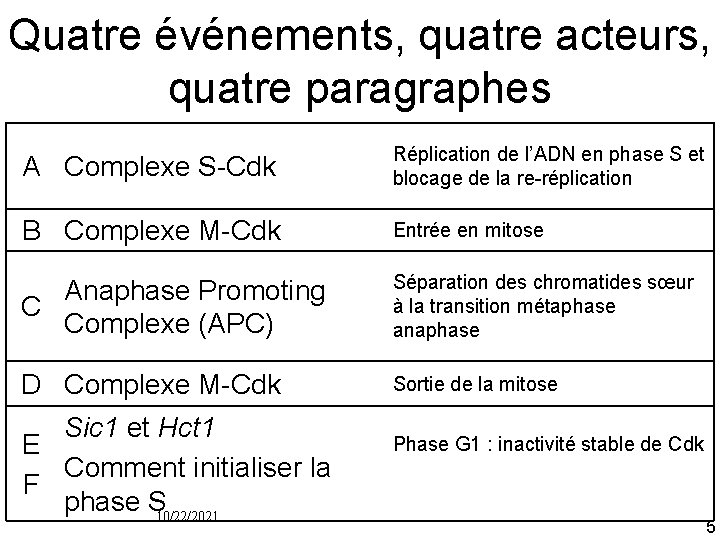
Quatre événements, quatre acteurs, quatre paragraphes A Complexe S Cdk Réplication de l’ADN en phase S et blocage de la re réplication B Complexe M Cdk Entrée en mitose Anaphase Promoting C Complexe (APC) Séparation des chromatides sœur à la transition métaphase anaphase D Complexe M Cdk Sortie de la mitose Sic 1 et Hct 1 E Comment initialiser la F phase S 10/22/2021 Phase G 1 : inactivité stable de Cdk 5

Composition de S Cdk et M Cdk des vertébrés et des levures bourgeonnantes Table 17 1 10/22/2021 6

A Complexe S Cdk Réplication de l’ADN en phase S et blocage de la re réplication

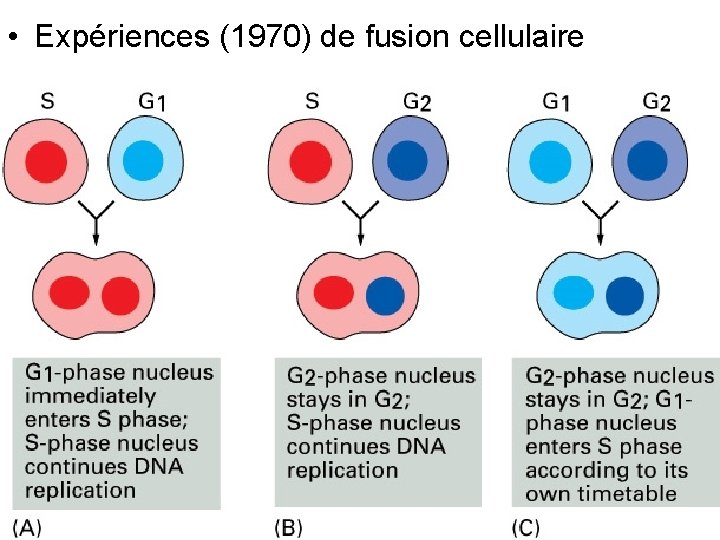
Expériences de fusion cellulaire • G 1 + S G 1 se réplique S contient S Cdk • G 2 + S Pas de synthèse d’ADN en G 2 • G 2 + G 1 Pas de synthèse d’ADN en G 1 10/22/2021 8

• Expériences (1970) de fusion cellulaire Fig 17 21 10/22/2021 9

Origin Recognition Complex (ORC) • Gros complexe multiprotéique qui se fixe sur l’origine de réplication (chez la levure) • Puis addition de nombreuses protéines régulatrices supplémentaires dont Cdc 6 10/22/2021 10

Cdc 6 • • Taux bas pendant le cycle cellulaire Augmentation transitoire en début de G 1 Se fixe à ORC Nécessaire à la liaison de protéines proches, les Mcm 10/22/2021 11

Protéines Mcm (Minichromosome Maintenance) • Maintien des minichromosomes circulaires dans la levure (en fait des plasmides) • Se fixent à ORC grâce à Cdc 6 • ORC + Cdc 6 + Mcm = pre replicative complexe 10/22/2021 12

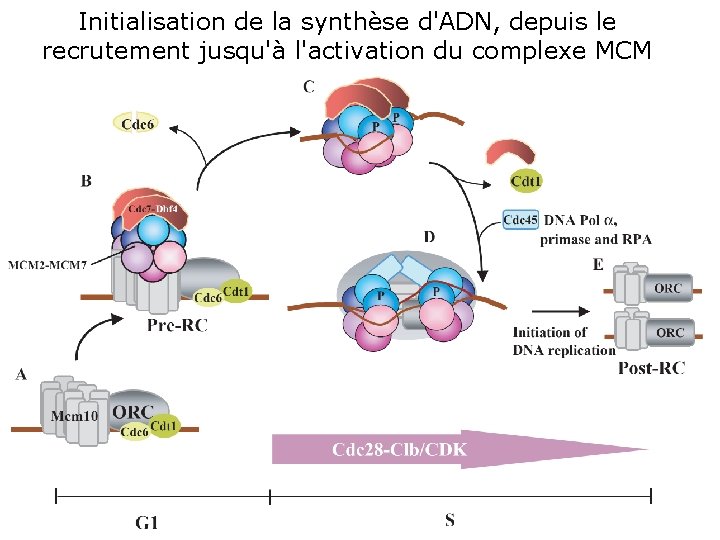
Initialisation de la synthèse d'ADN, depuis le recrutement jusqu'à l'activation du complexe MCM Initiating DNA synthesis: recruiting to Fig. Lei, M 2001 p 1447: 1. Initiating DNA synthesis, from recruitment to activation from of the MCM complex. (A) Assembly of the pre RC begins the during the G 1 phase, when Cdc 6 and Cdt 1 activating MCM complex. are recruited to replication origins to which ORC and Mcm 10 bind. (B) Cdc 6 and Cell Sci 2001, 114 Cdt 1 facilitate the loading of. Jthe MCM complex. Anchoring of the MCM complex is mediated through interaction between individual subunits of the MCM complex and multimers of the Mcm 10 protein. Cdc 6 is removed from origins once the MCM complex is recruited. The Cdc 7 Dbf 4 kinase is also recruited to the origin during G 1 phase. (C) Phosphorylation of the MCM complex by Cdc 7 Dbf 4 occurs during S phase and is controlled locally at individual origins. Phosphorylation of the MCM complex is coupled to a conformational change in the complex that results in the melting of origin DNA. ORC and Mcm 10 are hidden from view. (D) This conformational change is believed to convert the inactive MCM complex into the enzymatically active helicase, whose ring shaped structure becomes topologically linked to DNA (Tye and Sawyer, 2000). Recruitment of Cdc 45 requires both the phosphorylation of the MCM complex and the activity of CDKs. Disassociation of the MCM helicase by Cdc 45 from the Mcm 10 anchor initiates the melting of DNA and recruits RPA, DNA polymerase a, and primase to the origins for the initiation of DNA synthesis. (E) The melting of the ds. DNA induces a conformational change in ORC before replication origins assume a post replication chromatin state. Like the ORC, Mcm 10 is believed to remain bound to origins throughout the cell cycle. 10/22/2021 13

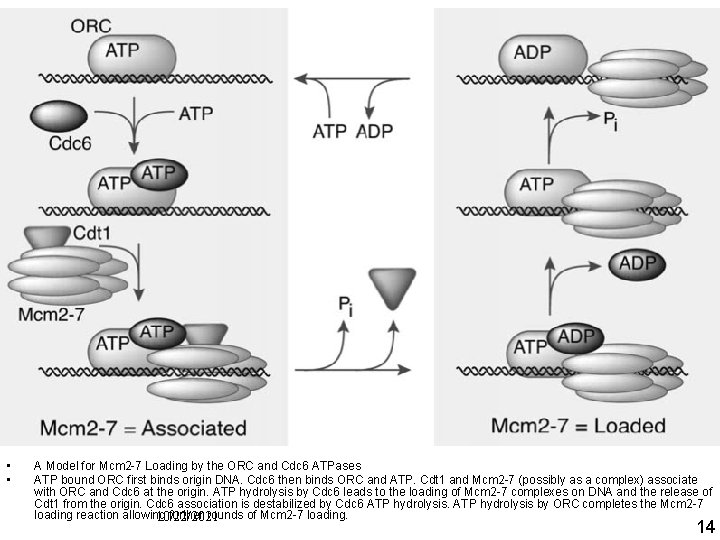
Mol Cell Volume 21, Issue 2 , 20 January 2006, Pages 143 144 Christin A. Cvetic and Johannes C. Walter Getting a Grip on Licensing: Mechanism of Stable Mcm 2 7 Loading onto Replication Origins • • A Model for Mcm 2 7 Loading by the ORC and Cdc 6 ATPases ATP bound ORC first binds origin DNA. Cdc 6 then binds ORC and ATP. Cdt 1 and Mcm 2 7 (possibly as a complex) associate with ORC and Cdc 6 at the origin. ATP hydrolysis by Cdc 6 leads to the loading of Mcm 2 7 complexes on DNA and the release of Cdt 1 from the origin. Cdc 6 association is destabilized by Cdc 6 ATP hydrolysis by ORC completes the Mcm 2 7 loading reaction allowing further rounds of Mcm 2 7 loading. 10/22/2021 14

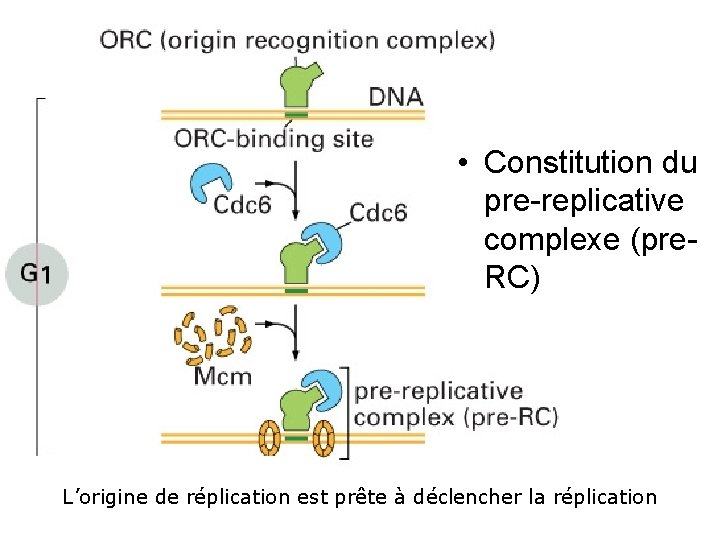
Fig 17 22 • Constitution du pre replicative complexe (pre RC) L’origine de réplication est prête à déclencher la réplication 10/22/2021 15

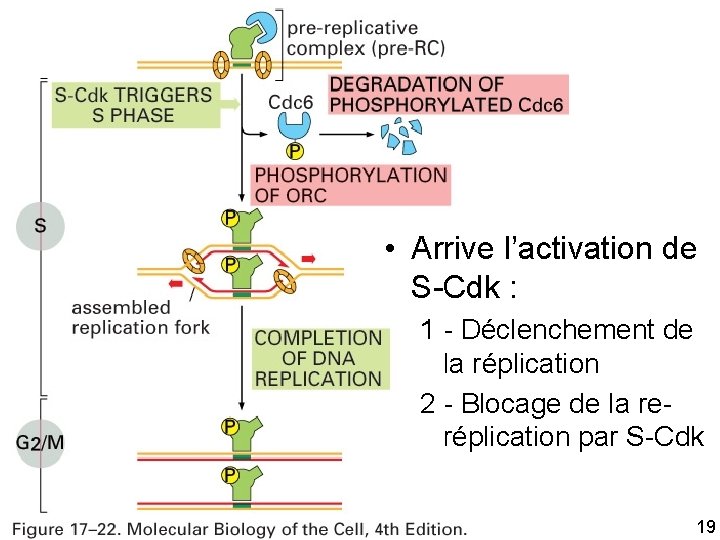
Arrive l’activation de S Cdk Deux actions "contraires" 1 Déclenchement de la réplication 2 Blocage de la re réplication 10/22/2021 16

1 Déclenchement de la réplication • Déclenchement par S Cdk en fin de G 1 • Phosphorylation de ORC par S Cdk et une autre protéine kinase 10/22/2021 17

2 Blocage de la re réplication par S Cdk • Par la dissociation de Cdc 6 du ORC (donc plus de pre RC plus de réplication) • Phosphorylation de Cdc 6 ubiquitinylation par le complexe SCF dégradation de Cdc 6 dans un protéasome • Phosphorylation de protéines Mcm exportation hors du noyau (intervention de G 1/S Cdk) 10/22/2021 18

Fig 17 22 • Arrive l’activation de S Cdk : 1 Déclenchement de la réplication 2 Blocage de la re réplication par S Cdk 10/22/2021 19

Inhibition de la re réplication de l'ADN : intervention des autres Cdk pendant les autres phases du cycle cellulaire • S Cdk – Activité élevée pendant G 2 et mitose précoce – Empêche la re réplication quand S est terminée • Pendant la mitose – M Cdk • phosphoryle Cdc 6 et les protéines Mcm • donc empêche la re réplication • En fin de G 1 – Aide à l'exportation des Mcm hors du noyau par 10/22/2021 G 1/S Cdk 20

Comment se fait la réplication au cycle suivant ? • Réponse : • A la fin de la mitose, toutes les activités Cdk sont ramenées à zéro • Déphosphorylation de Cdc 6 et Mcm • Réassemblage de pre RC (pre replicative complexe) 10/22/2021 21

B Complexe M Cdk Entrée en mitose

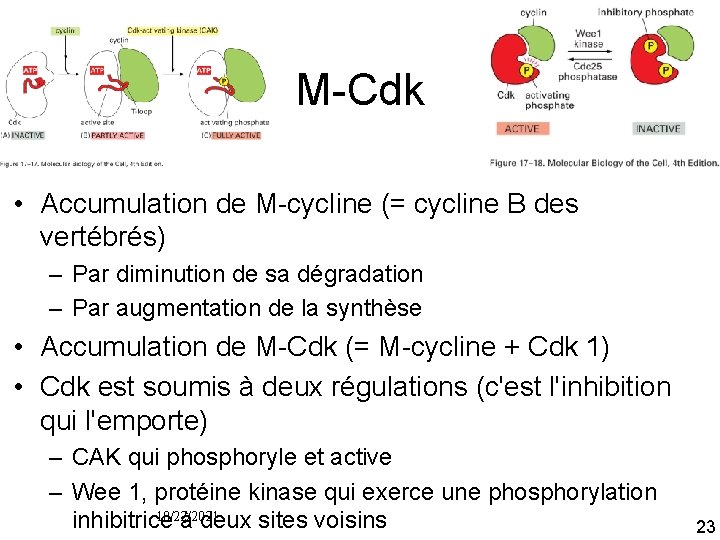
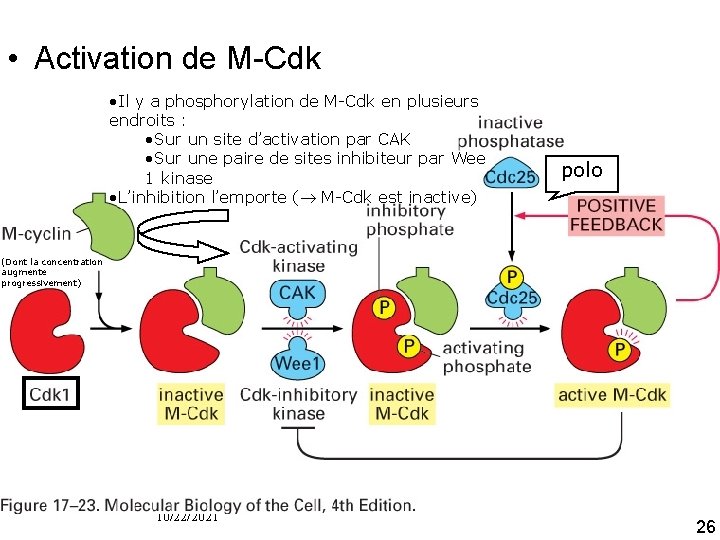
M Cdk • Accumulation de M cycline (= cycline B des vertébrés) – Par diminution de sa dégradation – Par augmentation de la synthèse • Accumulation de M Cdk (= M cycline + Cdk 1) • Cdk est soumis à deux régulations (c'est l'inhibition qui l'emporte) – CAK qui phosphoryle et active – Wee 1, protéine kinase qui exerce une phosphorylation 10/22/2021 inhibitrice à deux sites voisins 23

M Cdk • Accumulation de M Cdk prêt à agir mais inhibé par la double phosphorylation inhibitrice maintenue par Wee 1 • En fin de G 2 activation de Cdc 25 (protéine phosphatase) • Qui retire les deux phosphates inhibiteur de M Cdk • En même temps l'activité de la kinase inhibitrice Wee 1 est supprimée 10/22/2021 24

Qu'est ce qui active Cdc 25 ? • Deux protéine kinases – Kinase Polo – M Cdk elle même et M Cdk phosphoryle et inhibe Wee 1 • M Cdk – Active son activateur (Cdc 25) – Inhibe son inhibiteur • Feed back positif activation de tous les complexes M Cdk de la cellule explosion d'activité 10/22/2021 M Cdk 25

• Activation de M Cdk • Il y a phosphorylation de M-Cdk en plusieurs endroits : • Sur un site d’activation par CAK • Sur une paire de sites inhibiteur par Wee 1 kinase • L’inhibition l’emporte ( M-Cdk est inactive) (Dont la concentration augmente progressivement) polo Fig 17 23 10/22/2021 26

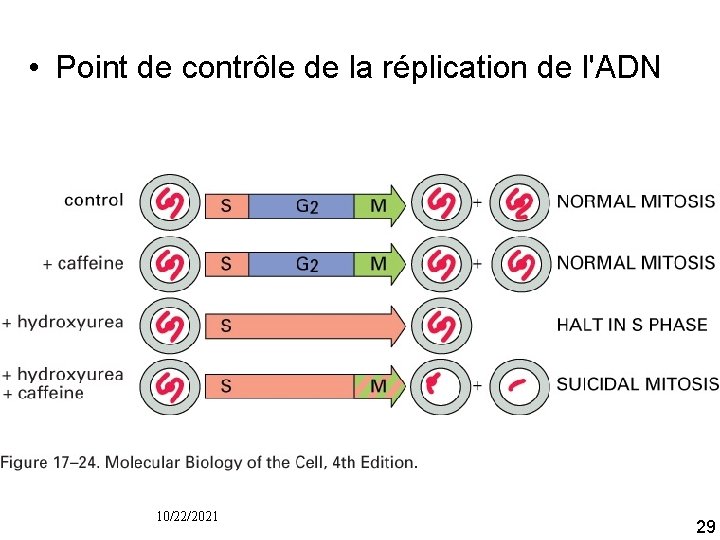
Point de contrôle de la réplication de l'ADN • Permet d'éviter de faire entrer en mitose des cellules qui n'ont pas répliqué tout l'ADN • Comment ? – Soit détection de l'ADN non répliqué – Soit détection d'une fourche de réplication en activité • Bloque l'activation de M Cdk (signal négatif) 10/22/2021 27

Expériences • Hydroxyurée : bloque la synthèse de l'ADN activation d'un point de contrôle pas d'entrée en mitose (signal négatif) • Caféine à fortes doses : bloque le point de contrôle (signal négatif) • Hydroxyurée + caféine entrée en mitose malgré un ADN incomplètement répliqué ("mitose suicide") 10/22/2021 28

• Point de contrôle de la réplication de l'ADN Fig 17 24 10/22/2021 29

C’est M-Cd k qui ça ! fait to u Rôles de M Cdk t • A elle seule, elle déclenche tous les processus d'entrée en mitose – – – – Assemblage du fuseau Attachement des chromosomes au fuseau Condensation des chromosomes (condensines) (…) Fragmentation de l'enveloppe nucléaire (lamina nucléaire) Réarrangement des filaments d'actine Réorganisation du Golgi Réorganisation de reticulum endoplasmique Réorganisation des microtubules • Tout se fait par des phosphorylations de protéines spécifiques de l'événement 10/22/2021 30

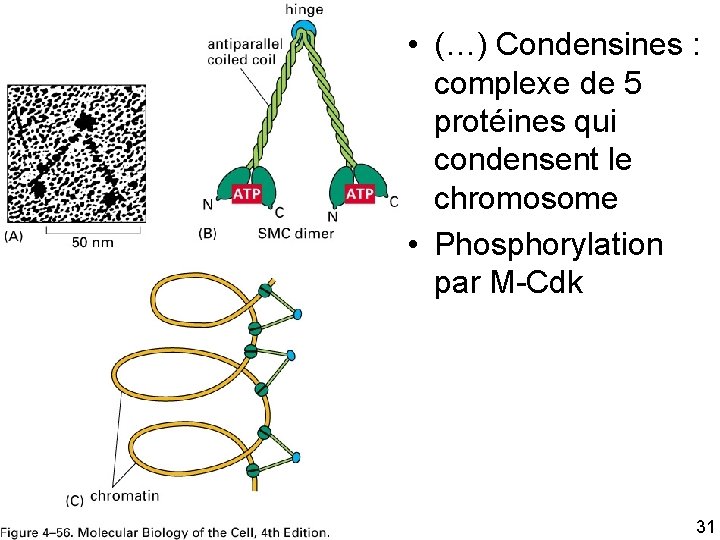
• (…) Condensines : complexe de 5 protéines qui condensent le chromosome • Phosphorylation par M Cdk Fig 4 56 10/22/2021 31

C Anaphase Promoting Complexe (APC) Séparation des chromatides sœur à la transition métaphase anaphase

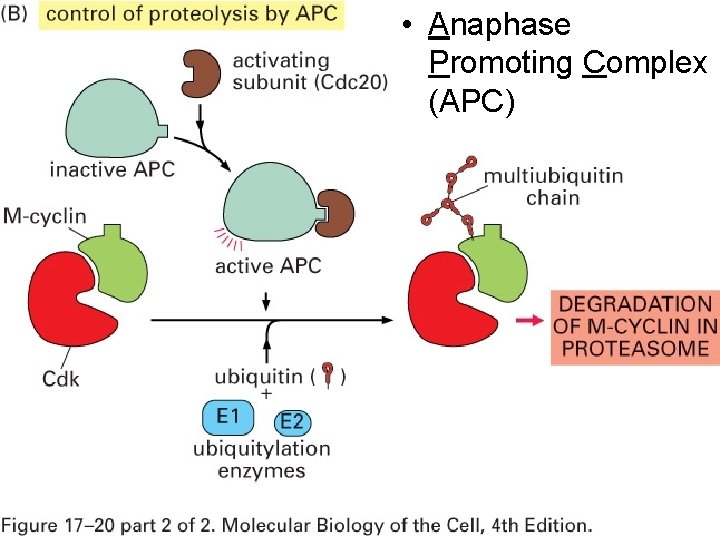
Séparation des chromatides sœur • A la transition métaphase – anaphase • Déclenchement par M Cdk puis • complexe Anaphase Promoting Complex (APC) • Perte soudaine de la cohésion entre les chromatides par activation de APC Rappel : les deux plus importantes ubiquitine ligases : 1. 2. Complexe SCF (Skp 1–Cul 1–FBP [F box protein]) APC 10/22/2021 (anaphase promoting complex) 33

Anaphase Promoting Complex (APC) • Ubiquitine ligase • Complexe très différent de M Cdk 10/22/2021 34

• Anaphase Promoting Complex (APC) Fig 17 20 B 10/22/2021 35

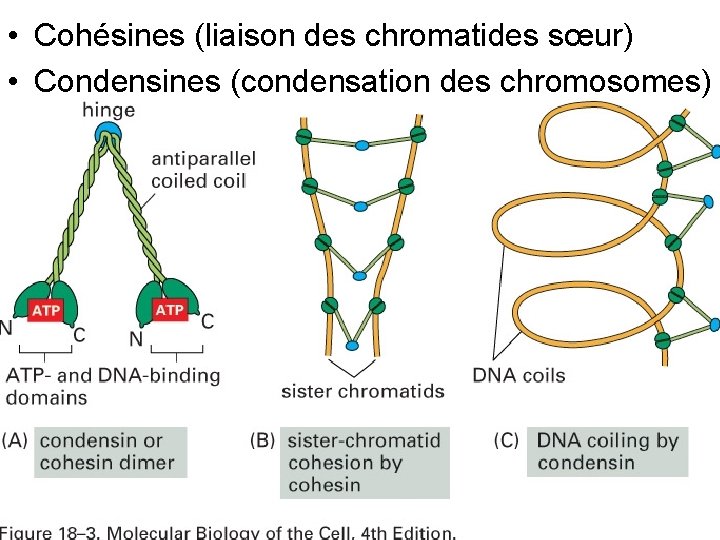
• Cohésines (liaison des chromatides sœur) • Condensines (condensation des chromosomes) Fig 18 3 10/22/2021 36

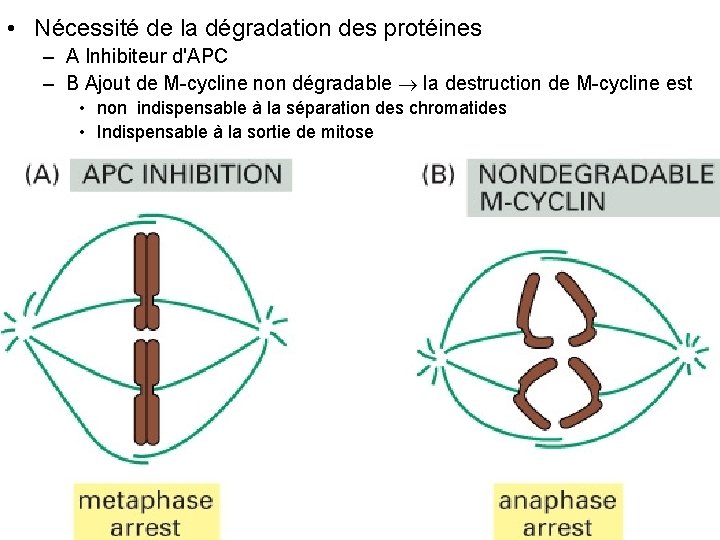
• Nécessité de la dégradation des protéines – A Inhibiteur d'APC – B Ajout de M cycline non dégradable la destruction de M cycline est • non indispensable à la séparation des chromatides • Indispensable à la sortie de mitose Fig 17 25 10/22/2021 37

Sécurine • Cible de APC • Avant l'anaphase se lie et inhibe la séparase 10/22/2021 38

Séparase • Protéase • Inhibée par la sécurine 10/22/2021 39

Réaction • • Activation de APC par Cdc 20 (cf infra) Destruction de la sécurine Libération de la séparase Phosphorylation du complexe cohésine (médiée par polo kinase) • Clivage du complexe cohésine • Les chromatides perdent leur cohésine et se séparent 10/22/2021 40

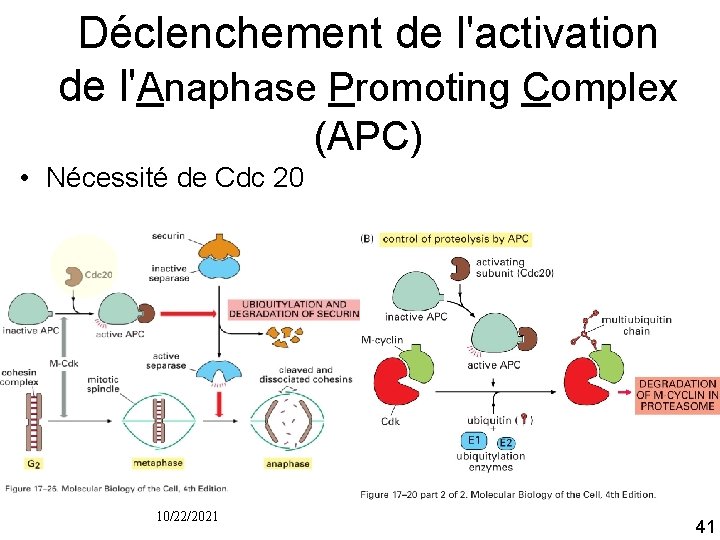
Déclenchement de l'activation de l'Anaphase Promoting Complex (APC) • Nécessité de Cdc 20 10/22/2021 41

Déclenchement de la séparation des chromatides par APC Fig 17 26 10/22/2021 42

Régulation de Cdc 20 1. Synthèse qui augmente à l'approche de la mitose (par augmentation de la transcription) 2. Phosphorylation de APC 10/22/2021 43

Quelles kinases phosphorylent et activent le complexe Cdc 20 – APC ? • Quelles kinases phosphorylent et activent le complexe Cdc 20 – APC ? – M Cdk ? Oui mais phase de latence – Autre ? – Inconnu et pourtant étape clé dans le déclenchement de l'anaphase pendant la phase M 10/22/2021 44

Point de contrôle de l'attachement du fuseau • Vérifie que tous les chromosomes sont attachés correctement au fuseau • Se fait sur le kinétochore • Un kinétochore mal attaché envoie un "signal négatif" qui bloque l'activation de Cdc 20 – APC • Quel "signal négatif" ? 10/22/2021 45

Nature du signal négatif • Mad 2 – Se fixe sur un kinétochore libre – Nécessaire au fonctionnement du point de contrôle • Un seul kinétochore libre entraîne – la liaison de Mad 2 et l'inhibition de Cdc 20 – APC – donc l’inhibition de la destruction de sécurine, – donc l’inhibition de l’activation de séparase – donc l’inhibition de la séparation des chromatides etc… 10/22/2021 46

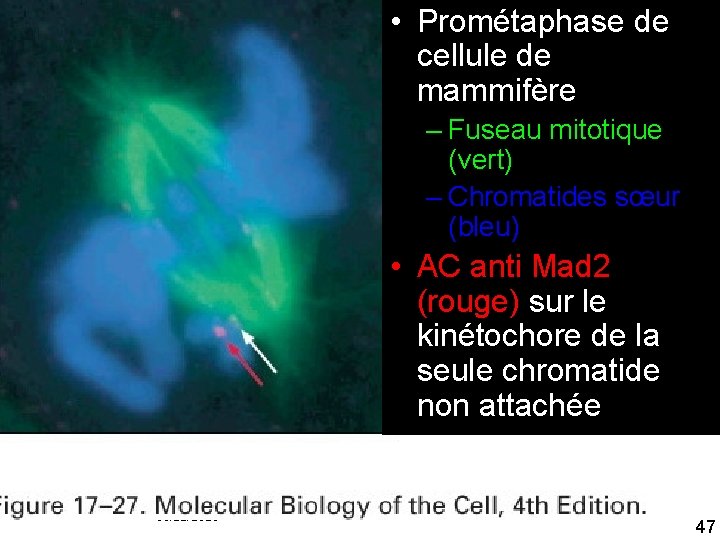
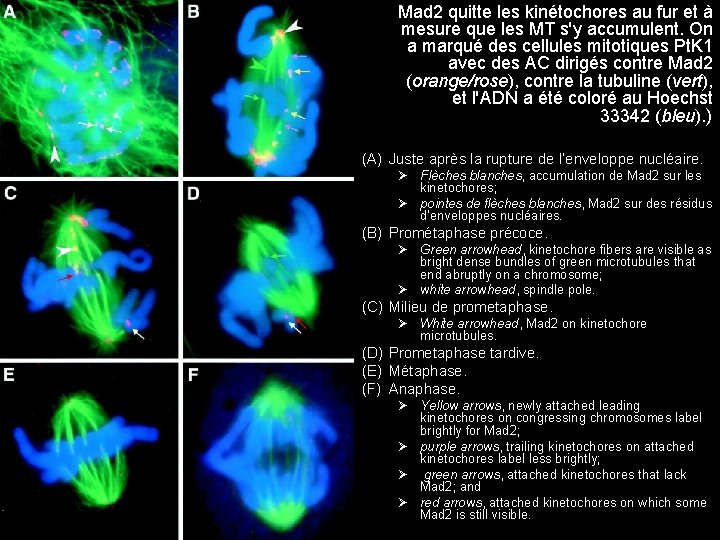
• Prométaphase de cellule de mammifère – Fuseau mitotique (vert) – Chromatides sœur (bleu) Fig 10/22/2021 • AC anti Mad 2 (rouge) sur le 17 27 kinétochore de la seule chromatide non attachée 47

J. Cell Biol. , Volume 141, Number 5, June 1, 1998 1181 1191. Localization of Mad 2 to Kinetochores Depends on Microtubule Attachment, Not Tension Jennifer C. Waters, Rey Huei Chen, Andrew W. Murray, and E. D. Salmon 10/22/2021 Mad 2 quitte les kinétochores au fur et à mesure que les MT s'y accumulent. On a marqué des cellules mitotiques Pt. K 1 avec des AC dirigés contre Mad 2 (orange/rose), contre la tubuline (vert), et l'ADN a été coloré au Hoechst 33342 (bleu). ) (A) Juste après la rupture de l’enveloppe nucléaire. Ø Flèches blanches, accumulation de Mad 2 sur les kinetochores; Ø pointes de flèches blanches, Mad 2 sur des résidus d’enveloppes nucléaires. (B) Prométaphase précoce. Ø Green arrowhead, kinetochore fibers are visible as bright dense bundles of green microtubules that end abruptly on a chromosome; Ø white arrowhead, spindle pole. (C) Milieu de prometaphase. Ø White arrowhead, Mad 2 on kinetochore microtubules. (D) Prometaphase tardive. (E) Métaphase. (F) Anaphase. Ø Yellow arrows, newly attached leading kinetochores on congressing chromosomes label brightly for Mad 2; Ø purple arrows, trailing kinetochores on attached kinetochores label less brightly; Ø green arrows, attached kinetochores that lack Mad 2; and Ø red arrows, attached kinetochores on which some Mad 2 is still visible. 48

Point de contrôle de la chronologie de l'anaphase • Il n'y en a pas • Si mutation du point de contrôle de l'attachement du fuseau, la chronologie de l'anaphase est normale (ou légèrement retardée chez les mammifères) 10/22/2021 49

D M Cdk Sortie de la mitose Mitosis Exit Network (MEN)

Sortie de la mitose • Après la ségrégation de l'anaphase, • Il faut tout refaire en sens inverse : – Désassemblage du fuseau – Décondensation des chromosomes – Reconstruction de l'enveloppe nucléaire 10/22/2021 51

Sortie de la mitose • Entrée en mitose phosphorylation • Sortie de mitose déphosphorylation des mêmes protéines • Hypothèses : – Inactivation de M Cdk (le plus important) … – Activation de phosphatases – Les deux 10/22/2021 52

Inactivation de M Cdk • Ubiquitinylation des cyclines M… • … activées par le même complexe Cdc 20 APC que celui qui détruit la sécurine à la transition métaphase – anaphase 10/22/2021 53

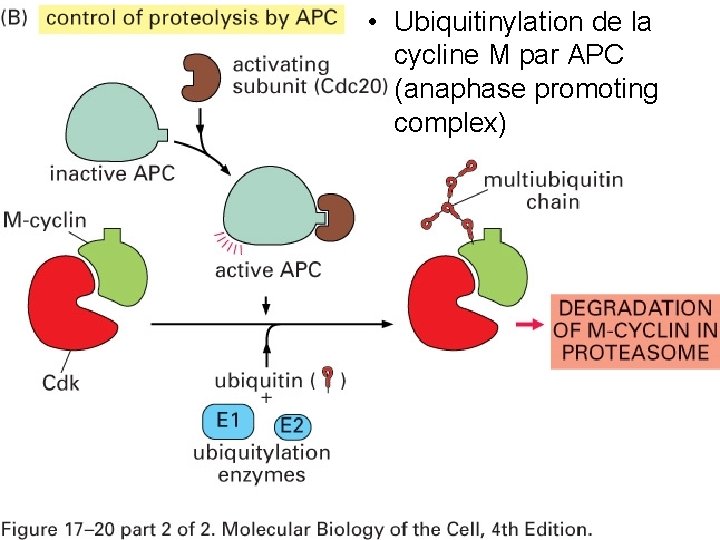
Fig 10/22/2021 • Ubiquitinylation de la cycline M par APC 17 20 (anaphase promoting complex) 54

Résumé sur Cdc 20 APC • Conduit à l'anaphase • Conduit à l'inactivation de M Cdk donc la sortie de mitose 10/22/2021 55

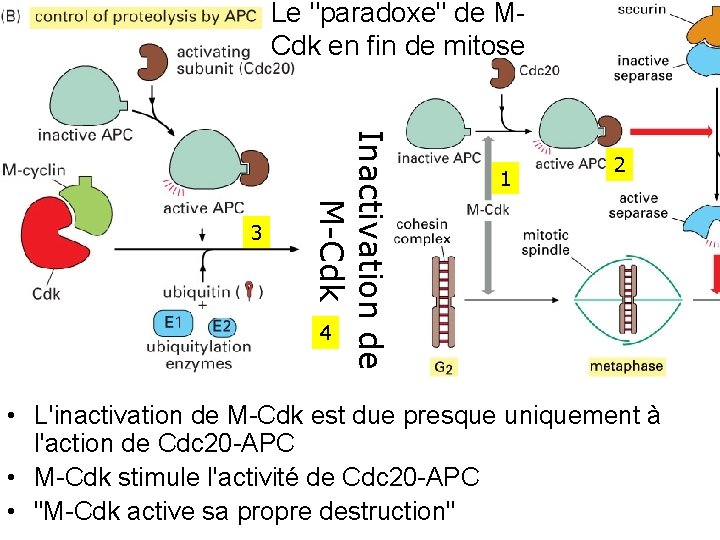
Le "paradoxe" de M Cdk en fin de mitose Inactivation de M-Cdk 3 1 2 4 • L'inactivation de M Cdk est due presque uniquement à l'action de Cdc 20 APC • M Cdk stimule l'activité de Cdc 20 APC • "M Cdk active sa propre destruction" 10/22/2021 56

E Phase G 1 : Hct 1 et Sic 1 Inactivité stable de Cdk 10/22/2021 57

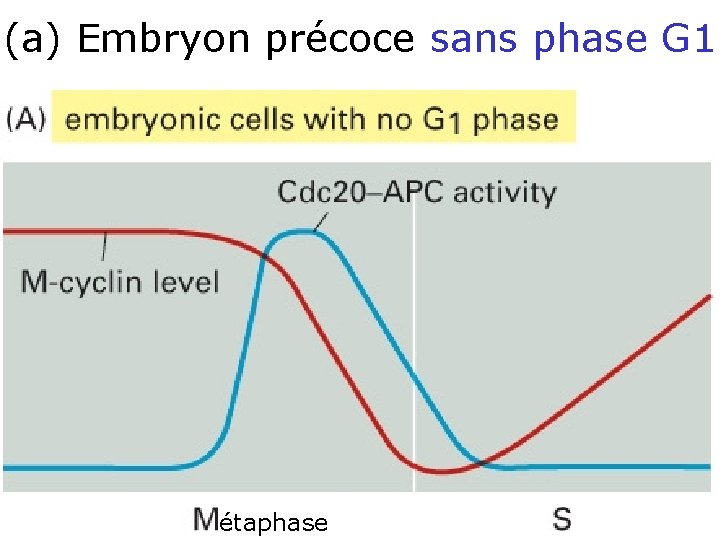
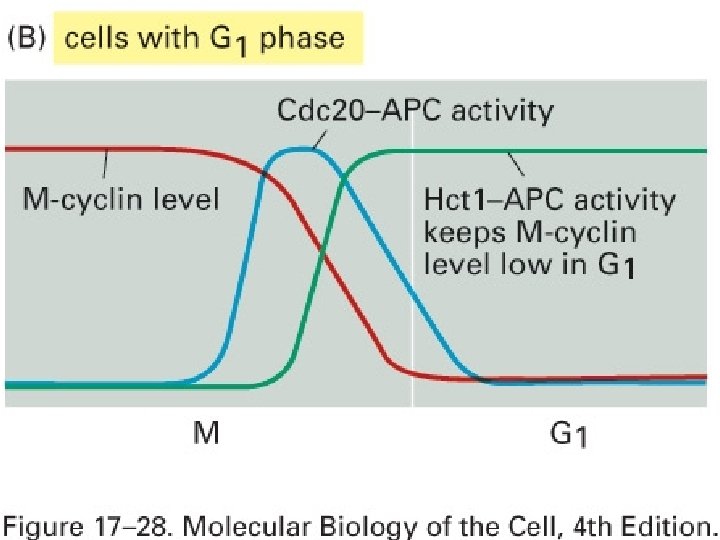
(a) Embryon précoce sans phase G 1 • Les deux données de base – (Cdc 20 -APC inactive M-Cdk) – (M-Cdk stimule Cdc 20 -APC) • M-Cdk est haut • Cdc 20 -APC augmente • M-cycline (de M-Cdk) diminue • inactivation de APC • La cellule peut à nouveau accumuler de la M-cycline rapidement 10/22/2021 58

(a) Embryon précoce sans phase G 1 • Création d’une phase G 1 stable : cellules d’embryon Figprécoces 17 28 Asans phase G 1 étaphase 10/22/2021 59

(b) Cellules dont le cycle comporte une phase G 1 • • • L’accumulation rapide de cycline n’est pas nécessaire Il faut laisser le temps à la cellule de croître Il faut éviter la réactivation de M Cdk à la fin de la mitose plusieurs mécanismes 1. Protéine Hct 1 2. Protéines CKI (cdk inhibitor protein) 3. Baisse de la transcription des gènes de cycline M 10/22/2021 60

Les trois mécanismes pour supprimer l’activité de M Cdk en G 1 1. Protéine Hct 1 ( Cdc 20) 2. Augmentation de la production de protéines CKI (Cdk inhibitor protein eg Sic 1) 3. Baisse de la transcription des gènes de cycline M 10/22/2021 61

1 Protéine Hct 1 • Proche de Cdc 20 • Active APC comme Cdc 20 • Toutefois – Cdc 20 -APC est activé par M-Cdk (accélérant la destruction de M-Cdk) – Hct 1 est inhibé par M-Cdk qui la phosphoryle directement • Hct 1 -APC augmente en mitose tardive après la destruction de M-cycline par Cdc 20 -APC la destruction de la cycline M continue après la mitose : • Bien que l’activité de Cdc 20 -APC ait baissé l’activité 10/22/2021 de Hct 1 -APC reste élevée 62

• Création d’une phase G 1 stable dans des cellules avec phase G 1 Fig 17 28 B 10/22/2021 63

Cellules avec phase G 1 • La chute d’activité de M Cdk en fin de mitose (à cause de Cdc 20 -APC) • conduit à l’absence de baisse de Hct 1 APC (parce que M-Cdk inhibe Hct 1 -APC [levée d’inhibition]) • Garantissant une suppression continue de l’activité de M Cdk après la mitose (parce que Hct 1 active APC qui détruit la cycline M) 10/22/2021 64

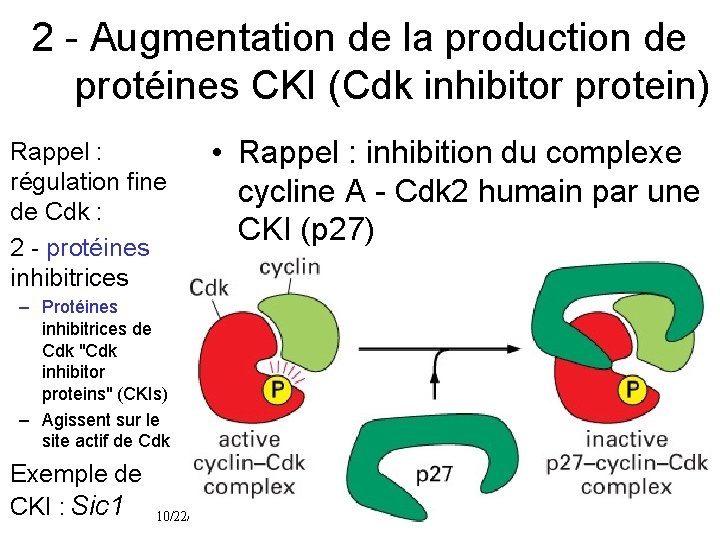
2 Augmentation de la production de protéines CKI (Cdk inhibitor protein) Rappel : régulation fine de Cdk : 2 protéines inhibitrices • Rappel : inhibition du complexe cycline A Cdk 2 humain par une CKI (p 27) – Protéines inhibitrices de Cdk "Cdk inhibitor proteins" (CKIs) – Agissent sur le site actif de Cdk Exemple de CKI : Sic 1 10/22/2021 65

Sic 1 • • • C’est une Cdk Inhibitor protein (CKI) Étudiée chez la levure bourgeonnante Inactive M Cdk en fin de mitose Inactivée par M Cdk (comme Hct 1) M Cdk – inhibe Sic 1 – Inhibe un gène de synthèse de Sic 1 diminution de la production • Inhibition mutuelle de M Cdk et Sic 1 – Sic 1 inhibe M Cdk – M Cdk inhibe Sic 1 • Comme pour M Cdk et Htc 1 (inhibition mutuelle) 10/22/2021 66

3 Baisse de la transcription des gènes de cycline M • Normalement M Cdk active les gènes de cycline feed back positif • Mais en fin de mitose – Hct 1 et Sic 1 inactivent M Cdk – Diminution de la transcription des gènes de cycline 10/22/2021 67

Résumé des trois mécanismes • L’activité de M Cdk est supprimée par – L’activation de Hct 1 APC – L’accumulation de CKI • Sic 1 chez la levure • p 27 chez les mammifères – La diminution de production de cycline • mécanisme robuste… • Comment en sortir ? ? 10/22/2021 – Il faut la synthèse de cycline G 1 (cf. infra) 68

F Comment initialiser la phase S • Accumulation de cycline G 1 – Non détruites par Hct 1 APC – Non inhibée par Sic 1 • Accumulation de G 1 Cdk 10/22/2021 69

Conséquences de l’augmentation du complexe G 1 Cdk • Déclenche la transcription des gènes de la cycline G 1/S • G 1/S augmente • Formation de complexes G 1/S Cdk (qui sont résistants à Hct 1 APC et Sic 1) qui – Font entrer la cellule en phase S – Stimulent la transcription des gènes de cyclines S et la formation de complexes S Cdk • Ces complexes S Cdk sont inhibés par Sic 1 • Mais G 1/S Cdk phosphoryle et inactive Sic 1 (et Hct 1 APC) • Activation 10/22/2021 de S Cdk 71

Conclusion sur le passage d’un G 1 stable à S • C’est la même boucle qui – déclenche l’inactivation de M Cdk en mitose tardive – et qui active rapidement et complètement S Cdk en fin de G 1 • mais en sens inverse 10/22/2021 72

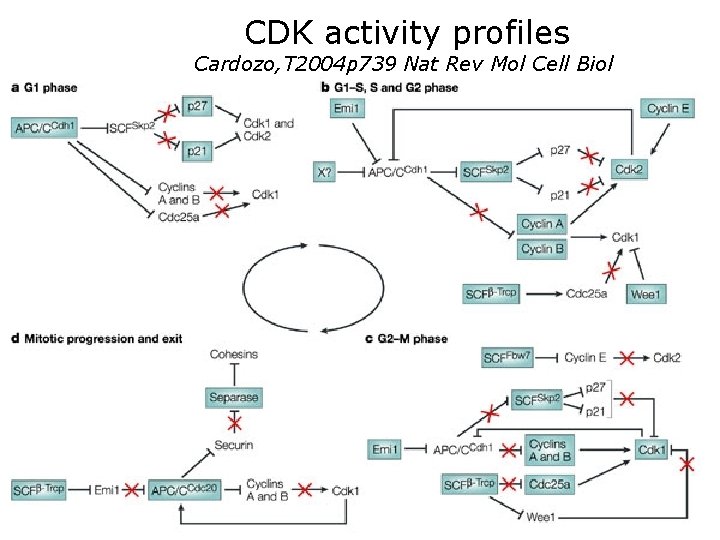
CDK activity profiles Cardozo, T 2004 p 739 Nat Rev Mol Cell Biol • Cyclin dependent kinases (CDKs) represent both the engine and the pacemaker of the cell cycle. It is now clear that proteolysis is a significant force that imposes the required checks and balances on this engine. During G 1, Cdk 1 and Cdk 2 need to be idle to avoid premature DNA synthesis and mitosis (see figure, panel a). Starting at the G 1–S checkpoint — the point at which DNA replication and centrosome duplication begins — Cdk 2 markedly increases its activity (see figure, panel b). The activity of Cdk 2, and therefore the phosphorylation of its substrates, builds to a peak through the DNA synthesis and centrosome duplication phase into G 2, at which point the activity of Cdk 2 is attenuated again. The coincidence of peaking Cdk 2 activity and peaking activity of the DNA replication and centrosome duplication machinery indicates that Cdk 2 somehow releases and maintains the nuclear environment that is necessary for the synthetic machinery to function. Although Cdk 2 seems to be the optimal agent for this purpose, it is not absolutely required. Low Cdk 1 activity and/or the action of other CDKs contribute to these processes, and can accomplish them in the absence of Cdk 2, at least under normal cellular conditions 3. 10/22/2021 Cardozo, T 2004 p 739 Nat Rev Mol Cell Biol 73

Protéine Rb • Rappel : suppression de l'activité de M-Cdk en G 1 par – Activation de Hct 1 – Accumulation de CKI • Sic 1 chez la levure • p 27 chez les mammifères – Inhibition de la transcription des gènes de cycline • Activation du complexe G 1 Cdk en fin de G 1 – Inversion des 3 mécanismes 10/22/2021 75

G 1 Cdk • Les effets les mieux connus de G 1 Cdk sont médiés par E 2 F 10/22/2021 76

E 2 F • Protéine régulatrice de gène • Sert de médiateur à l'activité de G 1 Cdk • Se fixe sur des promoteurs d'ADN codant pour des protéines nécessaires à l'entrée en phase S dont les cyclines G 1/S et S • E 2 F est contrôlé par la protéine du rétinoblastome Rb 10/22/2021 77

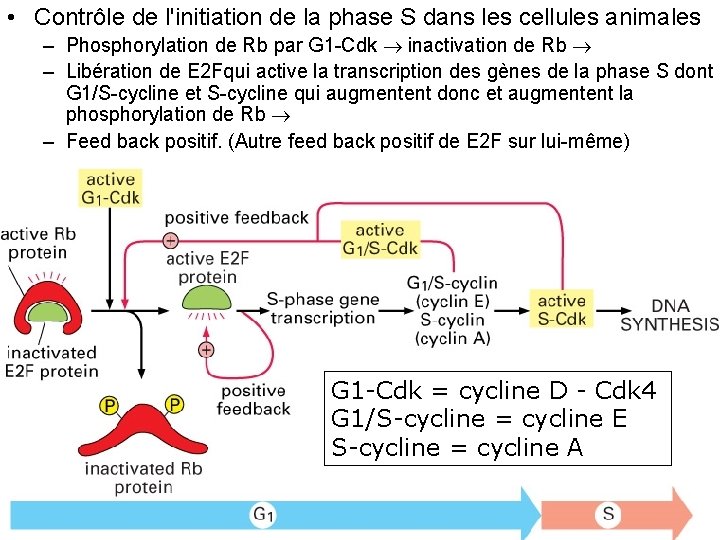
• Contrôle de l'initiation de la phase S dans les cellules animales – Phosphorylation de Rb par G 1 Cdk inactivation de Rb – Libération de E 2 Fqui active la transcription des gènes de la phase S dont G 1/S cycline et S cycline qui augmentent donc et augmentent la phosphorylation de Rb – Feed back positif. (Autre feed back positif de E 2 F sur lui même) Fig 17 30 G 1 -Cdk = cycline D - Cdk 4 G 1/S-cycline = cycline E S-cycline = cycline A 10/22/2021 79

Les boucles de feed back • E 2 F augmente sa propre synthèse (positif) • E 2 F transcription de G 1/S cycline et S cycline activité de G 1/S Cdk et S Cdk phosphorylation de Rb libération de E 2 F transcription de G 1/S cycline et S-cycline activité de G 1/S-Cdk et S-Cdk phosphorylation de Rb libération de E 2 F etc… (positif) • Activation de G 1/S Cdk et S Cdk phosphorylation de Hct 1 et p 27 destruction 10/22/2021 de G 1/S Cdk et S Cdk (négatif) 80

Résultat final • Activation rapide et complète du complexe S Cdk nécessaire à l'initiation de la phase S 10/22/2021 81

Rétinoblastome • Cancer de la rétine chez l'enfant • La perte des deux copies du gène Rb 1 conduit à une prolifération excessive de la rétine immature • La perte complète du gène est compensée au début – par Hct 1 et p 27 dans les autres types de cellules – Et des protéines proches de Rb 10/22/2021 82

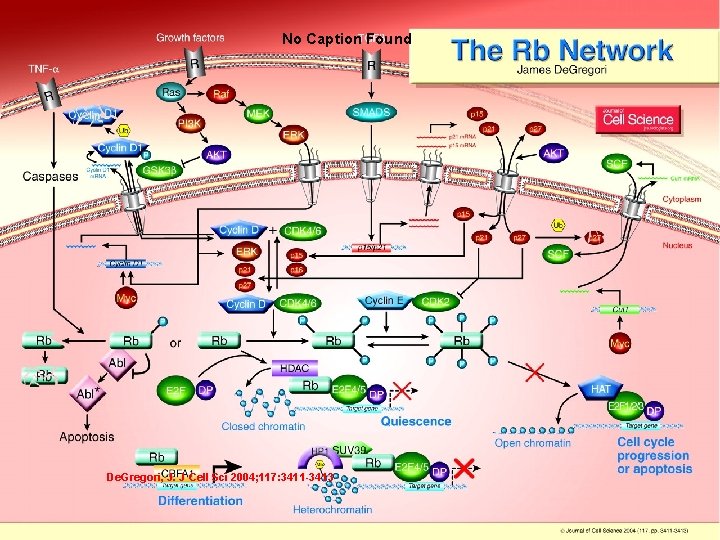
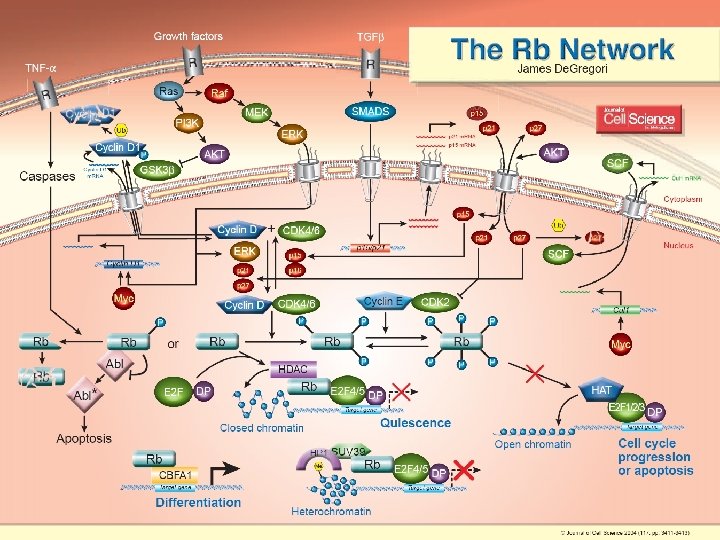
No Caption Found De. Gregori, J 2004 p 341 1 De. Gregori, J. J Cell Sci 2004; 117: 3411 -3413 10/22/2021 83

De. Gregori, J 2004 p 3411 10/22/2021 84

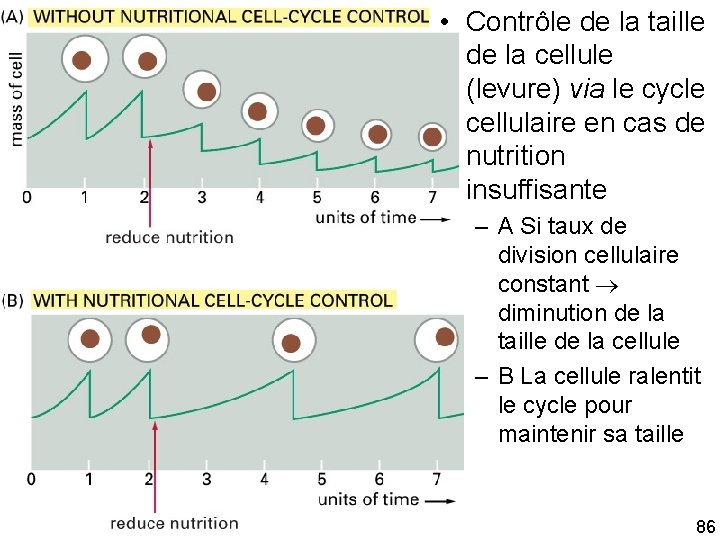
Coordination croissance prolifération • Nécessité d’une phase suffisamment longue pour multiplier le nombre de molécules par deux – Cycle trop court cellule trop petite – Cycle trop long cellule trop grosse • rôle de l’environnement sur le cycle • Grâce à cycline 3 (Cln 3 chez la levure cycline D des vertébrés) 10/22/2021 85

• Contrôle de la taille de la cellule (levure) via le cycle cellulaire en cas de nutrition insuffisante Fig 17 31 10/22/2021 – A Si taux de division cellulaire constant diminution de la taille de la cellule – B La cellule ralentit le cycle pour maintenir sa taille 86

Cycline Cln 3 chez la levure ( cycline D des vertébrés) • C’est une cycline G 1 • Taux de synthèse parallèle à la croissance de la cellule (la quantité augmente mais la concentration reste constante) – Si on augmente artificiellement Cln 3 la cellule se divise en deux cellules plus petites – Si on diminue artificiellement Cln 3 la cellule se divise en deux cellules plus grosses • la cellule entre en division à partir d’un certain seuil de Cln 3 10/22/2021 87

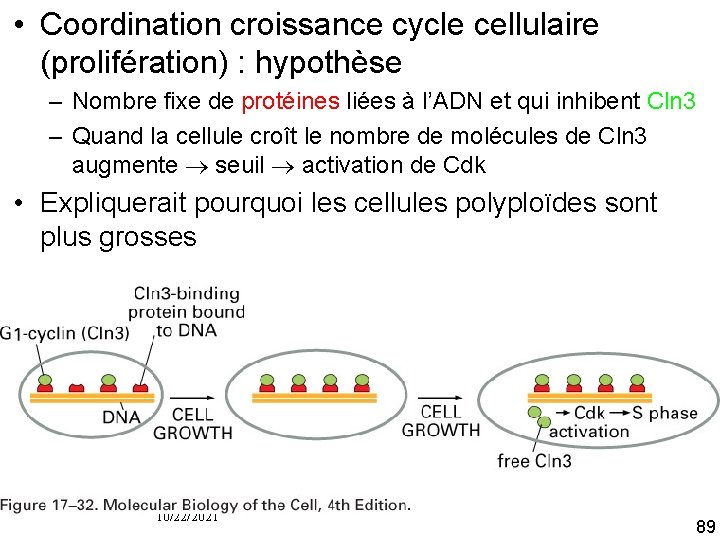
Comment gérer la quantité de Cln 3 plutôt que sa concentration ? • Hypothèse : la cellule aurait hérité d’une quantité fixe d’un inhibiteur qui se lierait et bloquerait l’activité de Cln 3 • Quand Cln 3 dépasse l’inhibiteur, elle déclenche l’activation de G 1 Cdk nouveau cycle • Nature de cet inhibiteur en quantité constante ? – ADN lui même ? – Ou protéine liée à l’ADN ? 10/22/2021 88

• Coordination croissance cycle cellulaire (prolifération) : hypothèse – Nombre fixe de protéines liées à l’ADN et qui inhibent Cln 3 – Quand la cellule croît le nombre de molécules de Cln 3 augmente seuil activation de Cdk • Expliquerait pourquoi les cellules polyploïdes sont plus grosses Fig 17 32 10/22/2021 89

Exceptions à la coordination croissance prolifération • Levure : la croissance se fait en fonction des nutriments extérieurs • Cellule animale : présence de signaux qui stimulent croissance et prolifération • Croissance et prolifération peuvent évoluer de façon indépendante – Croissance sans division ou – Division sans croissance • Œuf de xénope – Au début (avant fécondation) croissance sans division – Puis (après fécondation) division sans croissance 10/22/2021 90

Les points de contrôle des dommages de l’ADN • Il existe des points de contrôle de l’intégrité de l’ADN – Si l’ADN est altéré il faut attendre qu’il soit réparé avant de le répliquer – au moins deux points de contrôle pour stopper le cycle 1. Un en fin de G 1 (bloque l'entrée en phase S) 2. Un en fin de G 2 (bloque l'entrée en mitose) 10/22/2021 91

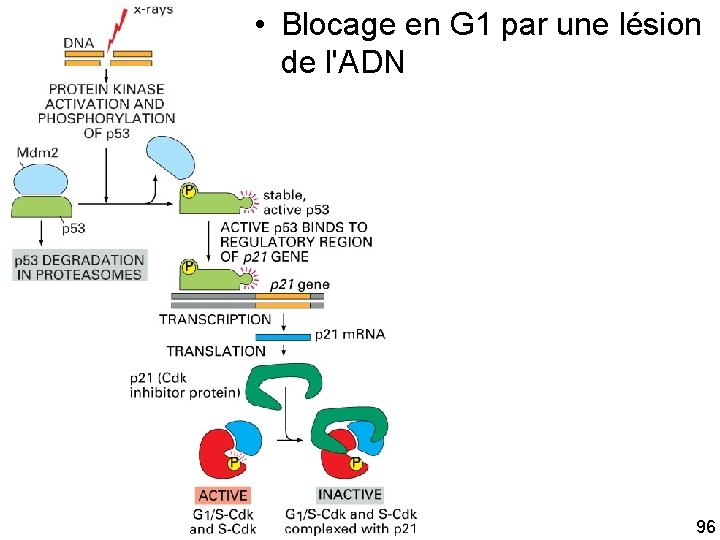
1 Point de contrôle en fin de G 1 pour bloquer l'entrée en phase S • • • Au point G 1 tardif : inhibition de l'activation des complexes G 1/S Cdk et S Cdk eg : Altération de l'ADN * activation de la protéine régulatrice de gène p 53 qui stimule la transcription de gènes dont la CKI p 21 qui se lie à G 1/S Cdk et inhibe leur action blocage de l'entrée en phase S Comment ? ? Par un mécanisme indirect 10/22/2021 92

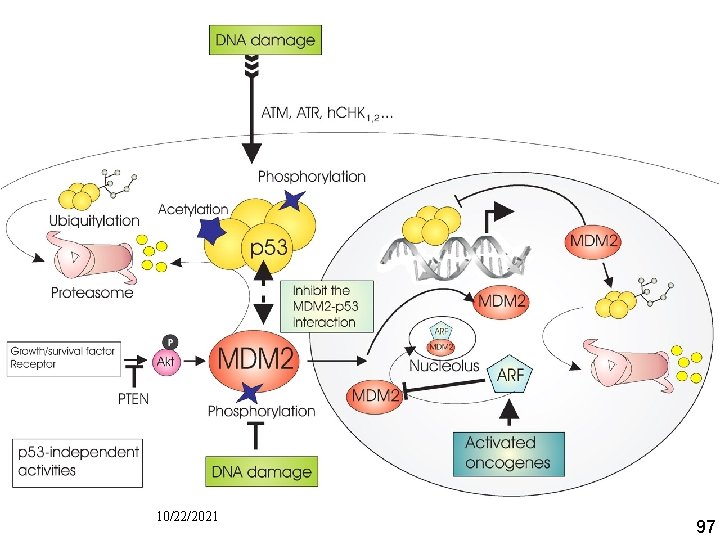
Comment une altération de l'ADN active t elle p 53 ? • Dans une cellule normale : – p 53 est instable et à faible concentration car interagit avec Mdm 2 qui se comporte comme une ubiquitine ligase • Si lésion de l'ADN – – – Activation de protéines kinases qui phosphorylent p 53 Affaiblissement de sa liaison avec Mdm 2 Diminution de la dégradation de p 53 Augmentation de la p 53 dans la cellule Activation de CKI (p 21) etc… cf. supra 10/22/2021 93

Proto Oncogene Proteins c mdm 2 • An e 3 ubiquitin ligase that – interacts with and – inhibits tumor suppressor protein p 53. • Its ability to ubiquitinate p 53 is regulated by tumor suppressor protein p 14 arf. 10/22/2021 94

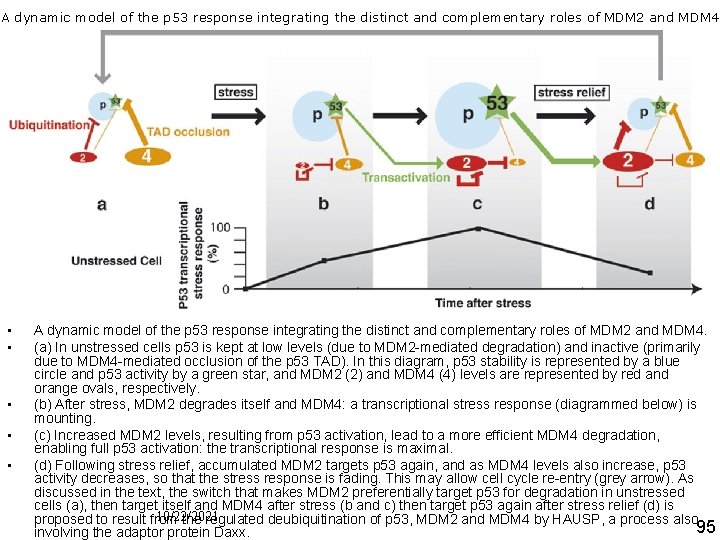
A dynamic model of the p 53 response integrating the distinct and complementary roles of MDM 2 and MDM 4 Int J Biochem Cell Biol. 2007; 39(7 8): 1476 82. MDM 2 and MDM 4: p 53 regulators as targets in anticancer therapy. Toledo F, Wahl GM. • • • A dynamic model of the p 53 response integrating the distinct and complementary roles of MDM 2 and MDM 4. (a) In unstressed cells p 53 is kept at low levels (due to MDM 2 mediated degradation) and inactive (primarily due to MDM 4 mediated occlusion of the p 53 TAD). In this diagram, p 53 stability is represented by a blue circle and p 53 activity by a green star, and MDM 2 (2) and MDM 4 (4) levels are represented by red and orange ovals, respectively. (b) After stress, MDM 2 degrades itself and MDM 4: a transcriptional stress response (diagrammed below) is mounting. (c) Increased MDM 2 levels, resulting from p 53 activation, lead to a more efficient MDM 4 degradation, enabling full p 53 activation: the transcriptional response is maximal. (d) Following stress relief, accumulated MDM 2 targets p 53 again, and as MDM 4 levels also increase, p 53 activity decreases, so that the stress response is fading. This may allow cell cycle re entry (grey arrow). As discussed in the text, the switch that makes MDM 2 preferentially target p 53 for degradation in unstressed cells (a), then target itself and MDM 4 after stress (b and c) then target p 53 again after stress relief (d) is 10/22/2021 proposed to result from the regulated deubiquitination of p 53, MDM 2 and MDM 4 by HAUSP, a process also 95 involving the adaptor protein Daxx.

• Blocage en G 1 par une lésion de l'ADN Fig 17 33 10/22/2021 96

• • Molecular Cancer Research Vol. 1, 1001– 1008, December 2003 Ute M. Moll and Oleksi Petrenko The MDM 2 p 53 Interaction FIGURE 1. Regulation of p 53 by MDM 2. p 53 and MDM 2 form an autoregulatory feedback loop. p 53 stimulates the expression of MDM 2; MDM 2, in turn, inhibits p 53 activity because it stimulates its degradation in the nucleus and the cytoplasm, blocks its transcriptional activity, and promotes its nuclear export. A broad range of DNA damaging agents or deregulated oncogenes induces p 53 activation. DNA damage promotes phosphorylation of p 53 and MDM 2, thereby preventing their interaction and stabilizing p 53. Likewise, activated oncogenes induce ARF protein, which sequesters MDM 2 into the nucleolus, thus preventing the degradation of p 53. Conversely, survival signals mediate nuclear import of MDM 2 via Akt activation, which destabilizes p 53. Moll, UM 2003 p 1001(fig 1) 10/22/2021 97

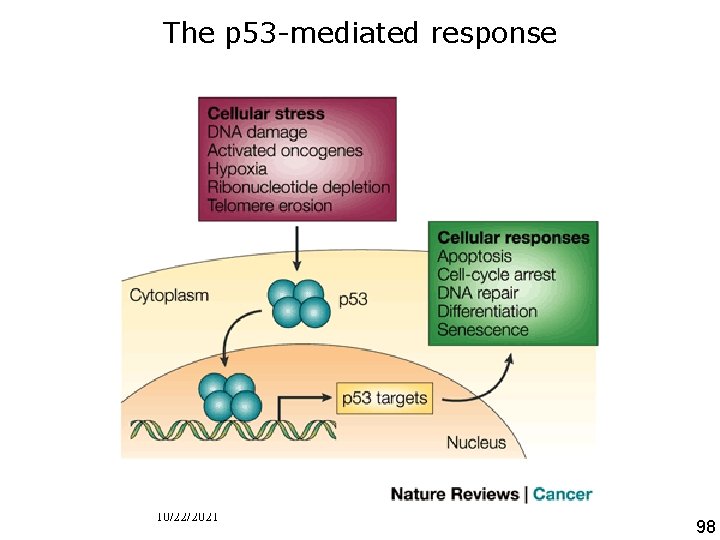
The p 53 -mediated response • Figure 1 | The p 53 -mediated response. p 53 exists in nonstressed cells at a very low concentration. Under stress conditions, the p 53 protein accumulates in the cell, binds in its tetrameric form to p 53 response elements and induces the transcription of various genes that are involved in Chene, P 200 cell cycle control, apoptosis, DNA repair, differentiation and senescence. The loss of p 53 3 p 102 Nat tumour suppressor activity by mutation/deletion of TP 53 or inhibition of. Cancer p 53 allows the proliferation of Rev the cells that are damaged under the stress conditions. This uncontrolled proliferation can lead to tumour development. 10/22/2021 98

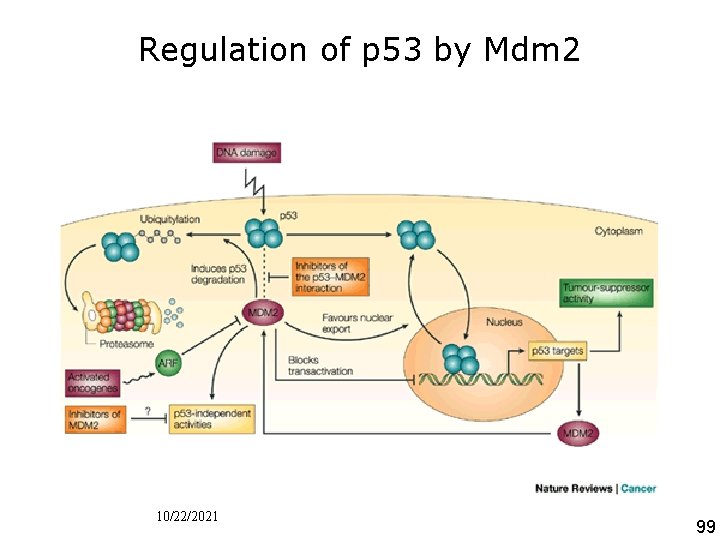
Regulation of p 53 by Mdm 2 • Figure 2 I Regulation of p 53 by M DM 2. p 53 and MDM 2 form an auto regulatory feedback loop. p 53 stimulates the expression of MDM 2; MDM 2 inhibits p 53 activity because it blocks its transcriptional activity, favours its nuclear export and stimulates its degradation. Different cellular signais, such as DNA damage or oncogene activation, induce p 53 activation. DNA damage favours p 53 phosphorylation, preventing its association with MDM 2. Activated oncogenes activate the ARF protein, which prevents the MDM 2 mediated degradation of p 53. Similarly, inhibitors of the p 53 MDM 2 interaction should activate p 53 tumour suppressor activity in tumour cells that express wild type p 53. These compounds, because they bind to MDM 2, could also affect the p 53 independent activities of MDM 2. Chene, P 200 3 p 102 Nat Rev Cancer 10/22/2021 99

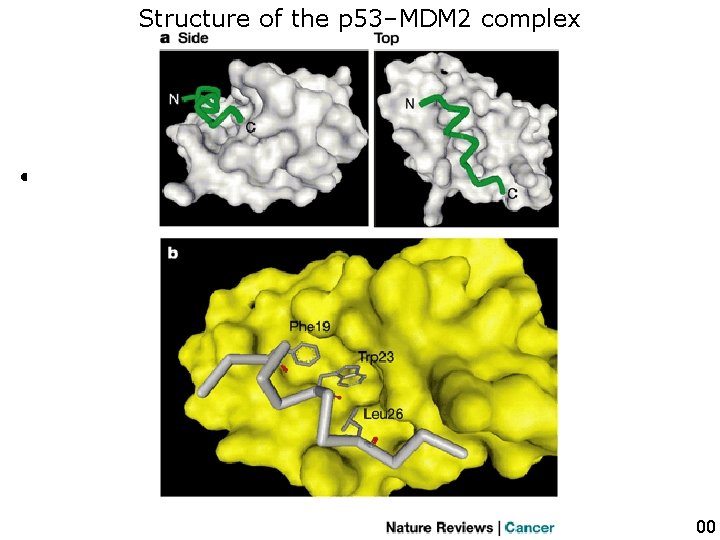
Structure of the p 53–MDM 2 complex • Figure 3 | Structure of the p 53–MDM 2 complex. a | The surface of MDM 225– 109 is in white and the backbone of p 5317– 29 is in green. Two. Chene, P 200 different views of the complex are presented, and the amino (N) and carboxyl 3 p 102 Nat (C) termini of the p 53 peptide are indicated. b Revbackbone Cancer is in grey and the | The p 5317– 29 side chains of Phe 19, Trp 23 and Leu 26 are represented. The surface of MDM 225– 109 is in yellow. 10/22/2021 100

2 Point de contrôle en fin de G 2 pour bloquer l'entrée en mitose • Mécanisme semblable à celui qui bloque l'entrée en mitose en réponse à une réplication incomplète de l'ADN • Si ADN altéré par radiation eg, l'ADN lésé envoie un signal qui aboutit à la phosphorylation et l'inactivation de la phosphatase Cdc 25 • Blocage de la déphosphorylation et de l'activation de M Cdk (cf. Activation de M-Cdk) • Blocage de l'entrée en mitose 10/22/2021 101

"Application au cancer" • Cellule normale + conditions normales points de contrôle n'ont pas besoin de fonctionner • Si petit dommage à l'ADN + point de contrôle non fonctionnel accumulation de petits dommages • gros dommages augmentation de la fréquence des mutations génératrices de cancer 10/22/2021 102

Exemple • Des mutations du gène de p 53 surviennent dans au moins la moitié des cancers • Accumulation plus facile de mutations dans les cellules cancéreuses par perte de la fonction de la p 53 10/22/2021 103

Ataxie télangiectasie • Maladie génétique rare • Altération d'une des protéines kinases qui phosphoryle et active p 53 en réponse à une lésion d'ADN radio induite • Perte des points de contrôle d'altération de l'ADN • Fréquence accrue de cancer chez ces patients très sensibles aux RI 10/22/2021 104

Réparation de l'ADN • Organismes unicellulaires – Arrêt du cycle pour réparer la lésion – Si réparation impossible le cycle se poursuit quand même – "La vie vaut mieux que pas de vie du tout" • Organismes multicellulaires – "L'organisme prévaut sur la cellule" – Une cellule atteinte menace l'individu (cancer) – On suicide la cellule en exécutant un programme de mort cellulaire (apoptose) 10/22/2021 105

Importance de p 53 • Rôle dans la décision d'exécuter l'apoptose • Rôle de protection contre le cancer 10/22/2021 106

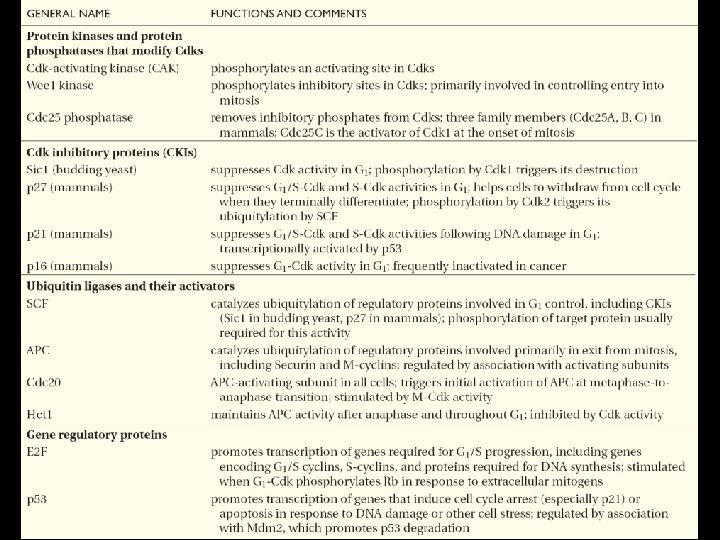
Tableau résumant les principales protéines régulatrices du cycle cellulaire 10/22/2021 107

• Tableau résumant les principales protéines régulatrices du cycle cellulaire Table 17 2 10/22/2021 108

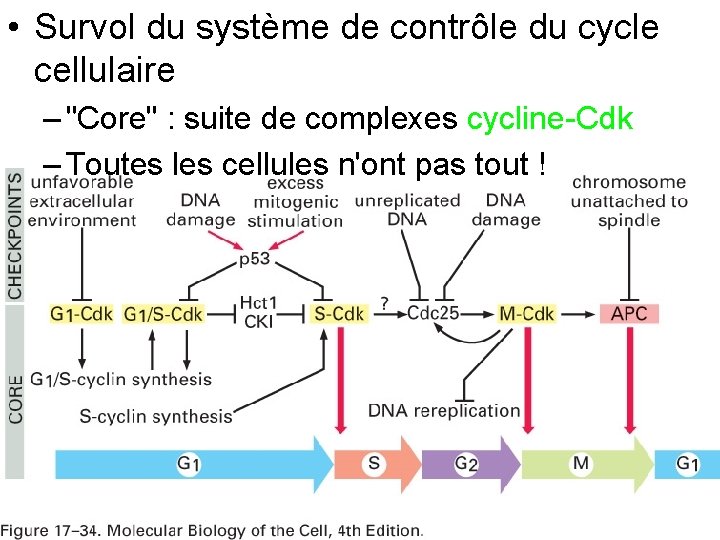
• Survol du système de contrôle du cycle cellulaire – "Core" : suite de complexes cycline Cdk – Toutes les cellules n'ont pas tout ! Fig 17 34 10/22/2021 109

Résumé du cycle cellulaire 10/22/2021 110

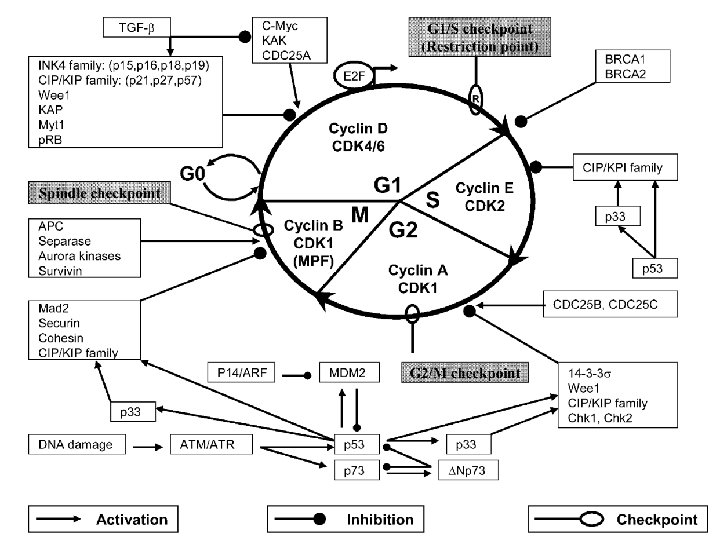
Virchows Arch (2004) 444: 313– 323 Mathewos Tessema · Ulrich Lehmann · Hans Kreipe. Cell cycle and no end Fig. 1 Negative and positive regulators of the normal cell cycle. Signals promoting and inhibiting the different phases of the cell cycle as well as checkpoints monitoring the proper completion of every phase of the cell cycle are indicated. In the centre of the cycle, the CDK/cyclin complexes driving the respective phase are shown. For details, see the text 10/22/2021 111

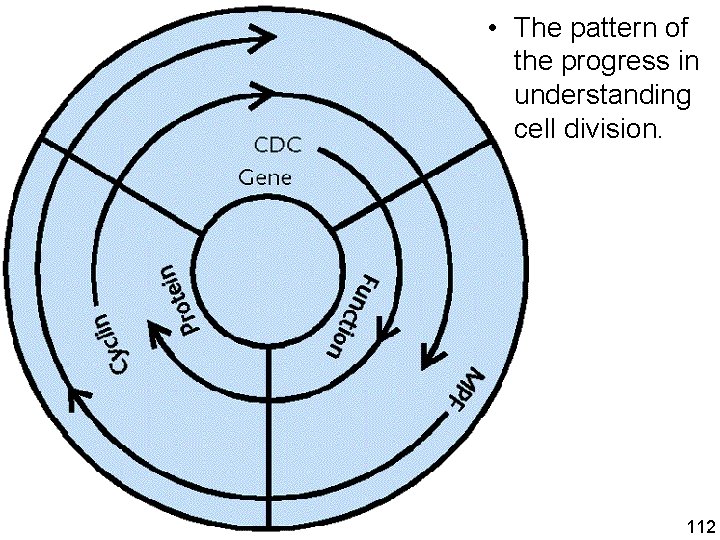
• The pattern of the progress in understanding cell division. Understanding the cell cycle Paul Nurse et al. Nature Medicine 4, 1103 1106 (1998) 10/22/2021 112

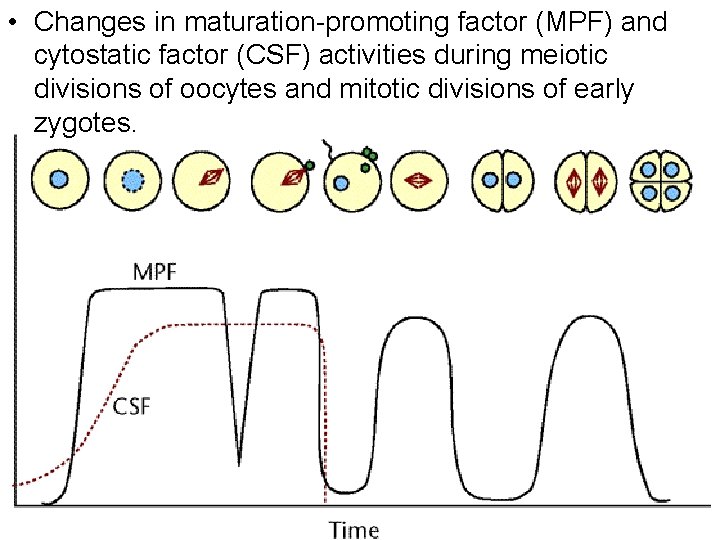
• Changes in maturation promoting factor (MPF) and cytostatic factor (CSF) activities during meiotic divisions of oocytes and mitotic divisions of early zygotes. Understanding the cell cycle Paul Nurse et al Nature Medicine 4, 1103 1106 (1998) 10/22/2021 113
 Signalisation cellulaire
Signalisation cellulaire Oxydoreduction
Oxydoreduction Cellule animale schéma
Cellule animale schéma Psm culture cellulaire
Psm culture cellulaire Vacuole cellule animale
Vacuole cellule animale Des des des
Des des des Contrle parental program
Contrle parental program Contrle parental program
Contrle parental program Contrle parental software
Contrle parental software Contrle
Contrle Contrle parental
Contrle parental Contrle technique
Contrle technique Hamlet act iii scene iii
Hamlet act iii scene iii La diffusion des idées des lumières
La diffusion des idées des lumières Il existe des personnes qui sont des lumières pour tous
Il existe des personnes qui sont des lumières pour tous Les temps verbaux et leurs valeurs
Les temps verbaux et leurs valeurs Affiche de propagande plan marshall
Affiche de propagande plan marshall Diversification des espaces et des acteurs de la production
Diversification des espaces et des acteurs de la production Volume d un corps
Volume d un corps Volume correspondant à une division
Volume correspondant à une division Cartographie des flux
Cartographie des flux Je t'offrirai des fleurs et des nappes en couleurs
Je t'offrirai des fleurs et des nappes en couleurs Robin des bois des alpes
Robin des bois des alpes Des attacks
Des attacks Budget des ventes
Budget des ventes Ulla sippola
Ulla sippola Intra siunsote
Intra siunsote Intraalveolar extraction
Intraalveolar extraction Intrapersonal skills definition
Intrapersonal skills definition Intra vs interpersonal
Intra vs interpersonal Srv intra
Srv intra Type of clasp in rpd
Type of clasp in rpd Transpulmonary pressure meaning
Transpulmonary pressure meaning Classification d'izard
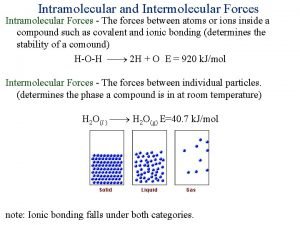
Classification d'izard Intra vs intermolecular
Intra vs intermolecular Kycpaninquiry
Kycpaninquiry Exophtalmie classification
Exophtalmie classification Intramolecular vs intermolecular
Intramolecular vs intermolecular Intra vs intermolecular
Intra vs intermolecular Intra fallopian transfer
Intra fallopian transfer Inter intra extra
Inter intra extra Intranet kk
Intranet kk Aileron sacré
Aileron sacré Interaksi alel
Interaksi alel Missing trader intra-community
Missing trader intra-community Missing trader intra-community fraud
Missing trader intra-community fraud Nerf alvéolaire inférieur
Nerf alvéolaire inférieur Colestaz
Colestaz Merkonomista tradenomiksi
Merkonomista tradenomiksi Intra-elite schism
Intra-elite schism Contoh variabel sekunder
Contoh variabel sekunder Intra versus inter
Intra versus inter Ibpc certificate
Ibpc certificate Holtech
Holtech Platre babp
Platre babp Fermeture de cia
Fermeture de cia Intra entity transactions
Intra entity transactions What is categorical thinking in communication
What is categorical thinking in communication Vtc intranet
Vtc intranet Lshp intra
Lshp intra Intra-generational interaction
Intra-generational interaction Papillome intra galactophorique
Papillome intra galactophorique Intra building backbone cabling
Intra building backbone cabling Intra thoracique
Intra thoracique Intra sectoral coordination
Intra sectoral coordination Ges global experience specialists
Ges global experience specialists Belastningsovervågning
Belastningsovervågning Intra.eip
Intra.eip Intra action review
Intra action review Brachial cutdown
Brachial cutdown Jaakko rinne
Jaakko rinne Dalbo attachment rpd
Dalbo attachment rpd Requirements of direct retainers
Requirements of direct retainers Hyperprolactinémie
Hyperprolactinémie Vascolarizzazione intra e perinodulare
Vascolarizzazione intra e perinodulare échographie cervicale et parotidienne
échographie cervicale et parotidienne Wwqqaa
Wwqqaa Displaced intra articular fracture
Displaced intra articular fracture Intra community acquisition
Intra community acquisition Intra vgf
Intra vgf Emociones intrapersonales
Emociones intrapersonales Llums.intra.bt.com/
Llums.intra.bt.com/ Baanaelisa
Baanaelisa Intra business e commerce
Intra business e commerce Premie woonkwaliteit gent
Premie woonkwaliteit gent Intra.agfanet
Intra.agfanet Route of drug administration
Route of drug administration Modello intra 13
Modello intra 13 Lshp intra
Lshp intra Kpb intra
Kpb intra Myslo.intra
Myslo.intra Major intra and extracellular electrolytes
Major intra and extracellular electrolytes Inter and intra personal skills
Inter and intra personal skills Pk 21
Pk 21 Intra uems
Intra uems Intas intra web
Intas intra web Como se alimentan los parasitos intra y extracelulares
Como se alimentan los parasitos intra y extracelulares What does parenteral route mean
What does parenteral route mean Intrapulmonary pressure is
Intrapulmonary pressure is Intra call
Intra call Sofia bargellini
Sofia bargellini Intra lase
Intra lase Intra country vs inter country
Intra country vs inter country Schéma cycle de vie d'une entreprise
Schéma cycle de vie d'une entreprise Exemple carnet de suivi des apprentissages
Exemple carnet de suivi des apprentissages Feuille maitresse audit
Feuille maitresse audit Brainpop.com water cycle
Brainpop.com water cycle Quizlet
Quizlet Difference between phosphorus cycle and carbon cycle
Difference between phosphorus cycle and carbon cycle Difference between open cycle and closed cycle gas turbine
Difference between open cycle and closed cycle gas turbine Forbidden latency
Forbidden latency