TECHNIQUES DE CULTURE CELLULAIRE Anne 2006 2007 quipe


















- Slides: 21

TECHNIQUES DE CULTURE CELLULAIRE Année 2006 -2007 *Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET

Techniques de culture cellulaire n n n Les cellules Les milieux de culture Les contenants L’environnement L’entretien Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 2

Les cellules n Cellules normales n n À nombre de repiquages limité Obtention n n À partir d’un prélèvement tissulaire : avec ou sans dissociation Dissociation des liaisons fortes entre cellules n n Mécanique : broyage, vortexage … Enzymatique essentiellement Mise en culture : culture primaire Repiquage ou « passage » : culture secondaire Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 3

Les cellules n Cellules transformées (ou éventuellement embryonnaires) À nombre de passages illimité donnant une lignée continue les plus utilisées en culture cellulaire et virologie médicale : Cellules Vero, cellules rénales de singe vert africain (Cercopithecus aethiops) n Aspect de fibroblaste : fusiforme n Adhérant rapidement au support de verre ou plastique grâce aux ions Ca 2+ ou Mg 2+. n n n Autres cellules n Cellules tumorales : n n n He. La (tumeur utérine) ; KB (carcinome oral humain) Cellules embryonnaires : n n MRC-5 (poumon de foetus humain) ; 3 T 3 (embryon de souris) Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 4

Les cellules Log n cellules Culture primaire Culture secondaire Cellules transformées Lignée continue Cellules non transformées Mort programmée = apoptose Premier passage Année 2006 -2007 Deuxième passage Temps Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 5

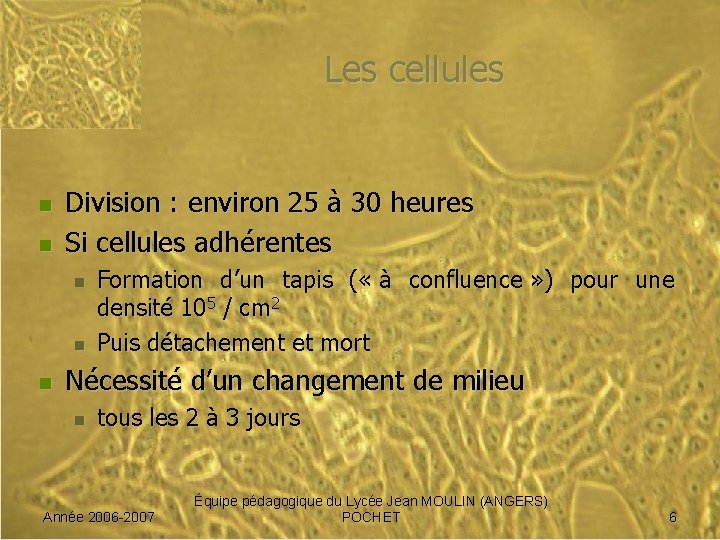
Les cellules n n Division : environ 25 à 30 heures Si cellules adhérentes n n n Formation d’un tapis ( « à confluence » ) pour une densité 105 / cm 2 Puis détachement et mort Nécessité d’un changement de milieu n tous les 2 à 3 jours Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 6

Les milieux de culture n Exigences cellulaires minimales n n n n Base commune (milieux Hanks, Earl, PBS, Gey) : n n n eau ions minéraux donnant une osmolarité identique à celle du sérum physiologique source de carbone et d'énergie (glucose par exemple) source d'azote : acides aminés source d’acides gras p. H constant 7, 4 (indicateur de p. H : rouge de phénol) grâce un système tampon CO 2/HCO 3 - ou phosphates. Sels minéraux : Na. Cl, KCl, Ca. Cl 2, Mg. Cl 2, Na. H 2 PO 4… Sucre : glucose Compléments variables selon les milieux (RPMI, MEM, DMEM…) n n n Acides aminés Vitamines et cofacteurs Bases azotées, ribose et désoxyribose Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 7

Les milieux de culture n Compléments à ajouter extemporanément : n Mélanges d’antibiotiques au taux final de 1 % Pénicilline G, n Streptomycine, n Amphotéricine B (antifongique)… Glutamine à 1% (acide aminé instable) n n n Sérum de veau fœtal (S. V. F. ou F. C. S. Fœtal Calf Serum) entre 1, 5 et 10 % n n prélevé stérilement et décomplémenté apportant n facteurs de croissance cellulaire n n n Année 2006 -2007 EGF (facteur de croissance épidermique), FGF (facteur de croissance fibroblastique) PDGF (facteur de croissance dérivé des plaquettes) Facteurs de différenciation comme fibronectine (ancrage des cellules). Inhibiteurs comme l’alpha 1 antitrypsine (neutralisation de l’action enzymatique de la trypsine) Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 8

Les contenants n Flacons n n n En polystyrène optiquement clair stérile Traités ou non pour adhérence De contenance et surface variable par ex : n n 25 cm 2 contenance totale 60 m. L / vol 5 m. L 75 cm 2 contenance totale 250 m. L / vol 10 m. L 150 cm 2 contenance totale 60 m. L / vol 20 m. L Plaques multipuits n n En polystyrène optiquement clair stérile Traités ou non pour adhérence À fond plat et couvercle n Boites Nombre de puits et contenance n En polystyrène optiquement clair variable stérile n 6, 12, 24, 48, 96 n Traités ou non pour adhérence n Diamètre allant de 35 à 150 mm Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 9

L’environnement durant l’incubation Respectant certains paramètres physico-chimiques nécessaires à la culture cellulaire n n n la température : 37 °C l'hygrométrie : 84 à 85 % d’humidité le p. H 7, 4 maintenu grâce aux systèmes tampon n n du milieu renforcés par à l’atmosphère enrichie à 5% de CO 2 (système tampon avec HCO 3 -) Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 10

L’incubateur à CO 2 Double porte avec verrouillage 5 % 37°C Clayettes perforées pour circulation d’air Voyants de Pression en CO 2 et température Ses manomètres de pression Son système d’injection Incubateur fermé avec Année 2006 -2007 Bonbonne d’anhydride carbonique Bac d’eau stérilisée pour maintien d’un taux d’humidité suffisant Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 11

L’environnement durant le repiquage Respectant la stérilité Sensibilité des cellules aux infections n n n Bactériennes (en particulier les mycoplasmes), Fongiques, Virales. Utilisation de façon adéquate d’une enceinte à atmosphère stérile : n PSM Poste de Sécurité Microbiologique Indicateur de p. H : Rouge de phénol n rose à p. H 7, 4 n rouge si alcalinisation (infection fongique) n jaune si acidification (contamination bactérienne ou mort cellulaire) Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 12

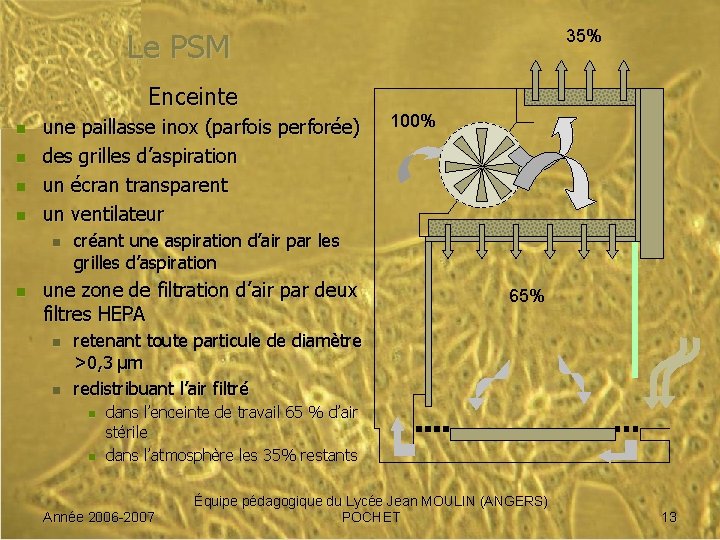
35% Le PSM Enceinte n n une paillasse inox (parfois perforée) des grilles d’aspiration un écran transparent un ventilateur n n créant une aspiration d’air par les grilles d’aspiration une zone de filtration d’air par deux filtres HEPA n n 100% 65% retenant toute particule de diamètre >0, 3 µm redistribuant l’air filtré n n dans l’enceinte de travail 65 % d’air stérile dans l’atmosphère les 35% restants Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 13

L’entretien Suivi de la culture cellulaire n Aspect macroscopique n n Au microscope inversé n n n Observation du milieu de culture limpide et rose pouvant devenir trouble et/ou rouge ou jaune sous la platine : les objectifs au dessus de la platine : l’éclairage avec contraste de phase : meilleure visualisation des prolongements cytoplasmiques, organites et vacuoles Vacuolisation et présence de cellules arrondies en suspension = souffrance et perte d’adhésion Nécessité de changer le milieu tous les 2 ou 3 jours Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 14

L’entretien n Microscope inversé avec contraste de phase au dessus de la platine : l’éclairage sous la platine : les objectifs Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 15

L’entretien n n Installation du Poste (PSM) Nettoyage des mains et avant bras Désinfection à l’alcool n n du plan de travail de tout le matériel nécessaire n n Pipettes stériles, portoirs, auxiliaire de pipetage ou pipettes automatiques avec filtres et cônes stériles, tubes stériles… de tous les récipients contenant les réactifs stériles n n Milieu complémenté (ou réactifs pour le constituer) Trypsine Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 16

L’entretien Lavage des mains et des avant-bras Désinfection du matériel Installation sous PSM après désinfection du plan Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 17

L’entretien Élimination du milieu ancien Rinçage en tampon sans Ca 2+ Ajout de trypsine Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 18

L’entretien Action de la trypsine surveillée au microscope Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 19

L’entretien Inaction de l’activité enzymatique de ta trypsine par ajout de milieu complémenté Prélèvement d’une fraction de la suspension pour dénombrement après une série d’aspirations refoulements prolongée pour détacher les cellules Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 20

L’entretien Dénombrement en présence d’un colorant pour estimation de la viabilité cellulaire : Par exemple, Bleu de Funk (ou Trypan) exclus des cellules vivantes et pénétrant dans les cellules mortes Calcul du volume de suspension cellulaire (cellules viables) à introduire dans le milieu neuf pour une nouvelle incubation de 2 à 3 jours Année 2006 -2007 Équipe pédagogique du Lycée Jean MOULIN (ANGERS) POCHET 21
 Psm culture cellulaire
Psm culture cellulaire Signalisation cellulaire
Signalisation cellulaire Respiration cellulaire
Respiration cellulaire Polysome schéma
Polysome schéma Membrane plasmique végétale
Membrane plasmique végétale Examples of non material culture
Examples of non material culture Sociologists define a symbol as
Sociologists define a symbol as Batch culture vs continuous culture
Batch culture vs continuous culture Batch culture vs continuous culture
Batch culture vs continuous culture Characteristics of collectivism
Characteristics of collectivism American culture vs indian culture
American culture vs indian culture Uses of selenite f broth
Uses of selenite f broth Folk culture and popular culture venn diagram
Folk culture and popular culture venn diagram Counterculture vs subculture
Counterculture vs subculture How does popular culture diffuse
How does popular culture diffuse Tsi
Tsi Folk culture and popular culture venn diagram
Folk culture and popular culture venn diagram In an inert organizational culture,
In an inert organizational culture, Anaerobic gaspak
Anaerobic gaspak Robertson cooked meat medium
Robertson cooked meat medium Laying the foundation for a quality culture
Laying the foundation for a quality culture Surface culture deep culture and esol
Surface culture deep culture and esol