Cours de Pharmacologie gnrale Pr Miloud SLIMANI Dpartement





























































![[P. A] plasmatique Cmax: C 0 Biodisponibilité 100% élimination Aire sous la courbe d. [P. A] plasmatique Cmax: C 0 Biodisponibilité 100% élimination Aire sous la courbe d.](https://slidetodoc.com/presentation_image_h2/687399d7d0c0da97a194bccee8f4b704/image-85.jpg)





















































- Slides: 161

Cours de Pharmacologie générale Pr Miloud SLIMANI Département de Biologie Faculté des Sciences Université Dr Tahar Moulay-Saida Pr SLIMANI. M 1

La pharmacologie : La pharmacologie, est la science du médicament : elle étudie les effets et le devenir du médicament dans l’organisme -étude des interactions entre le médicament et les tissus du corps humain. Biopharmacie : Etudie l'impact des formes galéniques d'un médicament sur son absorption par l'organisme. Pharmacocinétique : Devenir du médicament dans l’organisme depuis son administration jusqu’à son élimination – Étude de l’évolution des concentrations du médicament dans l’organisme au cours du temps Le devenir du médicament comprend 4 étapes, dites ADME – Absorption (pénétration) dans l’organisme – Distribution (diffusion) dans l’organisme – Métabolisme (biotransformations) – Élimination. Pharmacodynamie : elle étudie les effets des médicaments sur leur cible et en fonction des concentrations obtenues et précise donc la relation dose concentration- effet = l’intensité et la durée de son action au niveau d’un tissu ou d’un récepteur. Pr SLIMANI. M 2

-La pharmacologie expérimentale : qui étudie l’effet des médicaments in vitro ou chez l’animal. -La pharmacovigilance, qui s’intéresse à la détection, l’évaluation, la compréhension et la prévention des risques d’effets indésirables des médicaments pouvant survenir lors de l’usage d’un médicament dans une population après sa mise sur le marché. Evaluation de la balance bénéfice / risque grâce à : -la détection des effets indésirables rares - l’identification des populations à risque(enfants, sujets âgés, femme enceinte) -l’identification des risques d’interactions médicamenteuses -La pharmaco épidémiologie, est une discipline mettant en application les méthodes et/ou le raisonnement épidémiologique pour évaluer, l'efficacité, le risque, le bénéfice et l'usage des médicaments au sein d'une large population d'individus -La pharmacogénétique : L’étude des gènes impliqués dans le métabolisme des médicaments ou dans les effets du médicament. Elle étudie la variabilité génétique dans la réponse aux médicaments -La pharmacodépendance qui s’intéresse à la surveillance du potentiel addictif des médicaments. Pr SLIMANI. M 3

Médicament : origine, composition, formes Origine minérale : principes actifs d’origine minérale -Sulfate de Na, de Mg comme purgatifs - Sulfates de cuivre et de zinc comme antiseptiques -Bicarbonate de Na comme correcteur de p. H pour l ’acidité gastrique Silicate d’aluminium et de magnésium : pansement gastro-intestinal origine animale (opothérapie) : Principes actifs obtenues par extraction d’organes. Ex : insuline (pancréas), héparine (poumons) , Médicaments dérivés du sang humain, (ex : albumine, ex : fibrinogène Hormones polypepetidiques extractives : ex insuline , gonadotrophines Enzymes : trypsine , chymotrypsine. Pr SLIMANI. M 4

origine végétale : Phytothérapie = traitement des affections par des substances actives végétales -Plantes entières ou parties de plantes (tisane, préparation en poudre) -Préparations à bases de plantes Poudre de plantes , Préparations extractives , Essence liquide -Composés extraits des plantes: alcaloïdes: quinine , strychnine , morphine ex : morphine , appartient à la famille chimique des alcaloïdes. Elle est utilisée dans le traitement de la douleur sous forme de sels solubles de morphine (sulfate, chlorhydrate). Son action se situe au niveau du système nerveux central (elle a des similitudes avec les endorphines, appelées aussi "morphines endogènes"). -hétérosides, ex : digitaline , extraite de la digitale pourpre (Digitalis purpurea) Activité cardiotonique les gommes : ex : mucilages laxatifs Les glycosides : ils contiennent des sucres dans leur structure chimique , ex : digitoxine, digoxine Pr SLIMANI. M 5

Origine microbiologique Levures , Bactéries , Virus Produits élaborés par les micro-organismes cultivés en milieu liquide Pénicilline : antibiotique Streptomycine : traitement de la tuberculose Ciclosporine : immunodépresseur utilisé lors de greffes pour éviter un rejet chez le receveur Probiotiques : Micro-organisme ayant fait preuve de bénéfices sur la santé, et survivant suffisamment longtemps dans l’intestin pour agir. Les bactéries contenues dans les yaourts aident à digérer le lactose. Acides aminés Maladie de Parkinson : la L-DOPA pénètre dans le cerveau et la dopamine formée restaure la transmission dopaminergique Vitamines: Vitamine C ou acide ascorbique : antioxydant, Action Anti infectieuse Pr SLIMANI. M 6

Origine biotechnologique (génie génétique) P. A. obtenus à partir de micro-organismes divers ou à partir de cellules. -Produits élaborés par les micro-organismes : techniques de fermentation Production des antibiotiques par des champignons inférieurs ex. Penicillium , pénicilline Origine synthétique : La plupart des médicaments actuellement commercialisés sont d'origine synthétique, obtenus par : - Synthèse totale ; - Hémi-synthèses Hemisynthèse : Produit existant que l’on modifie pour améliorer ses performances thérapeutiques par : - augmentation de l’absorption par l’organisme - diminution des effets secondaires néfastes - modification de la lipophilie pour favoriser le passage transmembranaire - modification d’une interaction chimique avec un agent pathogène. Exemple : les pénicillines ont toutes un noyau beta-lactame. On effectue des modifications chimiques autour de ce noyau, donnant des pénicillines plus efficaces. -Très nombreux et obtenus par hémi-synthèse ou synthèse. Pr SLIMANI. M 7

2 -2 Composition du médicament : “ Toute substance ou composition, possédant des propriétés curatives ou préventives à l’égard des maladies humaines ou animales, administré pour corriger, modifier ou restaurer une fonction affectée de l’organisme. Un médicament comprend une partie responsable de ses effets sur l’organisme humain, le principe actif ( par exemple , l’acide acétyl salicylique est le principe actif de l’aspirine) , et d’autres substances qui enrobent les principes actifs pour faciliter leurs absorption et accélérer leur diffusion dans l’organisme. Ces substances sont les excipients , une partie inactive( Exemples Amidon ; silice ; glycine ; arôme mandarine ; bicarbonate de sodium ; acide citrique ; leucine). Pr SLIMANI. M 8

2 -2 -1 Propriétés physico-chimiques du principe actif : -Stabilité: en fonction de la voie d’administration , Protection du P. A : -ex du liquides du tube digestif (p. H, enzymes) -Forme galénique protégeant le P. A - Franchissement des barrières biologiques Ces propriétés du P. A. lui permettent de franchir les barrières biologiques pour arriver en concentration suffisante au site d’action. Pour que le PA exerce de façon efficace son activité thérapeutique, il est nécessaire que sa concentration sanguine atteigne un taux suffisant pour un effet thérapeutique mais pas supérieur au seuil de toxicité. Cette fourchette de concentration sanguine est nommée la zone thérapeutique Pr SLIMANI. M 9

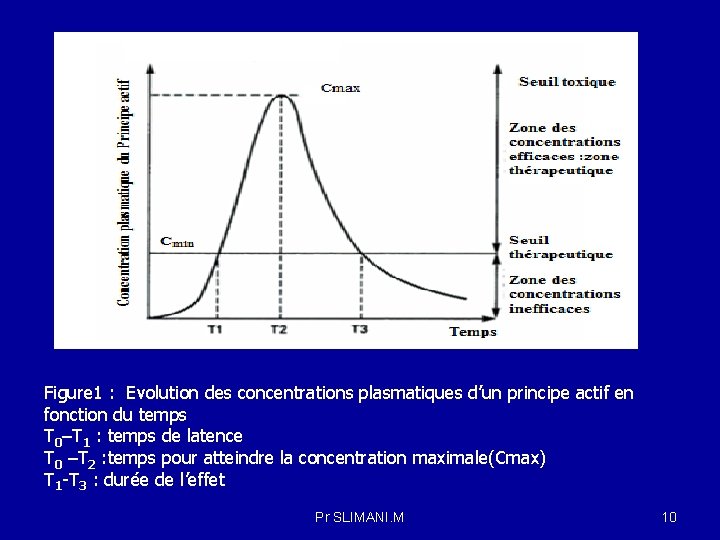
Figure 1 : Evolution des concentrations plasmatiques d’un principe actif en fonction du temps T 0–T 1 : temps de latence T 0 –T 2 : temps pour atteindre la concentration maximale(Cmax) T 1 -T 3 : durée de l’effet Pr SLIMANI. M 10

2 -2 -2 Excipients : ou adjuvant , neutre , dépourvu d’activité thérapeutique pour assurer la conservation et jouent un rôle important dans l’absorption , la stabilité du médicament et dans la vitesse de mise à disposition de l’organisme du principe actif (biodisponibilité). Ils permettent ainsi une bonne dissolution. ils conditionnent son aspect, sa couleur et son goûts. Les excipients sont classés selon leur fonction en : - agrégants : excipients qui assurent la cohésion d’un mélange de poudres et permettent la réalisation de comprimés - diluants ou véhicules : phase continue qui permet la solution ou la dispersion des constituants du médicament dans un volume suffisant - intermèdes : substances permettant la réalisation physique du médicament ou assurant sa stabilité (par exemple, émulsionnant) - colorants : substances colorées servant de témoin d’homogénéité d’un mélange de poudres ou à identifier le médicament fini - édulcorants ou correctifs : modificateurs du goût permettant de rendre une préparation agréable ou de masquer le mauvais goût d’un principe actif - conservateurs : substances destinées à empêcher la dégradation chimique ou l’altération microbiologique d’un médicament. Pr SLIMANI. M 11

Cas particuliers : L'excipient devrait être bien toléré, néanmoins, certains peuvent entraîner des intolérances individuelles. C’est ce qu’on appelle un excipient à effet notoire , l’intolérance peut être liée à un problème d’allergie à une substance ou à un excipient spécifique , à titre d’exemples : - lactose : troubles digestifs en cas d'intolérance, - huile d'arachide : réactions allergiques , contre indiqué en cas d’allergie à l’arachide ou au soja , déconseillée chez l'enfant de moins de 3 ans, -Amidon de blé : réactions allergiques chez les personnes allergiques au blé ou intolérantes au gluten : maladie cœliaque, -Glycérol : troubles digestifs La présence de ces excipients à effet notoire détermine certaines précautions d'emploi propres à l’utilisation des médicaments , en fonction des effets indésirables qu'ils peuvent provoquer. Pr SLIMANI. M 12

Un médicament générique contient la même substance active que le médicament original (princeps). son action curative est identique , les seules différences possibles étant la présentation et les excipients Placebo : Préparation dépourvue de tout principe actif, utilisée à la place d'un médicament pour son effet psychologique, dit « effet placebo » Des placebos sont utilisés dans les essais cliniques pour déterminer, par comparaison, l'efficacité d'un médicament ou produit. Un médicament princeps ou médicament d’origine est un médicament mis au point par un laboratoire pharmaceutique qui en garde l’exclusivité jusqu’à expiration du brevet. Pr SLIMANI. M 13

2 -2 -3 Pro médicaments: ou précurseurs « prodrugs » : Sont des dérivés devant subir une biotransformation enzymatique avant d’exercer leur effet pharmacologique (bioactivation). -Une prodrogue s’obtient en liant une molécule active à un groupement temporaire, ce qui donne une nouvelle molécule moins active que le médicament d’origine, ou même inactive. La séparation doit se faire très vite et le groupement temporaire ne doit avoir, par lui-même, ni action pharmacologique ni toxicité. De nombreuses situations nécessitent le recours aux pro drogues : passer de la formule liquide à la forme comprimé ou inversement, masquer une odeur ou une saveur, résister au milieu stomacal, aux enzymes hépatiques, passer la barrière intestinale, cutanée ou hémato encéphalique, obtenir un effet retard. Pr SLIMANI. M 14

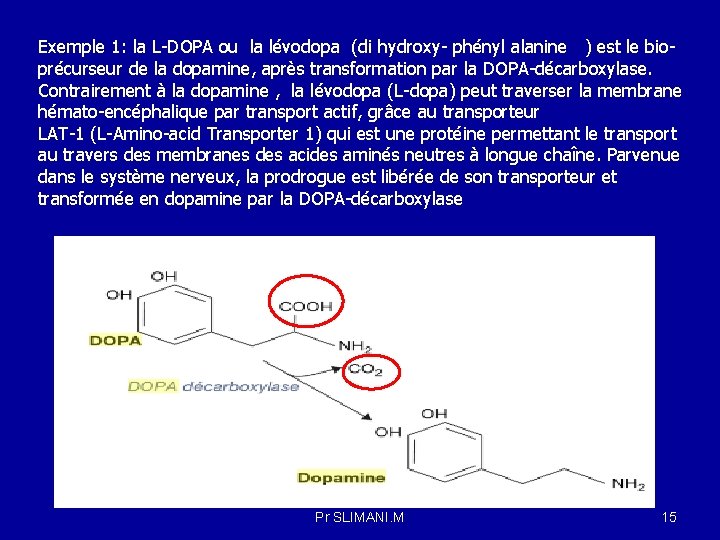
Exemple 1: la L-DOPA ou la lévodopa (di hydroxy- phényl alanine ) est le bioprécurseur de la dopamine, après transformation par la DOPA-décarboxylase. Contrairement à la dopamine , la lévodopa (L-dopa) peut traverser la membrane hémato-encéphalique par transport actif, grâce au transporteur LAT-1 (L-Amino-acid Transporter 1) qui est une protéine permettant le transport au travers des membranes des acides aminés neutres à longue chaîne. Parvenue dans le système nerveux, la prodrogue est libérée de son transporteur et transformée en dopamine par la DOPA-décarboxylase Pr SLIMANI. M 15

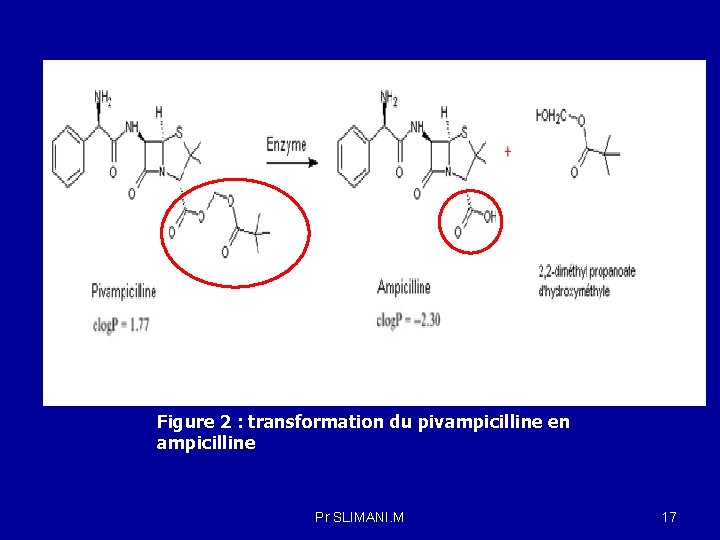
Exemple 2: La pivampicilline , une forme inactive transformé en forme active : ampicilline. L’'absorption digestive de l'ampicilline est de l'ordre de 40 % de la dose ingérée, les 60 % restant éliminés dans les fèces. La raison de cette mauvaise résorption réside dans la présence du groupe acide carboxylique –COOH qui diminue sa lipophilie. Afin d'améliorer l'absorption de ce principe actif, on le transforme en pivampicilline et son taux d'adsorption devient 98% par la transformation de la fonction acide carboxylique de l'ampicilline en ester ce qui fait disparaître l'ionisation due à la fonction acide. La pivampicilline est plus lipophile avec un coefficient de partage , clog P= 1. 77 que l’ampicilline (clog P= - 2. 30 ) et elle pénètre plus facilement dans les cellules intestinales. La pivampicilline est hydrolysée par des estérases, présentes au niveau de la lumière intestinale et à l’intérieur des entérocytes. Lorsque la pivampicilline est à l’intérieur des entérocytes, l’ampicilline formée suite à son hydrolyse intracellulaire est majoritairement prise en charge par des transporteurs situés sur le pôle basal, et se retrouve dans la circulation sanguine. Pr SLIMANI. M 16

Figure 2 : transformation du pivampicilline en ampicilline Pr SLIMANI. M 17

Quelles sont les classes de médicament ? On distingue les différentes classes thérapeutiques et à l’intérieur de celles ci différentes classes en fonction de leur propriétés pharmacologiques. Classes thérapeutiques: Antalgiques, Anti-inflammatoires, Cancérologie, Cardiologie et angiologie, Dermatologie, Urologie - Néphrologie. les antalgiques (ou analgésiques) : Ce sont des médicaments qui suppriment ou diminuent la douleur, Acide Acétylsalicylique (Aspirine). A l’intérieur de chaque classe thérapeutique, plusieurs classes pharmacologiques : par exemple parmi les anti-infectieux, on distingue les antibiotiques, les antiparasitaires, les anti-fongiques, les anti-viraux, les antiseptiques. Pr SLIMANI. M 18

Dénomination des médicaments : - Dénomination scientifique ou chimique trop compliquée pour une utilisation quotidienne(ex : acide acétylsalicylique) - Dénomination commune internationale (DCI = proposition de l’OMS), (ex : aspirine) La DCI ou dénomination commune internationale désigne le principe actif responsable de l’effet thérapeutique qui est contenu dans un médicament. - Dénomination commerciale ou spéciale, ex : (ex : Aspégic, Kardégic, …) Famille Pharmaco-thérapeutique Exemples de DCI (Spécialités) -ac Anti-inflammatoires non stéroïdiens dérivés de l’ ibufénac : Dérivés aryl carboxyliques Diclofénac ( Difal – Voltarène ) -adol Analgésiques divers Tramadol (Tremadol ) -alol β-bloqueurs. Labétalol (Trandate ), Sotalol (Sotalex) -azépam Benzodiazépines du groupe du diazépam Diazépam (Valium), Nordazépam (Nordaz) - caïne Anesthésiques locaux Bupivacaïne (Marcaïne – Périanest), Lidocaïne (Elma – Procto - Glyvénol – Xylocaïne …) Pr SLIMANI. M 19

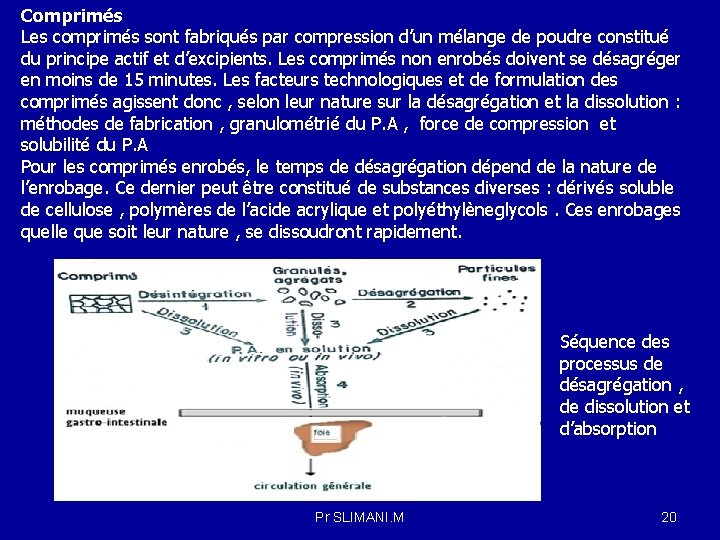
Comprimés Les comprimés sont fabriqués par compression d’un mélange de poudre constitué du principe actif et d’excipients. Les comprimés non enrobés doivent se désagréger en moins de 15 minutes. Les facteurs technologiques et de formulation des comprimés agissent donc , selon leur nature sur la désagrégation et la dissolution : méthodes de fabrication , granulométrié du P. A , force de compression et solubilité du P. A Pour les comprimés enrobés, le temps de désagrégation dépend de la nature de l’enrobage. Ce dernier peut être constitué de substances diverses : dérivés soluble de cellulose , polymères de l’acide acrylique et polyéthylèneglycols. Ces enrobages quelle que soit leur nature , se dissoudront rapidement. Séquence des processus de désagrégation , de dissolution et d’absorption Pr SLIMANI. M 20

Les objectifs d’un enrobage gastro –solubles peuvent être : - masquage d’une odeur ou d’un goût désagréable -protection du principe actif, contre la lumière ou l’humidité – améliorer l’aspect esthétique Type de comprimé Enrobage Temps de désagrégation Pelliculé Film polymère très mince utilisé pour cacher la couleur ou le goût du médicament. ≤ 30 minutes -Doliprane (1000 mg) Filmé Enrobage plus épais , souvent coloré ≤ 60 minutes Dragée A base de sucre ≤ 30 minutes Temps de désagrégation Deux types d’enrobage : -La dragéification ou l’enrobage un sucre , le comprimé obtenu est dit : dragée -Le pelliculage ou l’enrobage par film à l’aide d’un agent filmogène , le comprimé est dit pelliculé Pr SLIMANI. M 21

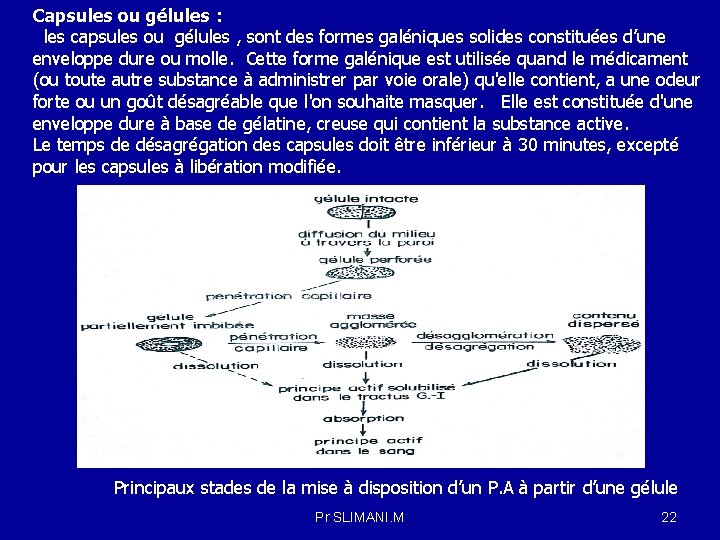
Capsules ou gélules : les capsules ou gélules , sont des formes galéniques solides constituées d’une enveloppe dure ou molle. Cette forme galénique est utilisée quand le médicament (ou toute autre substance à administrer par voie orale) qu'elle contient, a une odeur forte ou un goût désagréable que l'on souhaite masquer. Elle est constituée d'une enveloppe dure à base de gélatine, creuse qui contient la substance active. Le temps de désagrégation des capsules doit être inférieur à 30 minutes, excepté pour les capsules à libération modifiée. Principaux stades de la mise à disposition d’un P. A à partir d’une gélule Pr SLIMANI. M 22

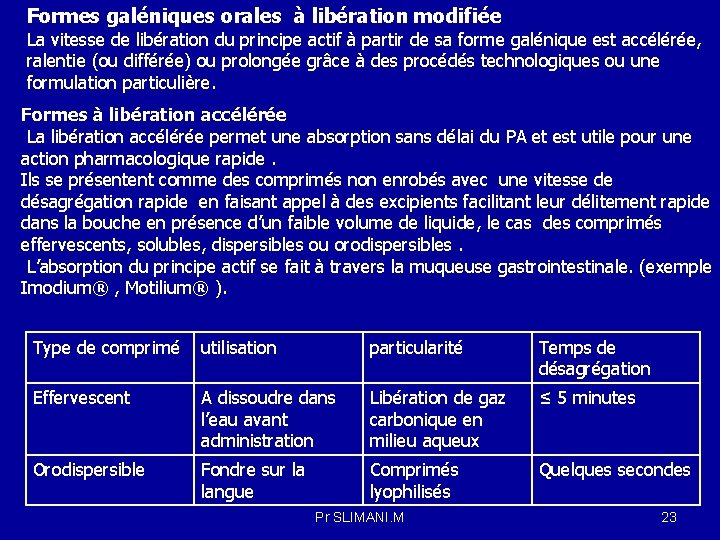
Formes galéniques orales à libération modifiée La vitesse de libération du principe actif à partir de sa forme galénique est accélérée, ralentie (ou différée) ou prolongée grâce à des procédés technologiques ou une formulation particulière. Formes à libération accélérée La libération accélérée permet une absorption sans délai du PA et est utile pour une action pharmacologique rapide. Ils se présentent comme des comprimés non enrobés avec une vitesse de désagrégation rapide en faisant appel à des excipients facilitant leur délitement rapide dans la bouche en présence d’un faible volume de liquide, le cas des comprimés effervescents, solubles, dispersibles ou orodispersibles. L’absorption du principe actif se fait à travers la muqueuse gastrointestinale. (exemple Imodium® , Motilium® ). Type de comprimé utilisation particularité Temps de désagrégation Effervescent A dissoudre dans l’eau avant administration Libération de gaz carbonique en milieu aqueux ≤ 5 minutes Orodispersible Fondre sur la langue Comprimés lyophilisés Quelques secondes Pr SLIMANI. M 23

Libération prolongée (forme LP) Certains médicaments présentés sous forme de comprimés ou de gélules sont recouverts d’un enrobage spécial qui ralentit et prolonge la diffusion du médicament dans le corps. Elles libèrent d’abord une dose initiale , puis la libération est progressive dans le temps afin de maintenir une concentration plasmatique efficace plus longtemps par rapport aux formes conventionnelles ce qui se traduit par une augmentation de la durée d’action et une réduction du nombre de prises par jour. Elles sont gastro-résistantes car une dissolution du comprimé ou de la gélule dans l'estomac expose le principe actif a des acides forts susceptibles de le dissoudre rapidement. Pr SLIMANI. M 24

Exemple 1 : Madopar (lévodopa + benzérazide ) , traitement de la Maladie de Parkinson. Ce médicament est constitué de 3 couches pour une libération biphasique de levodopa. La première couche libère rapidement une partie de la levodopa et la totalité du bensérazide. La deuxième couche est protectrice, elle ne contient pas le P. A. La troisième couche libère de façon prolongée le reste de levodopa. Exemple 2 : Après injection par voie IM d’extencilline , le benzathine benzylpénicilline s'hydrolyse très lentement en libérant de la benzylpénicilline. Le pic sérique est obtenu 12 à 24 h après l'injection. La longue demi-vie plasmatique assure une pénicillinémie stable et prolongée active pendant au moins une semaine. Pr SLIMANI. M 25

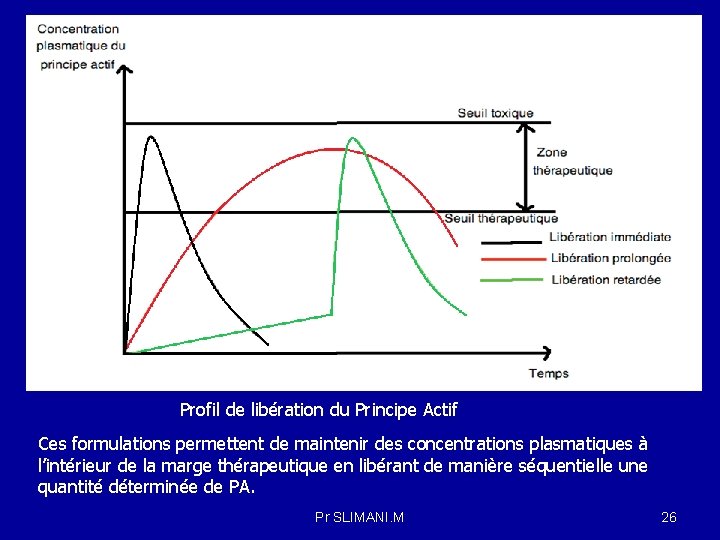
Profil de libération du Principe Actif Ces formulations permettent de maintenir des concentrations plasmatiques à l’intérieur de la marge thérapeutique en libérant de manière séquentielle une quantité déterminée de PA. Pr SLIMANI. M 26

Libération retardée (forme à action différée ) La libération du PA peut être retardée par rapport à la libération immédiate (un temps de latence par rapport à la forme conventionnelle). La libération différée ou retardée signifie que le principe actif est libéré de sa forme galénique à un moment ou un lieu différent par rapport à une forme conventionnelle, par exemple dans l’intestin au lieu de l’estomac, ce sont des formes gastro résistantes. La dissolution et l’absorption du principe actif s’effectuent au niveau intestinal. Ces « formes retard » permettent de protéger le PA de certains paramètres du milieu environnant tels que le p. H ou les enzymes du tractus gastro-intestinal ou de protéger les muqueuses intestinales du PA (formes gastro résistantes ). Les comprimés ou granulés sont recouverts d’un film polymérique, insoluble en milieu acide mais perméable à l’eau en milieu alcalin ou de type lipidique dégradé par les lipases intestinales. Exemple 1 : Salazopyrin® : La sulfasalazine , comprimé enrobé gastro résistant , avec la particularité protection de l’estomac (substances irritantes) , ce médicament appartient à la famille des sulfamides et des salicylés. Il a une action anti-inflammatoire sur la muqueuse intestinale. Pr SLIMANI. M 27

Exemple 2: Le Dexilant® est un médicament qui appartient à la famille des inhibiteurs de la pompe à protons. Il contient du dexlansoprazole, une substance active indiquée dans le traitement du reflux gastro-œsophagien, des brûlures d'estomac et de l'œsophagite (RGO). Ce médicament fait appel à la technologie à double libération retardée. Deux types de granules à revêtement gastro-résistant et entérosoluble permettent deux libérations de médicament à des moments différents avec un profil de concentration plasmatique dans le temps comportant deux pics distincts. Le premier pic de concentration plasmatique est observé 1 à 2 heures après l’administration du médicament dans la partie proximale de l’intestin grêle , tandis que le deuxième pic de médicament est observé après 4 à 5 heures dans la partie distale de l’intestin grêle. Pr SLIMANI. M 28

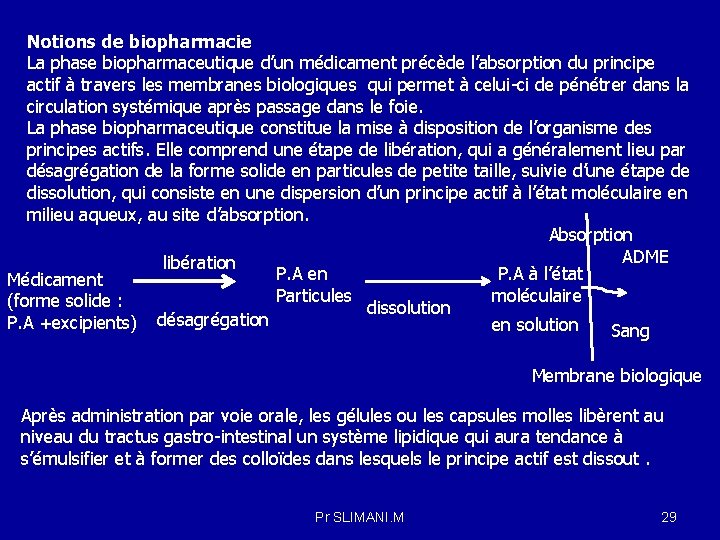
Notions de biopharmacie La phase biopharmaceutique d’un médicament précède l’absorption du principe actif à travers les membranes biologiques qui permet à celui-ci de pénétrer dans la circulation systémique après passage dans le foie. La phase biopharmaceutique constitue la mise à disposition de l’organisme des principes actifs. Elle comprend une étape de libération, qui a généralement lieu par désagrégation de la forme solide en particules de petite taille, suivie d’une étape de dissolution, qui consiste en une dispersion d’un principe actif à l’état moléculaire en milieu aqueux, au site d’absorption. Absorption ADME libération P. A en P. A à l’état Médicament Particules moléculaire (forme solide : dissolution P. A +excipients) désagrégation en solution Sang Membrane biologique Après administration par voie orale, les gélules ou les capsules molles libèrent au niveau du tractus gastro-intestinal un système lipidique qui aura tendance à s’émulsifier et à former des colloïdes dans lesquels le principe actif est dissout. Pr SLIMANI. M 29

4 -Absorption des médicaments La phase d’absorption correspond à l’ensemble des phénomènes intervenant dans le transfert d'une molécule depuis son site d’administration jusqu’à la circulation sanguine. Elle est très importante car elle détermine la quantité de substance qui va pénétrer dans l'organisme Le franchissement des membranes par les médicaments dépend : - Caractéristiques de la membrane : Epaisseur/surface ; composition lipidique, présence de transporteurs Caractéristiques physico –chimiques : Pour traverser la membrane cellulaire, le principe actif doit posséder des caractéristiques physico-chimiques favorables: taille , Poids moléculaire. , solubilité en milieu acqueux , structure , charge/polarité , degré d’ionisation ( p. H, Pka), liposolubilité / hydrpsolubilité Pr SLIMANI. M 30

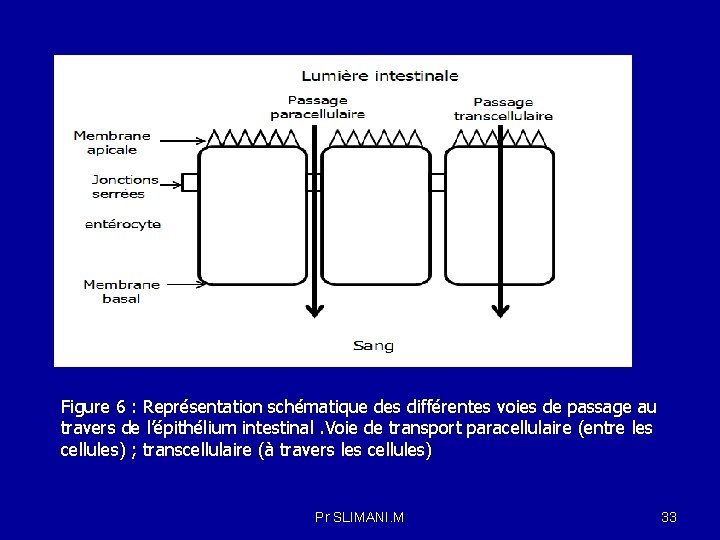
4 -1 Modalités du passage : Pour pénétrer dans la cellule, le médicament doit franchir la membrane cytoplasmique. Pour passer d’un compartiment dans l’autre, le médicament doit franchir une ou plusieurs membranes. Les membranes sont formées de cellules liées les unes aux autres d’une manière plus ou moins serrée. Ces cellules reposent sur une membrane basale, elle-même plus ou moins perméable aux molécules. On distingue : Le passage transcellulaire correspond à différents mécanismes comme la diffusion passive de composés lypophiliques , l’utilisation de transporteurs spécialisés ou encore la transcytose. Pr SLIMANI. M 31

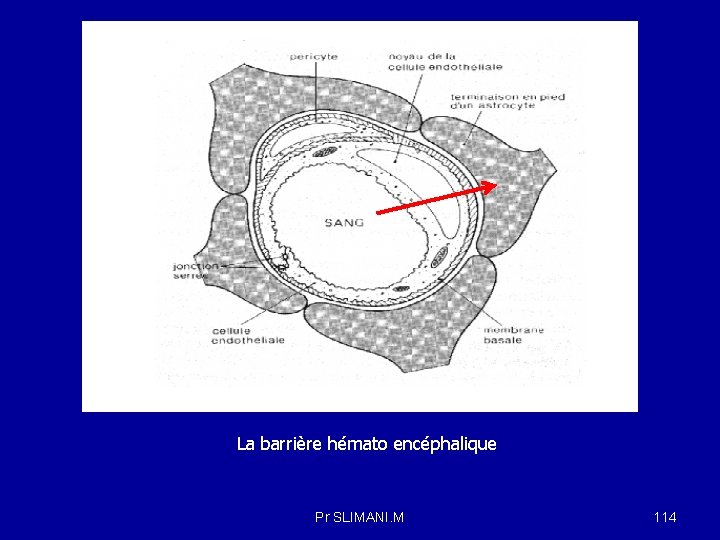
4 -1 -1 le passage transcellulaire ou transépithéliale (c'est-à-dire en passant par l'intérieur des cellules) : Lorsque les cellules sont serrées les unes contre les autres, comme c’est le cas au niveau de l’endothélium des capillaires cérébraux, le médicament doit traverser les cellules elles-mêmes, c’est-à-dire la membrane cytoplasmique, pour passer d’un compartiment à l’autre. La traversée des membranes se fait par transport passif (sens du gradient de concentration et ne nécessite pas d’énergie, le cas des composés lipophiles ), par diffusion facilitée grâce à des protéines de transport spécifiques , le cas du glucose (SGLT-1, Na+-glucose co transporter-1, localisé dans l'épithélium du tube digestif et le néphron) et par un transport actif nécessitant un apport d’énergie sous forme d’ATP. Par exemple, dans le cas de la réabsorption de sodium, l’étape active est la sortie basolatérale de sodium par la Na+/K+-ATPase, qui consomme de l’énergie et permet de maintenir un gradient électrochimique favorable à l’entrée passive de sodium au travers de la membrane apicale dans le sens du gradient électrochimique. Pr SLIMANI. M 32

Figure 6 : Représentation schématique des différentes voies de passage au travers de l’épithélium intestinal. Voie de transport paracellulaire (entre les cellules) ; transcellulaire (à travers les cellules) Pr SLIMANI. M 33

4 - 1 -2 le passage paracellulaire : Le passage paracellulaire utilise le gradient de concentrations des ions et solutés. Lorsque les cellules épithéliales membranaires sont séparées les unes des autres par des jonctions plus lâches, les molécules peuvent passer par ces jonctions appelées «gap junctions» . Le passage paracellulaire concerne les ions et les molécules solubles présents dans l’espace intercellulaire, selon les gradients de concentration. Cette voie permet le passage d’eau entre les jonctions serrées entrainant les petites molécules hydrophiles. Le transport paracellulaire ne peut être que passif, dans le sens du gradient chimique ou électrochimique pour les solutés ou du gradient osmotique pour l’eau (par exemple, le tubule proximal). 4 -1 -3 -Le passage au travers des pores : Au niveau du glomérule rénal, les molécules dont le poids moléculaire est inférieur à 68 000 peuvent passer, mais, plus le poids moléculaire d’une molécule approche de 68 000, plus son passage devient difficile. D’autres paramètres que le poids moléculaire (directement lié à la taille), tels que les charges ou la flexibilité sont importants pour le passage au travers des pores. Pr SLIMANI. M 34

4 - 2 Mécanismes de résorption : Les médicaments peuvent traverser les membranes soit par des processus passifs ou par des mécanismes impliquant la participation active des composants de la membrane 4 -2 -1 La diffusion passive représente le mécanisme le plus important par lequel les molécules de principe actif passent à travers les membranes lorsque ces molécules ne sont pas chargées électriquement ( non ionisée , lipophile ). La vitesse de diffusion (V) peut être modélisée par la loi de Fick: V= DSK ( Cext - Cint) / E Cext - Cint : gradient de concentration D: coefficient de diffusion du médicament (taille et ionisation) S: surface de la membrane K (Kow): coefficient de Partage du médicament ( lipide/eau) E: épaisseur de la membrane Ce mécanisme n’est pas saturable et est non spécifique : il n’y a pas de compétition entre les molécules. Pr SLIMANI. M 35

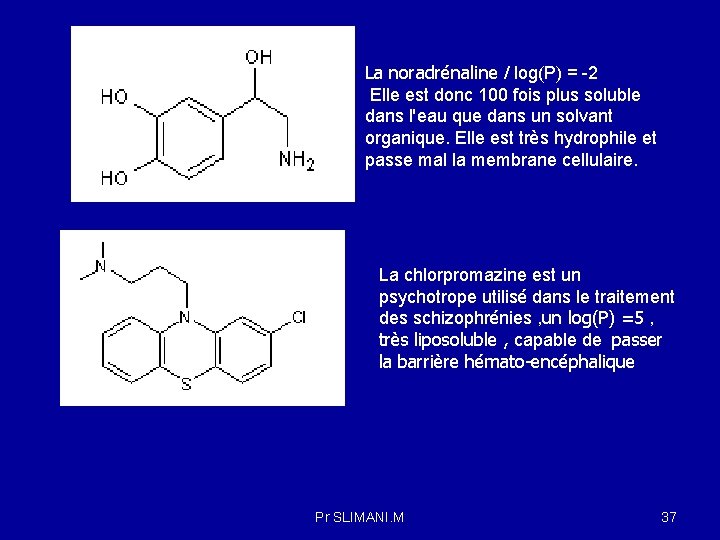
La diffusion passive dépend : -la lipophilie : Kow : coefficient de partition octanol / eau Le log P caractérise la lipophilie de la molécule. Plus le log P est élevé, plus la molécule est lipophile. log P> 0 , la substance est lipophile -Thio phénobarbital : Kow = 14 , log P = 1. 14 , lipophile la chlorpromazine , log P = 5 , est très liposoluble log P<0 , la substance est hydrophile -Phénobarbital : Kow = 0. 4, log P = -0. 39, hydrophile -Barbital : Kow = 0. 07 , log P= -1. 15, hydrophile N. B : La présence de groupes méthyle (-CH 3), éthyle (-C 2 H 5), méthyne =CH- ou les noyaux aromatiques confèrent à une molécule un caractère lipophile. Au contraire les groupements –OH, -COOH, C=O, et les groupes ionisés comme COO- ou NH 3+ confèrent à la molécule un caractère hydrophile donc lipophobe. (voire figure ) la concentration : La vitesse de diffusion se fait en fonction du gradient de concentration (d'une région de concentration élevée (p. ex. , liquides gastrointestinaux) vers une région de faible concentration (p. ex. , sang) , et n’implique pas de dépense d’énergie ; Pr SLIMANI. M 36

La noradrénaline / log(P) = -2 Elle est donc 100 fois plus soluble dans l'eau que dans un solvant organique. Elle est très hydrophile et passe mal la membrane cellulaire. La chlorpromazine est un psychotrope utilisé dans le traitement des schizophrénies , un log(P) =5 , très liposoluble , capable de passer la barrière hémato-encéphalique Pr SLIMANI. M 37

-la surface d'échanges (digestive - respiratoire - cutanée); -la taille : Les molécules de petite taille sont susceptibles de traverser les membranes plus rapidement que les molécules de grande taille ou fixée aux protéines plasmatiques -l’état d’ionisation : L’état d’ionisation dépend du p. Ka de la molécule et du p. H du milieu. Seule la forme non ionisée (liposoluble) est capable de passer la membrane cellulaire. Les substances actives acides faibles sont absorbées au niveau de l'estomac (estomac : p. H 2, 0) car elles ne sont pas ionisées en milieu acide ; sous forme nonionisée liposoluble, elles sont capables de franchir les barrières biologiques lipophiles. Les substances actives bases faibles sont elles faiblement absorbées au niveau de l'estomac, car elles sont ionisées en milieu acide. Les substances actives bases faibles sont faiblement absorbées au niveau de l'intestin grêle (jéjunum : p. H 8, 0), car elles ne sont pas ionisées en milieu basique ; sous forme non ionisée liposoluble , elles franchissent facilement les barrières biologiques lipophiles. Pr SLIMANI. M 38

4 -2 -2 La filtration : C’est un transport passif qui se réalise à travers les pores membranaires même pour les molécules hydrosolubles qui ont une petite taille et un faible poids moléculaires. Ces composés suivent généralement le flux d’eau à travers les pores protéiques ménagés dans les membranes cellulaires par des protéines intégrales ou entre des cellules. Ce flux est généré par des forces oncotiques ou osmotiques. Les pores sont plus abondants au niveau des capillaires surtout au niveau des capillaires des muscles rénaux. Les pores sont absents au niveau des capillaires du SNC. Le passage au niveau du filtre glomérulaire est déterminé par deux facteurs importants : -La pression de filtration glomérulaire de part et d’autre de la membrane filtrante -le poids moléculaire du médicament Pr SLIMANI. M 39

4 -2 -3 La pinocytose : C’est un transport qui se fait par vacuolisation de la membrane cytoplasmique. La molécule est englobée par la membrane pour former une vésicule qui se déplace tout le long de l’espace membranaire à traverser puis elle est libérée de l’autre côté par le processus inverse ( exocytose , endocytose ). 4 -2 -4 Diffusion passive facilitée (transporteur) Le passage membranaire par diffusion facilitée est réalisé grâce à la présence d’un transporteur intermembranaire. Les protéines membranaires qui assurent cette diffusion facilitée peuvent être soit des transporteurs (solutés et ions) soit des canaux (ions). Le transport facilité permet un transport plus rapide que la diffusion simple. Ce mécanisme ne consomme pas d’énergie, il fonctionne grâce à l’existence d’un gradient de concentrations qui existe entre les deux côtés de la membrane, le cas du transport passif effectué par les perméases (GLUT-1 à GLUT 5, glucose transporter). Pr SLIMANI. M 40

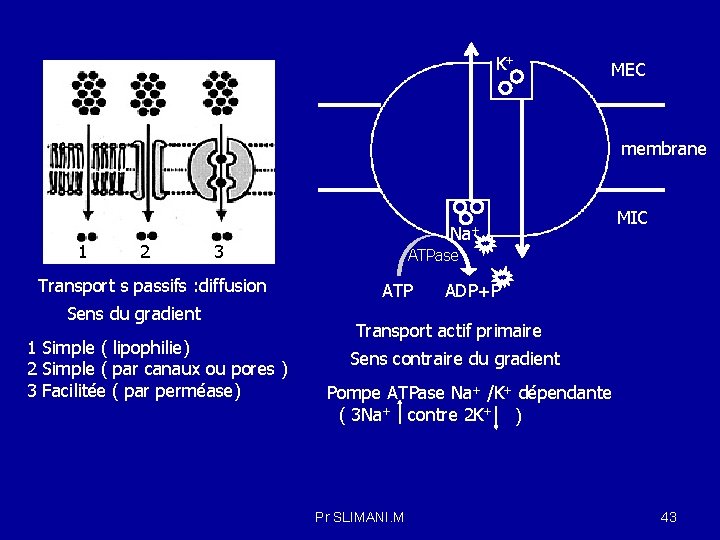
4 -2 -5 Transport actif : Est un processus de transport par lequel les molécules se déplacent contre un gradient de concentration et où de l’énergie est demandée (ATP). Formation complexe transporteur- molécule à transporter sur l'une des faces de la membrane - Dissociation sur l'autre face libérant la molécule transportée. -Il nécessite de l'énergie (ATP). -il est spécifique d'une substance -C'est un mécanisme saturable. -Il peut être inhibé et soumis à une compétition entre les molécules transportées (médicaments et substances endogènes, médicaments entre eux). -Les transporteurs ATP-dépendants: Le transport actif est caractérisé par le fait qu'il nécessite la présence d'un transporteur qui consommera de l'énergie, le plus souvent sous forme d'adénosine triphosphate (ATP). Cette consommation d'énergie permet au transport actif de prendre en charge des substrats et de leur faire traverser les membranes contre leur gradient de concentration. Ce sont ces transporteurs qui permettent de conserver une composition du milieu intracellulaire différente de celle milieu extracellulaire. Ces transporteurs agissent comme des pompes enchâssées dans la paroi cellulaire, les plus connus sont la pompe "Na+/K+ ATPase", et la superfamille des transporteur ABC. Pr SLIMANI. M 41

-La pompe "Na+/K+ ATPase" permet de maintenir des concentrations élevées de potassium dans le liquide intracellulaire, et d'effluer le sodium dans le liquide extracellulaire. - Les transporteurs "ATP-binding cassette" (ATP) sont présentes aux interfaces d'échanges entre les différents milieux de l'organisme comme les reins, le tractus gastro-intestinal et le foie… Cette famille de transporteurs est spécialisée dans l’élimination de divers composés, hors du cytoplasme ou hors des compartiments intracellulaires. Ils utilisent l'hydrolyse de l'ATP comme source d'énergie. Pr SLIMANI. M 42

K+ MEC membrane 1 2 Na+ 3 Transport s passifs : diffusion Sens du gradient 1 Simple ( lipophilie) 2 Simple ( par canaux ou pores ) 3 Facilitée ( par perméase) MIC ATPase ATP ADP+P Transport actif primaire Sens contraire du gradient Pompe ATPase Na+ /K+ dépendante ( 3 Na+ contre 2 K+ ) Pr SLIMANI. M 43

La vitesse et la durée de l'absorption dépendent de : - l'état physique du médicament et de la libération du principe actif : cette mise à disposition constitue la « phase galénique » . L'ordre décroissant de vitesse de passage est : solutions aqueuses > solutions huileuses > suspensions > solides - la concentration : plus elle est forte et plus le passage est rapide - la circulation : plus le tissu est vascularisé et plus le passage est rapide (muscle). Les tissus peu vascularisés retiennent les médicaments (graisse). La vasodilatation et la vasoconstriction accélèrent ou ralentissent l'absorption. -la surface : plus la surface d'absorption est grande, plus le passage est rapide et important. L’absorption: L’absorption décrit la vitesse à laquelle un médicament quitte son site d’administration vers la circulation générale. Un paramètre important est la biodisponibilité La biodisponibilité d’un médicament est définie comme étant la fraction de la dose administrée qui atteint la circulation systémique et la vitesse à laquelle cela se produit. Pr SLIMANI. M 44

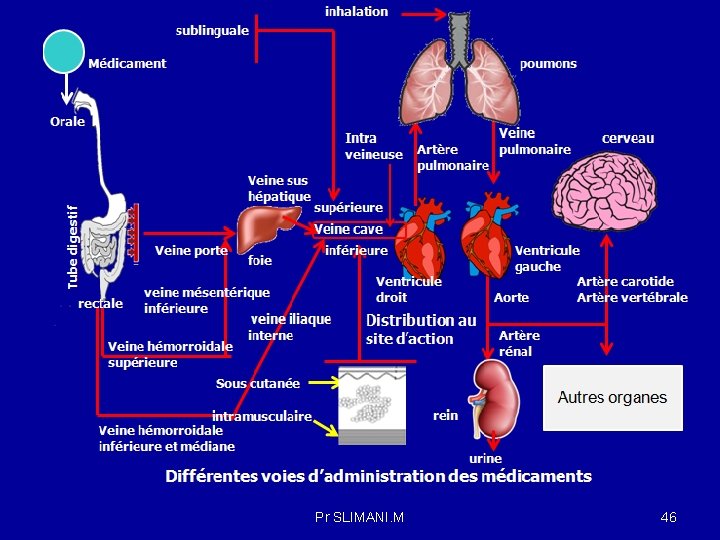
Voies d’administration des médicaments : Il existe plusieurs voies d’administration des médicaments qui présentent des avantages et des inconvénients. Lorsqu’on recherche un effet général, le médicament est administré par voie entérale (perlinguale , orale et rectale ) ou parentérale (injection : intramusculaire , intraveineuse , sous cutanée ). Si l’on veut obtenir un effet local, on utilise des préparations spéciales comme les collyres, les pommade( voie cutano-muqueuse). L’ absorption est le processus par lequel toute substance amenée de l’extérieur pénètre dans le sang ou la lymphe : • elle est directe quand le médicament pénètre directement dans l’organisme (voies intraveineuse, intramusculaire, sous-cutanée, etc. ) ; • elle est indirecte quand le médicament doit traverser une barrière avant de passer dans la circulation générale (voie orale, application sur la peau). 45 Pr SLIMANI. M

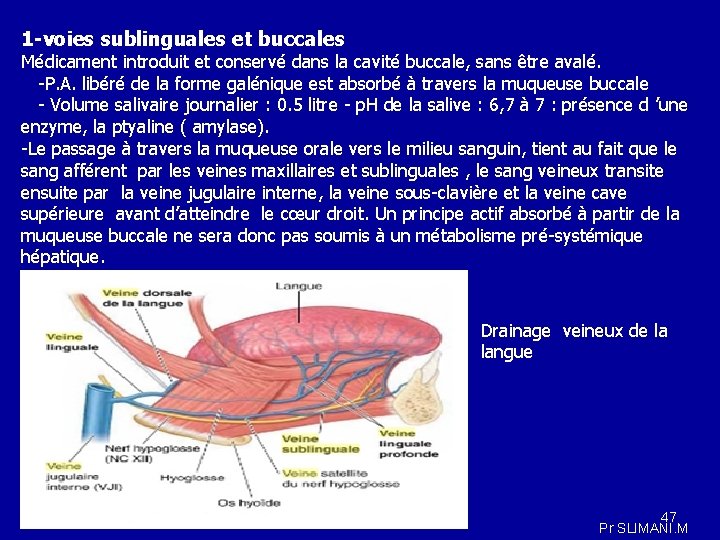
Pr SLIMANI. M 46

1 -voies sublinguales et buccales Médicament introduit et conservé dans la cavité buccale, sans être avalé. -P. A. libéré de la forme galénique est absorbé à travers la muqueuse buccale - Volume salivaire journalier : 0. 5 litre - p. H de la salive : 6, 7 à 7 : présence d ’une enzyme, la ptyaline ( amylase). -Le passage à travers la muqueuse orale vers le milieu sanguin, tient au fait que le sang afférent par les veines maxillaires et sublinguales , le sang veineux transite ensuite par la veine jugulaire interne, la veine sous-clavière et la veine cave supérieure avant d’atteindre le cœur droit. Un principe actif absorbé à partir de la muqueuse buccale ne sera donc pas soumis à un métabolisme pré-systémique hépatique. Drainage veineux de la langue 47 Pr SLIMANI. M

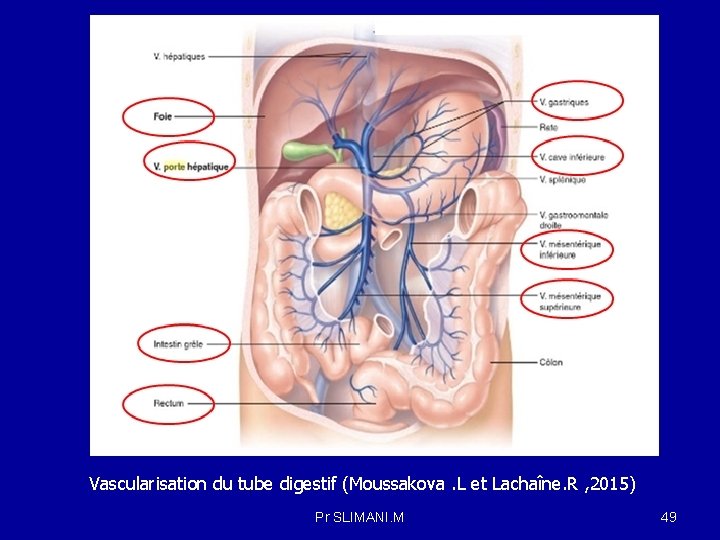
2 -La voie orale : -Après administration orale, le médicament traverse la barrière intestinale puis le foie avant d’atteindre la circulation générale et de là les organes pour son action thérapeutique. 2 -1 Le drainage veineux : -Le médicament administré par la voie orale traverse la barrière intestinale et transportée par la veine porte vers le foie avant d'atteindre la circulation systémique -La veine porte est issue de la réunion veineuse de la veine mésentérique supérieure, de la veine mésentérique inférieure, et de la veine splénique : -veine mésentérique supérieure draine tout l’intestin grêle , une partie du gros intestin (segment ascendant et transversale) et l’estomac -veine mésentérique inférieure draine les segments distaux du gros intestin et le rectum. Elle se jette dans la veine splénique juste avant que celle-ci s’unisse à la veine mésentérique supérieure pour former la veine porte hépatique -La fraction de principe actif qui ressort du foie par les veines hépatiques droite , gauche et moyenne se rend ensuite dans le cœur par la veine cave, puis vers les poumons artère pulmonaire et retourne au cœur via la veine pulmonaire Pr SLIMANI. M 48

Vascularisation du tube digestif (Moussakova. L et Lachaîne. R , 2015) Pr SLIMANI. M 49

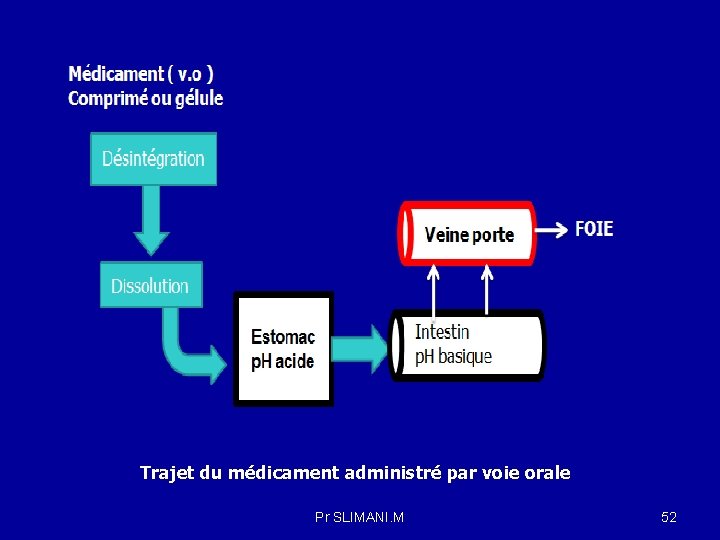
2 -2 La voie gastro-intestinale « voie orale » ( per os) La voie orale peut être utilisée pour un traitement local (pansements gastrointestinaux) ou général. La voie orale n'est pas utilisable si le médicament destiné à un traitement général est dégradé dans le tube digestif (p. H, flore microbienne, enzymes du tube digestif). L'absorption digestive peut se faire à tous les niveaux du tube digestif , selon le p. H du milieu où se trouve le médicament, (plasma : p. H 7, 4 ; estomac : p. H 2, 0 ; jéjunum : p. H 8, 0) son rapport fraction ionisée / fraction non ionisée varie. . Estomac : La surface de l'estomac est d'environ 1 m 2. Le p. H du liquide gastrique est acide. Le débit de drainage sanguin de l'estomac est faible, environ 0, 2 L/min. En raison de l’acide chlorhydrique sécrété par l’estomac, le p. H du liquide gastrique est acide : l’absorption y est limitée aux médicaments acides. Les médicaments sont le plus souvent des bases faibles, plus rarement des acides faibles. Ces médicaments existent donc sous 2 formes, ionisée et non ionisée, seule la forme non ionisée d’un médicament (si elle est suffisamment liposoluble) est capable de passer la membrane cellulaire. L’état d’ionisation dépend du p. Ka de la molécule et du p. H du milieu. Pr SLIMANI. M 50

Le rapport forme ionisée/non ionisée est défini par les équations d’Henderson. Hasselbach. AH A - + H+ [A - ] ionisée p. H = p. K + log [AH] non ionisée BOH B+ + OH[BOH ] non ionisée p. H = p. K + log [B+ ] ionisée -les substances actives acides faibles sont absorbées au niveau de l'estomac, car elles ne sont pas ionisées en milieu acide ; sous forme non-ionisée liposoluble, elles sont par conséquent capables de franchir les barrières biologiques lipophiles. Les substances actives bases faibles sont elles faiblement absorbées au niveau de l'estomac, car elles sont ionisées en milieu acide. 51 Pr SLIMANI. M

Trajet du médicament administré par voie orale Pr SLIMANI. M 52

Exemple : L’aspirine (acide acétylsalicylique) est un médicament acide faible, avec un p. Ka=3, 5: (acide acétylsalicylique non ionisée liposoluble / ion acétyl salicylate ionisée hydrosoluble) se trouve presque entièrement sous forme non ionisée, liposoluble, dans l'estomac (p. H=1). En milieu acide, dans l’estomac l’aspirine sera faiblement ionisée. Cet état de faible ou de non ionisation va lui permettre une bonne résorption au niveau gastrique. La proportion de forme non ionisée disponible (et donc la capacité du médicament à traverser une membrane) est déterminée par le p. H du milieu et le p. Ka du médicament (constante de dissociation de l'acide). A l’inverse, les médicaments bases faibles seront ionisés en milieu gastrique et peu ionisés en milieu intestinal, ce qui favorisera la résorption dans l’intestin. Pr SLIMANI. M 53

La transformation intra gastrique : Certaines substances sont instables en milieu acide. Sur le plan pharmacocinétique, l'absorption digestive de la pénicilline G est médiocre, inférieure à 30%, car elle est détruite par le suc gastrique acide (rapidement hydrolysé). La pénicilline G perd son activité par hydrolyse acide au niveau gastrique. C’est ce qui explique qu’il est préférable de lui substituer la Pénicilline V lorsqu’on désir e employer par la voie orale, étant donné que leurs spectre antibactérien sont semblables -Les tétracyclines forment un complexe insoluble avec des ions tels le calcium. -La lévodopa est métabolisée dans l’estomac par une décarboxylase. Les principaux métabolites sont des acides phénylcarboxyliques et de la méthoxydopa. Lorsque l’on retarde le vidange gastrique , on augmente la décomposition intra gastrique et on diminue par conséquent la biodisponibilité. -L’acidité gastrique n’a pas que des effets négatifs. Ainsi, il a été démontré qu’elle était nécessaire à la transformation du chlorazépate en nordiazépam. La chlorazépate est très polaire , très peu liposoluble et par conséquent très peu absorbé au niveau gastro-intestinal. Il est donc nécessaire qu’il se transforme en nordiazépam pour être absorbé. Pr SLIMANI. M 54

Intestin : L'absorption orale est majoritaire au niveau du pylore et de l'intestin grêle (duodénum, jéjunum, iléon). -Le p. H est alcalin : 6 à 8 (5 -6 au niveau des villosités et entre 6 et 8 dans l'espace luminale). -Voies de passage à travers l’épithélium intestinal L’épithélium intestinal est formé d’une monocouche de cellules étroitement liées les unes aux autres par des jonctions serrées. La molécule peut franchir la barrière intestinale , compte tenu de ses caractéristiques physico chimiques afin de quitter la lumière intestinale et rejoindre la circulation sanguine ou lymphatique : Pr SLIMANI. M 55

-Voies de passage à travers l’épithélium intestinal L’épithélium intestinal est formé d’une monocouche de cellules étroitement liées les unes aux autres par des jonctions serrées. La molécule peut franchir la barrière intestinale , compte tenu de ses caractéristiques physico chimiques afin de quitter la lumière intestinale et rejoindre la circulation sanguine ou lymphatique : -La voie paracellulaire correspond au passage des molécules entre les cellules épithéliales adjacentes , les jonctions serrées. Ce sont les complexes de jonctions serrées qui régulent cette voie en permettant le passage d’eau , d’ions et de molécules hydrophiles. La diffusion des petites molécules au travers des pores dépend du gradient de concentration ; . Pr SLIMANI. M 56

-la voie transcellulaire : Les nutriments sont essentiellement absorbés par voie transcellulaire , en traversant la membrane apicale , le cytoplasme entérocytaire et les membranes basolatérales , avant d’être drainés par voie sanguine ou lymphatique. Les composés lipophiles ont la capacité de diffuser au travers de la membrane plasmique et empruntent ainsi majoritairement la voie transcellulaire. En plus de cette diffusion passive, il existe des transports actifs faisant intervenir des transporteurs spécifiques comme pour les acides aminés ou le glucose ; - la voie lymphatique (capture par les cellules Microfolds , font partie des cellules épithéliales qui recouvrent le dôme des plaques de Peyer, retrouvées dans le grêle ). Elle peut subir un transport passif, actif ou facilité Pr SLIMANI. M 57

- Processus d’absorption : Les substances actives acides faibles sont faiblement absorbées au niveau de l'intestin grêle, car elles sont ionisées en milieu basique ; sous forme ionisée hydrosoluble, elles franchissent difficilement les barrières biologiques lipophiles. Les substances actives bases faibles, elles, sont bien absorbées à ce niveau. La surface d’échange : -La surface de l'intestin est de 200 à 300 m 2 , plus importante que celle de l’estomac ( longueur , présence de villosités et de microvillosités ). -débit sanguin : L'irrigation sanguine est importante, 1000 ml/min ( intestin ) alors 250 ml/min (estomac), la majorité des médicaments sont absorbés à ce niveau; -La bile : sels biliaires et certains phopholipides présents dans la bile sont des surfactifs qui peuvent aider de divers façons à l’absorption des médicaments; -Les transporteurs: Absent dans l’estomac , localisés dans l’intestin ces facteurs font que l’absorption des acides est plus rapide dans l’intestin que dans l’estomac. Pr SLIMANI. M 58

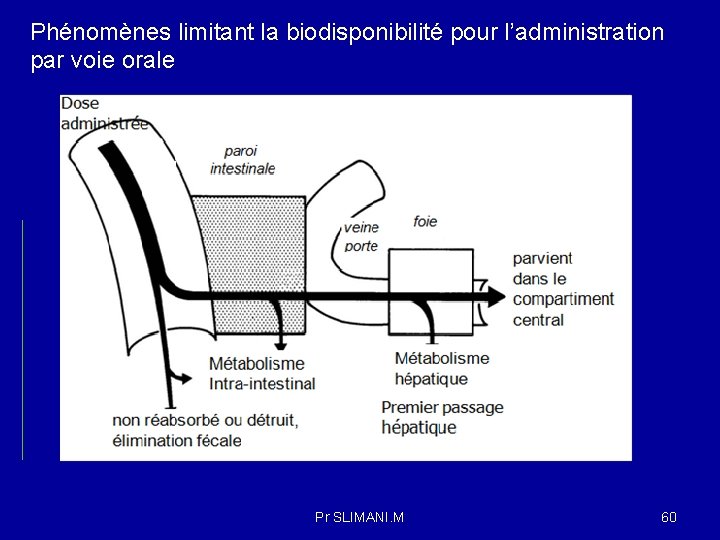
-Effet du premier passage : -Une particularité de l'absorption digestive est le métabolisme de premier passage: Le médicament, absorbé au niveau du tube digestif, passe par le foie, atteint le coeur et après passage pulmonaire se distribue dans l'ensemble de l'organisme. Au niveau de la muqueuse intestinale et du foie, le médicament rencontre des enzymes susceptibles de le transformer en un ou plusieurs métabolites parfois actifs mais le plus souvent inactifs. C'est le métabolisme de premier passage (First pass effect) ce qui conduit à une perte importante de médicament et entraîner ainsi une diminution de l’effet thérapeutique. L’effet de premier passage hépatique est surtout marqué pour les médicaments liposolubles. Il est saturable et soumis à des variations interindividuelles importantes. Les conséquences de ce premier passage hépatique sont généralement de diminuer la biodisponibilité. F = 1 – E ( coefficient d’extraction hépatique ) Pr SLIMANI. M 59

Phénomènes limitant la biodisponibilité pour l’administration par voie orale Pr SLIMANI. M 60

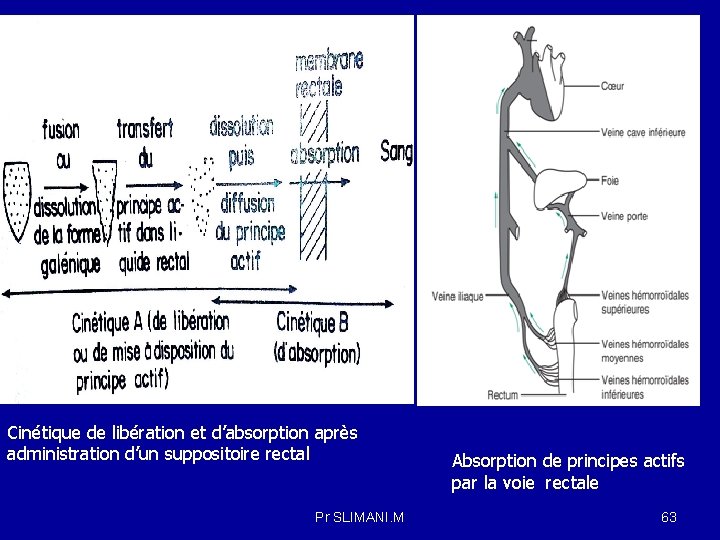
Voie rectale : la surface absorbante totale varie entre 200 et 400 cm 2 , par rapport à celle du petit intestin : 2000 cm 2. l’absorption se fait par diffusion passive. -Libération du P. A: La destruction de la forme galénique est fonction de la nature de l’excipient: -Lipophiles: un excipient fondant dans le rectum (matière grasses comme le beurre de cacao , ou glycérides semi synthétiques), fondent en donnant un liquide incolore. Le point de fusion compris entre 32. 6 ° et 37. 6°, l’optimum se situant à 36. 5°. -Un excipients hydrosolubles (masse gélatine/glycérine ou polyoxyéthyèneglycols ), utilisé pour son action laxative et lubrifiante au niveau du rectum. La vitesse de destruction est proportionnelle à la vitesse de dissolution de l’excipient dans le liquide du rectum. -Quelque soit l’excipient utilisé , après fusion ou dissolution , une masse plus ou moins visqueuse qui formera un film à la surface de la muqueuse , film à partir duquel le P. A va effectuer son transfert vers le liquide rectal. Pr SLIMANI. M 61

Le médicament est introduit dans le rectum qui est vascularisé par les veines hémorroïdales qui véhiculent le principe actif vers le foie ou vers la veine cave inférieure. Cette dernière retournant directement vers le coeur réduit ainsi le phénomène de premier passage l'absorption au niveau du rectum ne sera pas très importante du fait d'un passage hépatique pour environ un tiers du principe actif administré (seule la part du médicament absorbée par les veines hémorroïdaires inférieures et moyennes échappe à la circulation hépatique en rejoignant directement la veine cave inférieure) et d'une surface d'échange limitée. Les veines hémorroidales inférieurs et moyennes aboutissent aux veines iliaques internes qui se jettent dans la veine cave inférieure, évitant ainsi le premier passage hépatique , soustrait ainsi aux effets des sucs gastriques ( env. 30% ). -Les veines hémorroidales supérieures sont reliées à la veine mésentérique inférieure qui mène le sang à la veine porte puis au foie. Pr SLIMANI. M 62

Cinétique de libération et d’absorption après administration d’un suppositoire rectal Pr SLIMANI. M Absorption de principes actifs par la voie rectale 63

Comme la muqueuse rectale est très vascularisée, elle permet d’obtenir une action générale ou locale selon le type de médicament. Sont administrés par cette voie les suppositoires, les lavements et les pommades rectales. Les suppositoires sont utilisés pour obtenir un effet local (hémorroïdes, rectites, constipation) ou une action générale. Exemples : -La pommade a une action principalement locale. -Les suppositoires : préparations de consistance solide ou molle, contenant une dose unitaire de P. A. et destinés à être introduits dans le rectum pour s’y liquéfier à T° du corps en vue d’une action locale ou systémique. suppositoires peuvent avoir une action locale (suppositoires à la glycérine utilisés comme laxatif) ou une action générale (antibiotiques, sédatifs, hypnotiques). Le lavement est utilisé pour une action évacuatrice ou pour l'administration locale de médicaments. Pr SLIMANI. M 64

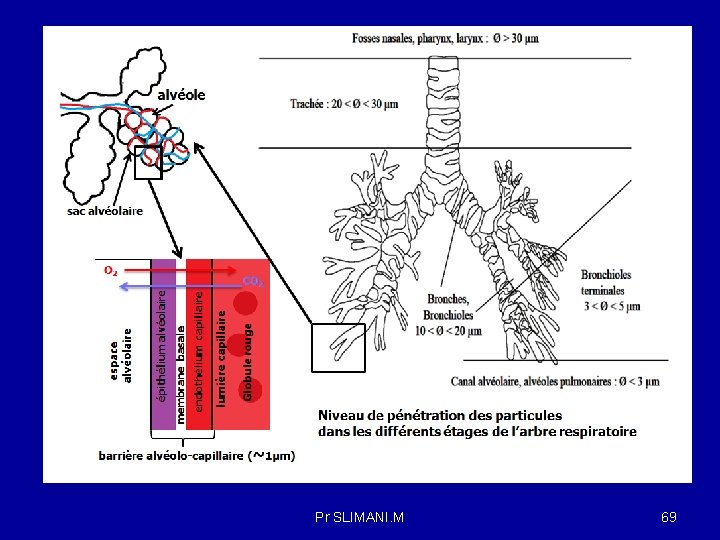
Voie pulmonaire : C’est une voie d’absorption et d’élimination rapide car elle évite le métabolisme de premier passage intestinal et hépatique, le médicament absorbé au niveau du poumon, passe dans l’oreillette gauche et le ventricule gauche, et ensuite dans la circulation générale. Cette voie permet de délivrer des concentrations plasmatiques et tissulaires élevées et une action des médicaments directement au niveau pulmonaire. Les poumons sont les organes ou se font les échanges gazeux entre l'air des alvéoles et le sang des vaisseaux capillaires qui tapissent les alvéoles pulmonaires. Cette voie est utilisée pour faire absorber les gaz (oxygène, chloroforme, éther, etc. ). On peut administrer un grand nombre de médicaments (sulfamides, antiasthmatiques, etc. ) grâce aux aérosols, qui sont des brouillards de fines particules médicamenteuses. On distingue trois niveaux pour les voies respiratoires : la région extra thoracique (cavités nasales, pharynx et larynx), la région thoracique (trachée, bronches et bronchioles) et la région alvéolaire (bronchioles terminales, sacs alvéolaires et alvéoles). Selon que le PA franchit ou non les alvéoles pulmonaires, on a une action générale (anesthésie générale ) ou locale (ex : traitement antiasthmatique). Pr SLIMANI. M 65

ex: Les bronchodilateurs β 2 stimulants (salbutamol) , représentent le traitement de référence de la crise d’asthme , par une fixation spécifique au niveau des récepteurs bêta-2 du muscle lisse bronchique, permettant ainsi une broncho dilatation rapide. Différents facteurs contribuent à favoriser l’absorption des substances au niveau des voies respiratoires : Le taux d’absorption dépend de la ventilation pulmonaire ( fréquence respiratoire , volume de l’inspiration) , du débit cardiaque ( qui conditionne le flux sanguin au niveau pulmonaire), et de la solubilité du xénobiotique (coefficient de partage sang : air). Les alvéoles ont une surface très importante (environ 80 m 2 chez l’humain). On estime à 300 à 400 millions le nombre total d’alvéoles chez l’homme. La paroi alvéolaire repose sur un réseau dense de capillaires et constituée d’un épithélium , d’une membrane basale interstitielle , de tissu conjonctif et d’un endothélium capillaire. A travers ces couches dont l’épaisseur est de 0. 8 µm que s’effectuent les échanges gazeux entre la phase aérienne et la phase liquide(sang), la diffusion des substances est très rapide. Pr SLIMANI. M 66

Diffusion alvéolo capillaire : Les échanges gazeux entre l’air alvéolaire et le sang capillaire à travers la barrière alvéolo capillaire se font par diffusion passive. La vitesse de diffusion d'un gaz (V gaz) à travers un tissu est régie par la loi de Fick: V gaz = S/E. D. (P 1 -P 2) -La surface d’échange : air –sang (S: 80 m 2 pour la barrière alvéolo-capillaire ); -la différence de pression partielle du gaz (P 1 -P 2) entre le sang capillaire et l’air alvéolaire ; -La constante de diffusion propre à chaque gaz (D); -inversement proportionnelle à l'épaisseur de la barrière alvéolo-capillaire (E: 0. 8µm ). Prenons l'exemple de la diffusion de l'O 2 de l'alvéole dans le sang capillaire. La pression partielle d' O 2 dans l'alvéole (PAO 2) est de 100 mm Hg, alors que la pression partielle d'O 2 dans le sang qui entre dans le capillaire pulmonaire (P v. O 2) est de 40 mm Hg. Ce gradient de pression permet la diffusion de l'O 2 de l'alvéole dans les globules rouges. Par contre , la diffusion du CO 2 du sang (46 mm. Hg) vers l’alvéole (40 mm. Hg). Pr SLIMANI. M 67

L’absorption des particules liquides ou solides , sous forme d’aérosols est fonction de leur forme , taille et diamètre , ces facteurs jouant un rôle prépondérant sur la localisation de leur dépôt dans l’appareil respiratoire. Les grosses particules se déposent principalement dans la région du naso pharynx d’où elles seront éventuellement éliminées par la toux. Les particules insolubles de taille moyenne ( entre 0. 1 µm et 5µm) se déposent dans la région trachéo -bronchique. Les grosses particules et les moyennes sont évacuées par les mucosités et les mouvements ciliaires des muqueuses respiratoires , ne générant qu'un effet local. Seules particules fines ( entre 0. 1 et 1µm) , les gaz et les vapeurs se pénètrent jusqu’aux alvéoles retrouvent dans la région alvéolaire où elles seront au contact directement avec les capillaires sanguins ou les vaisseaux lymphatiques qui les irriguent après diffusion à travers la paroi alvéolaire et de générer un effet systémique ( le monoxyde de carbone ). Pr SLIMANI. M 68

Pr SLIMANI. M 69

Exemple : Les intoxications par voie respiratoire impliquent essentiellement des gaz tels que le mono oxyde de carbone , l’acide cyanhydrique , des gaz lacrymogènes , des solvants organique , des toxiques semi volatils tels que certains pesticides et même certains métaux. L’absorption du monoxyde de carbone (CO) se fait exclusivement par les voies respiratoires. Il se diffuse très rapidement à travers les membranes alvéolo capillaires. Le CO entre en compétition avec l’oxygène (O 2), avec l’hémoglobine, pour former la carboxyhémoglobine (CO Hb). Cette liaison, stable mais réversible, empêche le transport de l'O 2 par le pigment, ce qui se traduit par une diminution la concentration sanguine en oxyhémoglobine et par conséquent, une diminution de l'oxygénation des tissus (hypoxie tissulaire). • Situation normale: O 2 + Hb → O 2 Hb (oxyhémoglobine). • Présence de CO: CO + Hb → CO Hb (carboxyhémoglobine). Quant à l'amiante, lorsque ses fibres en suspension dans l'air sont inhalées, elle peut se déposer dans le tissu pulmonaire et l'enveloppe du poumon et à long terme, peut provoquer des inflammations (asbestose) ou le cancer du poumon ou de la plèvre (mésothéliome). Pr SLIMANI. M 70

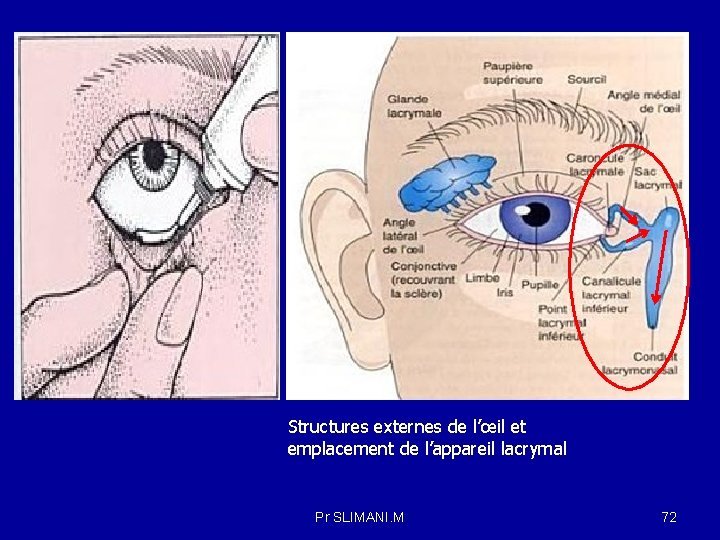
LA VOIE OCULAIRE: ce sont des préparations liquides, semi- solides ou solides, destinées à être appliquées sur le globe oculaire ou les conjonctives, ou à être introduites dans le sac conjonctival, pour une action locale. La fragilité et la sensibilité de l’oeil exigent des médicaments stériles dont le p. H et la pression osmotique sont strictement contrôlés. Lorsqu’ils sont administrés localement , les médicaments peuvent pénétrer à l’intérieur de l’œil en traversant la cornée celle ci est constituée de 03 couches superposées de tissu qui sont : épithélium , le stroma et l’endothélium Pour être capable de franchir la cornée, une substance doit être lipophile afin de traverser l’épithélium et l’endothélium , et hydrophile pour franchir le stroma. D’autres facteurs peuvent influencer l’absorption cornéenne. Ainsi , lorsqu’un médicament est instillé dans l’œil, une dilution est due à une sécrétion réactionnelle de larmes se produit. L’excés est évacué par les canaux lacrymaux, le sac lacrymal et le conduit naso-lacrymal jusqu’au nez ou il se mélange aux sécrétions nasales. le volume lacrymal chez l’humain est de 7 à 10 μl ( en absence de clignement des paupières); le volume des gouttes ophtalmiques se situe entre 50 à 70 μl) ce qui conduit à une réduction de la biodisponibilité intraocculaire par l’évacuation intranasale de l’excés. Pr SLIMANI. M 71

Structures externes de l’œil et emplacement de l’appareil lacrymal Pr SLIMANI. M 72

Exemple : les collyres ce sont des solutions ou des suspensions, aqueuses ou huileuses, stériles contenant un ou plusieurs P. A. destinées à l’instillation oculaire pour une action locale. les collyres, instillés dans le cul de sac conjonctival se diluent dans le liquide lacrymal et exercent leur activité sur la cornée, la conjonctive, les paupières. ils sont rapidement éliminés par les larmes vers les fosses nasales et leur temps de contact très court avec l’oeil nécessite des applications répétées. tensio-actifs : facilite l’étalement du collyre - conservateurs antioxydants : acide ascorbique - conservateurs antimicrobiens : chlorure de benzalkonium, esters de l’acide parahydroxybenzoïque - isotonisants : Nacl -viscogènes : ils augmentent le temps de contact oeil – collyre Pommades ophtalmiques : -Préparations semi-solides stériles destinées à être appliquées sur les conjonctives. Elles contiennent 1 ou plusieurs PA dissoutes ou dispersées dans un excipient approprié -Intérêt: prolonger le contact du PA avec les tissus oculaires externes et internes -Qualités requises: stérilité, dimensions des particules(<50 µm) -bonne tolérance, fluidité Pr SLIMANI. M 73

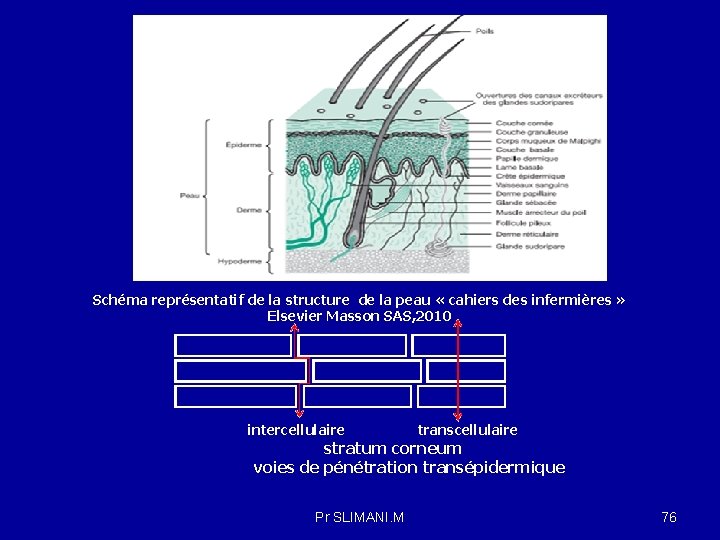
LA VOIE PERCUTANEE : Les principales couches cutanées comprennent de l’extérieur vers l’intérieur: L’épiderme : ( couche cornée ou stratum corneum : constituée de plusieurs couches compactes de cellules , le principal obstacle à l’absorption; -Le derme : tissu fibreux : très hydrophile et riche en vaisseaux sanguins ; -L’ hypoderme est constitué de fibres de collagène lâches, peu vascularisé mais richement innervé, ce qui explique l'absorption par cette voie sera relativement lente et douloureuse. Auxquelles s’ajoutent les annexes cutanées dont les follicules pileux, les glandes sudoripares et les glandes sébacées. La peau a pour rôles : • d'assurer une couverture protectrice et imperméable à l'ensemble de l'organisme ; • de permettre le toucher ; • de contrôler la régulation thermique du corps (transpiration) ; • de stocker des réserves énergétiques (tissu adipeux) ; • de synthétiser et métaboliser divers composés tels que la vitamine D. Absorption transcutanée est un phénomène de diffusion passive qui s’exerce au niveau de chacune des couches de la peau. Pr SLIMANI. M 74

Voies de pénétration percutanée Pour toute molécule appliquée sur la peau , deux voies distinctes s’offrent pour la pénétration : l’une , à travers les espaces intercellulaires de la couche cornée et à travers les cellules cornées elles mêmes (voie transépidermique), l’autre empruntant les annexes cutanées( follicules pilo-sébacés et /ou glandes sudoripares ): 1)absorption transépidermale par diffusion à travers la membrane lipidique , principalement pour les substances lipophiles et, dans une moindre mesure, par certaines substances hydrophiles à travers les pores. Les molécules peuvent pénétrer à travers les espaces intercellulaires de la couche cornée (voie intercellulaire) ou pénétrer directement dans les cornéocytes (voie intracellulaire). -Le passage transcellulaire direct avec traversée successive des cellules et des espaces extracellulaires, est surtout emprunté par les molécules de petites taille. Il fait intervenir les cornéocytes et la matrice lipidique. Les molécules diffusent passivement de cellule en cellule. Cette voie est réservée aux molécules hydrophiles qui vont se fixer sur les sites protéiques présents dans les cornéocytes. Pr SLIMANI. M 75

Schéma représentatif de la structure de la peau « cahiers des infermières » Elsevier Masson SAS, 2010 intercellulaire transcellulaire stratum corneum voies de pénétration transépidermique Pr SLIMANI. M 76

-Le passage intercellulaire à travers le stratum corneum se fait par diffusion dans les lipides intercellulaires. Les molécules lipophiles passent dans l’espace interlipidique puis dans le liquide interstitiel des couches vivantes. 2 -La pénétration à travers les annexes cutanées : l’absorption a lieu au niveau des surfaces cutanées pileuses , évitant ainsi la barrière membranaire. Ces structures offrent des zones de moindre résistance pour la pénétration des molécules. Les pores hydrophiles constituent le lieu de passage pour les produits hydrosolubles. Les particules lipophiles peuvent éventuellement pénétrer dans les follicules pileux pour rejoindre le derme réticulaire. Deux nouvelles étapes de distribution et diffusion permettent le passage dans le derme , suivies d’une étape de distribution dans les capillaires pour rejoindre la circulation générale. Les molécules lipophiles traversent facilement la peau. Le passage est facilité par la vasodilatation cutanée , le degré d’hydratation de la peau, la présence de lésions mécaniques ou l’irritation de l’épiderme. Pr SLIMANI. M 77

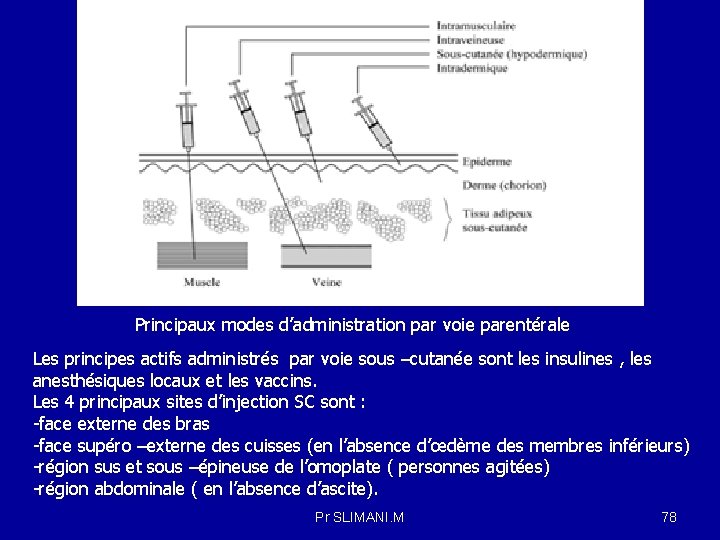
Principaux modes d’administration par voie parentérale Les principes actifs administrés par voie sous –cutanée sont les insulines , les anesthésiques locaux et les vaccins. Les 4 principaux sites d’injection SC sont : -face externe des bras -face supéro –externe des cuisses (en l’absence d’œdème des membres inférieurs) -région sus et sous –épineuse de l’omoplate ( personnes agitées) -région abdominale ( en l’absence d’ascite). Pr SLIMANI. M 78

L’injection par voie sous-cutanée est réalisée dans la partie profonde de l’hypoderme. La molécule doit d’abord quitter son excipient et se dissoudre dans le film hydrolipidique pour traverser la barrière cutanée. Elle pénètre dans le stratum corneum à travers les espaces intercellulaires. Elle diffuse dans les différentes couches de l’épiderme totalement hydratées pour ensuite continuer à diffuser dans le derme, barrière moins sélective , est plus facilement franchissable. Au niveau du derme, elles entrent en contact avec le système vasculaire capillaire qui se charge d’en résorber une partie, qui passe alors dans la circulation générale pour fournir une action systémique. La diffusion peut se poursuivre dans l’hypoderme et même dans les tissus sous-cutanés , afin d’agir au plus près de leur cible Les substances à bas poids moléculaires sont absorbés tout d’abord via les capillaires et est transporté par la circulation sanguine, alors que les molécules de haut poids moléculaires sont absorbés en premier lieu par les vaisseaux lymphatiques, car leur passage du tissu adipeux aux capillaires est très lent. Pr SLIMANI. M 79

-La vitesse de pénétration des médicaments à travers la peau est fonction de leur coefficient de partage ( huile/eau) , se fait au niveau de l'épiderme dépend de différents facteurs : - l'état de la peau, si elle est lésée (plaie, brûlure, eczéma), le passage est plus important ; -l'âge du sujet (passage plus important chez les jeunes du à la teneur en eau plus importante). L’action est locale si les composants ne peuvent pas pénétrer à travers la peau. Elle est générale si les composants peuvent traverser la barrière cutanée. La nature de l'excipient (certains excipients sont dépourvus de pouvoir de pénétration comme la vaseline). On les réserve donc à une action strictement locale, par contre il en existe d'autres qui vont manifester un pouvoir pénétrant qui va permettre un certain passage dans le milieu intérieur. L’adjonction d’additif , hyaluronidase qui détruit les muco-polysaccharides tissulaires permet d’améliorer l’absorption en augmentant l’étalement du dépôt et ainsi améliorer la vitesse d’absorption. Par contre , l’adjonction d’anesthésiques locaux , d’adrénaline ou de toute autre substance ou action provoquant une vasoconstriction , conduit à un ralentissement de l’absorption. Pr SLIMANI. M 80

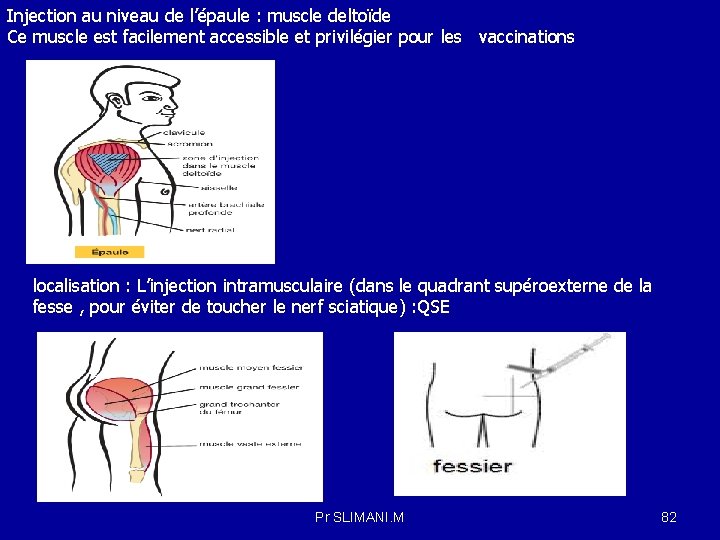
La voie intramusculaire localisation : -Injection au niveau de l’épaule : muscle deltoïde( les vaccinations) -Injection au niveau de la hanche : muscle fessier moyen et petit (ou fessier antérieur) , un site de choix car il ne contient pas de nerfs ni de vaisseaux sanguins importants. - Injection au niveau de la cuisse, face latérale : muscle vaste externe, est situé sur la face externe de la cuisse. Il n’y a pas de vaisseaux sanguins et de nerfs importants dans cette région. -Injection au niveau de la cuisse, face antérieur : muscle droit antérieur , situé sur la partie antérieure du tiers moyens de la cuisse mais n’est que rarement utilisé. -Injection au niveau de la fesse : muscle grand fessier (fessier postérieur) Consiste à diviser la fesse en quatre quadrants , l’injection intramusculaire (dans le quadrant supéro externe de la fesse pour éviter de toucher le nerf sciatique Pr SLIMANI. M 81

Injection au niveau de l’épaule : muscle deltoïde Ce muscle est facilement accessible et privilégier pour les vaccinations localisation : L’injection intramusculaire (dans le quadrant supéroexterne de la fesse , pour éviter de toucher le nerf sciatique) : QSE Pr SLIMANI. M 82

La voie intramusculaire Cette administration est réalisée sous forme d’un dépôt que le P. A doit abandonner afin d’atteindre le flux sanguin ou circulation lymphatique par pénétration. La résorption est variable pour une même substance en fonction de la richesse de vascularisation du muscle. Les facteurs susceptibles de modifier cette absorption : -ce qui sont propre à l’organisme receveur : âge du sujet , la taille : le poids du sujet , la température corporelle( T°: de la durée d’action et T° : de la vitesse d’absorption ), flux sanguin ( 0. 02 à 0. 07 ml/min/g), coef. partage, p. H milieu , nature du solvant utilisé , volume et concentration de la solution injectée) -Facteurs relatifs à la forme galénique: qu’il s’agit d’une solution aqueuse ou huileuse , d’une suspension ou d’une émulsion, la libération du P. A actif dépend de nombreux facteurs : forme chimique (acide , base , sel , éther ), concentration du P. A dans le véhicule , volume du l’absorption liquide injecté , type de solvant (aqueux , organique, huileux), vitesse de dissolution du P. A dans le dépôt, taille des particules du P. A dans les suspensions , coef de partage, présence d’agents favorisant l’absorption (hyaluronidase) , présence d’agents vasoconstricteurs. Pr SLIMANI. M 83

La voie intraveineuse -localisation : veine ( pli du coude main , du dos de la main ou du poignet pied ). le médicament est directement introduit dans la circulation générale, c’est une voie d’urgence car l’action est extrêmement rapide. -avantages : - biodisponibilité maximale (100%) on peut injecter des médicaments qui seraient irritants pour le tube digestif -Caractéristiques des formes galénique injectables: . Stérilité (absence de germe). Absence de pyrogènes : substances pouvant provoquer des poussées fébriles. Neutralité : p. H le plus proche du p. H sanguin. Isotonicité : même pression osmotique / plasma. Limpidité: absence de particules en suspension (sauf pour certaines émulsions ou suspensions ) La toxicité des médicaments injectés par voie intraveineuse est d’autant plus grande que la vitesse d’injection est plus rapide Temps d’injection : en moins de 1 minute Pr SLIMANI. M 84
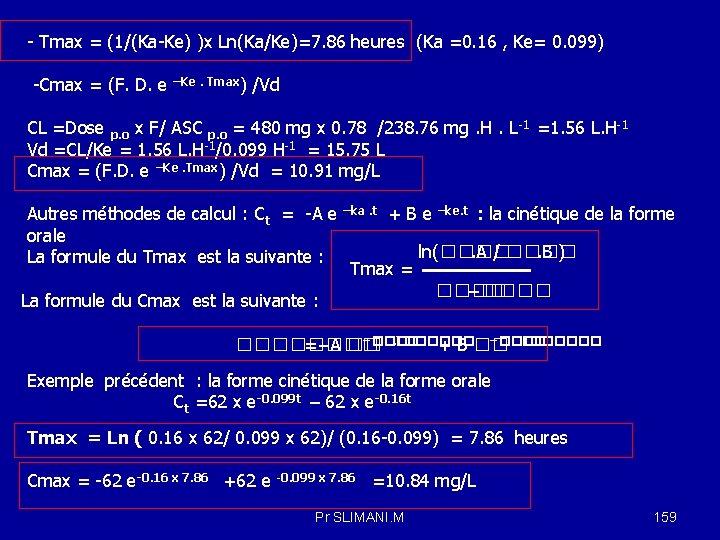
![P A plasmatique Cmax C 0 Biodisponibilité 100 élimination Aire sous la courbe d [P. A] plasmatique Cmax: C 0 Biodisponibilité 100% élimination Aire sous la courbe d.](https://slidetodoc.com/presentation_image_h2/687399d7d0c0da97a194bccee8f4b704/image-85.jpg)
[P. A] plasmatique Cmax: C 0 Biodisponibilité 100% élimination Aire sous la courbe d. C dt = - ke. C La vitesse de variation de la concentration du médicament par unité de temps est égale au produit de la concentration du médicament par la constante de vitesse de 1 er ordre (ke). Le signe négatif indique cette concentration diminue dans le temps. 0 Voie intraveineuse d. C/ C = - Ke. dt Ln C = Ln C 0 – Ke. t (Le logarithme de la concentration varie linéairement avec le temps. L’expression mathématique qui décrit cette courbe est : C(t) = C 0. e-Ke t (1) où C 0 = la concentration mesurée à l’instant zéro C(t) = la concentration au temps t Ke = la constante apparente d’élimination Pr SLIMANI. M 85

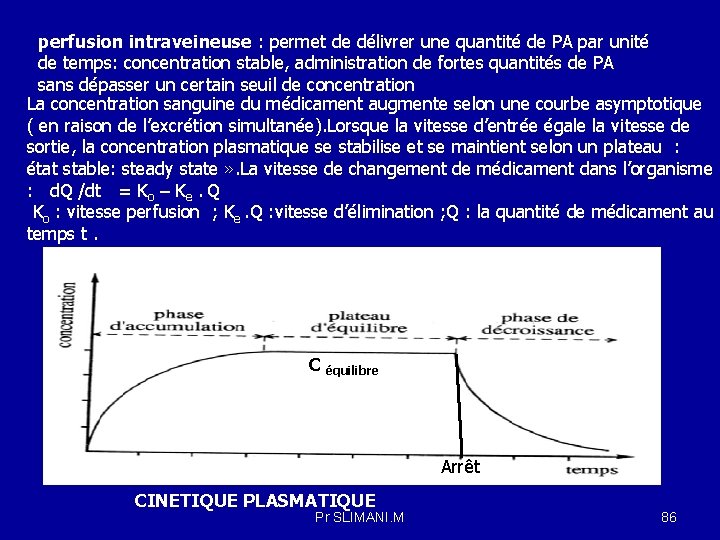
perfusion intraveineuse : permet de délivrer une quantité de PA par unité de temps: concentration stable, administration de fortes quantités de PA sans dépasser un certain seuil de concentration La concentration sanguine du médicament augmente selon une courbe asymptotique ( en raison de l’excrétion simultanée). Lorsque la vitesse d’entrée égale la vitesse de sortie, la concentration plasmatique se stabilise et se maintient selon un plateau : état stable: steady state » . La vitesse de changement de médicament dans l’organisme : d. Q /dt = Ko – Ke. Q Ko : vitesse perfusion ; Ke. Q : vitesse d’élimination ; Q : la quantité de médicament au temps t. C équilibre Arrêt CINETIQUE PLASMATIQUE Pr SLIMANI. M 86

La vitesse de changement des quantités de médicament dans l’organisme : d. Q / dt = K 0 –Ke. Q ; Q : la quantité de médicament au temps t distribué dans un volume de distribution Vd = Q/C ; Q = Vd. C C : concentration plasmatique observée à un temps donné: d. Q / dt = K 0 –Ke Q (Vd d. C) / dt = K 0 –Ke Vd C (Vd d. C) /dt = K 0 –CL x C : Au plateau , la vitesse de changement est nulle , et on obtient : Ko = CL x Ceq et Ceq =Ko/CL = Ko/ Vd. Ke K 0 = Ceq x CL ; K 0 : vitesse de perfusion D(dose de la charge ) = Ceq x Vd En tout temps , les concentrations plasmatiques correspondent à l’équation suivante: C = ( K 0/Vd. Ke )x (1 - e- Ke. t) C: concentration plasmatique au temps t K 0 : vitesse de perfusion Vd. Ke : clairance totale T: durée de la perfusion Pr SLIMANI. M 87

Quand la durée de la perfusion est très grande ( t > T 1/2 d’élimination , le terme exponentiel de l’équation précédente devient nul : e- Ke. t =0 , et l’équation devient : C = Ceq = K 0 /Vd. Ke Durant la période qui précède l’atteinte de Ceq et que la perfusion dure assez longtemps pour atteindre Ceq , on peut calculer les paramètres pharmacocinétiques du médicament : C= Ceq (1 -e- Ke. t) ; Ceq – C = Ceq e- Ke. t ; Ln (Ceq – C) = Ln Ceq – ( Ke. t ) La pente de la droite de régression permet de déterminer le t 1/2. A chaque période de temps équivalent à une valeur de t 1/2 du médicament, la concentration plasmatique du médicament va s’élever progressivement comme suit : après une demi –vie : C= 50 % de la Ceq ( concentration d’équilibre ) -2 T 1/2 : C= 75 % de Ceq -3 T 1/2 : C= 87. 5 % de Ceq - 3. 3 T 1/2 , on aura atteint 90 % de la valeur Ceq. -7 T 1/2 : C= 99 % de Ceq (99% de l’état d’équilibre ) Fss = fraction de steady state : Fss =1 -(0, 5)t/t 1/2 =1 – 1/2 Pr SLIMANI. M t / t 1/2 88

Exercices d’application : Exercice 1 : on administre , par perfusion intraveineuse et pendant 24 heures , un médicament qui possède un T 1/2 de 3. 5 heures, et la concentration atteinte est de 10 mg/L ; K 0 est 14 mg/heure. 1)Est-ce que Ceq est atteinte? 2)Quelle serait la concentration plasmatique trois heures après la cessation de la perfusion? Réponse : -Ceq est atteinte puisqu’on a administré le médicament pendant 7 T 1/2 ( 24 heures /3. 5 heures = 6. 86 ; fraction de l’état d’équilibre : F ss=1 -(0, 5)t/t 1/2 Fss = 1 – (O. 5) 6. 86 =0. 991 (99% de l’état d’équilibre). - C 3 heures =(Ko/Vd. Ke ) x e -Ke. t = 10 x e -0. 69 x 3/3. 5 = 5. 5 mg/L après la cessation de la perfusion. - C = Ceq = K 0 /Vd. Ke C = Ceq = 10 mg/L T 1/2 = Ln 2 /Ke , T 1/2 = 3. 5 heures , Ke = 0. 20 heures -1 K 0 = 14 mg/heure. Vd = K 0 / (Ceq. Ke ) = 7 L C 3 heures = (Ko / Vd. Ke ) x e -Ke. t = (14 mg/heure / (7 L x 0. 20 heures -1) x e C 3 heures = 10 x e -Ke. t = 10 x 0. 55 = 5. 5 mg / L Pr SLIMANI. M -Ke. t 89

Exercice 2 : On veut administrer un médicament par perfusion intraveineuse à un patient qui pèse 70 Kg. Le temps de demi –vie de cette substance est de 6 heures , la concentration optimale à l’équilibre est de 12 mg/ L, et son volume de distribution est de 0. 64 L/Kg. • A quelle vitesse doit –on administrer ce médicament ? • Quel sera le temps nécessaire pour atteindre 95% de l’état d’équilibre ? • Si on veut atteindre la concentration optimale rapidement , quelle dose de charge devra-t-on administrer ? Réponse : K 0 = Ceq x CL ; K 0 : vitesse de perfusion avec CL= Ke. Vd Ceq= Ko/Vd x Ke Vd : volume de distribution ; CL : clairance ; Ke : constante d’élimination Ceq : concentration à l’équilibre Ko : vitesse de perfusion Ke : constante d’élimination T 1/2= 6 heures d’où Ke =0. 69 / T 1/2 = 0. 69/ 6 H = 0. 115 H-1 Vd = 0. 64 L/Kg x 70 Kg =44. 8 L C eq = 12 mg / L K 0 = 12 mg/L x (44. 8 L x 0. 115 H-1 ) = 62 mg/H Pr SLIMANI. M 90

• Le temps nécessaire pour atteindre 95 % de Ceq ( 12 mg/L ) , la concentration sera de : 12 mg/L x 0. 95 = 11. 4 mg/L En utilisant l’équation C = Ceq (1 - e- Ke. t ) ; on a : 11. 4 mg/L =12 ( 1 - e- Ke. t ) 0. 05 = e- Ke. t Ln 0. 05 = Ln(e- Ke. t) Ln 0. 05 =- Ke. t t= Ln 0. 05/Ke Ln 0. 05= -2. 99 Ke=0. 69/6=0. 115 H-1 t = 26 heures • Si on veut atteindre la Ceq immédiatement , il faut que la dose de charge soit : Dose = Ceq x Vd ou Ko/Ke Vd =O. 64 L/Kg Dose = 12 mg/L x O. 64 L/Kg = 7. 68 mg/Kg Pr SLIMANI. M 91

Exercice 3 : Administration d’un médicament en perfusion durant 12 heures et à raison de 80 mg/heure a donné les concentrations plasmatiques suivantes : Temps ( heures ) [C] mg/L Ceq – C (mg/L) 0 1 2 4 6 8 10 12 0 6. 60 10. 80 15. 20 17. 40 18. 60 19. 0 12. 40 8. 20 3. 80 1. 60 0. 40 0 0 Calculez les paramètres pharmacocinétiques , t 1/2, Vd C= Ceq (1 -e- Ke. t) ; Ceq – C = Ceq e- Ke. t ; Ln (Ceq – C) = Ln Ceq – ( Ke. t ) En plaçant les valeurs de (Ceq – C) en fonction du temps (t) sur un graphique semi logarithmique , on peut déterminer Ke ( la pente ) ; la pente de la droite de régression permet de déterminer Ke = 0. 46 H -1 T 1/2 = 0. 69 / Ke = 1. 5 heures Pr SLIMANI. M 92

T 1/2 = 0. 69 / Ke =1. 5 heures ; Ke = 0. 46 H-1 On a : Ceq = K 0 / ( Vd. Ke) K 0 = 80 mg/H ; Ceq = 19. 0 mg/L ; Vd = 9. 11 L CL = Ke. Vd =4. 2 L/H Fraction éliminée dans l’urine : fu = vitesse d’excrétion au plateau mg/L/vitesse de perfusion K 0 (mg/H) Ou fu= Kr /Ke ; Kr : constante d’excrétion rénale ; Ke : constante d’élimination totale -Si la perfusion est poursuivie pendant 6 heures après l’atteinte de la Ceq et que la quantité excrétée sous forme inchangée dans l’urine pour la période de 6 heures est de 350 mg avec une vitesse de perfusion de l’ordre de 80 mg/H. fu = (350 mg /6 H )/ 80 mg. H-1 = 0. 73 Kr = fu. Ke = 0. 73 x 0. 46 heures-1 = 0. 34 heures-1 ; CLr = Kr. Vd = 0. 34 heures-1 x 9. 11 L = 3. 09 L/H Pr SLIMANI. M 93

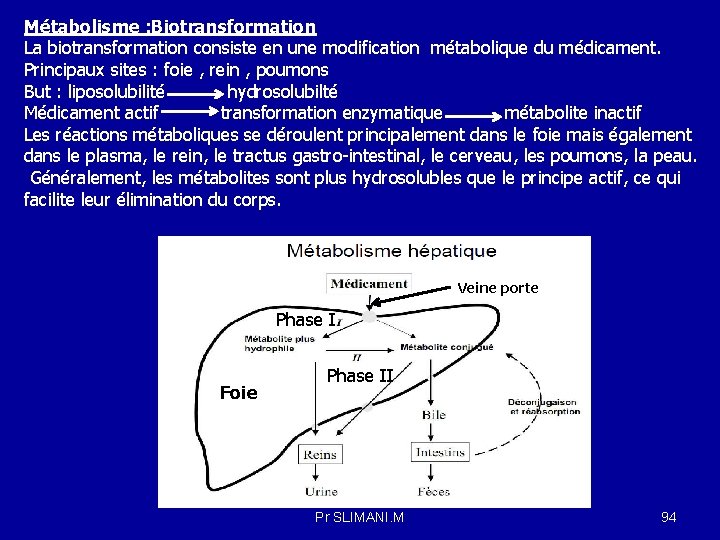
Métabolisme : Biotransformation La biotransformation consiste en une modification métabolique du médicament. Principaux sites : foie , rein , poumons But : liposolubilité hydrosolubilté Médicament actif transformation enzymatique métabolite inactif Les réactions métaboliques se déroulent principalement dans le foie mais également dans le plasma, le rein, le tractus gastro-intestinal, le cerveau, les poumons, la peau. Généralement, les métabolites sont plus hydrosolubles que le principe actif, ce qui facilite leur élimination du corps. Veine porte Phase I Foie Phase II Pr SLIMANI. M 94

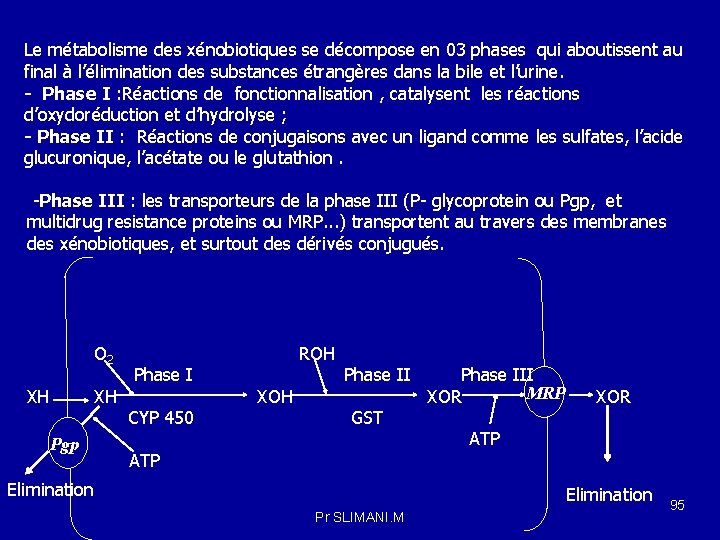
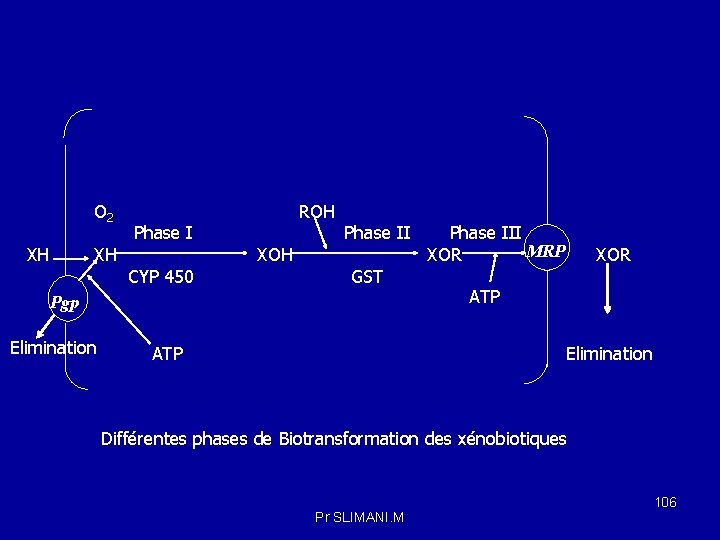
Le métabolisme des xénobiotiques se décompose en 03 phases qui aboutissent au final à l’élimination des substances étrangères dans la bile et l’urine. - Phase I : Réactions de fonctionnalisation , catalysent les réactions d’oxydoréduction et d’hydrolyse ; - Phase II : Réactions de conjugaisons avec un ligand comme les sulfates, l’acide glucuronique, l’acétate ou le glutathion. -Phase III : les transporteurs de la phase III (P- glycoprotein ou Pgp, et multidrug resistance proteins ou MRP. . . ) transportent au travers des membranes des xénobiotiques, et surtout des dérivés conjugués. O 2 XH XH Pgp Phase I CYP 450 ROH XOH Phase II GST Phase III MRP XOR ATP Elimination Pr SLIMANI. M 95

Les réactions de phase I sont des réactions : - d’oxydation qui impliquent des mono-oxygénases telles que le cytochrome P 450. Elles ont essentiellement lieu au niveau des microsomes hépatiques. - de réduction - d’hydrolyse qui ont lieu au niveau des organes (rein, foie, intestin, poumon. ). Les estérases impliquées dans les réactions d’hydrolyse ne sont pas spécifiques. -Les métabolites formés par les réactions de phase I ont des groupes fonctionnels hydroxyles (OH), amines (NH 2) ou carboxyles (COOH) qui peuvent ensuite être conjugués par les réactions de phases II. Pr SLIMANI. M 96

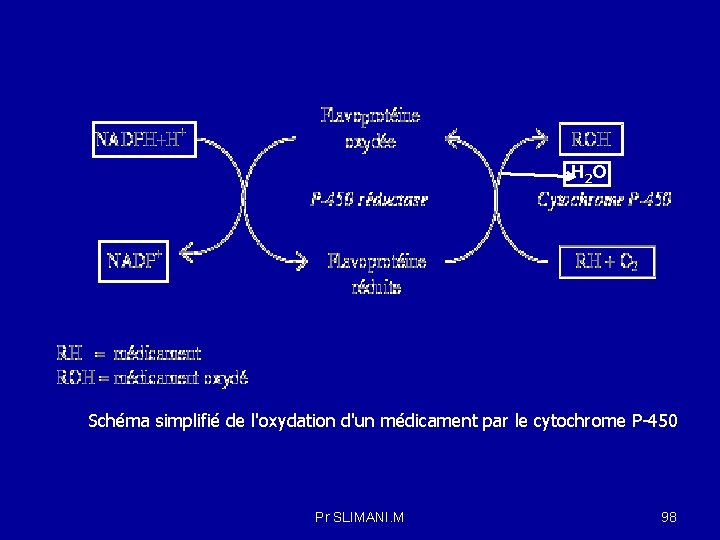
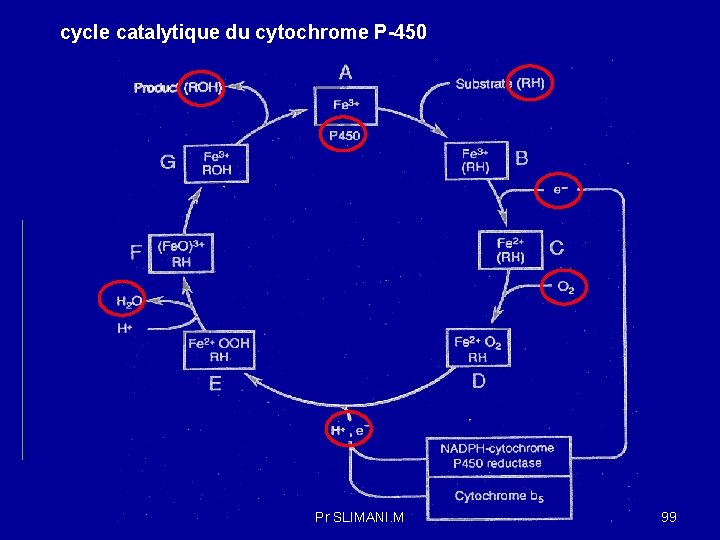
Phase I : Un très grand nombre de réactions d'oxydation sont catalysées par le cytochrome P-450. Les cytochromes P 450 ( CYP ) forment une superfamille de mono-oxygénases. Ce sont des protéines à noyau hème (hémoprotéine) qui catalysent des réactions d’oxydation nécessitant de l’oxygène et du NADPH. Le cytochrome P-450 constitue une famille d'isoenzymes à fer, métabolisant les médicaments. Les changements du degré d'oxydoréduction du fer sont à l'origine des biotransformations catalysées par l'enzyme. Le fonctionnement du cytochrome P-450 nécessite la présence d'une enzyme associée, appelée cytochrome P-450 réductase, qui prélève deux électrons à une flavoprotéine réduite pour les transférer au substrat qui sera oxydé. La flavoprotéine reçoit les électrons du NADPH + H+. CYP ou P 450 (Substrat )RH + O 2 + NADPH+H+ ROH( substrat oxydé) + NADP+ +H 2 O Nomenclature : Il existe un grand nombre d’iso-enzymes du cytochrome P 450, ou CYP, classées en famille 1, 2, ou 3, chaque famille pouvant se subdiviser en sous-famille A, B…puis en gène Exemple : CYP 3 A 4 Cytochrome P 450 famille sous famille iso enzymes Pr SLIMANI. M 97

H 2 O Schéma simplifié de l'oxydation d'un médicament par le cytochrome P-450 Pr SLIMANI. M 98

cycle catalytique du cytochrome P-450 Pr SLIMANI. M 99

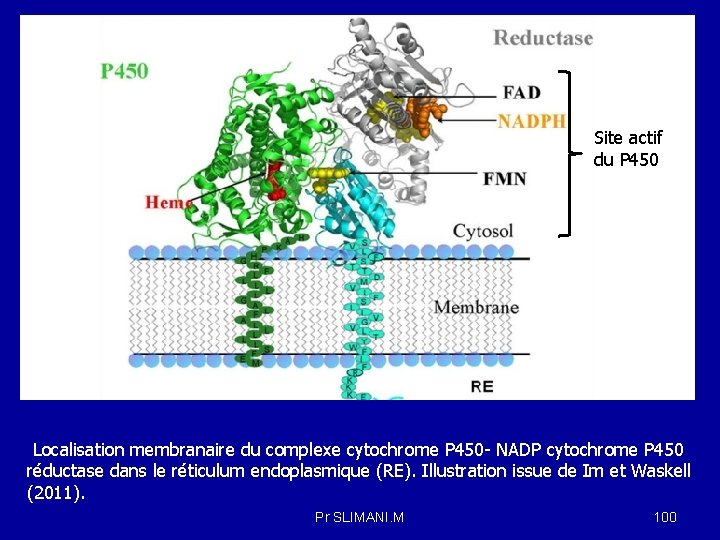
Site actif du P 450 Localisation membranaire du complexe cytochrome P 450 - NADP cytochrome P 450 réductase dans le réticulum endoplasmique (RE). Illustration issue de Im et Waskell (2011). Pr SLIMANI. M 100

Médicaments peuvent être : -Inducteurs: augmentation de l’activité du CYP: - métabolisme délai d’apparition de l’effet de quelques jours. -Inhibiteurs: diminue l’activité du CYP: -métabolisme effet immédiat Les isoenzymes les plus impliquées dans le métabolisme des médicaments chez l’Homme sont les CYP 3 A 4, CYP 2 D 6, CYP 2 C 9, CYP 1 A 2, CYP 2 C 19. -L’isoforme principale de ce système CYP 3 A 4 à une spécificité de substrat très large et contribue a elle seule au métabolisme de 25 à 50 % des médicaments -Il existe une variabilité interindividuelle ou chaque individu possède son propre équipement enzymatique CYP 3 A 4 : Métabolisme de la plupart des médicaments, par exemple codéine en norcodéine, ce qui la rend inactive. CYP 1 A 2 qui métabolise, par exemple, la caféine, la théophylline, la clozapine, l'imipramine, la tacrine. CYP 2 D 6 qui métabolise divers antidépresseurs, divers neuroleptiques, divers bbloquants. Pr SLIMANI. M 101

Phase. II: Réactions de conjugaison Le processus de conjugaison consiste à établir un lien entre un groupement fonctionnel d'un principe actif ou d'un métabolite généré dans la phase I et une molécule polaire endogène telle que l'acide glucuronique, la glycine , les ions sulfate, acétate , le groupement méthyle et le glutathion. Ces réactions sont catalysées par les transférases. Les composés formés sont très souvent inactifs, hautement polaires et très hydrosolubles. Ils sont donc rapidement excrétés par le rein dans les urines et par la bile dans les fèces. Différents enzymes de la phase II: UDP glucosyl transférases , Sulfotransférases, Glutathion S transférases, N acétyl transférases, conjugaison aux acides aminés (glycine , acide glutamique ), réactions de methylation R-OH R-O-acide glucuronique (glucuronoconjugaison) R-NH 2 R-NH-COCH 3 R-OH R-O-SO 3 - (N-acétylation): Acéyltyltransférase (sulfatation): Sulfo transférase Pr SLIMANI. M 102

Exemple de la détoxification hépatique : -L’Aspirine « Acide acétylsalicylique » • La phase I , une hydrolyse de la liaison ester qui libère l’acide acétique et l’acide salicyique, par les estérases de la muqueuse gastro-intestinale et du foie La phase II, la liaison de l'acide salicylique à la glycine donne de l'acide salicylurique , et avec l’acide glucuronique, produisant les glucuro conjugués de phénol salicylate et d’ acyl salicylate. Une petite fraction est oxydée en acide 2, 3 -dihydroxybenzoïque, en acide 2, 3, 5 -trihydroxybenzoïque et surtout en acide gentisique (acide 2, 5 dihydroxybenzoïque), lui-même en partie conjugué à la glycine pour former l’acide gentisurique. Pr SLIMANI. M 103

Réactions de la phase III: Les réactions de phase III font intervenir des transporteurs actifs multi-spécifiques d’efflux , principalement la P-glycoprotéine (P-gp : Permeability-Glyco. Protein ) également appelée MDR 1 (multidrug resistance 1) et les Multidrug Resistance‑associated Proteins-MRP), codé par le gène ABCB 1. Ces transporteurs appartiennent à la famille des transporteurs ABC (ATP binding cassette), utilise l’hydrolyse de l’ATP pour transporter des substrats du milieu intracellulaire vers le milieu extracellulaire, le plus souvent contre un gradient de concentration. Ils sont impliqués dans l’efflux de très nombreux toxiques et médicaments à l’extérieur de la cellule et jouant un rôle important dans la résistance aux médicaments. Ces transporteurs sont exprimés au niveau d’importantes barrières tissulaires, telles que la muqueuse intestinale et l’endothélium qui constitue la barrière hémato encéphalique, mais aussi d’épithéliums d’élimination, comme les membranes apicales du canicule biliaire des hépatocytes et du tubule rénal. Dans les cellules polarisées, certains sont situés au niveau de la partie apicale , d'autres au niveau de la partie basolatérale. Cette distribution spécialisée est observée au niveau des entérocytes , ainsi les transporteurs Pgp relarguent les xénobiotiques dans la lumière du tube digestif (partie apicale) et les transporteurs MRP dans les vaisseaux sanguins (partie basolatérale). Pr SLIMANI. M 104

-Dans l'hépatocyte les molécules diffusent pour atteindre la membrane canaliculaire où la P-gp et d'autres transporteurs les expulseront dans la bile -La P-gp intervient dans l'absorption intestinale des molécules en limitant le passage de la lumière intestinale vers les entérocytes et transportent au travers des membranes des xénobiotiques polaires et/ou de leurs métabolites conjugués hydrophiles en vue de leur élimination active de la cellule. Elle contribue à une diminution de la biodisponibilité orale de ses substrats. La P-gp fonctionne comme pompe d’efflux dépendant de l’ATP. Elle est responsable de l’expulsion hors de la cellule de nombreuses molécules. En éliminant des substances endogènes et exogènes potentiellement toxiques, la P-gp protège ainsi l’organisme. - Les transporteurs MRP (Multidrug Resistance associated Protein) sont impliqués dans l’efflux des médicaments conjugués (au glutathion ou à des groupements sulfate ou glucuronate). Pr SLIMANI. M 105

O 2 XH XH Phase I CYP 450 ROH XOH Phase II GST Pgp Elimination ATP Phase III MRP XOR ATP Elimination Différentes phases de Biotransformation des xénobiotiques Pr SLIMANI. M 106

Structure de la glycoprotéine P La P-gp est une protéine d'un poids moléculaire de 170 000 daltons, contenant 1280 acides aminés. Elle est composée de deux séquences symétriques , chacune incluant six segments transmembranaires hydrophobes (TM) (de 1 à 12) et un domaine intracellulaire hydrophile contenant deux sites de fixation de I'ATP (NBD, Nucleotide-Binding Domain). La première boucle extracellulaire contient trois sites de glycosylation. Les extrémités NH 2 et COOH terminales de la protéine sont intracellulaires. Les TMDs constituent les domaines hydrophobes de la P-gp est impliquée dans la reconnaissance des médicaments et dans leur excrétion, qui sont deux étapes distinctes. Il existe deux sites majeurs de liaison des médicaments, un dans chaque moitié de la P-gp, près des domaines transmembranaires TM 6 et TM 12. La région hydrophile cytoplasmique ou NBD est associée à l'utilisation de l'énergie apportée par l'hydrolyse de l' ATP nécessaire à la fonction de pompe. Pr SLIMANI. M 107

Le mécanisme d'action des transporteurs d’efflux ABC implique la liaison d'un substrat aux domaines TMD du transporteur d'efflux ABC. Cela stimule la liaison de l'ATP aux deux domaines NBDs. L’ATP est par conséquent hydrolysée pour fournir de l'énergie nécessaire pour déplacer le substrat à travers la membrane. Ils agissent ainsi comme des transporteurs actifs, s’opposant au gradient de concentration et permettant l’efflux de leurs substrats hors de la cellule, ce qui a pour conséquence une diminution de leur concentration intracellulaire. La P-gp protège les cellules des substances étrangères et des toxines. Elle travaille de pair avec les enzymes du métabolisme primaire comme le CYP 3 A 4 afin d'assurer une fonction de détoxification. Grâce à sa présence dans les différents organes excréteurs, elle agit au niveau de 1' absorption, de la distribution, du métabolisme et de 1' élimination des médicaments. Pr SLIMANI. M 108

Représentation schématique de la glycoprotéine P dans la membrane plasmique. La protéine est composée de 04 domaines , deux domaines transmembranaires hydrophobes ( TMD 1 et TMD 2 ) et deux domaines cytoplasmiques liant l'ATP (NBD 1 et NBD 2 ). La première boucle extracellulaire contient trois sites de glycosylation. Les extrémités NH 2 et COOH terminales de la protéine sont intracellulaires. Pr SLIMANI. M 109

Pour fonctionner, les transporteurs ABC utilisent l’énergie fournie par l’hydrolyse de l’ATP au niveau des domaines NBD. Ils agissent ainsi comme des transporteurs actifs, s’opposant au gradient de concentration et permettant l’efflux de leurs substrats hors de la cellule, ce qui a pour conséquence une diminution de leur concentration intracellulaire. La P-gp protège les cellules des substances étrangères et des toxines. Elle travaille de pair avec les enzymes du métabolisme primaire comme le CYP 3 A 4 afin d'assurer une fonction de détoxification. Grâce à sa présence dans les différents organes excréteurs, elle agit au niveau de 1' absorption, de la distribution, du métabolisme et de 1' élimination des médicaments. Interaction entre P-gp, CYP 3 A 4 et substance active Pr SLIMANI. M 110

Cas de l’intoxication médicamenteuse : . . paracétamol ou acétaminophène est le N-acétyl amino phénol (APAP) , est un Le agent analgésique et antipyrétique mais sans effet anti-inflammatoire. (Doliprane®, Dafalgan®, Efféralgan®, etc. ). Le paracétamol est métabolisé essentiellement au niveau du foie. Les deux voies métaboliques principales étant impliquées dans le métabolisme de l’APAP sont la glycuroconjugaison (~60 %) et la sulfoconjugaison (~30 %) , générant des métabolites hydrosolubles excrétés dans les urines et une fraction minime (~10 %) sera métabolisée par le Cytochrome p 450 (CYP 2 E 1, CYP 1 A 2) en N-acétyl pbenzoquinone imine ou NAPQI , un métabolite réactif toxique ( hépatotoxique ). A dose thérapeutique d’APAP, le NAPQI est rapidement neutralisé par une réaction avec le glutathion, puis éliminé dans l’urine après conjugaison à la cystéine et à l'acide mercaptopurique. Cependant, après ingestion de doses toxiques ( paracétamol) , il se produit une saturation des voies de glucuronidation et de sulfation, de telle sorte qu'une fraction beaucoup plus importante de paracétamol est dérivée vers la voie du cytochrome P-450, donnant lieu à une production accrue de dérivé toxique NAPQI. La concentration de ce métabolite actif dépasse les capacités de prise en charge par le glutathion, va se lier de façon covalente avec le groupe cystéine des protéines hépatocytaires , donnant lieu à des lésions oxydatives et à une nécrose centro-lobulaire. Pr SLIMANI. M 111

Pr SLIMANI. M 112

pénétration dans le système nerveux central (SNC) et le liquide céphalorachidien (LCR) Le SNC constitue 2% du poids du corps et reçoit 16% du débit cardiaque - une première barrière qui sépare le plasma du cerveau : barrière hémato encéphalique - une barrière située entre le plasma et le LCR : barrière hémato méningée - barrière qui sépare la substance nerveuse du LCR : barrière méningo encéphalique la barrière hémato –encéphalique (BHE) est l’ensemble des structures que doit traverser une molécule circulant dans le plasma pour parvenir au contact des neurones. Elle sépare la circulation sanguine et le liquide céphalo-rachidien (LCR), le fluide dans lequel baigne le cerveau et la moelle épinière. Elle se compose de la cellule endothéliale , de la lame basale et des prolongements gliaux ( pieds astrocytaires) qui entourent les vaisseaux et de les isoler du cerveau. Les molécules qui passent dans le cerveau doivent traverser le cytoplasme de la cellule endothéliale , la lame basale et l’espace cytoplasmique astrocytaire avant d’arriver au contact des éléments neuronaux. Pr SLIMANI. M 113

La barrière hémato encéphalique Pr SLIMANI. M 114

Le liquide Céphalo Rachidien : LCR Pr SLIMANI. M 115

La BHE possède de nombreuses protéines de transport permettant de réguler le passage des molécules, que ce soient pour l’efflux des xénobiotiques du SNC vers le sang ou le passage des molécules du sang vers le SNC. La plupart des médicaments lipophiles agissant au SNC traversent le BHE par diffusion passive (ex: anesthésiques volatils). Ainsi, seules molécules libres non liées aux protéines plasmatiques comme l’albumine ou lipoprotéine , sont capables de traverser la membrane plasmatique et donc la BHE. Ces barrières empêchent la pénétration des médicaments liés aux protéines , des médicaments hydrosolubles (Pénécilline )et des ions. Diverses substances à caractère polaire , les ions , les sucres , les acides aminés , franchissent la barrière hémato encéphalique en utilisant des transporteurs endogènes. Il s’agit d’un transporteur actif secondaire. Pr SLIMANI. M 116

Le passage intracérébral de ces substances relativement hydrophiles est assuré par différents transporteurs identifiés le long de la surface endothéliale des capillaires qui irriguent l'encéphale, tels que les transporteurs du glucose (GLUT 1), des acides aminés neutres (LAT 1) Large Neutral Amino Acid transporter. Ces transporteurs appartiennent à la super- famille des solute carriers (SLC). -la L- Dopa, un acide α-aminé non protéinogène est transporté par le transporteur LAT-1, d'atteindre les noyaux de la base du cerveau où elle sert de précurseur à la formation de dopamine. -Le SLC 7 transporte des acides aminés cationiques (arginine, lysine, ornithine). Les transport d’efflux : , les protéines d'efflux les plus connus et étudiés appartiennent à la superfamille des transporteurs ABC (ATP-binding cassette). Ces transporteurs jouent un rôle important dans la protection du cerveau contre les xénobiotiques potentiellement toxiques. -Pour administrer la médicament directement dans le système nerveux central sans passer par la barrière hématoencéphalique , est de l’injecter directement dans le liquide cérébro-spinal sous les méninges (injection intrathécale) ou directement dans les ventricules cérébraux (injection intraventriculaire). Pr SLIMANI. M 117

Passage des médicaments à travers le placenta : passage des médicaments à travers le placenta (échanges foeto-maternels). Le placenta n'empêche pas le passage d'un médicament du compartiment maternel vers le compartiment foetal, il peut seulement le limiter. Le passage placentaire d'un médicament obéit aux mêmes règles que pour les autres membranes. Le placenta , laisse passer les médicaments par simple diffusion , mais avec cependant une sélectivité qui est fonction de la taille des molécules ; les anticoagulants , les anti vitamines K passent bien la barrière placentaire. Cette barrière placentaire devient d’ailleurs de plus en plus perméable à mesure qu’on se rapproche du terme , car l’épaisseur du placenta s’amoindrit et sa surface augmente. Le lait maternel : les médicaments et les toxiques liposolubles passent très facilement à des concentrations qui sont celles de la concentration plasmatique de la mère. Par exemple, l’aspirine , les barbituriques , la morphine, la nicotine , l’alcool , passent très facilement avec des conséquences pour l’enfant. Exemple : La lidocaïne traverse le placenta et la barrière hématoencéphalique et est excrétée dans le lait maternel. Pr SLIMANI. M 118

Distribution des médicaments La distribution est la répartition du principe actif du médicament depuis son entrée dans la circulation générale jusqu’à son arrivée au site d’activité. Le principe actif se présente sous deux formes dans le plasma : une forme libre active, est disponible pour diffuser passivement jusqu'aux sites extravasculaires ou tissulaires où ont lieu les effets pharmacologiques; une forme liée aux protéines plasmatiques, sous laquelle le principe actif est incapable de se diffuser, donc d’atteindre son site d’action. Par conséquent, la concentration de médicament libre dans la circulation systémique reflète généralement la concentration du médicament au niveau du site d'action et donc son efficacité. Lorsque le médicament atteint le plasma, il peut soit être fixé aux protéines plasmatiques, soit être fixé aux éléments figurés, soit se retrouver sous forme libre, c’est à dire sous forme active, diffusible dans les tissus. La vitesse de distribution varie à la fois suivant le taux de fixation protéique et la facilité de diffusion tissulaire. Pr SLIMANI. M 119

1 -1 Fixation au niveau des éléments figurés ( erythrocytes, leucocytes , thrombocytes) Au niveau sanguin , différentes interactions sont possibles entre les médicaments et les cellules sanguines. Les interactions qui se produiront avec les substances fortement liposolubles, sont capables de pénétrer au niveau des érythrocytes , jusqu’à ce que l’équilibre soit atteint entre les concentrations de médicament libre de part et d’autre part de la membrane érythrocytaire. La fixation aux éléments figurés apparaît moins grande que celle relative aux protéines plasmatiques. La fixation aux éléments figurés est importante par exemple avec le phénobarbital. Les phénomènes de déplacement semblent différents à ceux observés avec les protéines. Ce type de fixation est à considérer dès lors que le volume de distribution est faible et que la concentration érythrocytaire est forte comparée à la concentration au niveau plasmatique, car on prend en compte les concentrations au niveau plasmatique, pas au niveau sanguin. Les éléments figurés du sang, notamment les érythrocytes lorsqu'ils fixent ou captent certains médicaments, jouent un rôle analogue aux protéines. Pr SLIMANI. M 120

1 -2. Distribution au niveau plasmatique Après avoir franchi les étapes de la mise à disposition et de l’absorption , le médicament se trouve dans la circulation systémique. Le sang joue le rôle d’un véhicule de transport par les hématies et les protéines circulantes susceptibles de fixer la substance médicamenteuse. Les médicaments hydrosolubles , ont tendance à rester à l’intérieur du flux sanguin et du liquide entourant les cellules (espace interstitiel). Les médicaments se fixent sur les protéines par des forces diverses, attraction électrostatique ou forces de VAN DER WALLS. Cette fixation est labile : la fraction liée est en équilibre réversible avec la fraction libre. La molécule se retrouve dans le flux sanguin sous forme libre ou sous forme liée. La forme liée agit comme une réserve qui ne traverse pas les membranes. La forme liée est une forme de stockage et de transport, qui va se dissocier pour libérer la molécule sous forme libre selon la loi d'action de masse. [P] + [M]libre ↔ [MP]liée Pr SLIMANI. M 121

Seul le médicament libre est disponible pour diffuser passivement jusqu'aux sites extravasculaires ou tissulaires , il se fixera plus ou moins fortement aux protéines ou autres constituants tissulaires et exercer ultérieurement un effet pharmacodynamique. L'équilibre s'établit à travers la paroi capillaire entre les concentrations des espaces interstitiels et du plasma en fraction libre. Cet équilibre est réversible et le passage peut se faire dans les deux sens. La concentration de médicament libre dans la circulation systémique reflète généralement la concentration du médicament au niveau du site d'action et donc son efficacité. La fixation est définie par le pourcentage de liaison pouvant aller de 0 à 100%. La fixation aux protéines plasmatiques est variable : - indométhacine (anti inflammatoire non stéroïdien) est de 95%, Les sulfamides retards est de 98% et une faible liaison du paracétamol aux protéines plasmatiques. On considère qu’une substance est fortement liée si son pourcentage de fixation dépasse 75%. Une forte fixation aux protéines plasmatiques a pour conséquence de limiter la diffusion du médicament en dehors du compartiment plasmatique. Pr SLIMANI. M 122

Phase plasmatique : La substance médicamenteuse injectée en intra-veineux ou résorbée se retrouve en contact avec les protéines plasmatiques sous forme libre ou liée aux protéines. Phase tissulaire: passages réversibles de la forme libre vers les lieux d’action et les lieux de stockage et irréversibles vers des lieux de transformation et des lieux d’élimination. Pr SLIMANI. M 123

Les principales protéines circulantes: La concentration des protéines dans le plasma est de 60 à 70 g/L. Certaines protéines plasmatiques jouent un rôle dans la fixation des médicaments Les principales protéines impliquées dans la fixation protéique sont l’albumine, l’alpha 1 -glycoprotéine, les lipoprotéines et les globulines. • L’albumine est la plus abondante et présente de nombreux sites pouvant interagir avec des substances médicamenteuses. L’albumine dont le poids moléculaire est de 68 000, est formée d’une chaîne polypeptidique avec de nombreux ponts disulfures. Elle fixe surtout les médicaments acides tels que les anti-inflammatoires non stéroïdiens médicaments acides liposolubles qui se fixent à des sites spécifiques de l’albumine. • L’alpha 1 -glycoprotéine est la plus petite en taille et riche en glucides et en acide sialique qui lui donnent un caractère acide. Elle fixe surtout les molécules basiques comme la lidocaïne, la prazosine • A l’inverse, les lipoprotéines sont de grande taille et contiennent des quantités variables de lipides expliquant leur classification ; on distingue alors les HDL (high density lipoprotein), les LDL (low density lipoprotein) et les VLDL (very low density lipoprotein). Les lipoprotéines qui fixent certains médicaments comme la chlorpromazine et l’imipramine. • Enfin, les globulines sont un groupe important de protéines susceptibles de fixer les médicaments et on distingue les alpha-, bêta- et gamma- globulines en fonction de leur masse molaire. Pr SLIMANI. M 124

On distingue deux types de fixation dépendant des caractéristiques acido-basiques des médicaments : la fixation des médicaments "acides faibles" ionisés et la fixation des médicaments base faible ionisés et substances non ionisables Fixation des médicaments (acide faible) Protéines fixatrices Albumine Fixation des médicaments( base faible) Albumine Alpha 1 glycoprotéine acide lipoprotéines gamma globuline affinité élevée faible Nombre de sites de fixation faible élevé Phénomène de saturation possible rare Les principales protéines circulantes Pr SLIMANI. M 125

La liaison aux protéines plasmatiques La liaison médicament – protéine dépend de plusieurs facteurs : 1 -L’affinité : La fixation aux protéines peut être très forte même si l’affinité est faible : il suffit que la concentration en médicament soit élevée, ou que le nombre de sites disponibles soit important. La fixation aux protéines peut être faible avec une très forte affinité. La fixation des anti-inflammatoires comme l’indométhacine , de certains antidépresseurs comme l'imipramine, est supérieure à 95%. La fixation du phénobarbital, de la théophylline est de l'ordre de 50%. 2 - La quantité de protéines disponibles pour la fixation peut varier en fonction de l’état physiologique et pathologique, mais aussi du fait de phénomènes de compétition entre le médicament et une autre molécule. Deux médicaments peuvent entrer en compétition pour les mêmes sites de fixation, et la fixation de l’un peut déplacer celle du second. Cela dépendra de l’affinité de chacun. Les traumatismes, les brûlures, la grossesse, les cirrhoses la diminuent alors que les syndromes néphrotiques, l'anxiété l'augmentent. Pr SLIMANI. M 126

3 -Le pourcentage fixé : la concentration du médicament est très importante car elle peut saturer les sites de fixation et tout nouvel apport de médicament se fait comme si la fixation était nulle. Dans ce cas la fraction libre est plus importante et donc la fraction potentiellement active est augmentée Exemple : -médicament fixé à 99% avec une concentration de 1 mg/L la forme libre représente 10 μg /L (1 mg/l x 0. 01 = 0. 01 mg/L ( 10 µg/l). -médicament fixé à 50% avec une concentration de 1 mg/L la forme libre représente 500 μg /L. La diminution de la fraction libre d'une substance par suite de sa liaison aux protéines affecte aussi sa biotransformation hépatique, ou son élimination rénale : en effet, seule la fraction libre du médicament pénétrera dans les cellules hépatiques responsables de cette transformation ou sera filtrée par les glomérules 4 -La compétition entre deux médicaments. En cas de compétition entre deux médicaments pour un même site , l’un peut déplacer l’autre : le clofibrate déplace les anti vitamines K. Le médicament déplace peut agir et donner des effets secondaires. . Pr SLIMANI. M 127

Diffusion tissulaire Après avoir franchi la barrière capillaire, le médicament se trouve dans les espaces interstitiels extracellulaires. Le franchissement de la barrière sang/tissu sera possible pour les molécules liposolubles par diffusion non ionique , tandis que pour les molécules hydrophiles, le passage sera possible grâce aux transporteurs. . Le médicament doit atteindre son site d’action pour produire l’effet pharmacologique. La diffusion tissulaire d’un médicament sera d’autant plus importante que la concentration plasmatique du médicament sous forme libre sera élevée, la forme libre étant la seule fraction du médicament capable de circuler. L’intensité de la liaison constitue un des facteurs modulant la distribution tissulaire, mais la distribution dépend également de l’affinité du médicament pour les protéines tissulaires, irrigation des organes ( débit sanguin ) et les caractéristiques physicochimiques de la molécule, à savoir sa masse molaire, la lipophilie (coefficient de partage), le p. Ka de la molécule (ou sa ionisation ou non ionisation) et donc de sa capacité à franchir les membranes vasculaires et cellulaires. Pr SLIMANI. M 128

La perfusion tissulaire exercera une influence considérable sur la distribution des médicaments. La vitesse de captation d’un médicament par un tissu = débit sanguin x(quantité qui arrive au niveau artériel –quantité qui sort au niveau veineux) Il faut distinguer les organes bien irrigués, comme le foie, les reins, le cœur, les poumons et le cerveau, et les organes ou tissus peu perfusés comme l’os, la peau et les graisses. Il existe une corrélation entre le vitesse de perfusion tissulaire et la vitesse de distribution vers ce même tissu. -Pour un même médicament, la quantité fixée peut être différente d’un tissu à l’autre, en fonction de l’affinité. Le tissu cérébral : il est riche en lipides, et a une grand affinité pour les molécules liposolubles. La distribution au niveau de cet organe sera donc importante pour les molécules plutôt liposolubles. Pr SLIMANI. M 129

Influence de la perfusion sanguine : La perfusion tissulaire s’exprime en ml/min/volume de tissus la vitesse de présentation d’un médicament = DS x Ca DS : débit sanguin Ca : concentration artérielle du médicament -La vitesse de captation d’un médicament par un tissu= DS ( Ca – Cv) Ca : quantité de médicament au niveau artérielle Cv : quantité qui sort au niveau veineux C. artérielle C. veineuse Organe entrée Sortie Débit sanguin de l’organe : Q Elimination Pr SLIMANI. M 130

L’évolution des concentrations au cours du temps est la résultante de l’entrée du médicament dans l’organisme et de son élimination. -Le facteur vitesse d’absorption : -T max : temps nécessaire pour atteindre la concentration maximale dans le plasma ; mesurée en mn ou en heure ; il donne une indication sur le délai d’action du médicament. -C max est la concentration maximale d’un médicament dans le plasma au temps T max ; elle est exprimée en mg/ml ou mg/l ou g/ml. La surface sous la courbe : SSC (AUC : Aera Under the curve ) Pr SLIMANI. M 131

Le volume apparent de distribution ( Vd) : est défini à l’état d’équilibre comme étant une constante de proportionnalité entre la quantité de médicament dans l’organisme et la concentration mesurée dans le milieu de référence. Le volume mesuré représente un espace de dilution ou de distribution Quantité de médicament dans l’organisme Vd = Concentration plasmatique La liaison aux protéines plasmatiques et tissulaires influence la fraction de la quantité totale de médicament au niveau plasmatique Le volume de distribution est relié à la fraction libre de médicament dans le sang et dans les tissus. Vd = Vp + Vt x (fl /flt ) Vp : volume plasmatique. Vt : volume totale. fl : fraction libre de médicament dans le plasma. flt : fraction libre de médicament dans les Tissus Chez un homme qui pèse 70 Kg : Vp = 3 L , Vt = 40 ; 12 litres de liquide interstitiel + 25 litres de liquide intra-cellulaire. Pr SLIMANI. M 132

Le volume de distribution permet d’estimer la façon dont se distribue la molécule dans l’organisme. Par exemple, si on administre 1000 mg d'un médicament (dose ) et que la concentration plasmatique en résultant est de 10 mg/L, Le volume de distribution est : 100 (dose/volume = concentration; Volume = dose /concentration = 1000 mg/ 10 mg/L = 100 L). Le Vd traduit l’intensité de la diffusion du médicament dans l’organisme. Si Vd est faible , c’est que la molécule est peu absorbée dans les tissus, elle reste dans le sang. Quand le volume de distribution est plus important, cela peut signifier que la molécule est fortement absorbée dans les tissus, ou qu’elle est fortement métabolisée. Volume de distribution ( valeurs moyennes : litres/kg) warfarine : 0. 1 ( diffusion tissulaire faible) Clofibrate : 0. 08 ( diffusion tissulaire faible) Halopéridol : 25, 00 (diffusion tissulaire élevée) Pr SLIMANI. M 133

Processus de redistribution des médicaments : Le passage d'un médicament du cerveau vers les organes périphériques est appelé redistribution. Un médicament comme le thiopental qui est très liposoluble, après administration intraveineuse pénètre très vite dans le cerveau (40 secondes ) , riche en lipides et bien irrigué, où sa concentration est rapidement maximum. Dans un deuxième temps, les autres tissus graisseux moins bien irrigués que le cerveau fixent le thiopental, entraînant un déplacement du produit du cerveau vers le sang et les tissus graisseux périphériques. Cette redistribution explique le thiopental agit très rapidement et que sa durée d'action est courte. Pr SLIMANI. M 134

INTERACTIONS MEDICAMENTEUSES -Elles peuvent être liées soit à la pharmacodynamie soit à la pharmacocinétique -Synergie : c’est l’augmentation de l’effet thérapeutique de deux médicaments pris conjointement, exemple paracétamol plus codéine E = A+ B+C -Potentialisation : , l’effet global de ces substances est supérieur à la somme des effets séparés de chacune de ces substances , exemple benzodiazépines plus alcool, anti-vitamine K plus hypoglycémiants A+B sup à A effet B potentialise l’effet de A : sensibilisation -Antagonisme : c’est la diminution de l’effet thérapeutique de deux médicaments pris conjointement. A+B inférieur A ; effet B antagonise effet A Pr SLIMANI. M 135

EXCRETION Elimination Les médicaments et leurs métabolites s'éliminent essentiellement dans l'urine et la bile. L'élimination pulmonaire concerne les produits volatils. Élimination rénale des médicaments : Le rein est le principal organe d’excrétion du principe actif inchangé et de ses métabolites. Chaque rein contient environ un million d’unités fonctionnelles : néphrons. Les néphrons sont les unités filtrantes des reins qui s'étendent sur la structure du rein, du cortex à la médulla, et sont entourés par un réseau de petits vaisseaux sanguins. -Les deux structures qui sont impliquées dans l’élimination rénale des médicaments sont le glomérule et le tubule, selon trois mécanismes : filtration glomérulaire , sécrétion et réabsorption tubulaire. - du plasma vers l'urine : filtration glomérulaire(barrière de type poreux)et sécrétion tubulaire (barrière à transport actif). -de l'urine vers le plasma : réabsorption tubulaire Excrétion urinaire = Filtration + Sécrétion - Réabsorption Pr SLIMANI. M 136

Artère rénal Artériole afférente Tube contourné proximal Tube contourné distal Veine rénale Canal collecteur cortical 1 Artériole efférente Capsule de Glomérule Bowman 1: filtration glomérulaire (du sang vers l’urine) 2: réabsorption de l’urine vers le plasma 3: sécrétion du plasma vers l’urine 3 urine Corpuscule rénal Anse de Henlé 2 Canal collecteur médullaire Urine définitive Capillaires péritubulaires Représentation schématique du néphron Bassinet du rein (pelvis rénal) vessie Pr SLIMANI. M uretère 137

Filtration glomérulaire : La filtration glomérulaire correspond à l’ultrafiltration du plasma sanguin, des capillaires glomérulaires jusqu’à l’intérieur de la capsule de Bowman par diffusion passive qui conduit à la formation d’un filtrat glomérulaire : urine primitive. La filtration glomérulaire est importante en raison d’une part d’un débit sanguin élevé ( 1000 ml/mn) et d’autre part d’un endothélium capillaire très mince présentant de larges pores. Les molécules circulantes à l’état libre dans le sang , passent dans le filtrat, en effet , la fixation aux protéines plasmatique est un facteur limitant de l’élimination urinaire par filtration glomérulaire ( absence de protéines dans l’urine). Le glomérule se comporte comme un filtre non sélectif qui laisse passer toutes les substances dont le poids moléculaire est inférieur à environ 65 000. C’est un phénomène passif dépend uniquement du gradient de pression de part et d’autre de la paroi glomérulaire. L’albumine dont le poids moléculaire est de 65 000 ne passe qu’en quantité infime. La filtration glomérulaire est suivie de la réabsorption et de la sécrétion tubulaires menant à l’obtention de l’urine définitive. Pr SLIMANI. M 138

Réabsorption tubulaire La réabsorption tubulaire est le passage d’une molécule de la lumière du néphron vers le sang. elle concerne les médicaments liposolubles et non ionisés au niveau des tubes contournés proximaux et distaux. C’est le processus par lequel des constituants filtrés disparaissent de l’urine définitive. La réabsorption peut intervenir par mécanisme actif ou par diffusion passive. -La réabsorption active concerne essentiellement les substances endogènes telles que le sodium, le potassium, l’acide urique, le glucose et les acides aminés, et quelques médicaments dont la structure est très proche de celle des acides aminés, par exemple α méthyl-dopa. Cette réabsorption active qui nécessite un apport d’énergie s’effectue essentiellement au niveau du tubule proximal, la force motrice principale étant le gradient électrochimique d’ion sodium établi par le transporteur Na+/K+ ATPase dépendante localisée dans la membrane basolatérale. −Réabsorption tubulaire passive: tout au long du néphron, par diffusion passive qui est influencé par le degré d’ionisation du médicament : seule la fraction non ionisée au p. H urinaire est réabsorbée. L’alcalinisation des urines favorise l’élimination urinaire des acides faibles. L’acidification des urines favorise l’élimination urinaire des bases faibles. Pr SLIMANI. M 139

La sécrétion tubulaire : Le processus de sécrétion tubulaire est un mécanisme de transport actif, qui utilise des transporteurs spécifiques, des capillaires péritubulaires (sang) vers la lumière du tubulaire , au niveau du tube contourné proximal rénal. La sécrétion tubulaire d’un médicaments sous la forme libre ionisées hydrosolubles n’a lieu au niveau des tubules contournés proximaux ( dépend des propriétés physico chimiques du médicament et du p. H du plasma ). Au niveau du tubule, la forme libre(Médicament) du liquide péritubulaire est sécrétée par dissociation du complexe médicament-protéine et élimination du médicament. La sécrétion tubulaire concerne : K+, H+, NH 4+, créatinine, médicaments (antibiotiques) et élimination dans l’urine. La sécrétion tubulaire proximal est un processus mettant en jeu deux types de transporteurs un pour les anions et un pour les cations -La sécrétion des acides faibles : sont sécrétés par le tube rénal sous forme anionique comme la pénicilline, et les salicylés -La sécrétion des bases faibles : la morphine, la procaïne , quinine. , thiamine -L’urine définitive est collectée au niveau du tubule collecteur. Pr SLIMANI. M 140

Exemple : -la pénicilline est un acide faible qui peut être transporté vers la lumière du tubule rénal par le transport actif des acides organiques situé dans les cellules du tube proximal rénal, la pénicilline se retrouve alors dans l’urine primitive. -Les salicylates sont principalement éliminés par le rein, à la fois par la filtration glomérulaire et l’excrétion tubulaire, sous forme d’acide salicylique libre et d’acide salicylurique ainsi que des glycuroconjugués phénolique et acyle. Les salicylates peuvent être décelés dans l’urine peu après l’ingestion. La morphine est métabolisée par le foie en morphine-3 -glucuronide , morphine-6 -glucuronide et normorphine qui sont toutes éliminées par le rein, ainsi qu’environ 10% de morphine. Pr SLIMANI. M 141

Excrétion biliaire et fécale : Ce phénomène intervient pour des principes actifs ayant une excrétion biliaire. Le médicament éliminé par voie biliaire peut être à nouveau résorbé à son arrivée dans le duodénum et rejoindre la circulation générale. Au niveau hépatique , les molécules peuvent être transformés en composés conjugués hydrophiles , couplés à des groupements polaires (acide glucuronique, acide sulfurique ou à d'autres molécules : réactions de conjugaisons). Les produits conjugués hydrophiles , peuvent être sécrétés dans la bile , par les voies biliaires et aboutissent de nouveau à l'intestin par le canal cholédoque. Une fois sécrétées dans l'intestin grêle, les enzymes luminales comme la ß- glucuronidase et la sulfatase hydrolysent les principes actifs conjugués et libèrent ainsi la molécule initiale ( déconjuguée), lui permettant d'être réabsorbé et rejoint la circulation générale et excrétés ultérieurement. Ce recyclage conduit à une augmentation des concentrations plasmatique et une prolongation de la durée de séjour du médicament : cycle entérohépatique. Pr SLIMANI. M 142

médicament Tube digestif Lumière Féces Veine porte foie bile Médicament conjugué Circulation générale Cycle entéro- hépatique Intestin Médicament déconjugué ( molécule initial) -Exemple: la digitoxine, une molécule liposoluble, est fortement métabolisée dans le foie, elle subit d’abord une hydrolyse puis une conjugaison (80% en métabolites actifs). L’excrétion par la bile dans la lumière intestinale avec réabsorption par l’intestin produit un effet prolongé de la molécule avec une demi-vie d’élimination de 7 jours, elle est éliminée principalement par métabolisme hépatique (cycle entéro -hépatique). -Certains AINS , ont une élimination biliaire avec cycle entéro - hépatique (indométacine, diclofénac , piroxicam). Autres voies d’élimination : Il existe d’autres voies d’élimination d’un médicament et de ses métabolites. Ce sont essentiellement les voies pulmonaire (dans l’air expiré ), cutanée ( sueur) , lacrymale ( larmes). Pr SLIMANI. M 143

Les paramètres de l’élimination: 1 - la période de demi vie d’élimination : T 1/2 Le temps nécessaire pour éliminer 50 % de la quantité de principe actif de l’organisme Voie intraveineuse : C =Co e -ke. t Ln C = Ln Co –Ke. t Pour t = T 1/2 Ln Co/2 = Ln Co – Ke. T 1/2 = Ln 2 / Ke Ke : constante d’élimination du médicament (Ket =Kr +Kh ) Ket : constante d’élimination totale ; Kr: rénale ; Kh : hépatique Pr SLIMANI. M 144

La demi-vie est exprimée en unité de temps et peut varier de quelques minutes à plusieurs semaines selon les médicaments. La fraction de médicament éliminée en fonction du temps dépend donc de sa demi-vie et l’on considère que la quasi-totalité du médicament est éliminée au bout de 5 demi-vie. Ainsi après 7 demi-vies la concentration résiduelle du médicament dans le sang est inférieure à 1% (considéré comme négligeable) : Nombre de demi-vie 1 T 1/2 2 T 1/2 3 T 1/2 4 T 1/2 5 T 1/2 6 T 1/2 7 T 1/2 Fraction éliminée (% dose administrée) 50 75 87. 5 94 97 98 99 -3 T 1/2 : 1 - (1/23) = O. 875 (87. 5%) -Temps mis pour atteindre le plateau d’équilibre =5 T 1/2 ( perfusion intraveineuse ) -Temps mis pour atteindre l’élimination complète : 7 T 1/2 Pr SLIMANI. M 145

- La clairance : La clairance plasmatique totale représente le volume de plasma totalement épuré du médicament par unité de temps. La clairance dépend du débit sanguin , de l’activité enzymatique , du pourcentage de fixation du médicament aux protéines plasmatiques. Le sang traversant successivement différents organes épurateurs, leurs effets s’additionnent et la clairance plasmatique totale est la somme des clairances de chaque organe. Ainsi, pour un médicament éliminé par le foie (H) et par le rein (R), on a : CLT = CLH + CLR. -La clairance d’un organe répond à la formule générale CL = Q x E avec Q = débit sanguin irriguant l’organe et E = coefficient d’extraction : CL = Ke x Vd = (Ln 2/ T 1/2) x Vd Ke : constante d’élimination ; Vd : volume de distribution Filtration glomérulaire : La vitesse de filtration = fl. C x clairance glomérulaire = quantité de P. A filtré par unité de temps. fl : concentration du principe actif CL FG = CL filtration + CL sécrétion – CL réabsorption Seule la fraction libre est filtrée CL FG = fu × CL créatinine ; CL FG ( clairance de filtration glomérulaire) , fu: fraction libre Pr SLIMANI. M 146

Clairance de la créatinine et filtration glomérulaire On appelle clairance (ou clearance) de la créatinine la capacité de filtration du rein. Elle mesure le débit de filtration glomérulaire et se calcule par le rapport entre le taux de créatinine dans le sang et son taux dans les urines. La clairance de la créatinine est le coefficient d'épuration plasmatique ou nombre de ml de plasma complètement épurés de créatinine par le rein, rapporté au temps. Elle permet d'estimer la filtration glomérulaire (DFG) et plus globalement la fonction rénale. Débit de la Filtration Glomérulaire DFG = U. V/ P = clairance de la créatinine U = concentration urinaire de créatinine ( m mol/l ) V = débit urinaire (en ml par 24 h soit 1440 ml/ min) P = concentration plasmatique de créatinine (en µmol/l La clairance de la créatinine varie en fonction de l’âge et du poids, c’est pourquoi on la compare avec une excrétion normale par unité de surface corporelle. Diurèse : volume d’urine émis en 24 heures. Il est normalement compris entre 1, 4 et 2 L/24/h. (140 -Age)x Poids(Kgs) Cl créatinine= x 1. 03 pour les femmes Créatininémie (µmol/l) x 1. 24 pour les hommes Pr SLIMANI. M 147

Biodisponibilité : La quantité de P. A absorbé à partir d’une forme pharmaceutique qui atteint la circulation systémique. -La biodisponibilité absolue : correspondant au rapport de la quantité absorbée par une voie d’administration donnée à celle obtenue par voie intraveineuse (égale à 100%, voie de référence). La quantité de médicament présente dans le plasma soit moindre qu’en administration intraveineuse , on peut donc écrire la relation : % de résorption = SSC orale x (1 OO /SSC intraveineuse) La fraction de substance active absorbée F ou biodisponibilité absolue est obtenue par la formule suivante, si la clairance totale est la même pour les deux voies : F = SSC orale /SSC intraveineuse) , pour une même dose administrée pour les deux voies. La valeur de F est comprise entre 0 et 1. SSC : surface sous la courbe ou AUC : area under curve SSC : représente la quantité de médicament ayant atteint la circulation générale. Pr SLIMANI. M 148

Cmax et T max observés 0 Dans le cas ou l’administration d’une même dose de principe actif est impossible, mais si la pharmacocinétique de ce P. A est linéaire, il sera possible de corriger la formule précédente (1) de la façon suivante: F = ( AUC orale x Dose iv) / (AUC iv x Dose orale). L’effet du premier passage hépatique influence fortement la biodisponibilité orale , la biotransformation F peut s’exprimer par la relation suivante : F = 1 - coefficient d’extraction ) Pr SLIMANI. M 149

Calcul de la surface sous la courbe (SSC) par la méthode des trapèzes. La surface sous la courbe au-delà du dernier point mesuré (en pratique un triangle) en l’extrapolant à l’infini (S ∞ ). Ct Biodisponibilité par voie orale de 3 médicaments Pr SLIMANI. M 150

Exercice d’application : calcul des SSC partielles par la méthode des trapèzes arithmétiques et par celle des trapèzes géométriques Temps (min) Concentration (µg/ml) SSC trapèzes Arithmétiques (µg. min/ml) SSC trapèzes géométriques (µg. min/ml) 0 20 10 16. 4 182. 0 181. 11 20 13. 4 149. 0 148. 24 30 11 122. 00 121. 41 40 8. 9 99. 50 98. 94 552. 5 549. 59 Total (0 à 40 minutes) Pr SLIMANI. M 151

Pour l’intervalle de temps : 0 à 10 minutes S t 1 - t 2 = ( (C 1 + C 2) / 2 ) x (t 2 -t 1 ) arithmétique = demi somme des concentrations x delta T = ((16. 4 + 20 ) / 2 ) x 10 = 18. 20 µg/ml x 10 minutes = 182 µg. min. ml-1 Moyenne géométrique : La moyenne géométrique d'une suite de données xn est calculée de la manière suivante : G =√(2&20 x 16. 4 )=18. 11 Trapèze géométrique = 18. 11 x 10 min = 181. 11 µg. min. ml -1 La moyenne géométrique est toujours inférieure à la moyenne arithmétique Pr SLIMANI. M 152

La biodisponibilité relative : la forme de référence est administrée sous une autre voie que la voie intraveineuse , permet de comparer des formes galéniques différentes ( un comprimé et une gélule ) ou des formulations différentes (deux comprimés de composition différentes : médicaments princeps et génériques ) et administrés par la même voie. -La biodisponibilité relative en % (F%) : F %= (AUC forme à tester ) x 100 / (AUC forme de référence) Médicament à tester ( médicament générique ) Médicament de référence ( médicament princeps) -Deux formes galéniques différentes : F% = (AUC gel/AUC cps ) x 100. - Pour des doses administrées différentes : La détermination de la fraction absorbée relative (FR): Dose forme de référence x AUC forme à tester FR(%) = Dose forme à tester x AUC forme de référence Pr SLIMANI. M 153

E n plus de F , il faut également comparer la Cmax et le Tmax -La Cmax : concentration maximale ( pic plasmatique) -Le Tmax : temps nécessaire pour atteindre le concentration maximale plasmatique ou pic plasmatique. -C max et T max calculés Cmax = Tmax = F. D. e-Ke. Tmax Vd 1 Ka -Ke x Ln F: facteur de biodisponibilité ; D: dose administrée Ke: constante d’élimination ; Vd: volume de distribution ; Ka : constante apparente d’absorption Ka Ke La comparaison de ces paramètres permet de définir la bioéquivalence de deux formes pharmaceutiques semblables. La bioéquivalence des formes sera un critère essentiel pour la reconnaissance d’un médicament générique. Bioéquivalence de deux produits galéniques différents du même principe actif sont bio équivalents , si les trois paramètres pharmacocinétiques sanguins (Cmax, t max, AUC) sont similaires. Pr SLIMANI. M 154

Calcul de SSC: La SSC du temps zéro à l’infini est une meure de la quantité de substance active résorbée et ayant pénétré dans la circulation sanguine générale L’ASC 0 -t est calculée comme la somme des surfaces de chacun des trapèzes formés par deux concentrations à des temps consécutifs, entre les temps 0 et t (méthode des trapèzes). L’estimation de la constante fractionnelle d’élimination (Ke) se fait par régression log-linéaire sur les points terminaux. Cette constante permet ensuite d’estimer la surface sous la courbe au-delà du dernier point mesuré (en pratique un triangle) en l’extrapolant à l’infini : SSC 0 ∞ = SSC 0 t + SSC dernier point Ke Le médicament décroit de manière exponentielle est directement éliminé sous forme intacte. L’intégrale de [C] f(t) représente la quantité totale épurée. Cette intégrale représente la surface sous la courbe (ou SSC ). Pr SLIMANI. M 155

Dans un modèle mono compartimental , ou l'évolution de la concentration (C) en principe actif au cours du temps est décrite par une mono-exponentielle ayant comme constante d'élimination K de la forme : C= C 0. e- Kt , la surface sous la courbe (SSC) du temps zéro à l’infini qui s’exprime par la formule : Co: concentration plasmatique au t=O ( par voie i. v : C max). ASC = -(-1/K). Co SSC 0 ∞= (C 0 /k ) SSC = Co/ Ke SSC 0 ∞ obtenue par les trapézoides de temps zéro au temps t, et du temps t jusqu’à l’infini correspond à celle qui est donnée à l’équation précédente. Ct Ainsi : SSC 0 ) ∞ = CO /Ke = (SSC 0 t + Ke La SSC est exprimée en unité de concentration x unité de temps/ litres : ( mg. h /L ). Clairance totale : CL =Ke. Vd avec Ke =CO/SSC plasma et Vd =D/C 0 ce qui donne : CL=( C 0/SSC plasma )x (D i. v /Co) =D i. v/SSC plasma ; CL orale = (D orale x F)/SSC F: facteur de biodisponibilité ; Vd = ( F. CL )/ Ke = (F. D)/ (Ke. SSC) Pr SLIMANI. M orale 156

Exercices d’application : Exemple 1 : Les paramètres pharmacocinétiques d’un médicament donné par voie orale sont les suivants : Ka =0. 80 h-1 Ke = 0. 03 h-1 Vd = 30 L F =0. 9 D= 50 mg Evaluez les paramètres Tmax et Cmax après une dose. Tmax = 1 x Ln Ka Ka -Ke Ke Tmax =4. 26 h Cmax = F. D. e-Ke. Tmax Vd Cmax = 1. 32 mg/L Pr SLIMANI. M 157

Exemple 1 : Une forme gélule d’un médicament est administrée à la dose de 480 mg. La pharmacocinétique de cette forme orale répond à un modèle mono compartimental et l’équation qui traduit les variations de la concentration plasmatique (mg/L) en fonction du temps (heures) est : Ct =62 x e-0. 099 t – 62 x e-0. 16 t ; Après l’administration IV bolus d’une dose de 240 mg de ce même principe actif la pharmacocinétique répond à un modèle mono compartimental et l’équation qui rend compte des variations de la concentration en fonction du temps est : Ct =15 x e-0. 098 t Calculer la demi-vie d’élimination, la clairance plasmatique totale, le volume de distribution et la biodisponibilité absolue de cette forme gélule. Ct =62 x e-0. 099 t – 62 x e-0. 16 t ; Ct = phase d’élimination – phase de résorption Sous la forme : Ct = -A e –kat +Be –ket Ke =0. 099 (constante d’élimination ) ; Ka =0. 16 (constante apparente d’absorption ) La demi vie : T 1/2 d’élimination T 1/2= Ln 2 /Ke = 0. 693/O. 099 = 7 heures , T 1/2 de résorption : T 1/2= 0. 693/O. 16 =4. 33 heures SSC = C /Ke : SSC orale= (62/0. 099)- (62/0. 16) =238. 76 mg. H /L SSC I. v =( 15/0. 098 ) = 153. 06 mg. H /L Bio disponibilité : F= (SSC orale/SSC iv)x (Dose iv /Dose orale) F= (238. 76/153. 06)x(240/480) = 0. 78 = 78% Pr SLIMANI. M 158

- Tmax = (1/(Ka-Ke) )x Ln(Ka/Ke)=7. 86 heures (Ka =0. 16 , Ke= 0. 099) -Cmax = (F. D. e –Ke. Tmax) /Vd CL =Dose p. o x F/ ASC p. o = 480 mg x 0. 78 /238. 76 mg. H. L-1 =1. 56 L. H-1 Vd =CL/Ke = 1. 56 L. H-1/0. 099 H-1 = 15. 75 L Cmax = (F. D. e –Ke. Tmax) /Vd = 10. 91 mg/L Autres méthodes de calcul : Ct = -A e orale La formule du Tmax est la suivante : –ka. t +Be Tmax = –ke. t : la cinétique de la forme ln(����. A / ����. B ) ���� −���� La formule du Cmax est la suivante : −����. T������ =−A �� + B �� Exemple précédent : la forme cinétique de la forme orale Ct =62 x e-0. 099 t – 62 x e-0. 16 t Tmax = Ln ( 0. 16 x 62/ 0. 099 x 62)/ (0. 16 -0. 099) = 7. 86 heures Cmax = -62 e-0. 16 x 7. 86 +62 e -0. 099 x 7. 86 =10. 84 mg/L Pr SLIMANI. M 159

Références : -AIACHE J-M et collaborateurs , Traité de biopharmacie et pharmacocinétique , éditions Vogot ( les presses de l’université de Montréal ), 1986 ALATA. W , 2015, Étude de la barrière hématoencéphalique dans des modèles animaux de la maladie d'Alzheimer, Doctorat en pharmacie Philosophiæ doctor (Ph. D. ), université de Laval , Québec, Canada BESSADOK. A , 2011, La multiplicité de transport de la P-glycoprotéine : Etudes de modélisation comparative et de docking au sein de la famille des protéines ABC , Thèse de doctorat de l’université PIERRE ET MARIE CURIE (Paris , France ) -BRUZZONI GIOVANELLI. H, Cours 2 : Principales cibles des médicaments, 2013 -CALVO. F , 2010 , Récepteurs des médicaments et action pharmacologique LAFFONT. C , 2011 http: //physiologie. envt. fr/spip. php. -ECLOUTIER. B et MÉNARD. N , 2005 , Pharma-Fiches, La pharmacocinétique 4 e édition, Montréal, Gaëtan Morin, p. 26 -27. IM , S. -C. , and Waskell, L. (2011). The interaction of microsomal cytochrome P 450 2 B 4 with its redox partners, cytochrome P 450 reductase and cytochrome b(5). Archives of biochemistry and biophysics, 507(1), 144– 53. Pr SLIMANI. M 160

-KEITH L. MOORE , ARTHUR F. DALLEY, ANNE MR AGUR, Anatomie médicale: Aspects fondamentaux et applications cliniques. -LEPAGE. P et GROS. P , 1995, La glycoprotéine P : de la résistance croisée aux médicaments au transport des lipides biliaires , médecine/sciences 1 995 ; 11 : 357 -66 -LOICHOT. C ET M. GRIMA -, 2004 Mécanismes d’action des médicaments -LANDRY M. et coll. Pharmacologie : Des cibles vers l'indication thérapeutique. , Ed. DUNOD 2003 -MOUSSAKOVA. L ET LACHAÎNE. R , (Editions Américaines MARIEBB. E. N and HORHN. K), Anatomie et physiologie humaines , Editions du renouveau pédagogique INC. (ERPI), 2015, Montreal (Québec). -PRUNEL. J, 2004 , Glycoprotéine-P et interactions médicamenteuses en pratique courante à l’officine, thèse de doctorat en pharmacie , université JOSEPH FOURIER (Grenoble , France) -STANKE –LABESQUE Françoise , Aspects pharmacocinétiques , 2011 -WEISSENBURGER. J , Pharmacodynamie , Faculté de Médecine , Université Pierre& Marie Curie, 2010 Pr SLIMANI. M 161
 Ceh pharmacologie
Ceh pharmacologie Ceh pharmacologie
Ceh pharmacologie Socit gnrale
Socit gnrale Cours vih ifsi
Cours vih ifsi Bilan thermique du corps humain def
Bilan thermique du corps humain def Antiseptique et désinfectant cours
Antiseptique et désinfectant cours Datagramme arp
Datagramme arp Tic et ihm
Tic et ihm Robot rrr
Robot rrr Cours vhdl ppt
Cours vhdl ppt Cio cenon
Cio cenon Stratégie corporate cours
Stratégie corporate cours Segmentation ciblage positionnement marketing
Segmentation ciblage positionnement marketing Cours sur les trames
Cours sur les trames Exposé sur la sensation en psychologie
Exposé sur la sensation en psychologie Tuan loc
Tuan loc Cours secondaire 5
Cours secondaire 5 Cod 1 pompier
Cod 1 pompier Cours présentation assistée par ordinateur
Cours présentation assistée par ordinateur Ihm
Ihm Is parkour a french word
Is parkour a french word Cours introductif
Cours introductif Les composantes de la gar
Les composantes de la gar Cem cours
Cem cours Les suites du cours
Les suites du cours Riahla cours
Riahla cours Les anticoagulants cours ifsi
Les anticoagulants cours ifsi Cours de narration
Cours de narration Cours traitement de texte open office
Cours traitement de texte open office Cours de communication professionnelle ppt
Cours de communication professionnelle ppt Audio numérique cours
Audio numérique cours Cours stmg
Cours stmg Zonecour
Zonecour Corporate finance cours
Corporate finance cours Oropharyngoscopie
Oropharyngoscopie Pl/sql cours
Pl/sql cours Politique commerciale cours
Politique commerciale cours Cours l2 neuchâtel
Cours l2 neuchâtel Hydrologie cours
Hydrologie cours Propriété probabilité
Propriété probabilité Sadt turbocompresseur
Sadt turbocompresseur Drain thoracique infirmier
Drain thoracique infirmier Identitovigilance définition oms
Identitovigilance définition oms Communication médiatique cours
Communication médiatique cours Cours sainte marie de hann piscine
Cours sainte marie de hann piscine Gestion de projet cours résumé
Gestion de projet cours résumé Cours emarketing
Cours emarketing Puffing billy aspirateur
Puffing billy aspirateur Cours sur les antennes
Cours sur les antennes Calcul indice de pompe pompier
Calcul indice de pompe pompier Politique rh cours
Politique rh cours Dut abb
Dut abb Diabete cours ide
Diabete cours ide Les parties du texte narratif
Les parties du texte narratif Ses versailles cours inversés
Ses versailles cours inversés Les incoterms cours
Les incoterms cours Les loi de thermodynamique
Les loi de thermodynamique Lignes de transmission cours
Lignes de transmission cours Cours e marketing
Cours e marketing Cned cel
Cned cel Crise biologique
Crise biologique Cours anthropologie infirmier
Cours anthropologie infirmier Cours sévigné abidjan
Cours sévigné abidjan Viande maturée danger
Viande maturée danger La tectonique des plaques - cours
La tectonique des plaques - cours Assemblage en cours
Assemblage en cours Les helminthes cours
Les helminthes cours Psychologie expérimentale - cours
Psychologie expérimentale - cours Distance interréticulaire hexagonal
Distance interréticulaire hexagonal Commentaire jsp
Commentaire jsp Gestion internationale des ressources humaines cours
Gestion internationale des ressources humaines cours Musibiol cours
Musibiol cours Syllabus de cours
Syllabus de cours Au cour de la semaine prochaine
Au cour de la semaine prochaine Cours dynatrace
Cours dynatrace Equilibre alimentaire ifsi
Equilibre alimentaire ifsi Cours hydrogéologie master
Cours hydrogéologie master Zonecourshec
Zonecourshec Tableur excel
Tableur excel Aéraulique cours
Aéraulique cours Intégrale impropre cours
Intégrale impropre cours Filtrage numérique cours
Filtrage numérique cours Westga.edu courseden
Westga.edu courseden Pharmacocinétique
Pharmacocinétique Cours turbomachine
Cours turbomachine La methode croc
La methode croc Cours mimo
Cours mimo Cours cap apr
Cours cap apr Représentation chromatique des nombres
Représentation chromatique des nombres Cours interactif
Cours interactif Pp2c uqtr
Pp2c uqtr Analyse zi fdf
Analyse zi fdf Cours modulo
Cours modulo Compteur asynchrone bascule jk
Compteur asynchrone bascule jk La tectonique des plaques - cours
La tectonique des plaques - cours Dialyse péritonéale
Dialyse péritonéale Cours virtualisation
Cours virtualisation Passage du mcd au mpd
Passage du mcd au mpd Psychologie analytique cours
Psychologie analytique cours Capteur et conditionneur cours
Capteur et conditionneur cours Data mining cours
Data mining cours Business plan zara
Business plan zara Jsf cours
Jsf cours Cours pharmacie constantine
Cours pharmacie constantine Chargé de cours
Chargé de cours Méthode hay grille
Méthode hay grille Relation entre ka et kb
Relation entre ka et kb Faculté de medecine constantine 3
Faculté de medecine constantine 3 Transistor cours
Transistor cours Dendrologie cours
Dendrologie cours Cytosquelette cours
Cytosquelette cours Fiche technique d'un cours
Fiche technique d'un cours Vision par ordinateur cours
Vision par ordinateur cours Cours emg
Cours emg Traitement automatique des langues cours
Traitement automatique des langues cours Hormone thyroïdienne
Hormone thyroïdienne Introduction aux relations internationales
Introduction aux relations internationales