Le proteine plasmatiche e loro significato clinico Le





























































- Slides: 90

Le proteine plasmatiche e loro significato clinico

Le proteine (dal greco protos: principale) Sono sostanze organiche formate da aminoacidi uniti con legame peptidico e da composti, diversi dagli aminoacidi (carboidrati nelle glicoproteine, lipidi nelle lipoproteine, ecc. ) legati con legame covalente La luciferina delle lucciole L’emoglobina degli eritrociti La cheratina di capelli, squame, corna, lana, unghie etc.

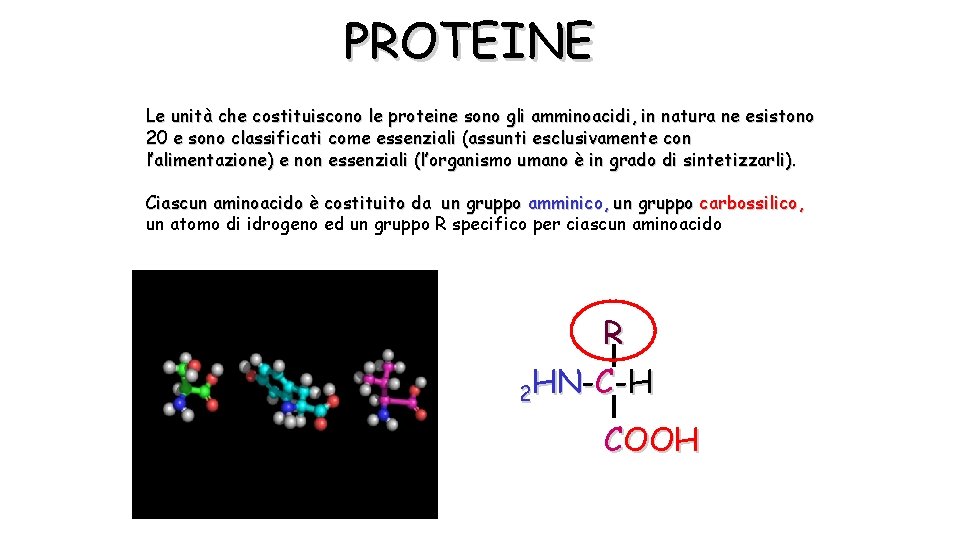
PROTEINE Le unità che costituiscono le proteine sono gli amminoacidi, in natura ne esistono 20 e sono classificati come essenziali (assunti esclusivamente con l’alimentazione) e non essenziali (l’organismo umano è in grado di sintetizzarli). Ciascun aminoacido è costituito da un gruppo amminico, un gruppo carbossilico, un atomo di idrogeno ed un gruppo R specifico per ciascun aminoacido R 2 HN-C-H COOH

Fattori che influenzano la STRUTTURA PROTEICA DI BASE • Composizione aa: a seconda che il gruppo R necessiti di stare lontano, vicino o a contatto con l’acqua, alla superficie della proteia ripiegata. • AA speciali: prolina, cisteina e metionina esercitano effetti sulla conformazione proteica a causa di ripiegamenti e ponti disolfuro. • Siti funzionali: le proteine strutturali o gli enzimi che catalizzano le reazioni hanno aa particolari che sono importanti per specifiche funzioni proteiche. Il gruppo R in questi siti influenza la conformazione proteica finale. • Modificazioni finali: la maggior parte delle proteine è costituita inizialmente da aa aggiuntivi che possono essere modficati o rimossi durante la maturazione delle proteine, determinando cosi una modifica della struttura finale. • Destinazione finale: sia che finisca in soluzione acquosa che in una membrana, la proteina modificherà il suo ripiegamento ( folding), come nel caso delle proteine di membrana che hanno i gruppi R all’esterno in contatto con la membrana idrofobica

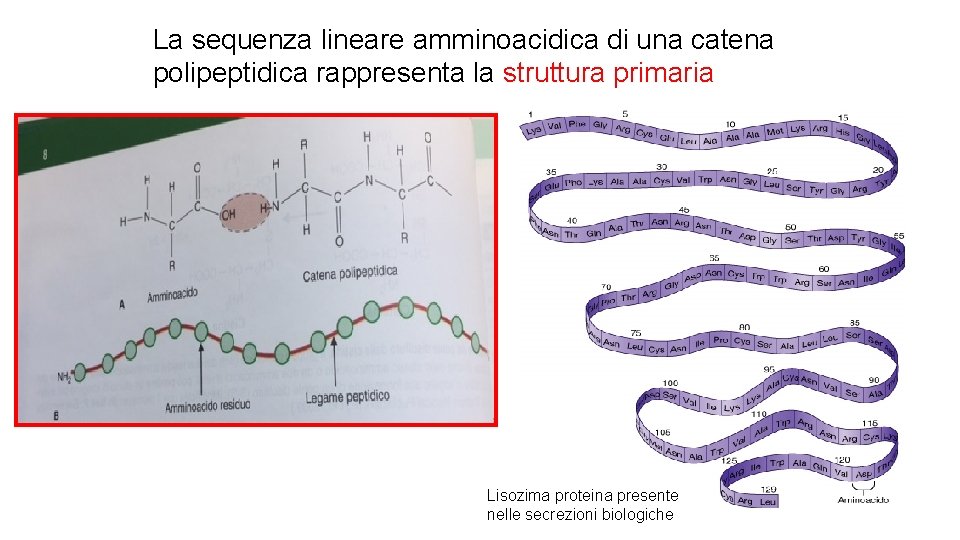
• I 20 amminoacidi che si trovano comunemente nelle proteine sono uniti l’uno all’altro da legami peptidici. • La sequenza lineare degli amminoacidi legati contiene l’informazione necessaria a generare una proteina con una forma tridimensionale esclusiva. • La struttura di una proteina è complessa: organizzazione in 4 livelli gerarchici (struttura primaria, secondaria, terziaria, quaternaria).

La sequenza lineare amminoacidica di una catena polipeptidica rappresenta la struttura primaria Lisozima proteina presente nelle secrezioni biologiche

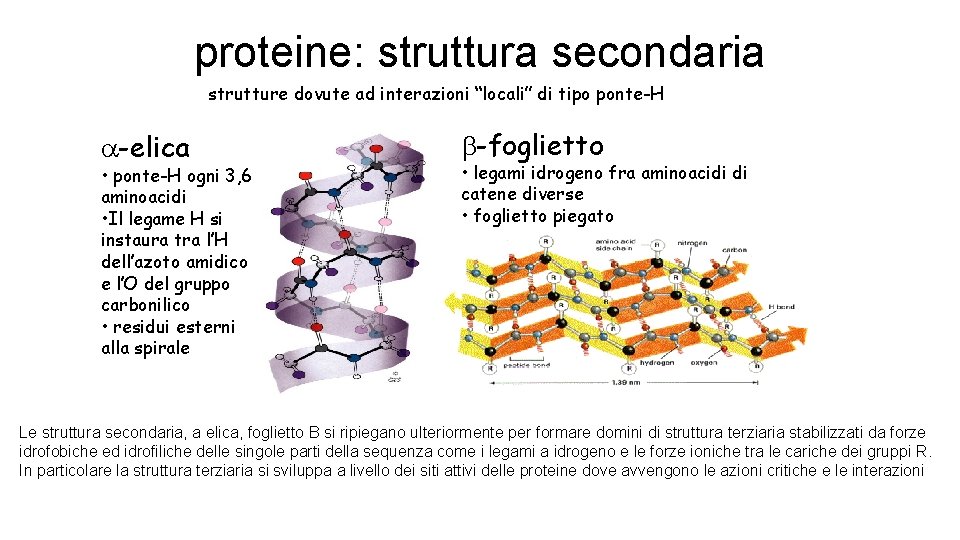
Struttura secondaria • Si riferisce alla conformazione locale della catena polipeptidica. • E’ determinata da interazioni di tipo legame a idrogeno fra l’ossigeno di un gruppo carbonilico del legame peptidico e l’idrogeno del gruppo ammidico di un altro legame peptidico. • Esistono due tipi di strutture secondarie: l’ a-elica ed il foglietto b.

proteine: struttura secondaria strutture dovute ad interazioni “locali” di tipo ponte-H -elica • ponte-H ogni 3, 6 aminoacidi • Il legame H si instaura tra l’H dell’azoto amidico e l’O del gruppo carbonilico • residui esterni alla spirale b-foglietto • legami idrogeno fra aminoacidi di catene diverse • foglietto piegato Le struttura secondaria, a elica, foglietto B si ripiegano ulteriormente per formare domini di struttura terziaria stabilizzati da forze idrofobiche ed idrofiliche delle singole parti della sequenza come i legami a idrogeno e le forze ioniche tra le cariche dei gruppi R. In particolare la struttura terziaria si sviluppa a livello dei siti attivi delle proteine dove avvengono le azioni critiche e le interazioni

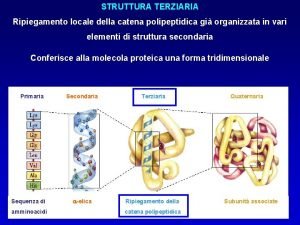
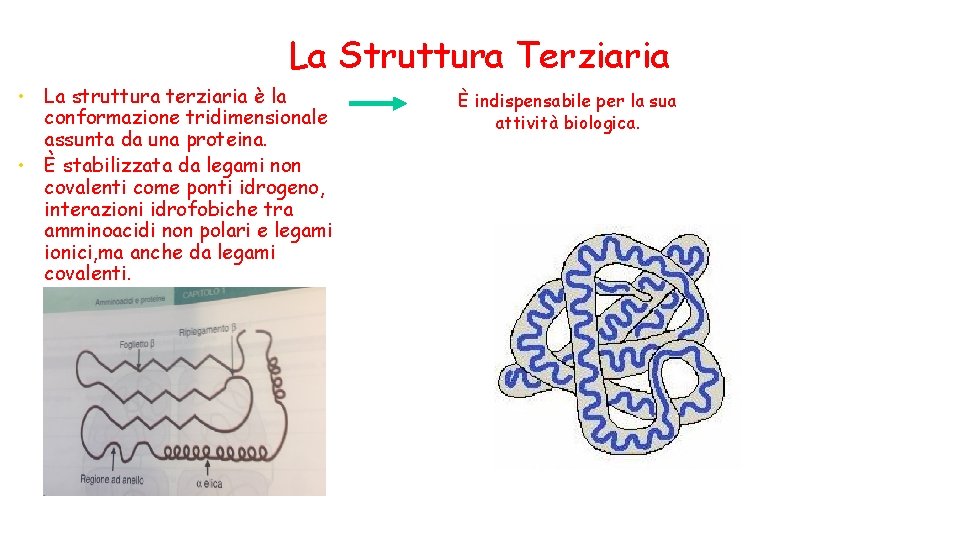
La Struttura Terziaria La struttura terziaria è la conformazione tridimensionale assunta da una proteina. • È stabilizzata da legami non covalenti come ponti idrogeno, interazioni idrofobiche tra amminoacidi non polari e legami ionici, ma anche da legami covalenti. • È indispensabile per la sua attività biologica.

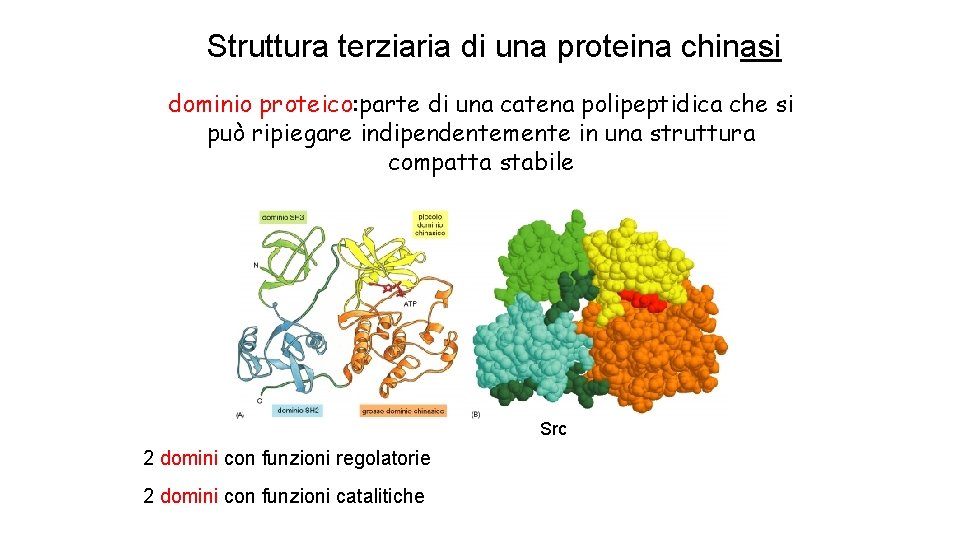
Struttura terziaria di una proteina chinasi dominio proteico: parte di una catena polipeptidica che si può ripiegare indipendentemente in una struttura compatta stabile Src 2 domini con funzioni regolatorie 2 domini con funzioni catalitiche

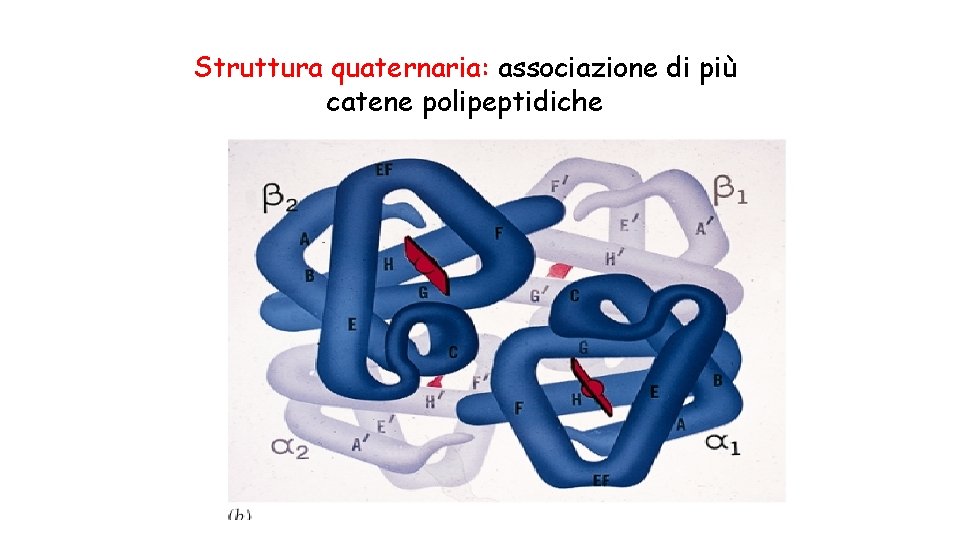
Struttura quaternaria • Molte proteine sono costituite da una sola catena polipeptidica (proteine monomeriche). • Alcune proteine sono costituite da 2 o più catene polipeptidiche (subunità) strutturalmente identiche o diverse (proteine multimeriche). • L’associazione di queste subunità costituisce la struttura quaternaria. • Le subunità sono tenute insieme da interazioni non covalenti.

Struttura quaternaria: associazione di più catene polipeptidiche

CLASSIFICAZIONE DELLE PROTEINE • Gli aa, i peptidi, le proteine che essi formano rivestono diversi ed importanti ruoli nella biochimica umana e nella vita. • Il ruolo fondamentale degli aa è quello di costituire i mattoni delle proteine oltre ad essere i precursori di numerose ed importanti molecole. • Quindi l’eccesso o il deficit di aa può determinare diverse patologie a carico del sistema nervoso centrale, del metabolismo, difetti sulla funzione epatica e renale, etc.

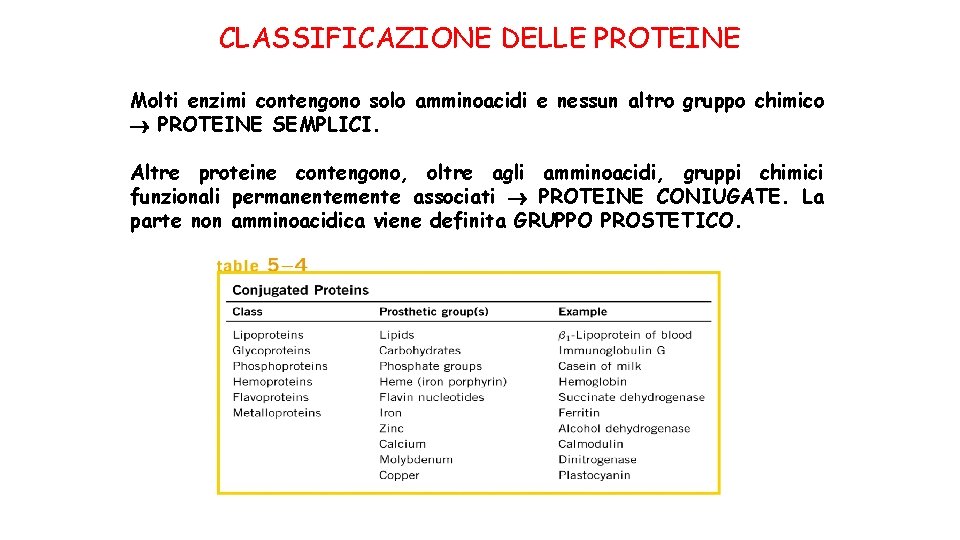
CLASSIFICAZIONE DELLE PROTEINE Molti enzimi contengono solo amminoacidi e nessun altro gruppo chimico PROTEINE SEMPLICI. Altre proteine contengono, oltre agli amminoacidi, gruppi chimici funzionali permanentemente associati PROTEINE CONIUGATE. La parte non amminoacidica viene definita GRUPPO PROSTETICO.

CLASSIFICAZIONE DELLE PROTEINE Le proteine possono essere classificate in due gruppi principali: proteine globulari e fibrose.

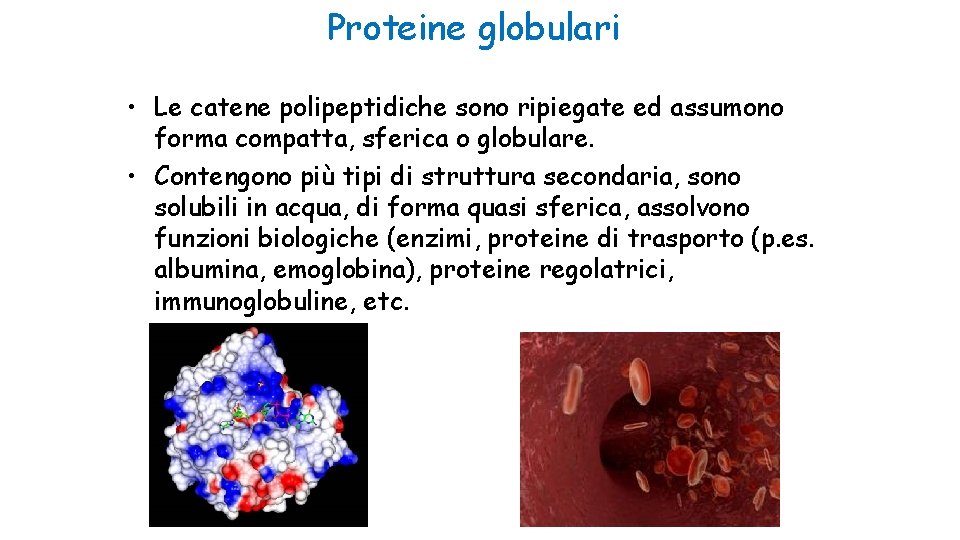
Proteine globulari • Le catene polipeptidiche sono ripiegate ed assumono forma compatta, sferica o globulare. • Contengono più tipi di struttura secondaria, sono solubili in acqua, di forma quasi sferica, assolvono funzioni biologiche (enzimi, proteine di trasporto (p. es. albumina, emoglobina), proteine regolatrici, immunoglobuline, etc.

Le Proteine Fibrose • Sono di origine animali, • insolubili in acqua, • Assolvono ruoli strutturali per lo più. Si dividono in tre categorie: Ø le cheratine Ø i collageni Ø le sete Formano tessuti protettivi Formano tessuti connettivi Come i bozzoli dei bachi da seta

Alcune funzioni delle proteine I catalizzatori (acceleratori) delle reazioni biologiche noti come enzimi sono proteine Le proteine note come immunoglobuline sono la prima linea di difesa contro le infezioni batteriche e virali Le proteine di trasporto sono indispensabili per la vita. Ad esempio l’emoglobina trasporta l’ossigeno dai polmoni ai tessuti più lontani Molti ormoni, come l’insulina, sono proteine di regolazione Le proteine strutturali, forniscono un supporto meccanico. Il collagene è la proteina principale del tessuto connettivo e delle ossa Proteine come l’actina e la miosina servono per contrarre e distendere i muscoli

Proteine alimentari le proteine alimentari sono la fonte principale di aa indispensabili per diverse funzioni dell’organismo: Funzione plastica: esse forniscono le unità strutturali per la formazione delle proteine umane che sono soggette ad un continuo turnover Funzione regolatrice: gli aa sono i precursori degli ormoni, neurotrasmettitori ed altre molecole azotate Funzione enrgetica: lo scheletro carbonioso degli aa può essere ossidato per formare ATP o convertito in glucosio tramite la gluconeogenesi.

• Il legami che stabilizzano la struttura tridimensionale delle proteine possono essere facilmente rotti da agenti denaturanti come il calore, la variazione di p. H, tutti elementi che fanno perdere alla proteina quella organizzazione strutturale bene definita che ne assicura la funzione. • Questa caratteristica ha effetti positivi nei confronti della digeribilità delle proteine alimentari che aumenta in seguito alla denaturazione per effetto della cottura.

Ad esempio sottoponendo l’uovo a cottura le proteine perdono la struttura tridimensionale subendo un processo di denaturazione irreversibile. Una volta assunte esse subiscono più facilmente l’azione degli enzimi litici che idrolizzano le proteine alimentari nei singoli aminoacidi

Gli enzimi permettono di utilizzare i nutrienti • Gli enzimi sono proteine specializzate necessari affinchè i processi catalitici (liberazione dell’energia contenuta nei nutrienti etc, ) possano avvenire in un arco temporale compatibile con le esigenze cellulari. • La natura proteica della quasi totalità degli enzimi li differenzia dai catalizzatori inorganici al punto che la loro efficienza nella velocità delle reazioni è di gran lunga superiore. • Le reazioni catalizzate da enzimi non richiedono condizioni drastiche, mentre i catalizzatori inorganici operano in condizioni di T, P e p. H incompatibili con la vita della cellula.

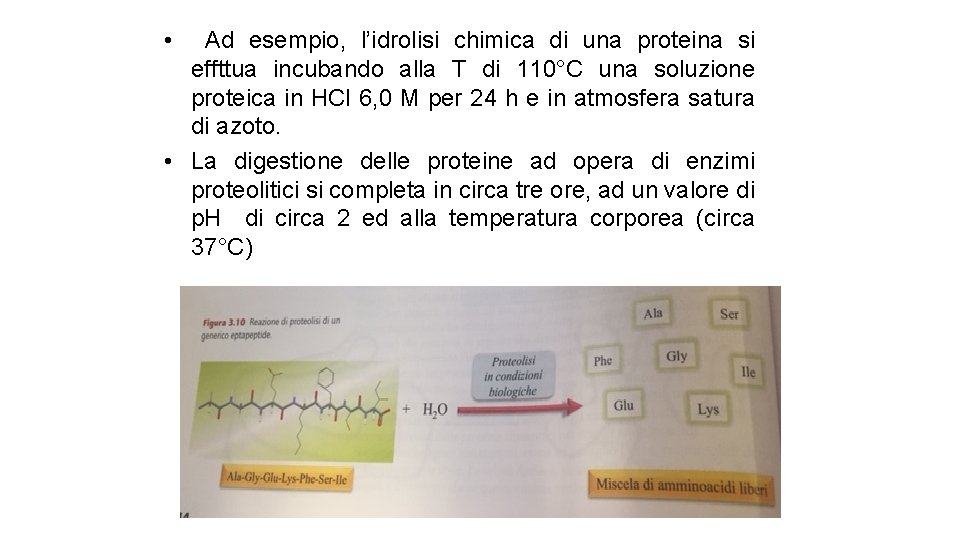
• Ad esempio, l’idrolisi chimica di una proteina si effttua incubando alla T di 110°C una soluzione proteica in HCl 6, 0 M per 24 h e in atmosfera satura di azoto. • La digestione delle proteine ad opera di enzimi proteolitici si completa in circa tre ore, ad un valore di p. H di circa 2 ed alla temperatura corporea (circa 37°C)

• Gli isoenzimi sono proteine che catalizzano la stessa reazione metabolica ma sono codificati da geni differenti. Possono esistere all’interno degli stessi organi oppure in organi diversi. • Anche se non hanno una composizione aminoacidica diversa possono presentare caratteristiche cinetiche differenti (valori della Km). • Nell’uomo l’esochinasi è presente in 4 isoforme. La I e la II (predominante nel muscolo) hanno un basso valore di Km e sono inibite dal substrato, il glucosio 6 fosfato quando si accumula. • Diversamente l’isoforma IV (presente nel fegato), presenta valori più elevati di Km e non è inibita dal prodotto della reazione.

• Questa differenza nella cinetica dei vari isoenzimi denota una sostanziale differenza nel ruolo del fegato e del muscolo nel metabolismo del glucosio. • Infatti, sfruttando queste proprietà cinetiche, il fegato può tenere sotto controllo il valore della glicemia anche nei periodi postprandiali, quando arriva una grossa quantità di glucosio dalla digestione dei carboidrati e lo accumula per rifornire tutti i tessuti che ne hanno necessità. • Il muscolo invece, consuma glucosio esclusivamente per le proprie esigenze metaboliche. • Altri esempi di isoenzimi sono la lattato deidrogenasi, presente in 5 isoforme diverse, o la protein chinasi C, presente in 15 isoforme.

Fabbisogno proteico nutrizionale • Le proteine introdotte con gli alimenti hanno un importanza per quanto riguarda la loro composizione qualitativa. • Tra i 20 aa, in particolare 10 di questi (isoleucina, treonina, lisina, metionina, fenilalanina, triptofano, valina, arginina e istidina) devono essere introdotti con la dieta e per questo motivo sono definiti essenziali. • Essi devono essere presenti in quantità adeguata per garantire all’organismo la crescita ed il mantenimento della massa muscolare.

Fabbisogno proteico nutrizionale • Le proteine della carne, delle uova, del latte e dei suoi derivati sono definite ad alto valore biologico in quanto contengono gli aa essenziali. • Le proteine a basso valore biologico come quelle dei cereali sono quelle in cui manca anche uno solo degli aa essenziali (lisina). • Le proteine di questi alimenti sono però ricche di aa solforati (cisteina e metionina) e pertanto abbinate a legumi ricchi di lisina ma carenti di aa solforati, forniscono una quota proteica atta a soddisfare il fabbisogno dell’organismo. • Affinchè una proteina possa essere ritenuta ideale è necessario che la sua composizione aa sia pragonabile alle proteine che l’organismo dovrà costruire.

Composizione e turnover • Le proteine introdotte con gli alimenti a differenza dei carboidrati e dei lipidi non possono essere immagazzinate nel nostro organismo, per cui gli aa costituenti, o vengono utilizzati per la biosintesi di proteine endogene e composti azotati oppure vengono degradati per scopi energetici. • Tutte le proteine dell’organismo subiscono quindi un continuo processo di degradazione e sostituzione (turnover proteico), in cui le proteine non più funzionali vengono degradate e sostituite con nuove molecole analoghe, per la cui sintesi l’organismo attinge ad un pool di aa sia provenienti dalla digestione delle proteine alimentari sia da quelli provenienti dalla degradazione delle proteine endogene. • Il tunover proteico è influenzato dallo stato metabolico delle cellule, dall’età , dal sesso, dall’attività fisica.

L’importanza clinica delle proteine plasmatiche Le proteine plasmatiche sono indicatori molto importanti della funzionalità di molti organi in quanto le alterazioni delle loro quote possono rendere visibile un gran numero di patologie e controllare l’evoluzione di molteplici malattie. Per esempio: • del fegato, che produce la maggior parte delle proteine • dei reni, in quanto in condizioni patologiche le proteine possono essere perse con le urine; • del sistema immunitario (le gamma globuline possono essere diminuite nelle immunodeficienze o aumentate in alcuna patologie come nel caso del mieloma multiplo).

Le proteine sieriche • ammontano in totale a circa 6 -8 g/d. L • Sono costituite da una mescolanza di specie molecolari diverse per natura chimica, origine e funzioni • in particolare, nel siero si trovano: proteine semplici, costituite unicamente da aminoacidi, come l’albumina proteine complesse o coniugate nelle quali sono presenti zuccheri, lipidi o loro derivati, legati alla catena proteica con legame di natura covalente e, quindi, sufficientemente stabile

Caratteristiche chimico-fisiche In base alla solubilità, le proteine sieriche sono frazionabili in: • Albumine, solubili in acqua • Globuline, solubili in soluzioni saline • In condizioni fisiologiche, le proteine sieriche costituiscono una soluzione colloidale • Questa soluzione di solito è stabile e diventa progressivamente instabile quando la concentrazione dell’albumina scende al di sotto del 50% del totale e la frazione globulinica aumenta La pressione colloido-osmotica, anche detta come pressione oncotica, indica la pressione esercitata dai soluti in una soluzione (di solito biologica come liquido interstiziale e/o plasma). Essa viene determinata da una maggiore concentrazione di proteine e minerali presenti nei liquidi biologici.

Funzioni biologiche delle proteine plasmatiche Alcune proteine rivestono precise funzioni biologiche nel plasma: • Funzione nutritiva (frazione albuminica) • Capacità tampone (nonostante l’effetto tampone dovuto all’emoglobina sia • • preponderante, le proteine plasmatiche ne prendono parte) Coagulazione e fibrinolosi (molte proteine coinvolte sono già presenti allo stato attivo nel plasma, altre sono in uno stato inattivo o vengono liberate in conseguenza alla cascata emocoagulativa) Fattori di difesa (immunoglobuline e fattori del complemento) Funzioni di trasporto (le proteine plasmatiche rendono biodisponibili molte sostanze insolubili in acqua come lipidi ormoni steroidei, vitamina, bilirubina, sostanze tossiche, farmaci, alcuni metalli , creando con le stesse dei legami differenti per affinità e specificità ) Mantenimento della pressione colloidoosmotica (l’albumina, sia per la sua concentrazione che per il basso peso molecolare, gioca un ruolo chiave nella distribuzione dei fluidi extracellulari) Altre proteine, come gli ormoni, alcuni enzimi, presentano una localizzazione plasmatica transitoria, ma non esplicano funzioni biologiche.

Sintesi delle proteine plasmatiche • Sono sintetizzate prevalentemente dal fegato • Fanno eccezione le immunoglobuline (sintetizzate dalle plasmacellule) • Alcuni costituenti del sistema del complemento (sintetizzati dai macrofagi) • Alcune lipoproteine (sintetizzate dalle cellule intestinali)

Alterazioni delle proteine del plasma Alterazioni nella concentrazione plasmatica delle proteine possono riscontrarsi sia in condizioni patologiche a carico del metabolismo proteico, sia in situazioni che alterano la volemia. La volemia rappresenta il volume totale di sangue nell‘organismo e comprende sia il volume del sangue circolante che quello del sangue immobilizzato in alcuni organi (fegato, milza, ecc. ).

L’aumento delle proteine totali può essere causato da: • Quali sono le possibili cause per l’aumento delle proteine totali? La concentrazione è sempre dipendente da due fattori: • La quantità del soluto • La quantità del solvente • diminuendo il volume del solvente (disidratazione) • aumentando la quantità del soluto (iperproteinemia)

L’aumento delle proteine totali può essere causato da: • Disidratazione o processi di emoconcentrazione sia fisiopatologici che legati ad esempio a fenomeni di stasi durante il prelievo: in questi casi si ha un aumento proporzionale di tutte le frazioni proteiche

La diminuzione delle proteine totali è un fenomeno di più frequente riscontro, e può essere causata da: • Durante la gravidanza, a causa dei fenomeni di iperidratazione, si riscontra una diminuzione della protidemia generale, che però non indica una diminuzione delle proteine in senso assoluto. • Una reale diminuzione della protidemia si riscontra in seguito a diminuita sintesi proteica (per insufficiente apporto proteico alimentare, malassorbimento, ecc. ), o ad aumentata perdita proteica (attraverso il rene, l’intestino, per emorragie, in seguito ad ustioni o neoplasie).

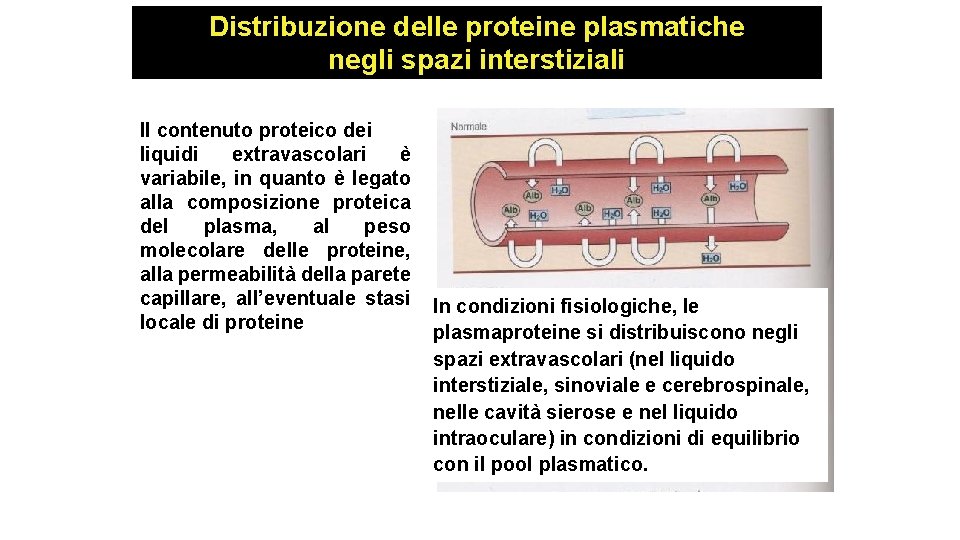
Distribuzione delle proteine plasmatiche negli spazi interstiziali Il contenuto proteico dei liquidi extravascolari è variabile, in quanto è legato alla composizione proteica del plasma, al peso molecolare delle proteine, alla permeabilità della parete capillare, all’eventuale stasi locale di proteine In condizioni fisiologiche, le plasmaproteine si distribuiscono negli spazi extravascolari (nel liquido interstiziale, sinoviale e cerebrospinale, nelle cavità sierose e nel liquido intraoculare) in condizioni di equilibrio con il pool plasmatico.

Mentre, in condizioni patologiche tale equilibrio è spostato e provoca una anomala distribuzione proteica, dovuta a: • Modificazioni idrostatiche • Modificazioni osmotiche • Aumento della permeabilità capillare

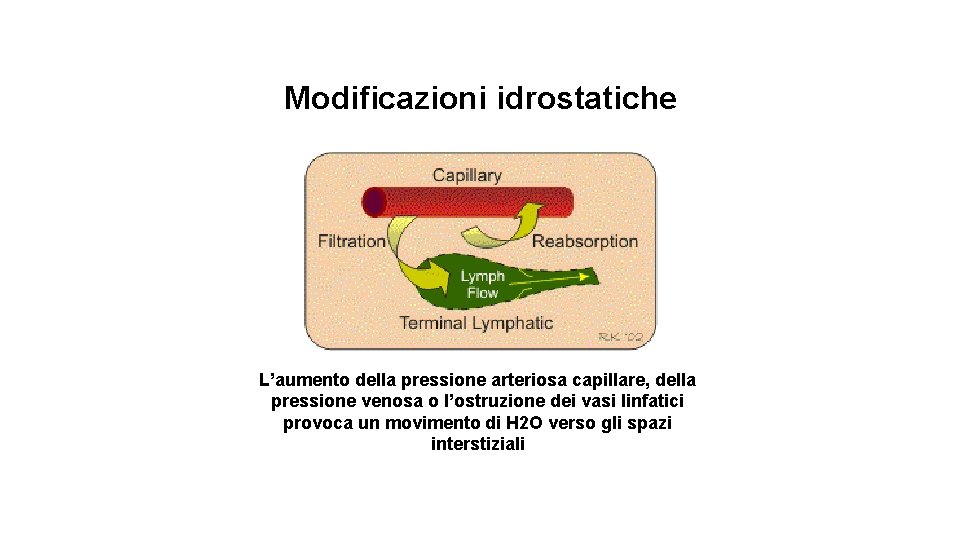
Modificazioni idrostatiche L’aumento della pressione arteriosa capillare, della pressione venosa o l’ostruzione dei vasi linfatici provoca un movimento di H 2 O verso gli spazi interstiziali

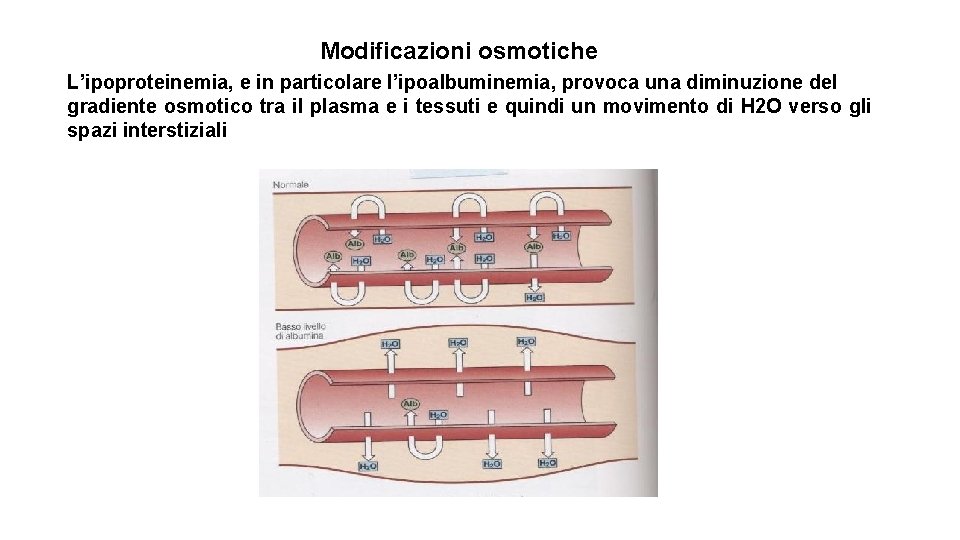
Modificazioni osmotiche L’ipoproteinemia, e in particolare l’ipoalbuminemia, provoca una diminuzione del gradiente osmotico tra il plasma e i tessuti e quindi un movimento di H 2 O verso gli spazi interstiziali

Aumento della permeabilità capillare tipica delle patologie infiammatorie Se l’integrità anatomica-capillare è preservata, il liquido extravascolare presenta un modesto contenuto in proteine e si parlerà si trasudato • per capillari gravemente danneggiati, si riscontra un incremento spiccato della quota proteica e si parlerà di essudato, caratterizzato da una concentrazione proteica superiore a 25 -30 g/l, aspetto giallo/dorato/paglierino, vischioso con fiocchi di fibrina essudato

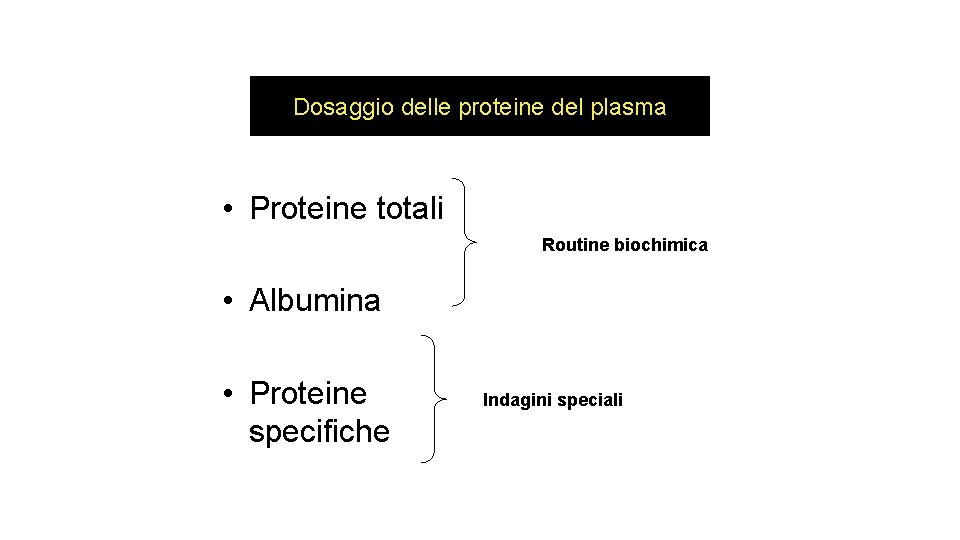
Dosaggio delle proteine del plasma • In biochimica clinica si misurano normalmente le proteine totali e l’albumina in un campione di siero, riportando la frazione globulinica, come differenza tra I primi due risultati. • Le immunoglobuline vengono misurate come classi, mentre per misurare proteine specifiche ed ormoni vengono adoperati metodi immunochimici. • Gli enzimi vengono misurati sia mediante la determinazione della loro attività, sia con metodi immunochimici per determinare la loro massa.

Dosaggio delle proteine del plasma • Proteine totali Routine biochimica • Albumina • Proteine specifiche Indagini speciali

Modulo di richiesta indagini biochimiche Proteine specifiche Elettroforesi delle proteine

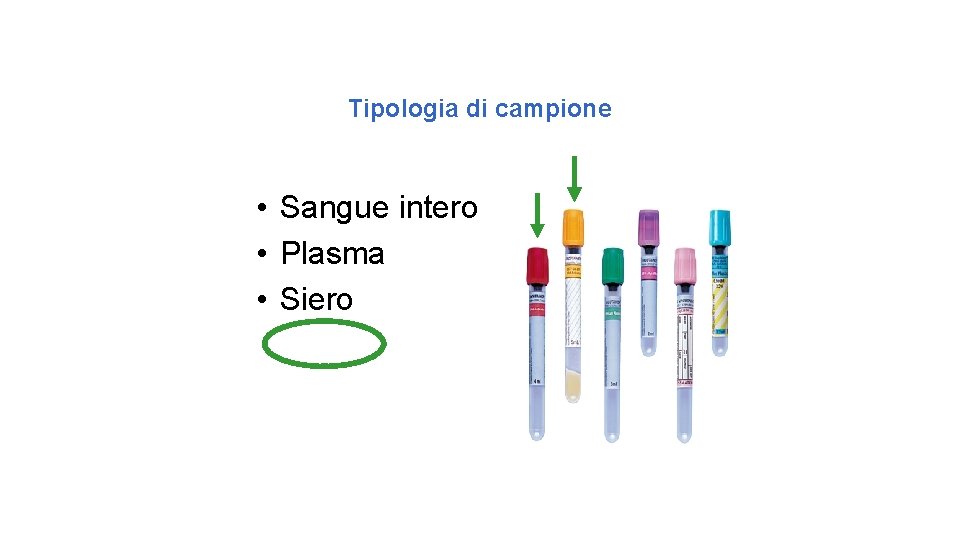
Tipologia di campione • Sangue intero • Plasma • Siero

Elettroforesi delle proteine • • Si definisce elettroforesi la migrazione di particelle dotate di carica elettrica attraverso un mezzo fluido e sotto l’influenza di un campo elettrico Studio delle macro molecole al fine di ottenere la loro separazione qualitativa e la loro analisi quantitativa Mobilità elettroforetica • Massa molecolare • Conformazione della proteina • Punto isoelettrico (p. I)

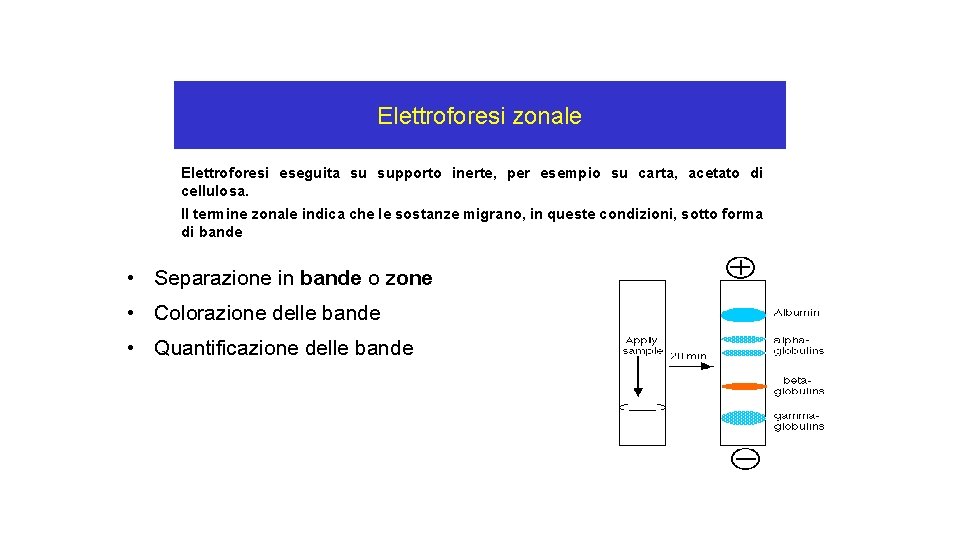
Elettroforesi zonale Elettroforesi eseguita su supporto inerte, per esempio su carta, acetato di cellulosa. Il termine zonale indica che le sostanze migrano, in queste condizioni, sotto forma di bande • Separazione in bande o zone • Colorazione delle bande • Quantificazione delle bande

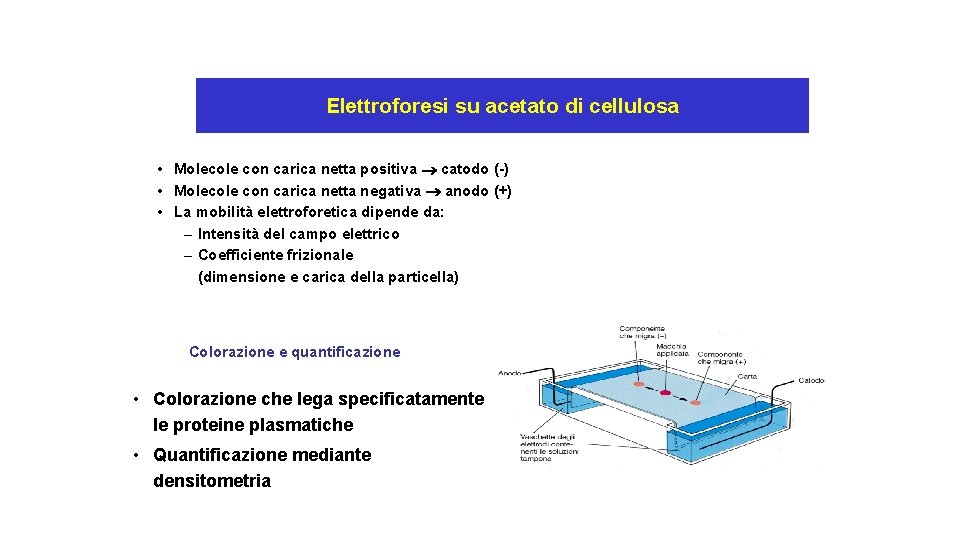
Acetato di cellulosa • • Non presenta fenomeni di adsorbimento Alto potere risolutivo Tempi brevi di esecuzione Tempi brevi di colorazione

Elettroforesi su acetato di cellulosa • Molecole con carica netta positiva catodo (-) • Molecole con carica netta negativa anodo (+) • La mobilità elettroforetica dipende da: – Intensità del campo elettrico – Coefficiente frizionale (dimensione e carica della particella) Colorazione e quantificazione • Colorazione che lega specificatamente le proteine plasmatiche • Quantificazione mediante densitometria

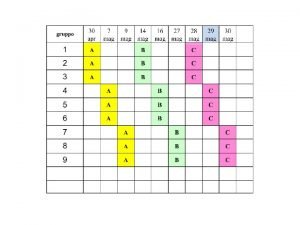
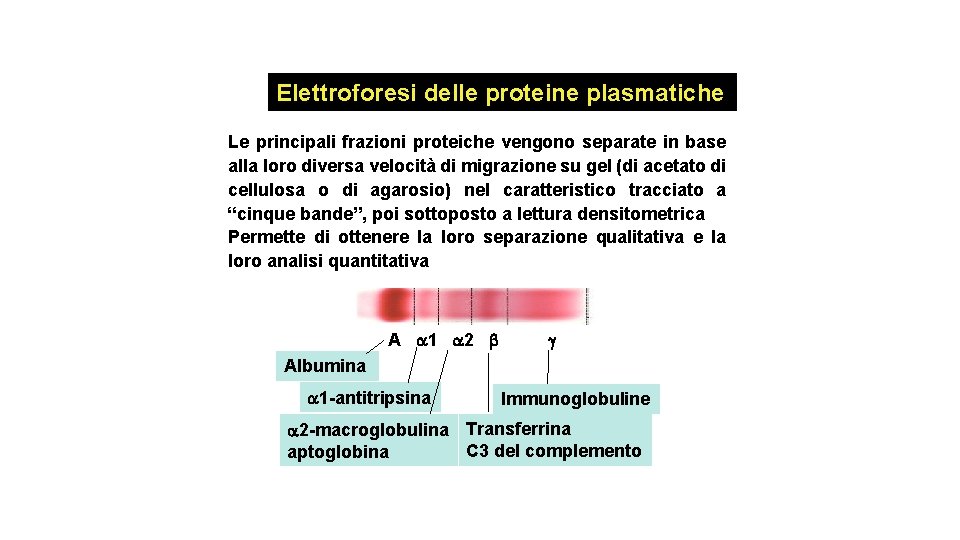
Elettroforesi delle proteine plasmatiche Le principali frazioni proteiche vengono separate in base alla loro diversa velocità di migrazione su gel (di acetato di cellulosa o di agarosio) nel caratteristico tracciato a “cinque bande”, poi sottoposto a lettura densitometrica Permette di ottenere la loro separazione qualitativa e la loro analisi quantitativa A 1 2 Albumina 1 -antitripsina Immunoglobuline 2 -macroglobulina Transferrina C 3 del complemento aptoglobina

I tracciati elettroforetici, una volta colorati, sono letti mediante il densitometro: le bande proteiche vengono trasformate in picchi di diversa altezza, a base larga o stretta a seconda della loro intensità di colorazione e della loro larghezza, che rispecchiano la quantità proporzionale delle diverse proteine contenute nel siero. Sul protidogramma normale si ritroveranno quindi diversi picchi e curve

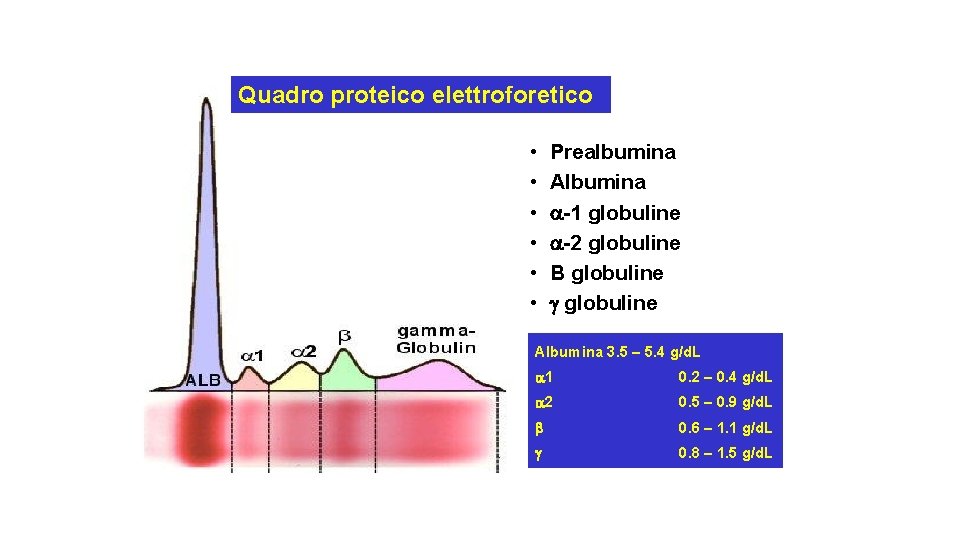
Quadro proteico elettroforetico • • • Prealbumina Albumina -1 globuline -2 globuline Β globuline Albumina 3. 5 – 5. 4 g/d. L 1 0. 2 – 0. 4 g/d. L 2 0. 5 – 0. 9 g/d. L 0. 6 – 1. 1 g/d. L 0. 8 – 1. 5 g/d. L

Tracciato elettroforetico normale 1. La banda “A” corrispondente all’albumina 2. La banda “ 1” corrispondente all’ 1 –antitripsina 3. La banda “ 2” costituita da due proteine: 2 -macroglobulina e l’aptoglobina 4. La banda “β” costituita nella parte anodica dalla transferrina e nella parte catodica dalla frazione C 3 del complemento 5. La banda “ ” rappresentata dalla maggior parte delle immunoglobuline anodo catodo

• Aumenti o diminuzioni in altezza o nel numero dei picchi del protidogramma sono quindi da mettere in relazione all’aumento o alla diminuzione patologica o fisiologica delle proteine che li compongono. • Più proteine si trovano in una banda, più alto sarà il rispettivo picco • l’altezza corrisponde grosso modo alla quantità totale di proteine appartenenti ad una categoria, ma se per esempio delle gamma globuline (immunoglobuline Ig. A, Ig. D, Ig. E, Ig. G, Ig. M) si vuole sapere la quantità di ognuna delle diverse classi, si dovrà ricorrere al dosaggio individuale.

Raccomandazioni • Per l’analisi sono raccomandati campioni freschi. • I sieri devono essere prelevati seguendo le procedure convenzionali per i test clinici di laboratorio. • I sieri vanno refrigerati (2 -8 ーC) e si possono conservare fino ad una settimana. • Se necessitano periodi di conservazione più lunghi mantenere i campioni congelati (fino ad un mese).

CAMPIONI DA EVITARE - Non utilizzare campioni di siero emolizzati L'emolisi causa un aumento delle zone alfa-2 e beta. Evitare campioni di plasma. Evitare campioni vecchi o mal conservati

Transtiretina o Prealbumina Definita cosi poichè ha una maggiore mobilità elettrodoretica rispetto all’albumina. Il termine transtiretina le fonisce un significato funzionale, dato che la proteina funge da trasportatore plasmatico di tiroxina e retinolo • • • 0. 2 -0. 4 g/L 2. 7% proteine totali Varia con l’età Trasporto aminoacidi, farmaci, ormoni, vitamine Marker stato nutrizionale (poichè ha una breve emivita (2 -3 giorni), è un marker ideale dello stato di nutrizione in quanto la sua sintesi non dipende dallo stato di salute del fegato, e poiché non risente dell'influenza dello stress e dell‘’infiammazione acuta). Diminuzione: denutrizione, patologie epato-biliari, stati infiammatori

Albumina Valori di riferimento: 3, 6 -4, 9 g/dl • È la proteina più abbondante della frazione sieroproteica • Viene sintetizzata e secreta dal fegato (rappresenta il 50% della produzione totale di proteine epatiche) • Tempo di persistenza: circa 20 giorni L’ipoalbuminemia è responsabile di ipoprotidemia, poiché costituisce da sola il 55 -64% delle proteine plasmatiche totali Le funzioni principali sono: • il mantenimento della pressione oncotica • Il trasporto di acidi grassi, bilirubina, ormoni e farmaci

Funzioni dell’albumina • L'albumina è una proteina del plasma e prodotta dal fegato con peso molecolare di 69000 daltons. • È contenuta anche nel latte, nell'albume dell'uovo, da cui il nome. • Essa costituisce circa il 60% di tutte le proteine del plasma; l'insieme di tutte le altre proteine plasmatiche viene chiamato globuline. • L'albumina è essenziale per la regolazione ed il mantenimento della pressione oncotica, ovvero la pressione osmotica necessaria per la corretta distribuzione dei liquidi corporei nei compartimenti intervascolari e nei tessuti • La molecola dell'albumina è carica negativamente, come la membrana glomerulare dei reni, la repulsione elettrostatica impedisce quindi il passaggio dell'albumina nell’urina. • Nelle sindromi nefritiche questa proprietà viene persa e quindi si nota la comparsa di albumina nelle urine del malato e per questo l’albumina è considerata un importante marcatore di disfunzioni renali che compaiono anche a distanza di anni

Funzioni dell’albumina • Contribuisce alla pressione oncotica plasmatica • La sua drastica diminuzione può determinare la formazione di un edema.

Le 4 cause principali che derminano abbassamento della concentrazione di albumina plasmatica….

1) Distribuzione anomala L’albumina può distribuirsi nello spazio interstiziale per effetto di un’aumentata permeabilità capillare, nella risposta alla fase acuta dell’infiammazione (in presenza di citochine infiammatorie, Tumor necrosis factor, interleuchine. . )

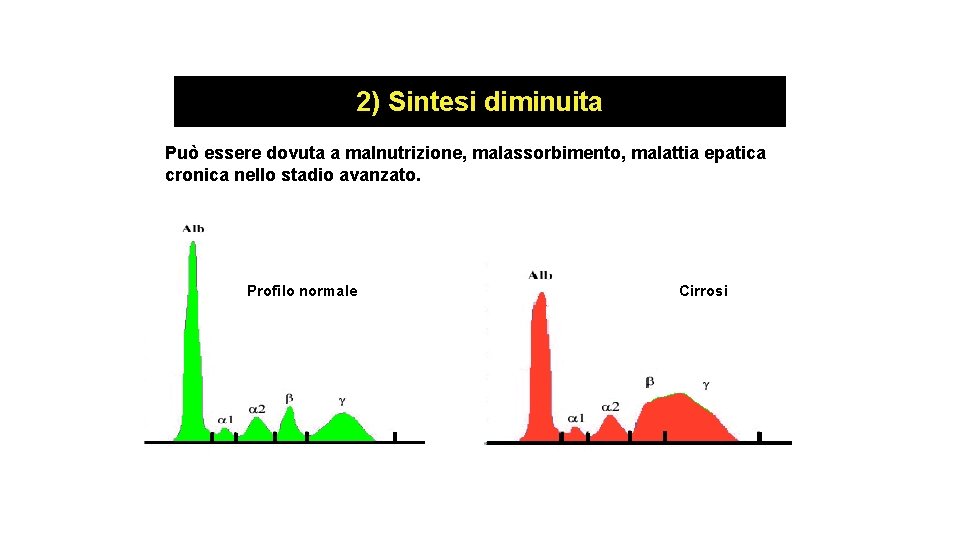
2) Sintesi diminuita Può essere dovuta a malnutrizione, malassorbimento, malattia epatica cronica nello stadio avanzato. Profilo normale Cirrosi

3) Diluizione Si può generare un’ipoalbuminemia per effetto di una sovraidratazione, Es. , in condizioni parafisiologiche come gravidanza e allattamento per effetto della ipervolemia

4) Escrezione anomala o degradazione Tra le cause principali ci sono la compromissione renale, ustioni, enteropatia con perdita di proteine, ferite, emorragia, stati catabolici.

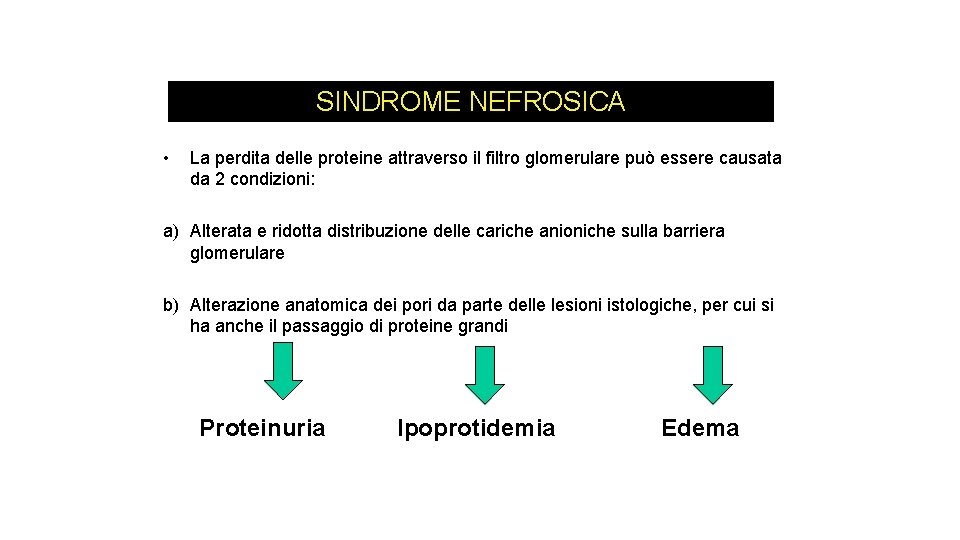
SINDROME NEFROSICA • La perdita delle proteine attraverso il filtro glomerulare può essere causata da 2 condizioni: a) Alterata e ridotta distribuzione delle cariche anioniche sulla barriera glomerulare b) Alterazione anatomica dei pori da parte delle lesioni istologiche, per cui si ha anche il passaggio di proteine grandi Proteinuria Ipoprotidemia Edema

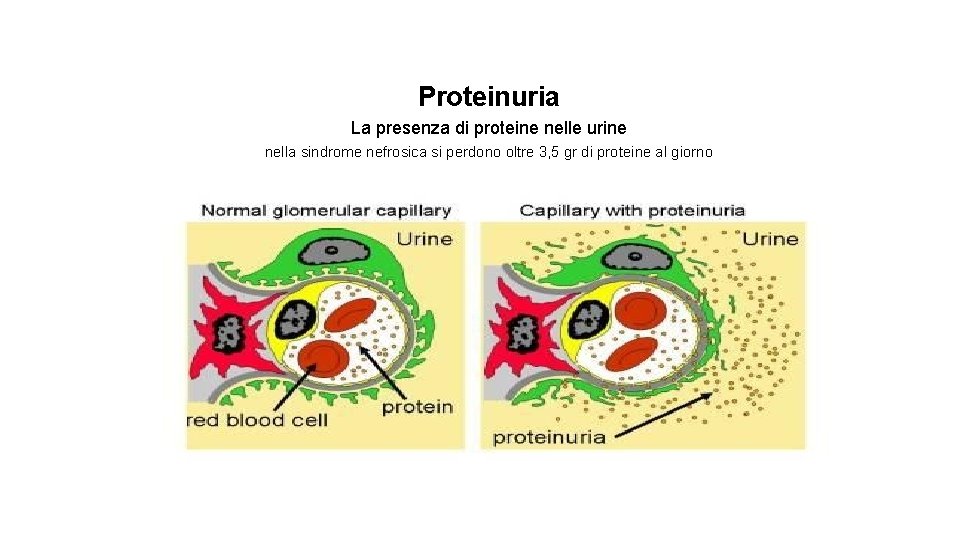
Proteinuria La presenza di proteine nelle urine nella sindrome nefrosica si perdono oltre 3, 5 gr di proteine al giorno

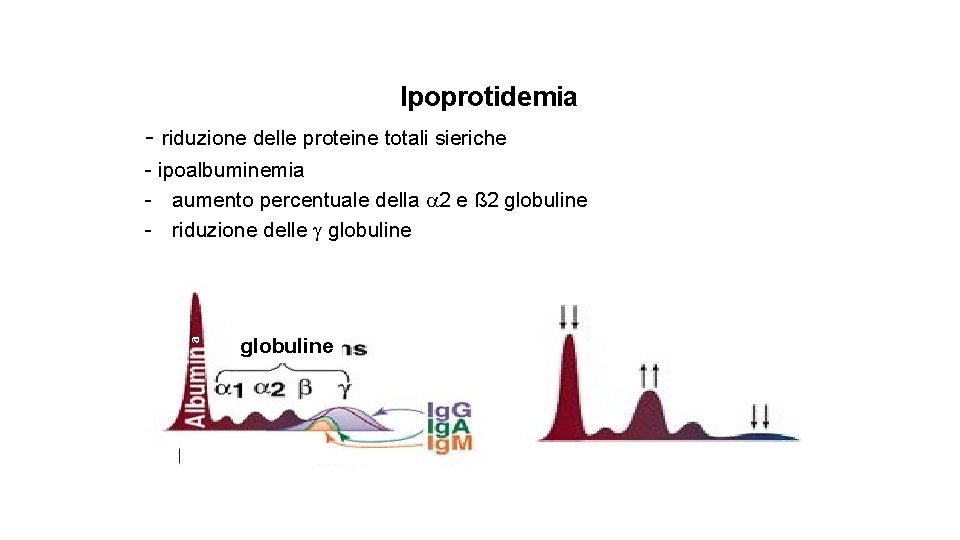
Ipoprotidemia - riduzione delle proteine totali sieriche a - ipoalbuminemia - aumento percentuale della 2 e ß 2 globuline - riduzione delle globuline

Edema La diminuzione della concentrazione di albumina dovuta alla ipoprotidemia, determina un ‘alterazione della pressione oncotica e una fuoriuscita di acqua verso gli spazi interstiziali determinando la formazione di un edema

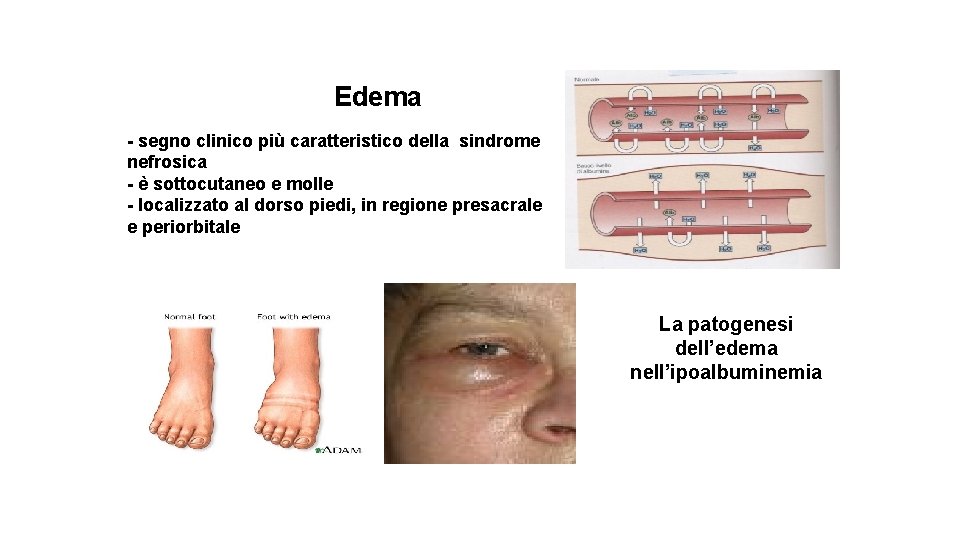
Edema - segno clinico più caratteristico della sindrome nefrosica - è sottocutaneo e molle - localizzato al dorso piedi, in regione presacrale e periorbitale La patogenesi dell’edema nell’ipoalbuminemia

Alfa 1 -globuline Valori di riferimento: 0, 2 -0, 4 g/dl Tale frazione elettroforetica esprime le proteine della fase acuta positive (α 1 -antitripsina, siero amiloide A, aptoglobina, α 1 -antichimotripsina, α 2 macroglobuline e ceruloplasmina) la cui produzione viene considerevolmente aumentata nel primo periodo dell’ infiammazione (soprattutto le alfa 1). Gravidanza Malattie infettive Malattie infiammatorie croniche Infarto del miocardio Neoplasie Carenza congenita di 1 -antitripsina Sclerodermia Sindrome nefrosica

1 antitripsina • • Banda -1 0. 8 -2. 0 g/L Glicoproteina Sintetizzata dal fegato Inibitore tripsina e plasmina Aumento: sindrome nefrosica, epatopatie terminali, pancreatiti acute, fase acuta dell’infiammazione Diminuzione: difetti congeniti, trattamento con steroidi anabolizzanti, estrogeni o gravidanza

Alfa 1 -fetoproteina Valori di riferimento: <5 mg/L • • Sintetizzata dal fegato È presente nei tessuti e nel plasma del feto, la sua concentrazione cala dopo la nascita in gravidanza Usata per il monitoraggio delle terapie anti-neoplastiche

Aumento di Alfa 1 -fetoproteina Nel liquido amniotico e nel siero materno: Anencefalia Spina bifida Epatocarcinoma Teratoma testicolare Diminuzione di Alfa 1 -fetoproteina Successo terapeutico antineoplastico Trisomia del cromosoma 21 (Sindrome di Down)

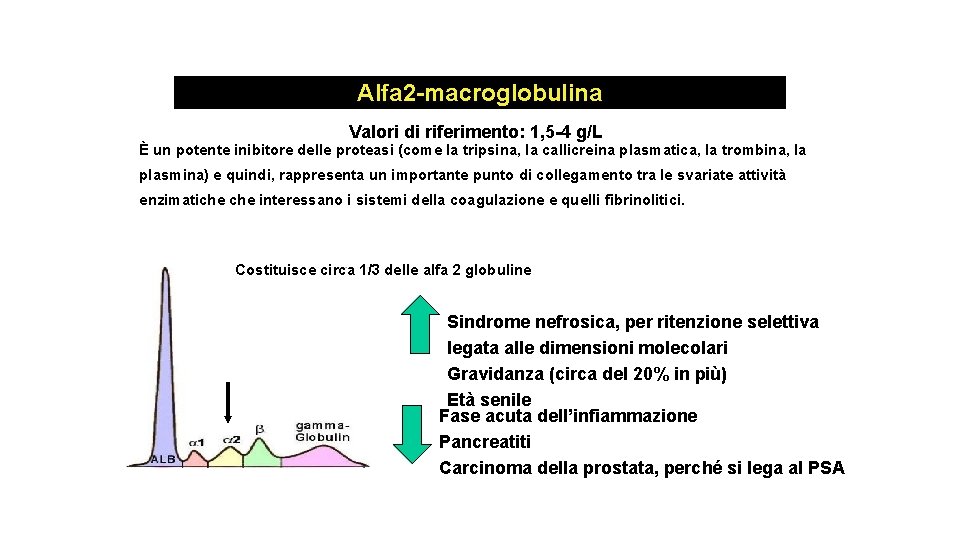
Alfa 2 -macroglobulina Valori di riferimento: 1, 5 -4 g/L È un potente inibitore delle proteasi (come la tripsina, la callicreina plasmatica, la trombina, la plasmina) e quindi, rappresenta un importante punto di collegamento tra le svariate attività enzimatiche interessano i sistemi della coagulazione e quelli fibrinolitici. Costituisce circa 1/3 delle alfa 2 globuline Sindrome nefrosica, per ritenzione selettiva legata alle dimensioni molecolari Gravidanza (circa del 20% in più) Età senile Fase acuta dell’infiammazione Pancreatiti Carcinoma della prostata, perché si lega al PSA

Aptoglobina • Banda -2 • 0. 4 -3. 2 g/L • Dimero dell’emoglobina libera • • Aumento: stati infiammatori Diminuzione: in caso di aumentato turnover dell’emoglobina

Ceruloplasmina Valori di riferimento: 0, 2 -0, 4 g/L È dotata di modesta attività ossidasica verso alcune sostanze di natura aminica e fenolica. Veicola il rame, legando fino a otto atomi di rame per molecola, controllandone l’omeostasi epatica. Gravidanza Assunzione di anticoncezionali Infezioni acute Neoplasie (leucemie) Morbo di Wilson

Beta-globuline Valori di riferimento: 0, 6 -1 g/dl Tale frazione elettroforetica esprime principalmente il comportamento della transferrina, C 3, proteina C reattiva, 2 -microglobulina, -lipoproteine, Ig Talora è possibile osservare uno sdoppiamento in frazioni 1 e 2 1: transferrina, complemento e Ig 2: microglobuline, lipoproteine e Ig. M Gravidanza Cirrosi epatica Sindrome nefrosica A-beta-lipoproteinemia congenita Atransferrinemia congenita Enteropatie essudative

Beta-globuline • Proteine della fase acuta infiammatoria positive: proteina C reattiva, transferrina, beta-lipoproteine. Un aumento delle beta globuline, se associato ad un aumento in zona alfa, è maggiormente significativo di un danno infiammatorio recente o tumorale. • Se associato ad un aumento delle gammaglobuline, è più significativo di un danno infiammatorio cronico, probabilmente di natura parassitaria, infettiva o immunomediata.

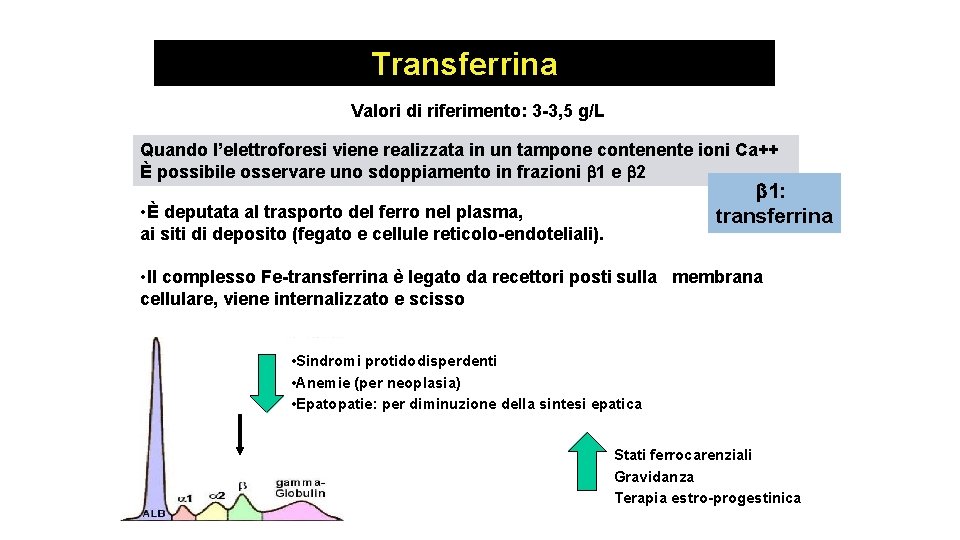
Transferrina Valori di riferimento: 3 -3, 5 g/L Quando l’elettroforesi viene realizzata in un tampone contenente ioni Ca++ È possibile osservare uno sdoppiamento in frazioni 1 e 2 1: transferrina • È deputata al trasporto del ferro nel plasma, ai siti di deposito (fegato e cellule reticolo-endoteliali). • Il complesso Fe-transferrina è legato da recettori posti sulla membrana cellulare, viene internalizzato e scisso • Sindromi protidodisperdenti • Anemie (per neoplasia) • Epatopatie: per diminuzione della sintesi epatica Stati ferrocarenziali Gravidanza Terapia estro-progestinica

β-2 -microglobulina • • Banda β-2 0. 002 g/L <1% nelle urine rispetto a quella plasmatica basso peso molecolare Aumento: insufficienza renale, infiammazione o neoplasia

Frazione C 3 del Complemento Valori di riferimento: 3 -3, 5 g/L Quando l’elettroforesi viene realizzata in un tampone contenente ioni Ca++ È possibile osservare uno sdoppiamento in frazioni 1 e 2 2: C 3 Con il termine di Complemento si comprendono un insieme di proteine, alcune delle quali con attività enzimatica, che insieme agli Anticorpi svolgono un ruolo di primaria importanza nei meccanismi di difesa dell’immunità umorale. Malattie autoimmuni Anemia emolitica, perché si determina consumo del complemento Epatiti Blocco del suo catabolismo in cirrosi biliare primitiva, Fase acuta (dopo 5 -6 giorni)

• Il complemento è costituito da una ventina di proteine circolanti capaci di interagire con le membrane biologiche e con specifici recettori situati sulla superficie di diversi tipi cellulari, hanno la capacità di opsonizzare i patogeni e di indurre una serie di reazioni infiammatorie che aiutano a combattere le infezioni.

Proteina C-reattiva • • • Banda <0. 005 g/L In condizioni normali è assente Monitoraggio infiammazione acuta Aumenta dopo circa 2 ore dallo stimolo infiammatorio fino a raggiungere un picco massimo alle 48 ore

Gamma-globuline Valori di riferimento: 0, 9 -1, 4 g/dl • Comprendono le Immunoglobiline (G, M, A, D, E) • È un gruppo di proteine eterogenee che migrano principalmente nella zona • Costituiscono gli anticorpi umorali in grado di facilitare la distruzione degli antigeni estranei all’organismo da parte del sistema immunitario • Sono sintetizzate e secrete dalle plasmacellule (derivanti dai linfo B) • Poichè la frazione Ig. G, in condizioni normali, è prevalente sulle altre, la banda delle globuline è rappresentata soprattutto dalle Ig. G

Gamma-globuline Valori di riferimento: 0, 9 -1, 4 g/dl Diagnosi differenziale: un aumento delle -globuline può essere distinto nei quadri della gammopatia policlonale o monoclonale Policlonale: con aumento di molte classi di immunoglobuline Epatopatie croniche (epatite cronica, cirrosi epatica) Infezioni congenite Infezioni batteriche acute e croniche Parassitosi Monoclonale: con aumento di un unico tipo di immunoglobulina Malnutrizione Ustioni Terapia immunosoppressiva Sindrome nefrosica

Gammapatia policlonale La stimolazione di numerosi cloni di plasmacellule da parte di antigeni o virus epatotropi induce l’incremento di diverse classi di Immunoglobuline All’elettroforesi le gammapatie policlonali sono caratterizzate da un incremento diffuso ed eterogeneo della frazione a In alcuni casi nelle malattie infettive si può avere aumento isolato di una classe di immunoglobuline, che non è diagnostico ma può contribuire alla diagnosi differenziale globuline Ig. M: fase precoce di infezione Ig. G: contatto con un antigene già noto Ig. A: danno epatico (alcool, contraccettivi orali)

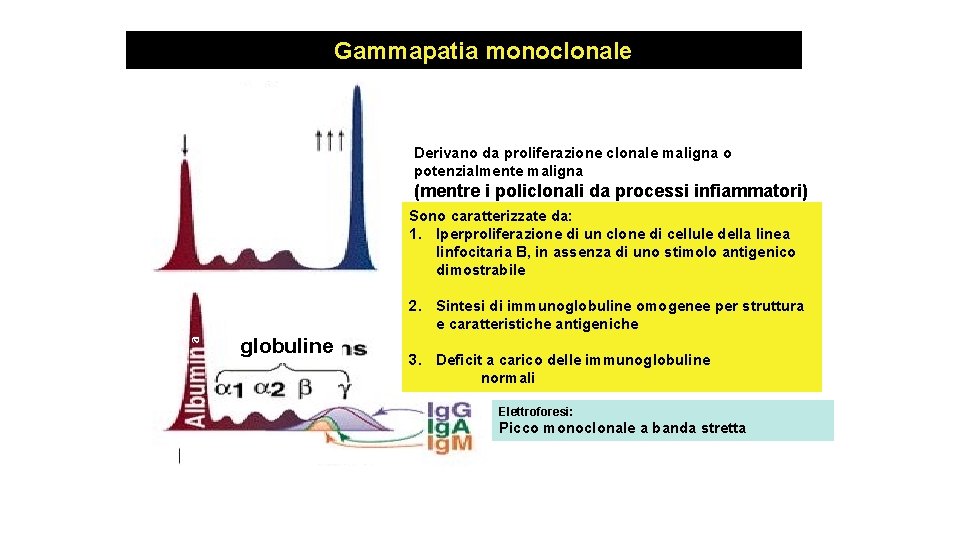
Gammapatia monoclonale Derivano da proliferazione clonale maligna o potenzialmente maligna (mentre i policlonali da processi infiammatori) Sono caratterizzate da: 1. Iperproliferazione di un clone di cellule della linea linfocitaria B, in assenza di uno stimolo antigenico dimostrabile a 2. Sintesi di immunoglobuline omogenee per struttura e caratteristiche antigeniche globuline 3. Deficit a carico delle immunoglobuline normali Elettroforesi: Picco monoclonale a banda stretta

Ipogammaglobulinemia La concentrazione delle immunoglobuline aumenta progressivamente fin dalla nascita. La diminuzione della sintesi di immunoglobuline è clinicamente associata ad una ridotta resistenza alle infezioni. Si distinguono deficit immunitari: • primitivi (globali o parziali) a • secondari (a infezioni, neoplasie, trattamento con farmaci, …) globuline Elettroforesi: È facilmente riconoscibile quando riguarda le tre classi; il contrario se l’immunodeficienza è selettiva È quindi necessario integrare con altri esami, es: conteggio e classificazione in sottopopolazioni dei linfociti circolanti
 Outcome funzionale
Outcome funzionale Colloquio clinico piaget
Colloquio clinico piaget Caso clinico asma bronquial
Caso clinico asma bronquial Escala de sedacion agitacion sas
Escala de sedacion agitacion sas Ejemplos de salud pública
Ejemplos de salud pública Tiempo lavado de manos clinico
Tiempo lavado de manos clinico Rischio clinico slide
Rischio clinico slide Conclusiones de un caso clinico
Conclusiones de un caso clinico Caso clinico
Caso clinico Criterios de centor pdf
Criterios de centor pdf Sbim unimi
Sbim unimi Lavado de manos clinico
Lavado de manos clinico 5 tipi di recurvatum
5 tipi di recurvatum Caso clínico
Caso clínico Modelo fenomenológico psicología
Modelo fenomenológico psicología Objetivos de un laboratorio clínico
Objetivos de un laboratorio clínico Intramuscolo ventroglutea
Intramuscolo ventroglutea Insuficiencia cardiaca clasificacion nyha
Insuficiencia cardiaca clasificacion nyha Hirsutismo
Hirsutismo Examen fisico caso clinico
Examen fisico caso clinico Caso clinico espondilitis anquilosante
Caso clinico espondilitis anquilosante Termometro clinico portata e sensibilità
Termometro clinico portata e sensibilità Quadro clínico
Quadro clínico Discusion en metodologia
Discusion en metodologia Brainly
Brainly Caso clinico de neumonia
Caso clinico de neumonia Analisis clinico
Analisis clinico Etapas del metodo clinico
Etapas del metodo clinico Organigrama de un laboratorio clínico
Organigrama de un laboratorio clínico Clinico anatomical hypothesis
Clinico anatomical hypothesis Estratgias
Estratgias Hiperplasia adrenal congênita não clássica
Hiperplasia adrenal congênita não clássica Caso clinico veterinario
Caso clinico veterinario Expediente clinico integral chihuahua
Expediente clinico integral chihuahua Neumotorax a tension
Neumotorax a tension Root cause analysis slide
Root cause analysis slide Otanr
Otanr Caso clinico
Caso clinico Fasi del rischio clinico
Fasi del rischio clinico Desecho de residuos biologicos
Desecho de residuos biologicos Preparacion del entorno clinico
Preparacion del entorno clinico Caso clinico pancreatite aguda
Caso clinico pancreatite aguda Che scopo ha il testo poetico
Che scopo ha il testo poetico Io tu lui lei noi voi loro essere
Io tu lui lei noi voi loro essere Passato prossimo regolare
Passato prossimo regolare Racconto sulle api scuola primaria
Racconto sulle api scuola primaria Falso doppio prodotto
Falso doppio prodotto Wacana eksposisi yaiku wacana kang nyritakake …
Wacana eksposisi yaiku wacana kang nyritakake … Le tre forme di governo e la loro degenerazione
Le tre forme di governo e la loro degenerazione Loro doznaka
Loro doznaka Unggah-ungguh basa yaiku
Unggah-ungguh basa yaiku Gli acquisti e il loro regolamento
Gli acquisti e il loro regolamento Cosa sono i principi nutritivi
Cosa sono i principi nutritivi Io tu lei lui noi voi loro
Io tu lei lui noi voi loro Prodotti notevoli definizione
Prodotti notevoli definizione Rampunge cerkak manggon ana ing
Rampunge cerkak manggon ana ing El loro tico tango
El loro tico tango Sarung tenun
Sarung tenun Una figura equivalente
Una figura equivalente Tre fari sono visibili dal lungomare
Tre fari sono visibili dal lungomare Nostro vostro and loro accounts
Nostro vostro and loro accounts Impatto
Impatto Nuove risorse digitali e loro impatto sulla didattica
Nuove risorse digitali e loro impatto sulla didattica Voi stessi date loro da mangiare
Voi stessi date loro da mangiare Loro sono generoso
Loro sono generoso Proteine del latte
Proteine del latte Proteine aa
Proteine aa Neutrisol
Neutrisol Matricea extracelulara
Matricea extracelulara Proteine funzioni
Proteine funzioni Proteine del latte
Proteine del latte Percorso benessere herbalife
Percorso benessere herbalife Protenler
Protenler Denaturazione proteine
Denaturazione proteine Post translasyonel modifikasyonlar
Post translasyonel modifikasyonlar Proteina definitie
Proteina definitie Mhc proteine
Mhc proteine Aliphatische aminosäuren
Aliphatische aminosäuren Proteine del latte
Proteine del latte Proteine intrinseche
Proteine intrinseche Sensibilità alle proteine del latte
Sensibilità alle proteine del latte Proteine intrinseche
Proteine intrinseche Struttura terziaria proteine
Struttura terziaria proteine Scienze
Scienze Mioglobina struttura secondaria
Mioglobina struttura secondaria Permeabilità intestinale
Permeabilità intestinale Biureto proteine esperimento
Biureto proteine esperimento Ictrento5
Ictrento5 Ciaperonine
Ciaperonine Proteine dna
Proteine dna Proteine sr splicing
Proteine sr splicing