Tolleranza centrale e periferica agli antigeni self I
- Slides: 9

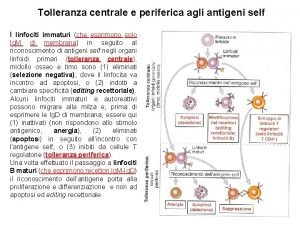
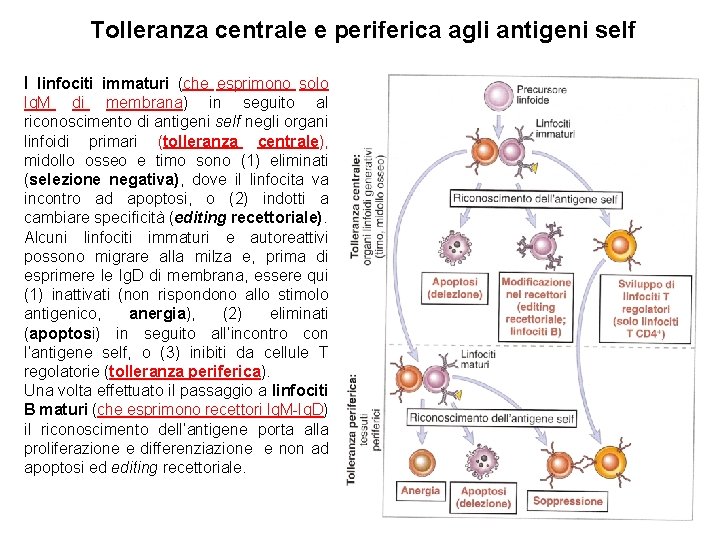
Tolleranza centrale e periferica agli antigeni self I linfociti immaturi (che esprimono solo Ig. M di membrana) in seguito al riconoscimento di antigeni self negli organi linfoidi primari (tolleranza centrale), midollo osseo e timo sono (1) eliminati (selezione negativa), dove il linfocita va incontro ad apoptosi, o (2) indotti a cambiare specificità (editing recettoriale). Alcuni linfociti immaturi e autoreattivi possono migrare alla milza e, prima di esprimere le Ig. D di membrana, essere qui (1) inattivati (non rispondono allo stimolo antigenico, anergia), (2) eliminati (apoptosi) in seguito all’incontro con l’antigene self, o (3) inibiti da cellule T regolatorie (tolleranza periferica). Una volta effettuato il passaggio a linfociti B maturi (che esprimono recettori Ig. M-Ig. D) il riconoscimento dell’antigene porta alla proliferazione e differenziazione e non ad apoptosi ed editing recettoriale.

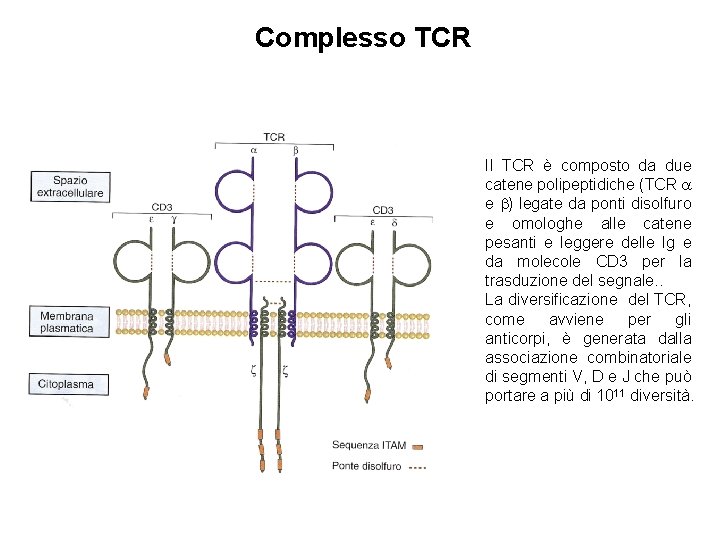
Complesso TCR Il TCR è composto da due catene polipeptidiche (TCR e ) legate da ponti disolfuro e omologhe alle catene pesanti e leggere delle Ig e da molecole CD 3 per la trasduzione del segnale. . La diversificazione del TCR, come avviene per gli anticorpi, è generata dalla associazione combinatoriale di segmenti V, D e J che può portare a più di 1011 diversità.

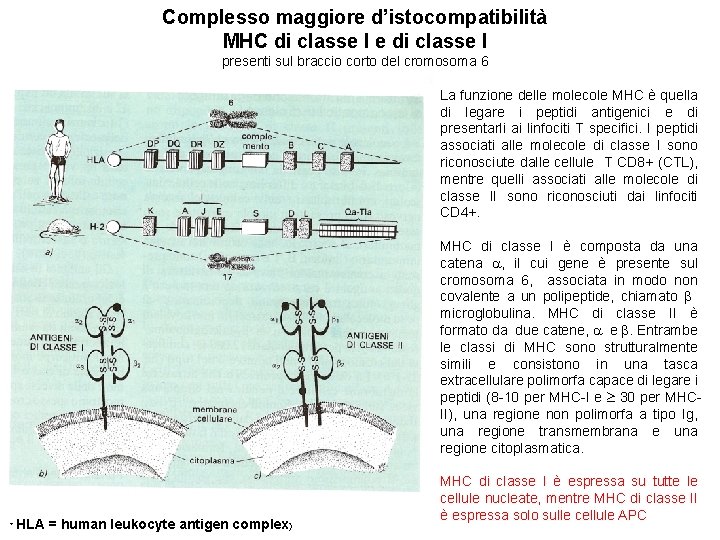
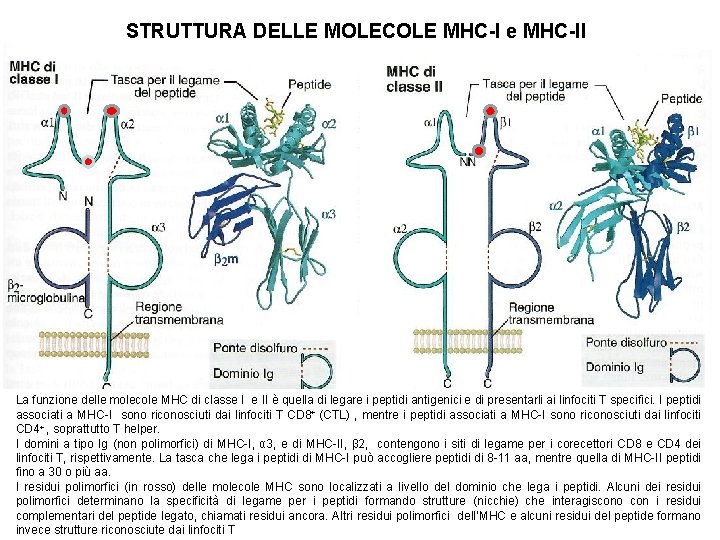
Complesso maggiore d’istocompatibilità MHC di classe I e di classe I presenti sul braccio corto del cromosoma 6 La funzione delle molecole MHC è quella di legare i peptidi antigenici e di presentarli ai linfociti T specifici. I peptidi associati alle molecole di classe I sono riconosciute dalle cellule T CD 8+ (CTL), mentre quelli associati alle molecole di classe II sono riconosciuti dai linfociti CD 4+. MHC di classe I è composta da una catena , il cui gene è presente sul cromosoma 6, associata in modo non covalente a un polipeptide, chiamato microglobulina. MHC di classe II è formato da due catene, e . Entrambe le classi di MHC sono strutturalmente simili e consistono in una tasca extracellulare polimorfa capace di legare i peptidi (8 -10 per MHC-I e 30 per MHCII), una regione non polimorfa a tipo Ig, una regione transmembrana e una regione citoplasmatica. * HLA = human leukocyte antigen complex) MHC di classe I è espressa su tutte le cellule nucleate, mentre MHC di classe II è espressa solo sulle cellule APC

STRUTTURA DELLE MOLECOLE MHC-I e MHC-II La funzione delle molecole MHC di classe I e II è quella di legare i peptidi antigenici e di presentarli ai linfociti T specifici. I peptidi associati a MHC-I sono riconosciuti dai linfociti T CD 8+ (CTL) , mentre i peptidi associati a MHC-I sono riconosciuti dai linfociti CD 4+ , soprattutto T helper. I domini a tipo Ig (non polimorfici) di MHC-I, α 3, e di MHC-II, β 2, contengono i siti di legame per i corecettori CD 8 e CD 4 dei linfociti T, rispettivamente. La tasca che lega i peptidi di MHC-I può accogliere peptidi di 8 -11 aa, mentre quella di MHC-II peptidi fino a 30 o più aa. I residui polimorfici (in rosso) delle molecole MHC sono localizzati a livello del dominio che lega i peptidi. Alcuni dei residui polimorfici determinano la specificità di legame per i peptidi formando strutture (nicchie) che interagiscono con i residui complementari del peptide legato, chiamati residui ancora. Altri residui polimorfici dell’MHC e alcuni residui del peptide formano invece strutture riconosciute dai linfociti T

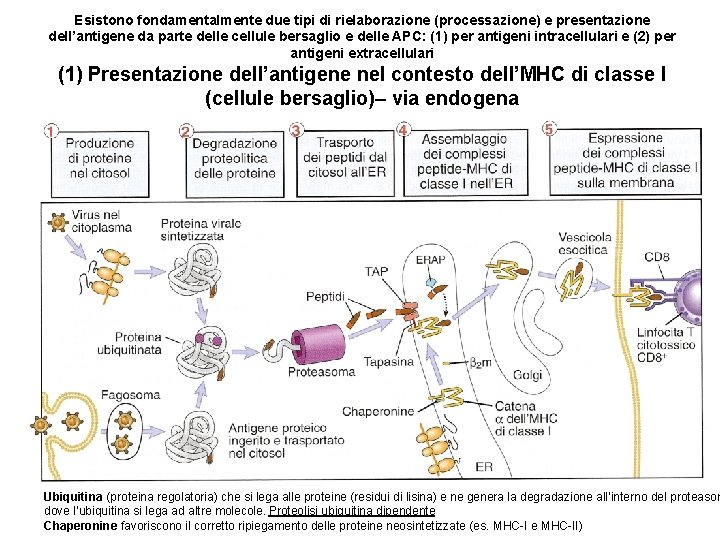
Esistono fondamentalmente due tipi di rielaborazione (processazione) e presentazione dell’antigene da parte delle cellule bersaglio e delle APC: (1) per antigeni intracellulari e (2) per antigeni extracellulari (1) Presentazione dell’antigene nel contesto dell’MHC di classe I (cellule bersaglio)– via endogena Ubiquitina (proteina regolatoria) che si lega alle proteine (residui di lisina) e ne genera la degradazione all’interno del proteasom dove l’ubiquitina si lega ad altre molecole. Proteolisi ubiquitina dipendente Chaperonine favoriscono il corretto ripiegamento delle proteine neosintetizzate (es. MHC-I e MHC-II)

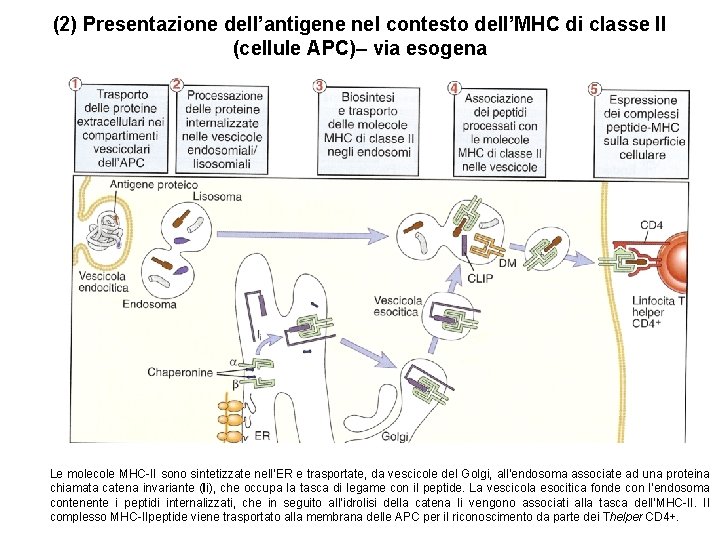
(2) Presentazione dell’antigene nel contesto dell’MHC di classe II (cellule APC)– via esogena Le molecole MHC-II sono sintetizzate nell’ER e trasportate, da vescicole del Golgi, all’endosoma associate ad una proteina chiamata catena invariante (Ii), che occupa la tasca di legame con il peptide. La vescicola esocitica fonde con l’endosoma contenente i peptidi internalizzati, che in seguito all’idrolisi della catena Ii vengono associati alla tasca dell’MHC-II. Il complesso MHC-IIpeptide viene trasportato alla membrana delle APC per il riconoscimento da parte dei Thelper CD 4+.

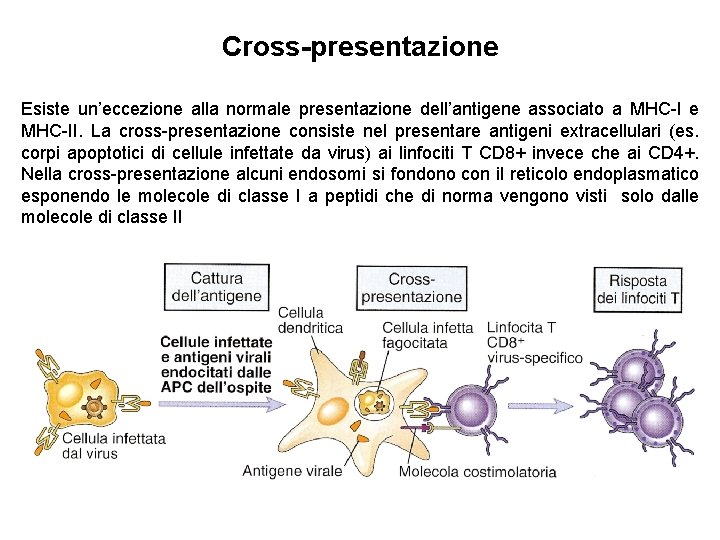
Cross-presentazione Esiste un’eccezione alla normale presentazione dell’antigene associato a MHC-I e MHC-II. La cross-presentazione consiste nel presentare antigeni extracellulari (es. corpi apoptotici di cellule infettate da virus) ai linfociti T CD 8+ invece che ai CD 4+. Nella cross-presentazione alcuni endosomi si fondono con il reticolo endoplasmatico esponendo le molecole di classe I a peptidi che di norma vengono visti solo dalle molecole di classe II

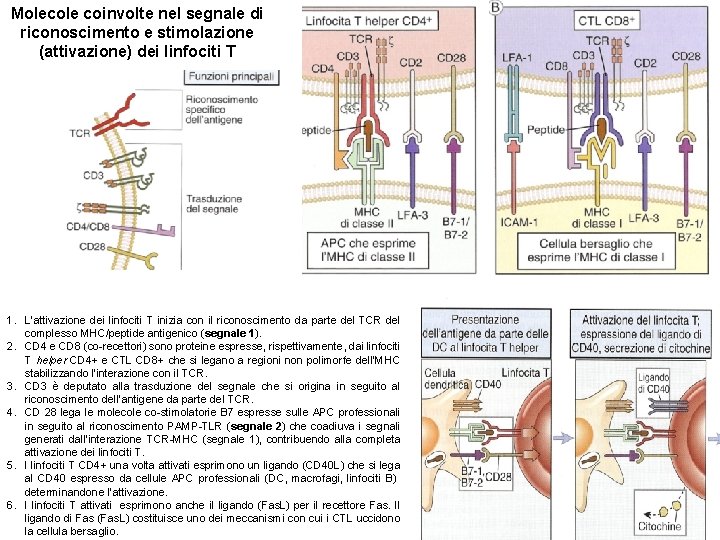
Molecole coinvolte nel segnale di riconoscimento e stimolazione (attivazione) dei linfociti T 1. L’attivazione dei linfociti T inizia con il riconoscimento da parte del TCR del complesso MHC/peptide antigenico (segnale 1). 2. CD 4 e CD 8 (co-recettori) sono proteine espresse, rispettivamente, dai linfociti T helper CD 4+ e CTL CD 8+ che si legano a regioni non polimorfe dell’MHC stabilizzando l’interazione con il TCR. 3. CD 3 è deputato alla trasduzione del segnale che si origina in seguito al riconoscimento dell’antigene da parte del TCR. 4. CD 28 lega le molecole co-stimolatorie B 7 espresse sulle APC professionali in seguito al riconoscimento PAMP-TLR (segnale 2) che coadiuva i segnali generati dall’interazione TCR-MHC (segnale 1), contribuendo alla completa attivazione dei linfociti T. 5. I linfociti T CD 4+ una volta attivati esprimono un ligando (CD 40 L) che si lega al CD 40 espresso da cellule APC professionali (DC, macrofagi, linfociti B) determinandone l’attivazione. 6. I linfociti T attivati esprimono anche il ligando (Fas. L) per il recettore Fas. Il ligando di Fas (Fas. L) costituisce uno dei meccanismi con cui i CTL uccidono la cellula bersaglio.

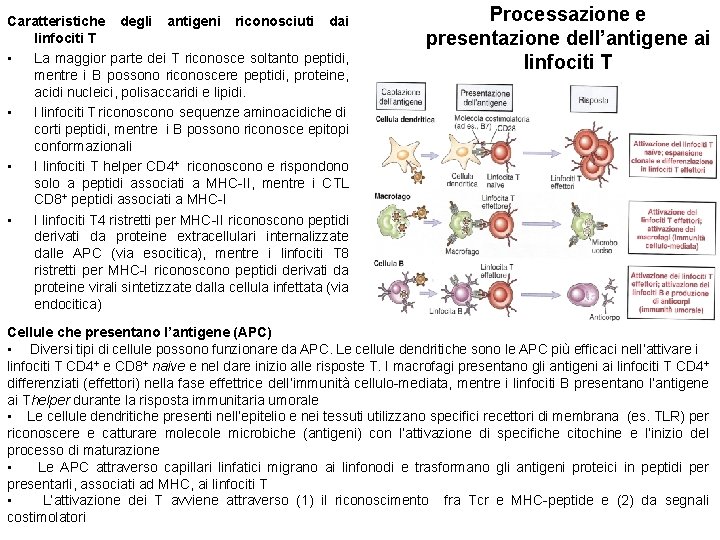
Caratteristiche degli antigeni riconosciuti dai linfociti T • La maggior parte dei T riconosce soltanto peptidi, mentre i B possono riconoscere peptidi, proteine, acidi nucleici, polisaccaridi e lipidi. • I linfociti T riconoscono sequenze aminoacidiche di corti peptidi, mentre i B possono riconosce epitopi conformazionali • I linfociti T helper CD 4+ riconoscono e rispondono solo a peptidi associati a MHC-II, mentre i CTL CD 8+ peptidi associati a MHC-I • I linfociti T 4 ristretti per MHC-II riconoscono peptidi derivati da proteine extracellulari internalizzate dalle APC (via esocitica), mentre i linfociti T 8 ristretti per MHC-I riconoscono peptidi derivati da proteine virali sintetizzate dalla cellula infettata (via endocitica) Processazione e presentazione dell’antigene ai linfociti T Cellule che presentano l’antigene (APC) • Diversi tipi di cellule possono funzionare da APC. Le cellule dendritiche sono le APC più efficaci nell’attivare i linfociti T CD 4+ e CD 8+ naive e nel dare inizio alle risposte T. I macrofagi presentano gli antigeni ai linfociti T CD 4+ differenziati (effettori) nella fase effettrice dell’immunità cellulo-mediata, mentre i linfociti B presentano l’antigene ai Thelper durante la risposta immunitaria umorale • Le cellule dendritiche presenti nell’epitelio e nei tessuti utilizzano specifici recettori di membrana (es. TLR) per riconoscere e catturare molecole microbiche (antigeni) con l’attivazione di specifiche citochine e l’inizio del processo di maturazione • Le APC attraverso capillari linfatici migrano ai linfonodi e trasformano gli antigeni proteici in peptidi per presentarli, associati ad MHC, ai linfociti T • L’attivazione dei T avviene attraverso (1) il riconoscimento fra Tcr e MHC-peptide e (2) da segnali costimolatori