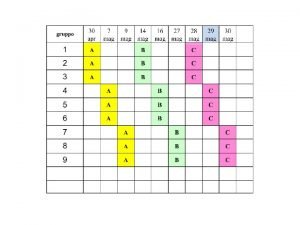
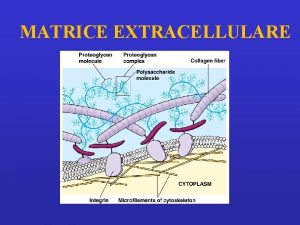
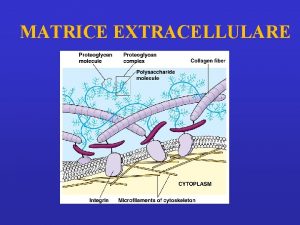
Studio proteine proteine extracellulari cellulari PROTEINE EXTRACELLULARI Matrice




- Slides: 11

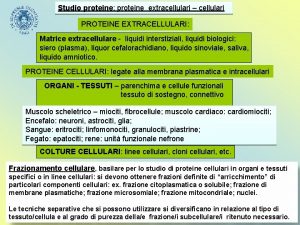
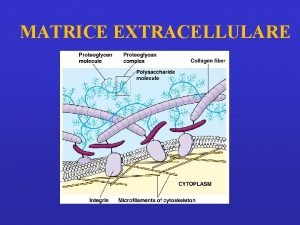
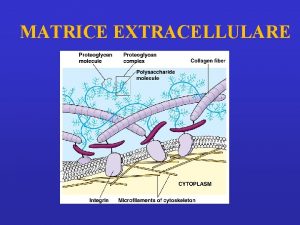
Studio proteine: proteine extracellulari – cellulari PROTEINE EXTRACELLULARI: Matrice extracellulare - liquidi interstiziali, liquidi biologici: siero (plasma), liquor cefalorachidiano, liquido sinoviale, saliva, liquido amniotico. PROTEINE CELLULARI: legate alla membrana plasmatica e intracellulari ORGANI - TESSUTI – parenchima e cellule funzionali tessuto di sostegno, connettivo Muscolo scheletrico – miociti, fibrocellule; muscolo cardiaco: cardiomiociti; Encefalo: neuroni, astrociti, glia; Sangue: eritrociti; linfomonociti, granulociti, piastrine; Fegato: epatociti; rene: unità funzionale nefrone COLTURE CELLULARI: linee cellulari, cloni cellulari, etc. Frazionamento cellulare, basilare per lo studio di proteine cellulari in organi e tessuti specifici o in linee cellulari: si devono ottenere frazioni definite di “arricchimento” di particolari componenti cellulari: ex. frazione citoplasmatica o solubile; frazione di membrane plasmatiche; frazione microsomiale; frazione mitocondriale; nuclei. Le tecniche separative che si possono utilizzare si diversificano in relazione al tipo di tessuto/cellula e al grado di purezza della/e frazione/i subcellulare/i ritenuto necessario.

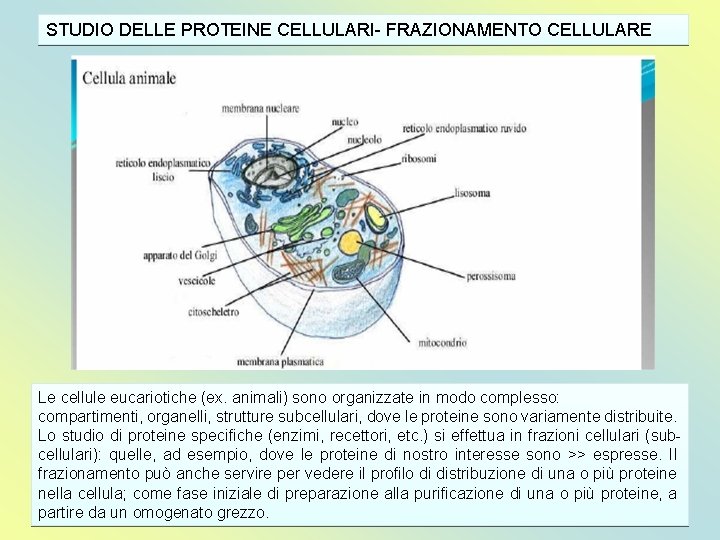
STUDIO DELLE PROTEINE CELLULARI- FRAZIONAMENTO CELLULARE Le cellule eucariotiche (ex. animali) sono organizzate in modo complesso: compartimenti, organelli, strutture subcellulari, dove le proteine sono variamente distribuite. Lo studio di proteine specifiche (enzimi, recettori, etc. ) si effettua in frazioni cellulari (subcellulari): quelle, ad esempio, dove le proteine di nostro interesse sono >> espresse. Il frazionamento può anche servire per vedere il profilo di distribuzione di una o più proteine nella cellula; come fase iniziale di preparazione alla purificazione di una o più proteine, a partire da un omogenato grezzo.

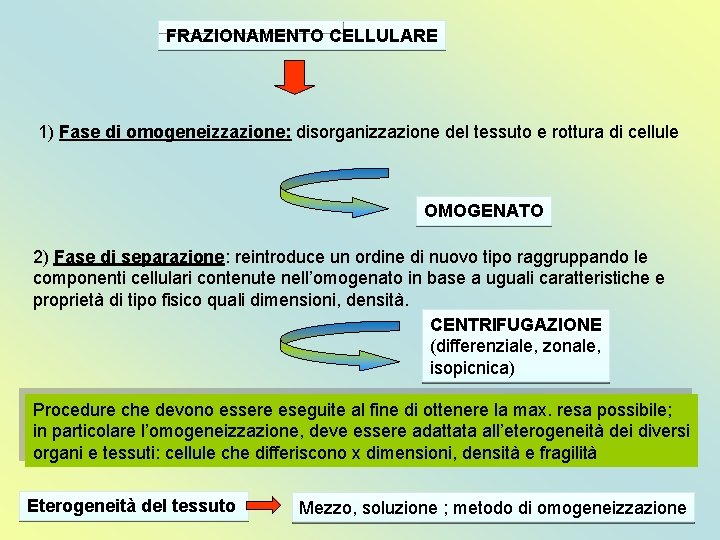
FRAZIONAMENTO CELLULARE 1) Fase di omogeneizzazione: disorganizzazione del tessuto e rottura di cellule OMOGENATO 2) Fase di separazione: reintroduce un ordine di nuovo tipo raggruppando le componenti cellulari contenute nell’omogenato in base a uguali caratteristiche e proprietà di tipo fisico quali dimensioni, densità. CENTRIFUGAZIONE (differenziale, zonale, isopicnica) Procedure che devono essere eseguite al fine di ottenere la max. resa possibile; in particolare l’omogeneizzazione, deve essere adattata all’eterogeneità dei diversi organi e tessuti: cellule che differiscono x dimensioni, densità e fragilità Eterogeneità del tessuto Mezzo, soluzione ; metodo di omogeneizzazione

(Blendor) Ultraturrax; Potter-Dounce manuale; Potter. Elvejham-elettr. Sonicazione: onde sonore alta freq. (x omogenati di colture batteriche) L’omogeneizzazione avviene in tampone solitamente ipotonico e a p. H fisiologico; il tampone ipotonico facilita la rottura delle cellule; si cerca tuttavia di mantenere condizioni in vitro non troppo drastiche: non deve essere alterata la struttura delle proteine che vogliamo studiare

Condizioni opportune per l’omogeneizzazione di tessuti e cellule: Se eseguiamo il frazionamento cellulare per studiare la funzione di una o più proteine, dobbiamo ottenere, alla fine della procedura, una buona resa di queste(a) proteine(a). Per ogni tessuto, organo, tipo di frazione cellulare e proteine in studio esistono procedure e protocolli adattati e variabili al fine di ottenere risultati il più possibile ottimizzati. Calore, p. H estremi, solventi organici, detergenti: possono provocare denaturazione delle proteine Temperatura: si opera in ghiaccio- 4°C – non si devono denaturare le proteine; a basse temperature si bloccano anche attività enzimatiche proteolitiche e digestive che si trovano in lisosomi e perossisomi e si possono liberare durante la lisi – inibitori di proteasi. Composizione salina bilanciata e adattata, ipotonica per provocare rottura delle membrane. p. H fisiologico, 7 -7. 4 – media che sono tamponi – uso di detergenti per solubilizzare proteine. Tamponi: impediscono cambiamenti del p. H fisiologico x aggiunta di acidi o basi – acido o base deboli + loro sale ottenuto da base e acido forte. Tamponi fosfato, Tris-HCl, Hepes-Na. OH, a varie conc. 5 -100 m. M vs. conc. salina isotonica ≈120 m. M Na. Cl.

Velocità di sedimentazione di particelle in soluzione per centrifugazione Tra le numerose applicazioni della centrifugazione vi è la separazione di particelle (cellule, organelli, frazioni sub-cellulari, macromolecole)- preparativa o analitica. -La velocità di sedimentazione V incrementa proporz al quadrato del raggio particella (rp 2) - La velocità di sedimentazione V aumenta. proporz. alla diff. tra densità particella e densità del mezzo -La V sed. incrementa con l’incremento del campo di centrifugazione = 2 r -- La V sed. diminuisce all’aumento della viscosità del mezzo ( ) e di f/f 0 = rapporto di attrito

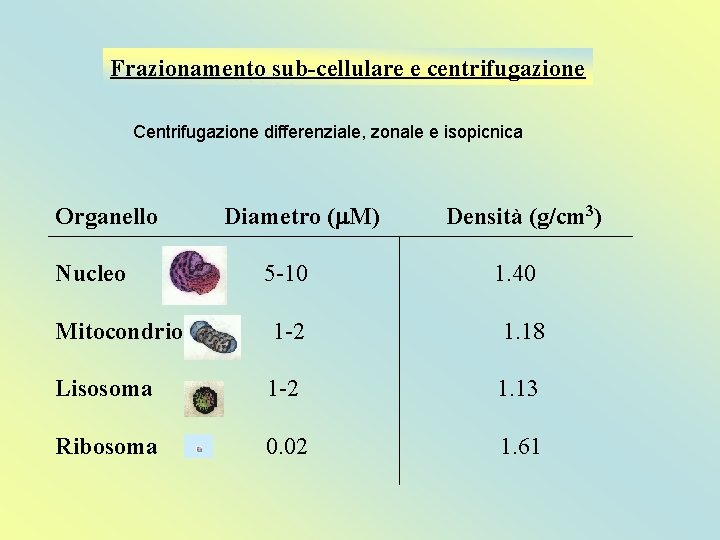
Frazionamento sub-cellulare e centrifugazione Centrifugazione differenziale, zonale e isopicnica Organello Nucleo Diametro (m. M) 5 -10 Densità (g/cm 3) 1. 40 Mitocondrio 1 -2 1. 18 Lisosoma 1 -2 1. 13 Ribosoma 0. 02 1. 61

Rotori swing-out – a braccio oscillante Rotori ad angolo fisso

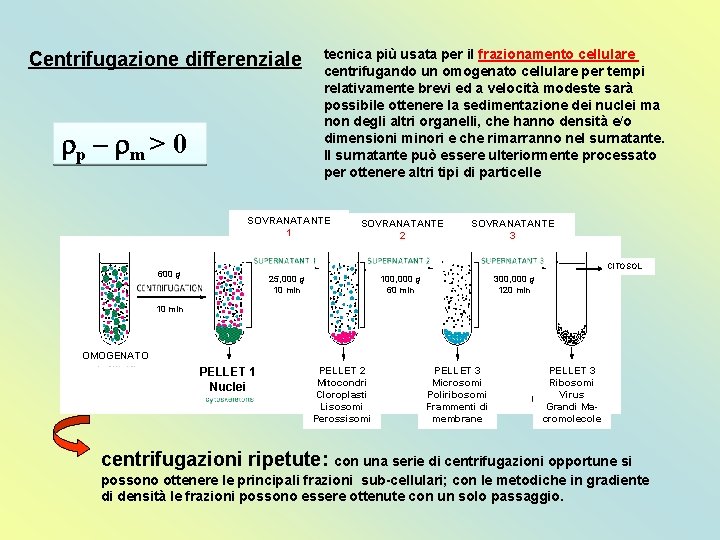
Centrifugazione differenziale rp – rm > 0 tecnica più usata per il frazionamento cellulare centrifugando un omogenato cellulare per tempi relativamente brevi ed a velocità modeste sarà possibile ottenere la sedimentazione dei nuclei ma non degli altri organelli, che hanno densità e/o dimensioni minori e che rimarranno nel surnatante. Il surnatante può essere ulteriormente processato per ottenere altri tipi di particelle SOVRANATANTE 1 SOVRANATANTE 2 SOVRANATANTE 3 25, 000 g 10 min 100, 000 g 60 min 300, 000 g 120 min CITOSOL 600 g 10 min OMOGENATO PELLET 1 Nuclei PELLET 2 Mitocondri Cloroplasti Lisosomi Perossisomi PELLET 3 Microsomi Poliribosomi Frammenti di membrane PELLET 3 Ribosomi Virus Grandi Macromolecole centrifugazioni ripetute: con una serie di centrifugazioni opportune si possono ottenere le principali frazioni sub-cellulari; con le metodiche in gradiente di densità le frazioni possono essere ottenute con un solo passaggio.

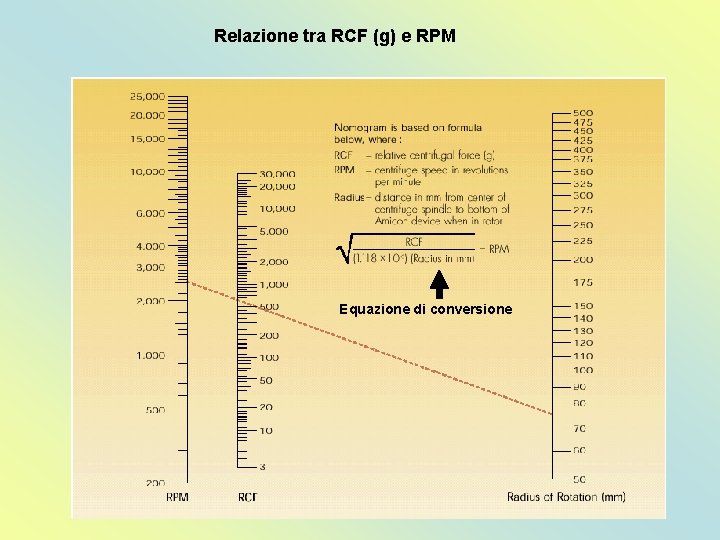
Relazione tra RCF (g) e RPM Equazione di conversione

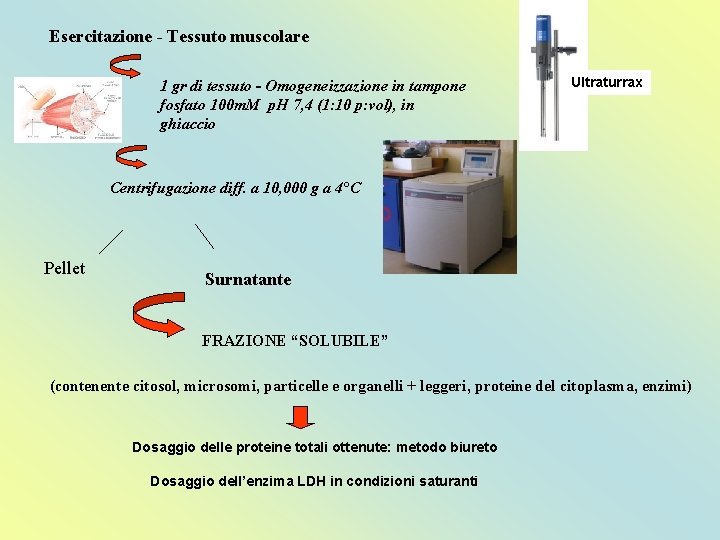
Esercitazione - Tessuto muscolare 1 gr di tessuto - Omogeneizzazione in tampone fosfato 100 m. M p. H 7, 4 (1: 10 p: vol), in ghiaccio Ultraturrax Centrifugazione diff. a 10, 000 g a 4°C Pellet Surnatante FRAZIONE “SOLUBILE” (contenente citosol, microsomi, particelle e organelli + leggeri, proteine del citoplasma, enzimi) Dosaggio delle proteine totali ottenute: metodo biureto Dosaggio dell’enzima LDH in condizioni saturanti