Lezione 3 Proteine Livelli strutturali delle proteine 06032019





























- Slides: 53

Lezione 3 Proteine Livelli strutturali delle proteine 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 0

Capitolo 3 Amminoacidi, peptidi e proteine

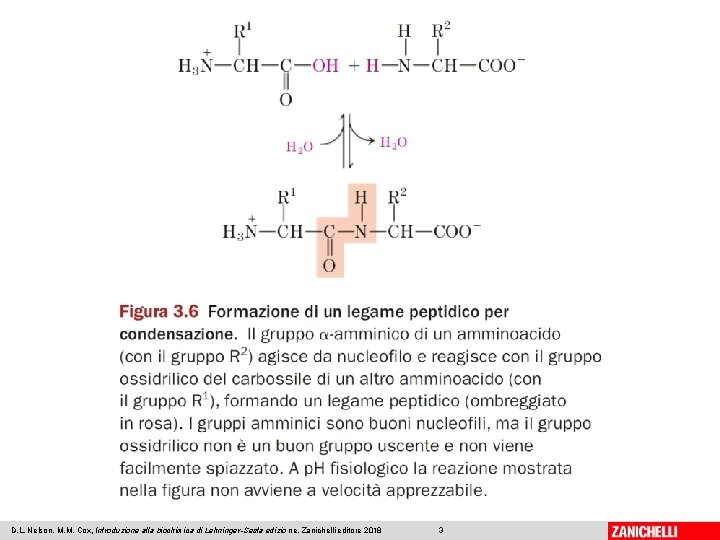
I polimeri degli amminoacidi • peptidi – dipeptidi, tripeptidi, tetrapeptidi, … oligopeptidi • polipeptidi o proteine – decine, centinaia, migliaia di amminoacidi • Due o più amminoacidi formano un legame peptidico, mediante una reazione di CONDENSAZIONE (e quindi uscita di una molecola d’acqua) 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 2

D. L. Nelson, M. M. Cox, Introduzione alla biochimica di Lehninger-Sesta edizio ne, Zanichelli editore 2018 3

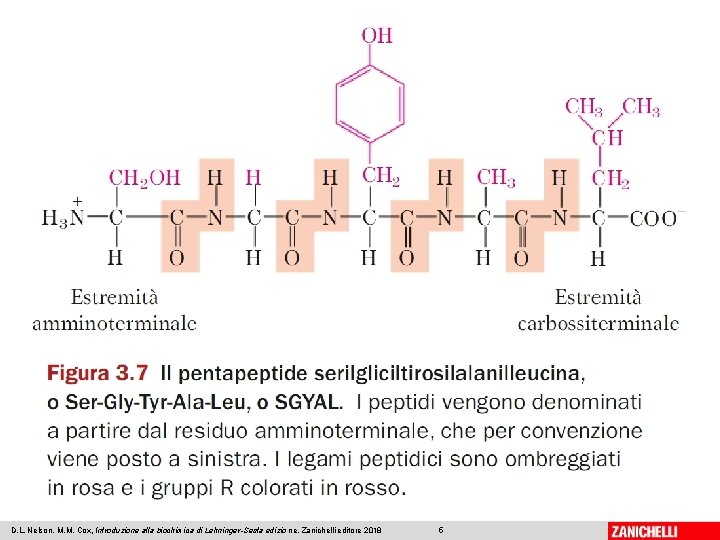
I nomi dei peptidi • Per convenzione l’amminoacido n. 1 è quello ammino-terminale • I nomi degli amminoacidi dei polipeptidi hanno il suffisso –ile (-il) al posto dell’ultima sillaba – – glicina glicil, glutammatao glutammil, aspartato aspartil, tirosina tirosil • L’amminoacido carbossiterminale mantiene il suo nome 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 4

D. L. Nelson, M. M. Cox, Introduzione alla biochimica di Lehninger-Sesta edizio ne, Zanichelli editore 2018 5

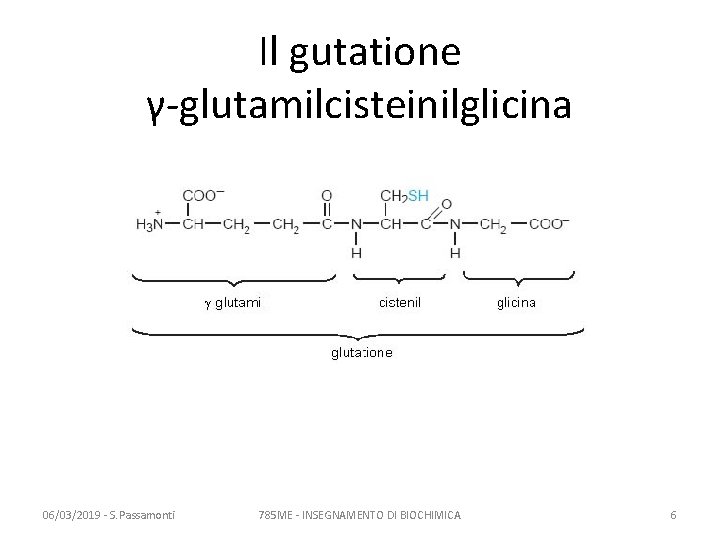
Il gutatione γ-glutamilcisteinilglicina 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 6

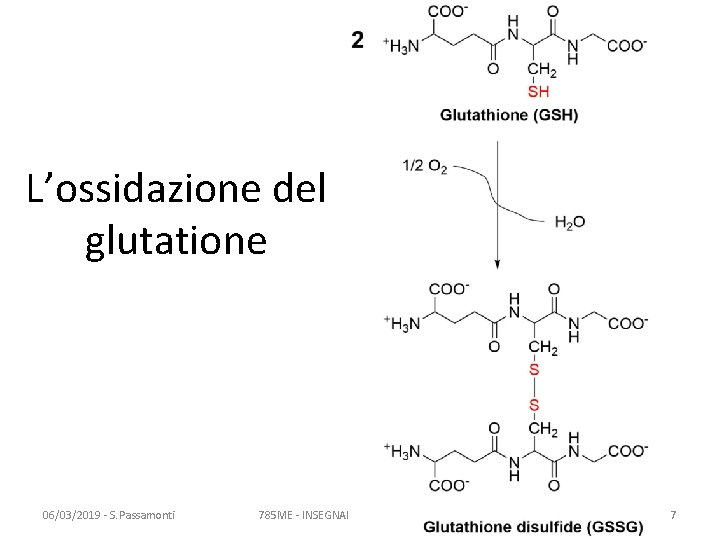
L’ossidazione del glutatione 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 7

Importanti caratteristiche dei (poli)peptidi • I legami peptidici sono stabili – vita media (t 1/2) = 7 anni – Le proteine sono però danneggiate dalle specie radicaliche • Possono ionizzarsi solo i gruppi ammino- e carbossiterminale – i gruppi impegnati nei legami peptici non ionizzano • I gruppi R degli amminoacidi peptidici possono ionizzarsi • La lunghezza dei polipeptidi è molto variabile – in genere circa 2000 amminoacidi 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 8

Le proteine si possono associare Gli assortimenti nelle proteine • singolo polipeptide • due, tre, quattro polipeptidi (o sub-unità) uguali – omodimero, omotrimero, omotetramero • due, tre, quattro polipeptidi (o sub-unità) diversi – eterodimero, eterotrimero, eterotetramero 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 9

Le proteine coniugate Alcune proteine legano dei GRUPPI PROSTETICI: ioni, gruppi chimici o molecole non proteiche 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 10

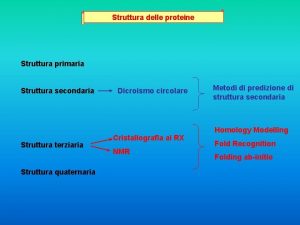
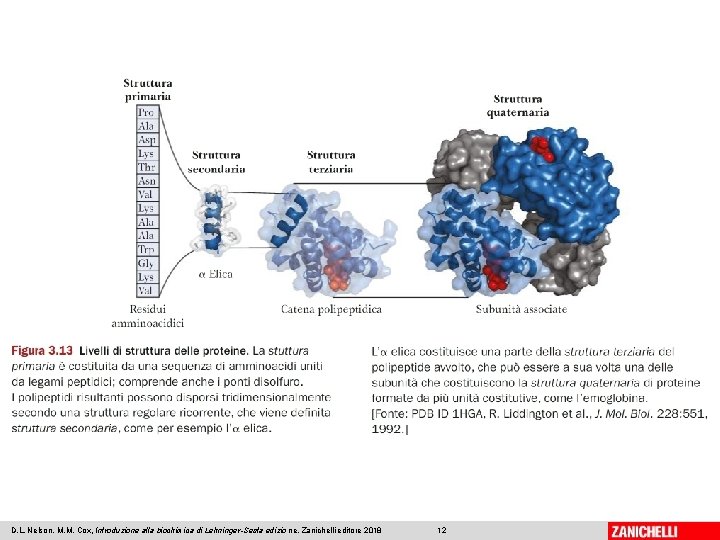
I livelli strutturali delle proteine • Struttura primaria – sequenza degli amminoacidi, legati mediante legame peptidico • Struttura secondaria – moduli strutturali ricorrenti (α-elica, foglietto β, …) che interessano solo alcune brevi sequenze all’interno del polipeptide • Struttura terziaria – struttura tridimensionale di tutto il polipeptide • Struttura quaternaria – struttura multimerica (aggregazione di sub-unità proteiche) 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 11

D. L. Nelson, M. M. Cox, Introduzione alla biochimica di Lehninger-Sesta edizio ne, Zanichelli editore 2018 12

Cosa si può dedurre dalla struttura primaria? • Le sequenze amminoacidiche sono depositate nelle banche dati – es. : ww. uniprot. org • Le sequenze si possono confrontare, per allineamento, grazie agli strumenti della Bioinformatica • Il grado di omologia (identità di sequenza) tra proteine diverse suggerisce relazioni genomiche o funzionali 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 13

Le proteine sono codificate da geni • La struttura primaria delle proteine corrisponde alla struttura primaria del DNA – ad una sequenza amminoacidica corrisponde una sequenza nucleotidica – il codice genetico consente di tradurre una sequenza nucleotidica in sequenza amminoacidica • Il genoma umano contiene circa 20. 000 geni che codificano almeno 20. 000 proteine – il proteoma (l’insieme delle proteine) umano non è ancora del tutto noto, per limiti analitici. 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 14

Le famiglie proteiche • Comprendono proteine che hanno: – omologie di sequenza amminoacidica – stessa o simile funzione TERMINOLOGIA Proteine omologhe = Omologhi • Famiglie proteiche possono essere presenti in molte specie diverse – Paraloghi = omologhi espressi nella stessa specie – Ortologhi = omologhi espressi in specie diverse 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 15

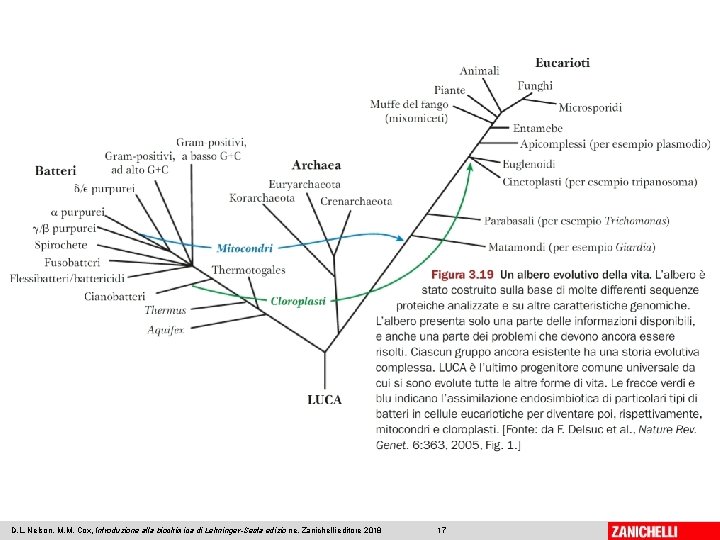
L’evoluzione molecolare • I geni che esprimono le proteine possono mutare da una generazione all’altra • L’evoluzione delle specie viventi ha portato ad avere genomi diversi • Si può immaginare un antenato comune 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 16

D. L. Nelson, M. M. Cox, Introduzione alla biochimica di Lehninger-Sesta edizio ne, Zanichelli editore 2018 17

La classificazione delle proteine • Le proteine si possono aggregare in gruppi in funzione dell’omologia di sequenza e similitudine di funzione • I gruppi sono: – FAMIGLIE – DOMINI – SEQUENZE 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 18

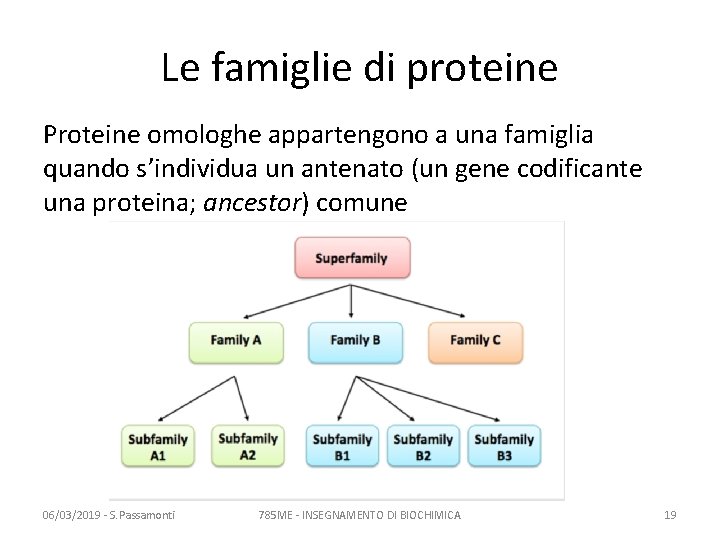
Le famiglie di proteine Proteine omologhe appartengono a una famiglia quando s’individua un antenato (un gene codificante una proteina; ancestor) comune 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 19

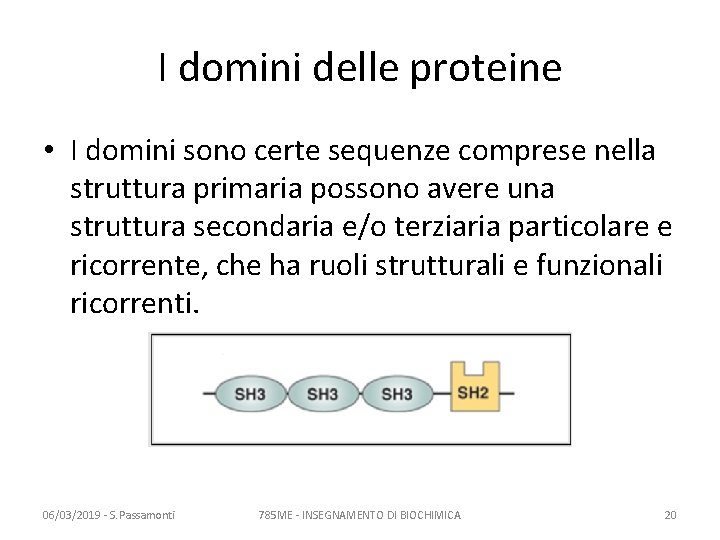
I domini delle proteine • I domini sono certe sequenze comprese nella struttura primaria possono avere una struttura secondaria e/o terziaria particolare e ricorrente, che ha ruoli strutturali e funzionali ricorrenti. 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 20

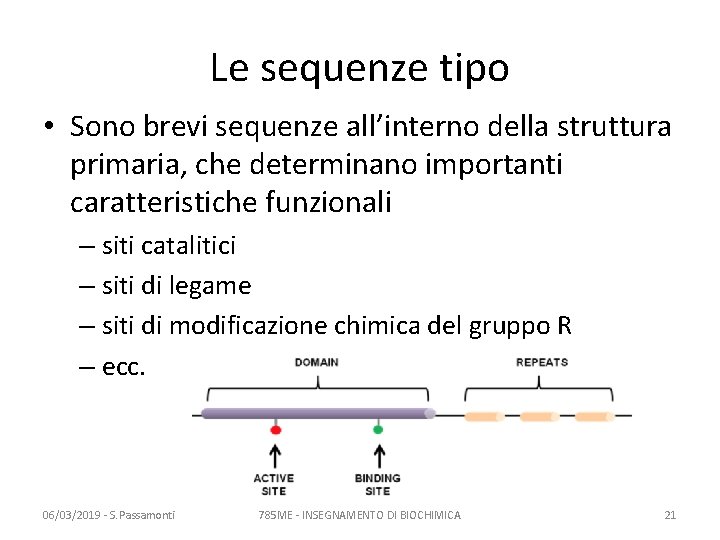
Le sequenze tipo • Sono brevi sequenze all’interno della struttura primaria, che determinano importanti caratteristiche funzionali – siti catalitici – siti di legame – siti di modificazione chimica del gruppo R – ecc. 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 21

Capitolo 4 Struttura tridimensionale delle proteine

La conformazione delle proteine • La conformazione è la struttura tridimensionale di una proteina – Un polipeptide è un filamento flessibile e può assumere (“disegnare”) teoricamente un numero enorme di forme (conformazioni) – ciò è possibile grazie alla rotazione degli atomi intorno ai legami • Le conformazioni più probabili (possibili) sono caratterizzate dalla minor energia libera di Gibbs, G, (en. potenziale, che può compiere lavoro) 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 23

Le conformazioni ripiegate sono più stabili • Le conformazioni lineari sono quelle associate alla maggior energia libera, a causa del massimo numero di interazioni possibili con l’acqua (entropia). • Quando un polipeptide si ripiega e si formano legami deboli intra-molecolari, questi sostituiscono i legami H con l’acqua, diminuisce l’entropia e così l’energia libera • Anche i legami disolfuro tra gruppi R delle cisteine contribuiscono a questa stabilizzazione conformazionale 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 24

Le forze del ripiegamento dei polipeptidi (cont. ) • I gruppi R apolari (Leu, Ile, Val, Phe, Trp) interagiscono tra di loro per effetto idrofobico e guidano il ripiegamento • Si forma un nucleo centrale apolare, da cui l’acqua è esclusa – diminuisce l’entropia • In questo nucleo apolare, gli atomi possono interagire grazie alle forze di van der Waals, e ciò stabilizza la conformazione 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 25

(cont. ) Le forze del ripiegamento dei polipeptidi • I gruppi R polari interagiscono con legami idrogeno • I gruppi R carichi interagiscono con legami elttrostatici • La superficie del polipeptide ripiegato interagisce con l’acqua mediante legami idorgeno 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 26

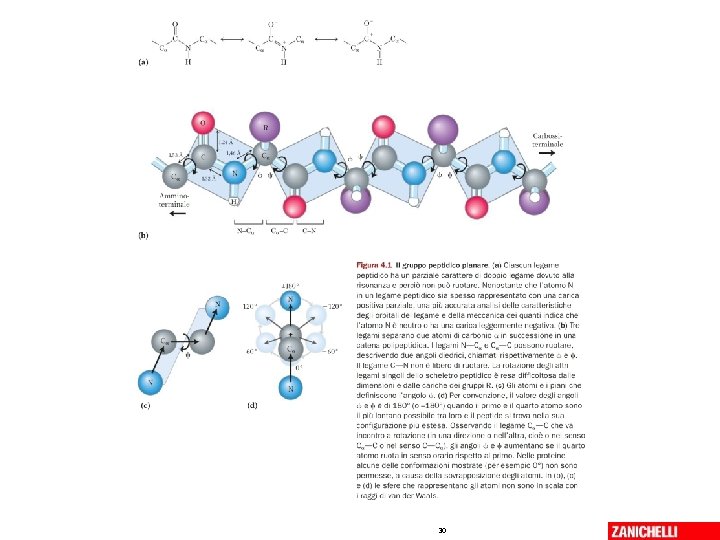
I limiti al ripiegamento dei polipeptidi • Il polipeptide ha una catena principale, costituita da gruppi peptidici che si ripetono -Cα-C-N-Cα-C-N-Cα • Gli atomi della catena principale dei polipeptidi NON sono completamente liberi di ruotare • Perché? vedi schema successivo 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 27

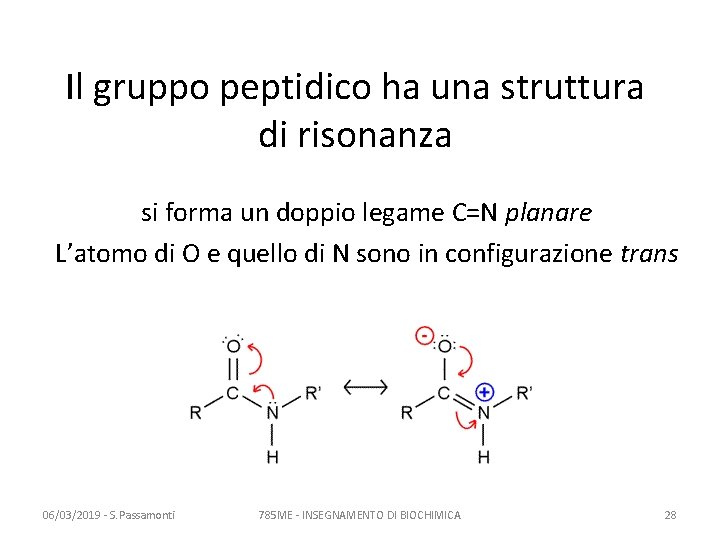
Il gruppo peptidico ha una struttura di risonanza si forma un doppio legame C=N planare L’atomo di O e quello di N sono in configurazione trans 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 28

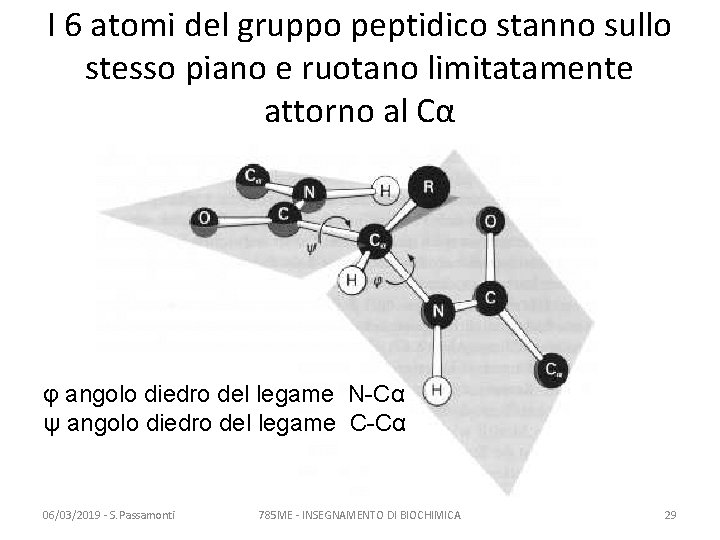
I 6 atomi del gruppo peptidico stanno sullo stesso piano e ruotano limitatamente attorno al Cα φ angolo diedro del legame N-Cα ψ angolo diedro del legame C-Cα 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 29

30

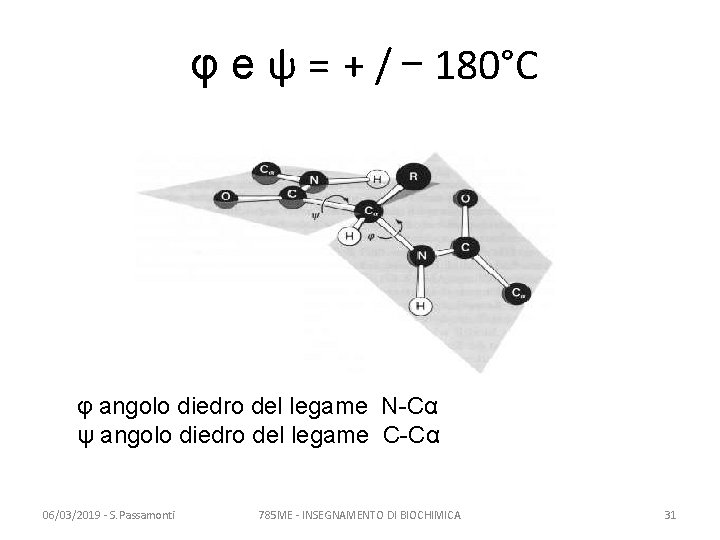
φ e ψ = + / – 180°C φ angolo diedro del legame N-Cα ψ angolo diedro del legame C-Cα 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 31

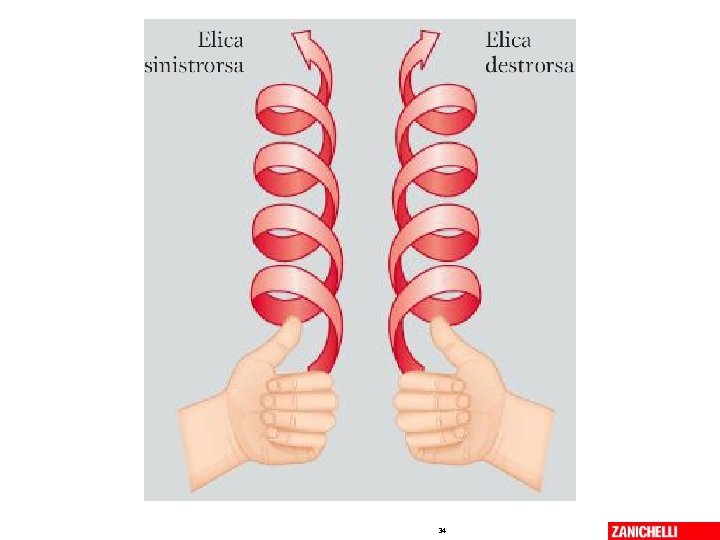
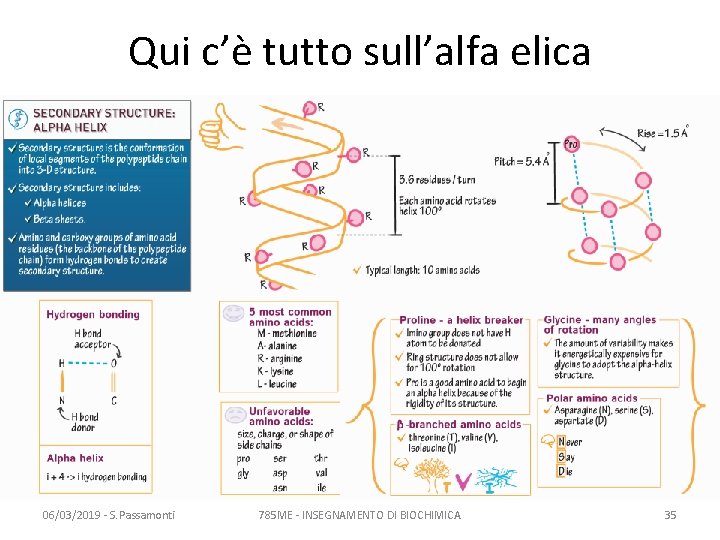
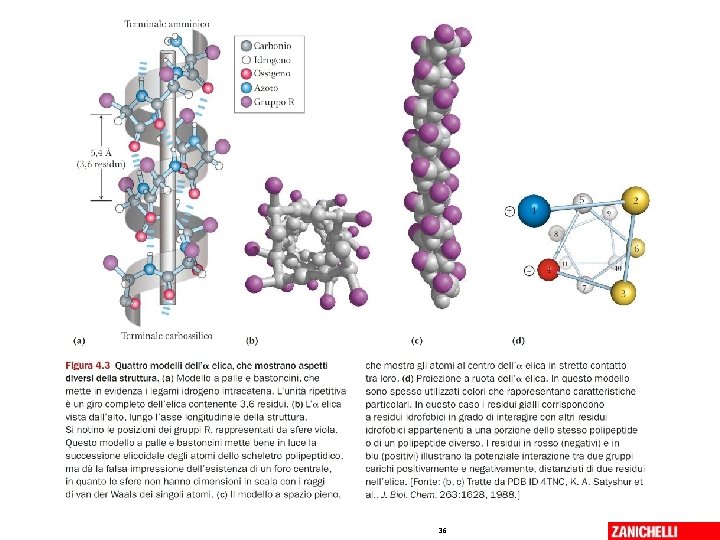
La struttura secondaria • Si riferisce solo alla catena principale • Si una struttura secondaria quando un segmento del polipeptide presenta angoli diedrici φ e ψ invariati • Le due principali strutture secondarie sono: α elica Il foglietto β • In assenza di struttura secondaria, la conformazione polipeptidica si definisce random coil 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 32

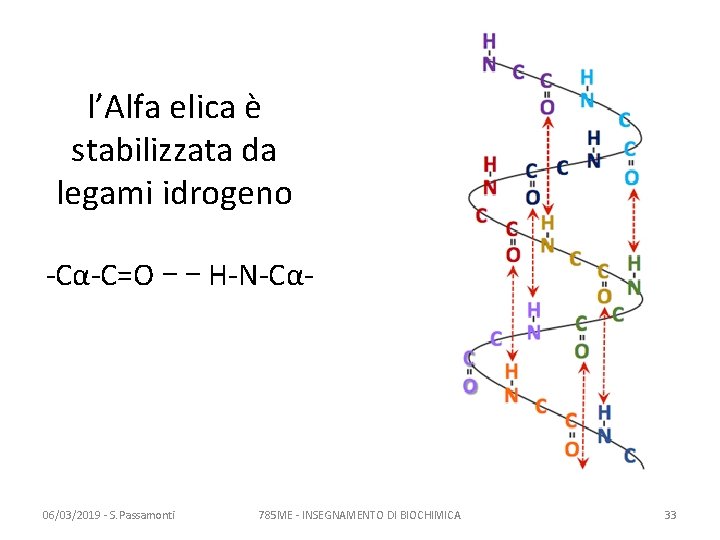
l’Alfa elica è stabilizzata da legami idrogeno -Cα-C=O - - H-N-Cα- 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 33

34

Qui c’è tutto sull’alfa elica 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 35

36

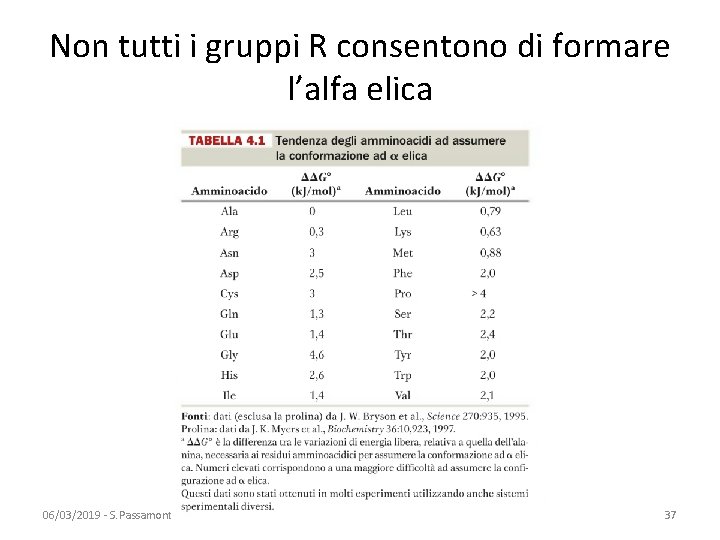
Non tutti i gruppi R consentono di formare l’alfa elica 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 37

Fattori limitanti la formazione di alfa-elica • Caratteristiche intrinseche dei gruppi R • Sequenze ricche di gruppi R carichi – repulsione o attrazione tra R influenzano gli angoli diedrici • La prolina (non ha un H per il legame H con O) • La glicina (il suo gruppo R=H le conferisce molta mobilità=entropia=delta G negativo) 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 38

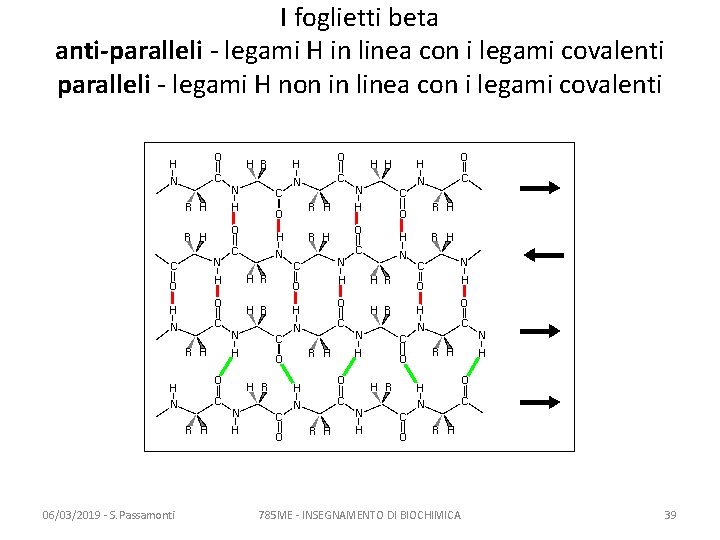
I foglietti beta anti-paralleli - legami H in linea con i legami covalenti paralleli - legami H non in linea con i legami covalenti 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 39

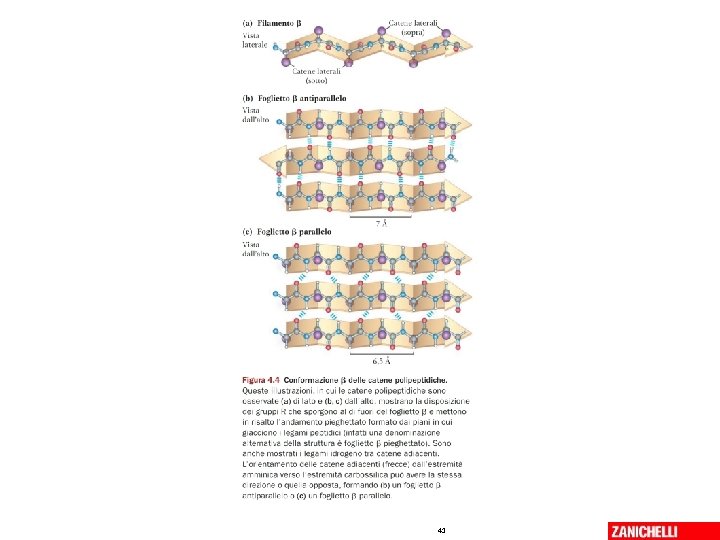
Il foglietto beta 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 40

41

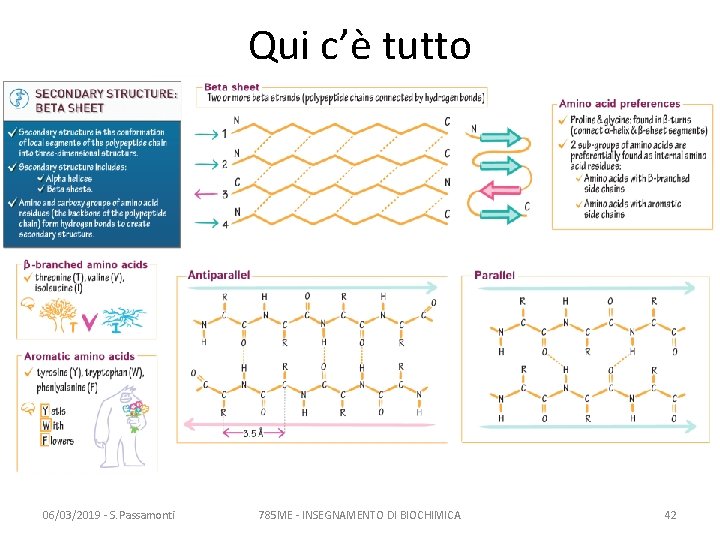
Qui c’è tutto 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 42

I fattori favorenti la formazione del foglietto beta • sequenze ricche di amminoacidi apolari, detti anche beta-ramificati: Thr, Val, Ile • sequenze ricche di amminoacidi aromatici: Tyr, Trp, Phe • Obbligatoria la possibilità di fare il ripiegamento beta del polipeptide, grazie a Gly e Pro – ripiegamento beta: vedi schema successivo 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 43

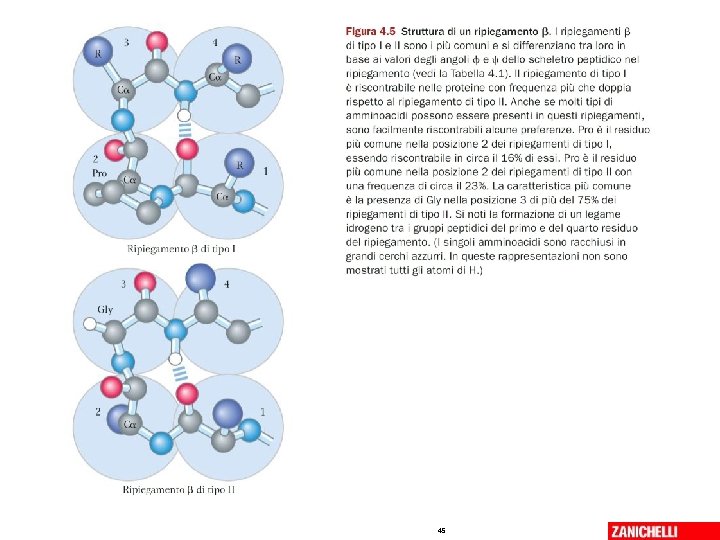
Il ripiegamento beta • La catena polipeptidica può formare delle anse strette: – ripiegamento di 180° – riguarda una sequenza di 4 amminoacidi – il gruppo C=O si lega con legame idrogeno all’atomo di H legato all’atomo di N del quarto amminoacido – I gruppi peptidici dei due amminoacidi centrali sono spesso esposti in superficie, e interagiscono con l’acqua 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 44

45

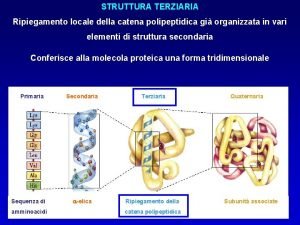
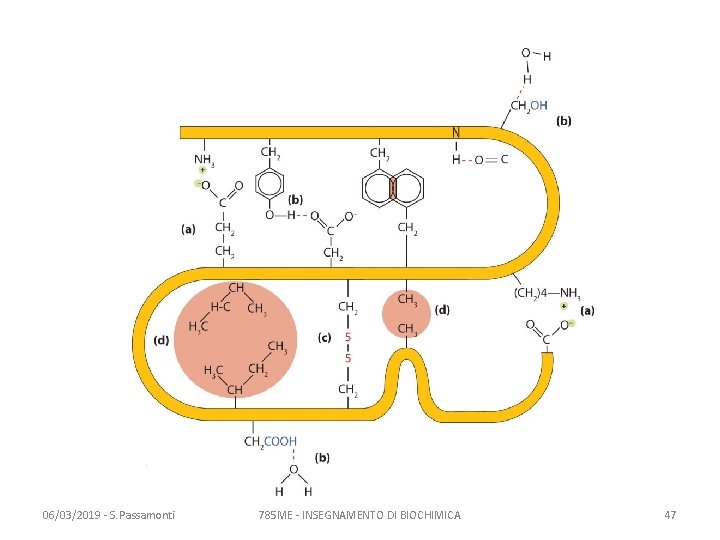
La struttura terziaria e quaternaria • Il polipeptide si avvolge su sé stesso, coinvolgendo gli eventuali domini aventi strutture secondarie, e assume una conformazione stabile (e caratteristica) • Le forze che determinano il ripiegamento finale sono i legami deboli tra atomi di amminoacidi anche molto distanti nella sequenza – MEMO: i legami deboli sono di 4 tipi 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 46

06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 47

La struttura quaternaria • Due o più polipeptidi (sub-unità) aventi una definita struttura terziaria si associano a formale una proteina multimerica • Le forze che determinano la struttura quaternaria sono i legami deboli tra atomi di amminoacidi di sub-unità diverse • MEMO: i legami deboli sono di 4 tipi 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 48

Due tipi di conformazioni • Proteine fibrose – ruoli strutturali • Proteine globulari – ruoli strutturali – ruoli catalitici – ruoli regolatori – ecc 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 49

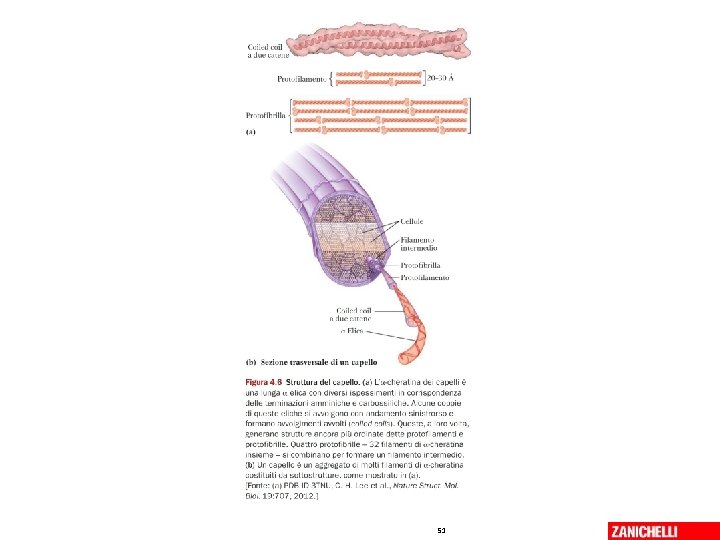
Proteine fibrose • alfa-cheratina • collegene • fibroina della seta 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 50

51

Fine A domani • Collagene • Proteine globulari 06/03/2019 - S. Passamonti 785 ME - INSEGNAMENTO DI BIOCHIMICA 52
 L'esperienza delle cose moderne e la lezione delle antique
L'esperienza delle cose moderne e la lezione delle antique La lezione delle antique cose
La lezione delle antique cose Tipologie strutturali
Tipologie strutturali Le tre parti del testo narrativo
Le tre parti del testo narrativo Guida ai fondi strutturali europei 2014-2020
Guida ai fondi strutturali europei 2014-2020 Sezione longitudinale e trasversale nave
Sezione longitudinale e trasversale nave Elementi strutturali coperture
Elementi strutturali coperture Membrana plasmatica doppio strato fosfolipidico
Membrana plasmatica doppio strato fosfolipidico Funzioni proteine
Funzioni proteine Funzioni dei carboidrati
Funzioni dei carboidrati Giuseppe valitutti
Giuseppe valitutti Metabolismo delle proteine
Metabolismo delle proteine La nascita delle lingue e delle letterature romanze
La nascita delle lingue e delle letterature romanze Igcse cambridge livelli
Igcse cambridge livelli Segmentazione informatica
Segmentazione informatica Agenda setting livelli
Agenda setting livelli Server radius packet tracer
Server radius packet tracer Livelli istituzionali
Livelli istituzionali Paul livelli
Paul livelli Somma di decibel
Somma di decibel Livelli del linguaggio
Livelli del linguaggio Livelli metalmeccanico
Livelli metalmeccanico Esempio di lezione clil diritto
Esempio di lezione clil diritto Lezione 7
Lezione 7 Lezione simulata
Lezione simulata Struttura della lezione
Struttura della lezione Esempi jigsaw
Esempi jigsaw La lezione della farfalla
La lezione della farfalla Plural of lezione in italian
Plural of lezione in italian Carboidrati proteine grassi vitamine sali minerali
Carboidrati proteine grassi vitamine sali minerali Proteine intrinseche
Proteine intrinseche Totul despre proteine
Totul despre proteine Proteine dna
Proteine dna Proteine del latte
Proteine del latte La contaminazione degli alimenti mappa concettuale
La contaminazione degli alimenti mappa concettuale Lipo proteine
Lipo proteine Sunt hidrati de carbon compusii
Sunt hidrati de carbon compusii Aufbau hühnerei
Aufbau hühnerei Vindecarea prediabetului
Vindecarea prediabetului Proteine intrinseche
Proteine intrinseche Scienze
Scienze Proteine g trimeriche
Proteine g trimeriche Degradazione proteine
Degradazione proteine Carbohidrati lista completa
Carbohidrati lista completa Amminoacidi aromatici
Amminoacidi aromatici Proteinele definitie
Proteinele definitie Modulatori allosterici emoglobina
Modulatori allosterici emoglobina Matrice extracelulara
Matrice extracelulara I legami chimici riassunto
I legami chimici riassunto Dicroismo circolare proteine
Dicroismo circolare proteine Fibrilläre proteine
Fibrilläre proteine Proteine del siero del latte
Proteine del siero del latte Mioglobina struttura secondaria
Mioglobina struttura secondaria Proteine prenilate
Proteine prenilate