COURS DE CHIMIE THEORIQUE M 1 Chimie Fondamentale






































































































- Slides: 103

COURS DE CHIMIE THEORIQUE M 1 Chimie Fondamentale N. KOMIHA cours de chimie théorique. N. Komiha

Présentation du cours • La chimie théorique a un rôle de prédiction, d’explication et de rationalisation (modélisation) de la chimie. • Ce cours se fera en une vingtaine d’heures et présentera – Les méthodes de résolution de la chimie quantique – Les fonctions d’onde moléculaires – Etats fondamental et excités(Interaction de configurations) cours de chimie théorique. N. Komiha

QU’EST-CE QUE LA CHIMIE QUANTIQUE? Introduction cours de chimie théorique. N. Komiha

DOMAINES D’APPLICATION • • • Synthèse organique Ch. analytique Ch. du solide Catalyse Biologie cours de chimie théorique. N. Komiha

HISTORIQUE: qques dates • • • 1926 : Equation de Schrödinger 1928 : Equations de Hartree-Fock 1931 : Méthode de Hückel 1944 : Construction du premier ordinateur 1967 : première méthode semi-empirique: CNDO 1970 : diffusion des premiers pgm ab-initio aux USA et en Europe • 1979 : première thèse d’état au Maroc en Ch. T. – Et création du laboratoire de chimie théorique de Rabat. • 1990: Méthodes ab initio DFT cours de chimie théorique. N. Komiha

Ce qu’a permis la chimie théorique • Apprentissage raisonné de la chimie(mise en œuvre de modèles simples utilisés par tous les chimistes: orbitale, liaison covalente, hybridation. . ) • Résolution de problèmes de synthèse(cyclobutadiène) • Guide les expériences de réalisation délicates. • Structures, • Réactivité, dynamique réactionnelle • Spectroscopie cours de chimie théorique. N. Komiha

La chimie Théorique au Maroc • 1979 : première thèse d’état soutenue en chimie théorique(Mme Chraibi) et création du laboratoire de chimie théorique de Rabat(1972). • Calculs effectués initialement en France • Moyens de calculs inexistants • 1980 : utilisation des premiers centres de calculs(sûreté nationale, PTT, EMI, ENIM. . ) • 1988: premier centre de calcul dans les facultés, station de travail UNIX, existence de labo de chimie théorique dans toute les fac • 1989: acquisition des premiers PC. • Depuis les travaux présentent des calculs entièrement faits au Maroc sur PC , stations de travail ou grille de calcul. cours de chimie théorique. N. Komiha

Difficultés • lié au formalisme mathématique de la théorie quantique Utilisation d’un vocabulaire spécialisé étroitement et à l’aspect numérique(peu familier au chimiste expérimentateur). – Veiller à la bonne compréhension de ce vocabulaire. – Faire le lien entre calcul et physique • Exigence de traitements par approximations successives pour l’étude de systèmes d’intérêt chimique(multitude d’ approches et de méthodes). – Adéquation méthode/problème étudié cours de chimie théorique. N. Komiha

AXIOMES DE LA MECANIQUE QUANTIQUE • Description probabiliste d’un système de particules. fonction d’onde d’un système. • Opérateurs associés aux grandeurs physiques. • Equations aux valeurs propres associées à toute mesure physique. • H =E. L’ensemble des fonctions propres de H est une base orthonormée complète de l’espace des fonctions d’onde. cours de chimie théorique. N. Komiha

Résolution de l’équation de Schrödinger H =E E? , ? donne accès aux propriétés électroniques du système. Plusieurs solutions (E , ) états excités et état fondamental cours de chimie théorique. N. Komiha

Méthodes de résolution: cours de chimie théorique. N. Komiha

1) Méthode variationnelle: Est minimisée par rapport à des paramètres Cij dont dépend . Ces paramètres sont , par exemple, les coefficients dans l’approximation LCAO-MO : i= Cir r cours de chimie théorique. N. Komiha

2) Méthode des perturbations • Les fonctions recherchées s’expriment sous forme de dvpt en série sur des fonctions ° d’un système de référence : • H° ° =E° ° • L’hamiltonien réel est : H=H°+V • L’énergie s’exprime en fonction des E° et des intégrales : < ° |V| ° >. • Les deux méthodes peuvent être couplées cours de chimie théorique. N. Komiha

APPROXIMATIONS cours de chimie théorique. N. Komiha

1)sur la fonction d’onde a-Cas d’un système à couches fermées déterminant de Slater: où fi= i i est une spin-orbitale (fonction monoélectronique) i = Cir r (LCAO-MO) La fonction obéit aux principes d’indiscernabilité et d’antisymétrie par rapport à la permutation de 2 électrons. cours de chimie théorique. N. Komiha

b-cas d’un système à couches ouvertes: est une combinaison linéaire de déterminants de Slater(I. C. ) cours de chimie théorique. N. Komiha

2) Sur l’Hamiltonien Pour un système de N noyaux et n électrons : H(i) opérateurs monoélectroniques 1/rij et 1/r. IJ répulsions interélectroniques et internucléaires cours de chimie théorique. N. Komiha

Différents types d’approximations • Termes biélectroniques négligés(approx. particules indépendantes), approximation grossière. • Termes biélectroniques remplacés par un potentiel monoélectronique de forme analytique à déterminer. cours de chimie théorique. N. Komiha

Formalisme de Hartree-Fock, Roothaan • L’Hamiltonien est intégralement préservé: • D. R. Hartree, Proc. Cambridge, Phil. Soc, 1928, 24, 89 • C. C. J. Roothaan, Rev. Mod. Phys. , 1951, 23, 1969. • On résoud le système d’équations: • Avec int. monélectroniques • et (pq|rs)=<p(1)q(1)|1/r 12|r(2)s(2)> int. biélectroniques • Les intégrales (pq|rs) difficiles à calculer. Pour cela plusieurs méthodes: seules méthodes ab-initio permettent de les calculer effectivement. • Il existe différents niveaux d’approximation pour le calcul de ces intégrales. cours de chimie théorique. N. Komiha

Méthodes de la chimie quantique • Méthodes empiriques (non variationnelles): Hückel, Hückel étendue • Méthodes semiempiriques(CNDO, MNDO, AM 1. . ) • Méthodes ab-initio cours de chimie théorique. N. Komiha

Méthodes empiriques: • • Approx. des particules indépendantes, seuls certains électrons( , valence), LCAO-MO, les int. biélectroniques non calculées, Hpq paramétrisées, recouvrement totalement ou partiellement négligés Méthodes très simplificatrices, idée grossière des propriétés électroniques, description qualitative des OM. Outil d’exploration des très gros systèmes. cours de chimie théorique. N. Komiha

Méthodes semi-empirique • CNDO, MNDO, AM 1 • Intégrales biélectroniques calculées par des formules simplifiées paramétrisées. • Les recouvrements généralement non négligés. • Rapides et peu coûteuses. • Bons résultats pour les composés classiques à l’état fondamental(structures, fréquences de vibrations) cours de chimie théorique. N. Komiha

Méthodes ab-initio monoconfigurationnelle • Excellents résultats pour systèmes couches fermées et l’étude de réaction où la corrélation électronique est quasi invariante. • Nécessité d’utiliser les méthodes décrivant la corrélation électronique pour accéder aux énergies d’activation, états de transition, dissociation etc… cours de chimie théorique. N. Komiha

Définition de la modélisation moléculaire: • Application des méthodes théoriques et méthodes de calcul pour résoudre des problèmes de structures et de réactivité chimique. • Ces méthodes peuvent être simples et rapides ou , au contraire , être extrêmement complexes demandant de nombreuses heures de calculs sur super-ordinateur. . cours de chimie théorique. N. Komiha

• Ces méthodes utilisent souvent des moyens infographiques très sophistiqués qui en facilitent l’utilisation et l’interprétation de la quantité impressionnante de nombres obtenus à l’issue de ces calculs. • Transformations de ces nombres en représentations graphiques facilement interprétables. cours de chimie théorique. N. Komiha

La modélisation par ordinateur d’une molécule implique : • Une présentation graphique de la géométrie, pour cela on utilise un logiciel infographique: Gaussview, Molden, Chemdraw. . • Suivie de l’ application d’une méthode théorique : méthodes quantiques ab-initio, semi-empiriques ou encore la mécanique moléculaire pour déterminer les propriétés physiques et chimiques de la molécule. • Ces méthodes sont implantées dans des logiciels commerciaux: Gaussian, Gamess, Molpro, turbomole , Spartan. . cours de chimie théorique. N. Komiha

CHAPITRE I-METHODES DE RESOLUTIONS DE LA CHIMIE THEORIQUE : • Une résolution exacte de l’équation de Schrödinger n’est possible que dans les cas les plus simples(particule libre, atome d’hydrogène, etc. . ). • La plupart des problèmes de la chimie quantique sont résolus à l’aide de méthodes approchées. • Les plus importantes méthodes sont les méthodes de variations et de perturbations. cours de chimie théorique. N. Komiha

1 -Méthode de Variations : • Elle est fondée sur le théorème suivant : • Si H est l’hamiltonien du système et E 1 la plus faible valeur propre (c. à. d. l’énergie de l’état fondamental), • alors pour toute fonction normalisée on a : • <E>= ∫ * H dτ ≥ E 1 • Démonstration : • La fonction peut être développée suivant la base des fonctions propres de l’hamiltonien : • =∑i ci i avec H i = Ei i cours de chimie théorique. N. Komiha

Considérons maintenant l’intégrale : • ∫ *(H-E 1) dτ=∑i∑j ci*cj ∫ i* (H-E 1) j dτ • =∑i∑j ci*cj (Ej-E 1)∫ i* jdτ • =∑i│ci²│(Ei-E 1) • │ci²│étant toujours positif ou nul et E 1 étant par hypothèse la plus faible valeur propre (E 1≤Ei i ) : • ∫ i* (H-E 1) j dτ≥ 0 • Et donc <E> ≥ E 1 cours de chimie théorique. N. Komiha

La fonction d’onde approchée ψ est dite fonction d’essai. • Plus cette fonction d’essai est proche de la fonction exacte, plus l’énergie obtenue à l’aide de cette fonction est proche de la valeur réelle. • Pour que la fonction soit plus ‘souple’ , on y introduit plusieurs paramètres variables c 1, c 2. . cn. • Les valeurs de ce » s paramètres sont trouvés en minimisant l’énergie : cours de chimie théorique. N. Komiha

Méthode variationnelle de RITZ : • La fonction d’essai ψ est exprimée sous forme d’une combinaison linéaire de fonctions approchées : • c 1, c 2…, cn étant des paramètres à faire varier. • En substituant ψ dans l’expression de <E> et en considérant que ψ est normée , on obtient : cours de chimie théorique. N. Komiha

• Avec Hij = i j d élément de matrice de l’hamiltonien. • Et Sij = i j d élément de la matrice de recouvrement . • La valeur minimale de l’énergie <E> est obtenue en écrivant les conditions de nullité des dérivées : • Or <E>=U/V cours de chimie théorique. N. Komiha

i • Et donc: • Σi ci (Hik- <E> Sik) =0 • Ce système d’équations linéaires et homogènes n’a de solutions non triviales que si le déterminant associé est nul : • • • |Hik - <E> Sik|=0 Ce déterminant est dit séculaire , il possède n racines E 1, E 2, . . En. La plus petite valeur correspond à l’énergie de l’état fondamental. Les autres valeurs correspondent aux état excités. Si on remplace E 1 par sa valeur dans le système d’équations, on détermine les coefficients de la fonction d’onde de l’état fondamental • Les fonctions d’ondes autres états sont déterminés de la même manière. cours de chimie théorique. N. Komiha

2 -Théorie des perturbations : • On considère que l’hamiltonien est la somme de 2 termes: • Un terme H 0 d’ordre zéro • et un terme de perturbation P(généralement moins important que H 0), • Les valeurs propres En° et les fonctions propres correspondantes n° de H 0 sont supposées connues: • H 0 n°= En° n° (1) • Le problème est alors de déterminer, partir des solutions de H 0, les valeurs propres En et les fonctions propres correspondantes n de H: • H n= En n (2) cours de chimie théorique. N. Komiha

Méthode de Rayleigh-Schrödinger: • On pose : H=H 0 + λ P (3) avec λ petit • On développe en série de λ les valeurs propres et fonctions propres correspondantes En, n: • En=En°+λEn 1+λ 2 En 2+… (4) • n= n°+λ n 1+λ 2 n 2+… (5) • On suppose tout d’abord, que tous les états n sont non dégénérés. • En reportant (4) et (5) dans (2) , on a : • (H 0 + λ P ) ( n°+λ n 1+λ 2 n 2+… )=(En°+λEn 1+λ 2 En 2+… )( n°+λ n 1+λ 2 n 2+… ) (6) cours de chimie théorique. N. Komiha

Cette équation est satisfaite si les termes de même puissance de λ sont égaux dans les deux membres: • • • H 0 n°= En° n° H 0 n 1+P n°= En° n 1+E 1 n n° H 0 n 2+P n 1= En° n 2+E 1 n n 1+ E 2 n n° (7) …. . H 0 nk+P nk-1= En° nk+E 1 n nk-1+ E 2 n nk-2+. . +Ekn n° On suppose que les états propres de H 0 sont normalisés et orthogonaux à tous les états des différents ordres de perturbations : • < n°I n°> =1 ; < ni. I ni>=1 ; < n 0 I ni>=1 i (8) cours de chimie théorique. N. Komiha

En multipliant à gauche par n 0* chacunes des équations précédentes et en intégrant , il vient que : • E°n =< n 0 IH 0 I n 0> énergie non perturbée • E 1 n =< n 0 IPI n 0> énergie de perturbation à • l’ordre 1 • • • E 2 n =< n 0 IPI n 1> énergie de perturbation à l’ordre 2 … Ekn =< n 0 IPI nk-1> énergie de perturbation à l’ordre k On voit que la correction à l’ordre k pour l’énergie s’obtient par la simple connaissance de la correction à l’ordre k-1 de la fonction d’onde. cours de chimie théorique. N. Komiha

En sommant la série (4) , l’énergie vraie s’écrit : • En=En°+λEn 1+λ 2 En 2+… • =En°+λ < n 0 IPI n 0> +λ 2 < n 0 IPI n 1> +… • = En°+λ < n 0 IP[I n 0> +λ I n 1> + λ 2 I n 2> +… …] • = En°+λ < n 0 IPI n> (10) • En incluant le paramètre λ dans P , on a : • En=En°+ < n 0 IPI n> = < n 0 IHI n> • C’est une expression purement formelle car l’état vrai n n’est pas connu. cours de chimie théorique. N. Komiha

Détermination de la fonction d’onde à l’ordre k : • Multiplions à gauche par °*m chacune des équations de (7) et intégrons : • < m 0 IH 0 I nk>+ < m 0 IPI nk-1> = • En° < m 0 I nk>+ En 1 < m 0 I nk-1>+. . + Enk-1 < m 0 I n 1> • Car Enk < m 0 I n 0>=0 du fait que m 0 et n 0 sont orthogonaux. • On note que : • < m 0 IH 0 I nk>= Em° < m 0 I nk> ce qui entraîne que : • < m 0 I nk>=1/(En° -Em°) [< m 0 IPI nk-1> cours de chimie théorique. k-1 < 0 I 1>] (12) • - En 1 < m 0 I nk-1>+. . + E n. N. Komiha m n

Or on peut écrire que : • Avec : • m ≠n par hypothèse car : • k , ce qui donne avec l’équation (12) , l’état perturbé d’ordre k : • nk = ∑ m ≠n {1/(En° -Em°) [< m 0 IPI nk-1> m 0 • - En 1 < m 0 I nk-1> m 0+. . + Enk-1 < m 0 I n 1> m 0} (13) cours de chimie théorique. N. Komiha

Application à l’ordre 1 : • L’équation (10) donne : • En=En°+ λ< n 0 IPI n 0> (14) • Et l’équation (13) conduit à : • (15) • Et donc : • (16) cours de chimie théorique. N. Komiha

Application à l’ordre 2 : • L’équation (10) donne : • E 2 n =< n 0 IPI n 1> • Soit en tenant compte de (15): • Et donc : cours de chimie théorique. N. Komiha

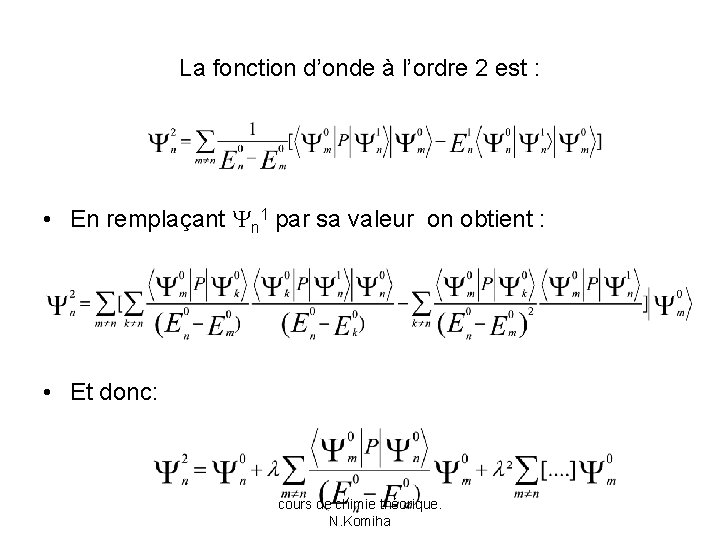
La fonction d’onde à l’ordre 2 est : • En remplaçant n 1 par sa valeur on obtient : • Et donc: cours de chimie théorique. N. Komiha

Chapitre II-Fonctions d’onde moléculaires Spin-orbitales et déterminants de Slater • Dans la théorie des orbitales moléculaires(OM), la fonction d’onde totale est obtenue à partir des fonctions décrivant les électrons individuellement dans le champ crée par les autres électrons et par les noyaux. • L’orbitale moléculaire est une fonction monoélectronique incluant une composante spatiale et une composante de spin(spin-orbitale): • (ri, i) = (ri) i • Chaque orbitale moléculaire est caractérisée par sa propre énergie ei. Les électrons de la molécule sont distribués sur les OM (occupant doublement les plus basses dans le cas de l’état fondamental). • La fonction d’onde totale du système est un déterminant de Slater construit sur ces OM. cours de chimie théorique. N. Komiha

a- La fonction d ’onde utilisée est donc un déterminant de Slater( somme anti-symétrisée de tous les produits possibles d ’OM) • (1, 2, …N)=1/ N! p p Pp 1(1) 2(2). . N(N) • où Pp est un opérateur qui réalise la permutation de 2 électrons , p un facteur qui vaut +1 ou -1 selon que la permutation est paire ou impaire et où la sommation est étendue à toutes les permutations possibles. cours de chimie théorique. N. Komiha

Ce déterminant s ’écrit aussi : • Une fonction de cette forme tient compte des propriétés fondamentales d ’un système d ’électrons : indiscernabilité et antisymétrie. • C ’est la représentation la plus simple du principe de Pauli : le déterminant s ’annule si deux lignes sont identiques c. à. d. si 2 électrons sont décrit par la même spin orbitale et jouent le même rôle. • Ce déterminant peut être noté : • = | 1(1) 2(2). . N(N)| cours de chimie théorique. N. Komiha

• Rappelons que dans l ’approximation B-O l ’hamiltonien s ’écrit: • VNN est un terme constant représentant la répulsion mutuelle des noyaux pour la géométrie considérée, nous le noterons H 0 dans la suite du cours. • La somme des deux premiers termes de cette expression est habituellement appelée hamiltonien monoélectronique(énergie cinétique et attraction par les noyaux des électrons), noté , dans la suite du cours. • VEE est un terme biélectronique (répulsion entre électrons), noté . • On peut donc écrire que HE= H 0 + + cours de chimie théorique. N. Komiha

C-Calcul de l ’énergie d ’un déterminant de Slater • L ’énergie s ’exprime de la manière suivante: • la constante H 0 n ’intervient pas dans la résolution de l ’équation électronique mais on n ’oubliera pas l ’existence de ce terme lors de calculs de grandeurs énergétique font intervenir un changement de géométrie (ex: énergie de dissociation). cours de chimie théorique. N. Komiha

Il faut donc calculer un certain nombre d ’intégrales portant sur les spin-orbitales i: • i*O i i où O désigne un des types d ’opérateurs contenus dans l ’hamiltonien (constant , mono-électronique ou bi-électronique). • La spin-orbitale se décompose en une fonction d ’espace et une fonction de spin de forme ( ) ou ( ) selon que le spin de l ’électron considéré est +1/2 ou -1/2 : • i= i ou i = i . • Les fonctions de spin et sont elles-mêmes orthogonales: * d = * d =1 et * d = * d =0 • L’orthogonalité de 2 spin-orbitales peut résulter de l’orthogonalité des fonctions de spin , de celles des fonctions d’espace ou des deux à la fois. cours de chimie théorique. N. Komiha

En principe , pour calculer une intégrale telle * O , on doit combiner chacune des permutations contenues dans * avec chacune des permutations de • * O d = 1/ N! p p Pp 1*(1) 2*(2). . N*(N) : O 1/ N! p p Pp 1(1) 2(2). . N(N) d. • Il existe, toutefois, une simplification • pour les opérateurs O qui agissent symétriquement sur un ensemble d’électrons, • comme c’est le cas de l’opérateur H( ) qui est somme d’opérateurs mono-électroniques agissant de la même façon sur chaque électron, • ou de l’opérateur < H( , ) qui est somme d’opérateurs biélectroniques agissant de la même façon sur chaque paire d’électrons et de l’opérateur unité. cours de chimie théorique. N. Komiha

• On peut réduire le déterminant * à sa diagonale principale à condition de supprimer les deux facteurs 1/ N! : • * O d = 1*(1) 2*(2). . N*(N) O p p Pp 1(1) 2(2). . N(N) d. cours de chimie théorique. N. Komiha

Comme il y a N! permutations dans *, on peut montrer , en effet, que chaque terme se trouve répété N! fois après intégration. • i) Cas de l’opérateur unité (ou d’un opérateur scalaire) • * d = 1*(1) 2*(2). . N*(N) x p p Pp 1(1) 2(2). . N(N) d. • Le seul terme non nul est: 1*(1) 1(1) d. 2*(2) x 2(1) d. . N*(N) N d =1. • ii)Cas d’un opérateur somme d’opérateurs monoélectroniques • Une telle intégrale s’écrit : • * d = 1*(1) 2*(2). . N*(N) p p Pp 1(1) 2(2). . N(N) d. cours de chimie théorique. N. Komiha

Calculons le terme particulier : *H( ) d = 1*(1) 2*(2). . i*( ). . N*(N) H( ) p p Pp 1(1) 2(2). . i( ). . N(N) d , • où i( ) désigne l ’orbitale affectée à l ’électron dans la diagonale de . • La seule permutation donnant un résultat non nul est l ’identité : 1*(1) 2*(2). i*( ). N*(N) H( ) 1(1) 2(2). . i( ). . N(N) d • = 1*(1) 1(1) d 1 x 2*(2) 2(2) d 2. . i*( )H( ) i( ) d . N*(N) N(N) d N= i*( )H( ) i( ) d • puisque les orbitales sont normées à l ’unité. • Si l ’on pose : Ii= i*( )H( ) i( ) d • = i*( )H( ) i( ) d où l ’indice i se rapporte à la fonction et non cours de chimie théorique. l ’électron. N. Komiha

On a donc : • * d = i*( )H( ) i( ) d = Ii • On remarque la sommation contenue dans l ’intégrale initiale se trouve transformée en une sommation sur les indices i des spin-orbitales. cours de chimie théorique. N. Komiha

iii) Cas d’un opérateur somme d’opérateurs biélectroniques: • Une telle intégrale s ’écrit : • * d • Calculons le terme particulier: • 1*(1) 2*(2). . j*( ). N*(N) H( , ) p p Pp 1(1) 2(2). . i( ). . N(N) d , • L ’opérateur H( , ) ne concerne que les électrons et donc: • 1*(1) 1(1) d 1 x 2*(2) 2(2) d 2. . N*(N) N(N) d N. i*( ) j*( ). H( , )[ i( ) j( )-. i( ) j( )] d µ d . cours de chimie théorique. N. Komiha

Lors de l’intégration sur les coordonnées de spin des électrons et , deux cas peuvent se présenter : • si dans la diagonale de les électrons et ont même spin , les deux termes donnent une contribution nulle , • mais si les spins de i et j sont différents, il ne subsiste que le premier terme car en permutant les électrons et on a : i*( ) j*( ). H( , ) i( ) j( ) d µ d i*( ) j*( ). H( , ) i( ) j( ) dvµ dv *( µ)d µ *( ) d =0. • Si l’on pose : i*( ) j*( ). H( , ) i( ) j( ) d µ d =Jij i*( ) j*( ). H( , ). i( ) j( )] d µ d =Kij où les indices i et j réfèrent aux spin-orbitales. • La contribution de l’opérateur H( , ) sera : Jij-Kij ou bien Jij selon que les électrons et ont ou pas cours de chimie théorique. N. Komiha le même spin dans la diagonale principale de .

Convenons d ’affecter d ’un indice i impair les spin-orbitales ayant une fonction de spin et d ’un indice j pair les spinorbitales ayant une fonction de spin . • On obtient donc: • * d = Ni<j Jij - Ni<j impair Kij - Ni<j pair Kij où les sommations portent maintenant sur les indices des spinorbitales. • iiii) Expression de l ’énergie totale : • En résumé, l ’énergie totale E d ’un système de N électrons représenté par un déterminant de Slater est : E= Ni. Ii + Ni<j Jij - Ni<j impair Kij - Ni<j pair Kij+H 0 • ou: E= Ni. Ii +1/2( Nijcours de chimie théorique. Jij - Ni, j de même parité Kij )+H 0 N. Komiha

Dans cette expression, toutes les sommations portent sur les indices des spin-orbitales figurant dans le déterminant de Slater. • Les termes Ii représentent l ’énergie cinétique et l ’énergie d ’attraction par les noyaux d ’un électron décrit par la spin-orbitale i. • Les termes Jij représentent l ’énergie de répulsion électrostatique de deux électrons et répartie dans tout l ’espace avec des densités i* i et j* j , ils sont appelés intégrales coulombiennes. • Les termes Kij , appelés intégrales d ’échanges , n ’ont pas d ’interprétation physique classique, ils n ’existent qu ’entre électrons de même spin. • Jij représentent des forces répulsives et Kij , affectées du signe moins, des forces attractives. cours de chimie théorique. N. Komiha

Energie d’un système à couches complètes: • Considérons un système contenant un nombre pair d’électrons: N=2 n , n électrons de spin et n électrons de spin : • 1= I = I _ 2= I = 3= II _ 4= II … _ N= n cours de chimie théorique. N. Komiha

On peut donc écrire , après intégration des coordonnées de spin , que : I 1 = I 2 = II ; I 3 = I 4 = III etc … J 12 = JI I ; J 23 = JI II ; J 34 = JII II etc … • L’ énergie totale s’écrit donc : E= ni=1 2 Ii + ni=1 Jii - ni<j (4 Jij - 2 Kij ) +H 0 • où i se rapporte cette fois à l’indice des orbitales d’espace i : • le premier terme est l’Ec+Eattraction nucléaire d’un système d’orbitales i doublement occupées; • le deuxième terme est la répulsion coulombienne entre 2 électrons occupant la même orbitale i ; • 4 Jij est la répulsion coulombienne entre 2 électrons occupant i et deux électrons occupant j ; • 2 Kij est un terme d’échange. • Un tel système porte le nom d’un système à couches complètes ou fermées (closed shells system). cours de chimie théorique. N. Komiha

Du fait que Jii=Kii et Jij =Jji et Kij=Kji, • on écrit souvent l’énergie d’un système à couches complètes : • E= ni=1 2 Ii + ni, j (2 Jij - Kij ) +H 0 • Pour un système à couches incomplètes (open-shells system) comprenant 2 n+1 électrons dont n+1 de spin et n électrons de spin , l’énergie s’écrit : • E= ni=1 2 Ii +In+1 + ni, j (2 Jij - Kij ) + ni (2 Ji, n+1 - Ki, n+1 ) + H 0 le dernier électron de spin est affecté à l’orbitale n+1. cours de chimie théorique. N. Komiha

Approximation LCAO-MO : • Si on s’intéresse à un système moléculaire et non à un atome , on adopte l’approximation LCAO-MO • i = mp=1 cpi p dont les coefficients sont déterminés par un processus variationnel: • Ii = mp=1 mq=1 c*pi cqi *p( ) H( ) q( ) d • Jij = mp=1 mq=1 mr=1 ms=1 c*pi cqi c*rj csj *p( ) *r ( ) H( , ) q ( ) s( ) d d • Kij= mp=1 mq=1 mr=1 ms=1 c*pi cqi c*rj csj *p( ) *r ( ) H( , ) q ( ) s( ) d d cours de chimie théorique. N. Komiha

ou alors : Ii = mp=1 mq=1 c*pi cqi Ipq; Jij = mp=1 mq=1 mr=1 ms=1 c*pi cqi c*rj csj (pq; rs) Kij= mp=1 mq=1 mr=1 ms=1 c*pi cqi c*rj csj (ps; rq • Avec : Ipq = *p( ) H( ) q( ) d • et : (pq; rs) = *p( ) *r ( ) H( , ) q ( ) s( ) d d cours de chimie théorique. N. Komiha

Chapitre IIIETATS EXCITES ET INTERACTION DE CONFIGURATIONS cours de chimie théorique. N. Komiha

1) Construction de fonctions d’onde moléculaire pour des états excités: • La résolution des équations de H. F. fournit plus d’orbitales que nécessaire pour construire le déterminant de Slater de l’état fondamental. • L’approximation LCAO-MO : i = mp=1 cpi p donne m orbitales (m n) , • nous avons n orbitales occupées et m-n orbitales virtuelles : • notation: _ _ 0= | 1 1 2 2| _ 4 4 1= | 1 1 2 3| 3 3 2 2 1 1 cours de chimie théorique. 0 1 N. Komiha

La méthode de Hartree-Fock comporte des défauts: • elle décrit imparfaitement la répulsion électronique, • chaque électron évolue librement dans le champ des noyaux et le champ moyen des autres électrons, le mouvement d’un électron n’influe donc pas , comme il le devrait , sur la position instantanée d’un autre électron. • Il manque l’énergie de corrélation électronique. En conséquence , la probabilité que 2 électrons soient proches est trop forte: • Ecorrélation=(Escf-Eexact) • les états électroniques ne peuvent pas toujours être décrits par un seul déterminant de Slater, ils ne sont a toujours états cours de chimie théorique. 2 N. Komiha propres de S et Sz.

2) Développement d’une fonction d’onde en série de configurations : • Les fonctions d’onde décrivant correctement les états électroniques doivent être fonctions propres de l’hamiltonien exact H. • Or les divers déterminants que l’on peut construire à partir des OM SCF ne satisfont pas cette condition. • Les fonctions propres de H devront être trouvées en diagonalisant H dans la base formée par tous les déterminants possibles construits sur toutes les OM provenant des calculs SCF ( interaction de configurations I. C. ). • Ces fonctions propres sont des combinaisons linéaires de déterminants (configurations). cours de chimie théorique. N. Komiha

• Les solutions exactes de l’équation de Schrödinger sont développables en séries infinies de déterminants de Slater K : • = K d. K K • K : configurations fondamentale et excitées obtenues par les différents arrangements des N électrons dans les différentes orbitales, • d. K : coefficients numériques associés à chaque état . • Dans la pratique la suite n’est pas infinies mais tronquée. • Les coefficients d. K sont déterminés par une méthode variationnelle qui minimise l’énergie. cours de chimie théorique. N. Komiha

L ’expression de l ’énergie moyenne est: • • Elle doit être minimum et donc : • et donc nous obtenons le système d ’équations suivant : cours de chimie théorique. N. Komiha

Pour obtenir des solutions non nulles pour ce système d ’équations, nous devons avoir : • det | HKL - E SKL | =0. • Les règles de Slater , données ici, permettent de simplifier le calcul des intégrales HKL: • Les configurations correspondant à des états de spins orthogonaux n ’interagissent pas entre elles (H ne contient pas de variables de spin), • les configurations de symétries différentes n ’interagissent pas entre elles (H est totalement symétrique ), • les mono-excitations n ’interagissent pas directement avec la configuration fondamentale (théorème de Brillouin) mais interagissent avec les bi ou multi-excitées, • les configurations différant de plus de deux spin-orbitales n ’interagissent pas directement entre elles (H est au plus bi-électronique). cours de chimie théorique. N. Komiha

La méthode d’interaction de configuration permet : • D’améliorer l’énergie des états calculés; • Les états calculés étant fonctions propre de l’hamiltonien, ils sont aussi fonctions propres de S² et Sz. On obtient donc les états spectraux du système. • Exemple : états de la molécule de H 2 (triplet, singulet). - Dissociation de H 2. . cours de chimie théorique. N. Komiha

Bases d’orbitales atomiques (OA) cours de chimie théorique. N. Komiha

Les calculs ab-initio utilisent l’approximation LCAO-MO : i = mr=1 cri r • Le choix de la base d’OA { r} s’impose. Ce choix est crucial et détermine à lui seul la qualité du calcul, tant que l’on reste au niveau Hartree-Fock. • I-Orbitales de Slater • A- Base minimale • C’est le choix le plus naturel : on utilise les OA occupées dans les atomes libres • Par exemple, les orbitales 1 s, 2 px, 2 py et 2 pz pour les atomes de la deuxième période: B, C, N, O, F, Ne ou l’orbitale 1 s pour H et He. • Une telle base est dite minimale. L’expression de ces OA sont: 1 S = Ne- r 2 S = N’ r e- ’r • ces 2 orbitales sont différentes et ne sont pas orthogonales. cours de chimie théorique. N. Komiha

• 2 px = N x e- r 2 py = N y e - r 2 pz = N z e = N(xx, yy, zz, xy, yz, ou xz) e- r 3 d • Il reste à choisir les exposants de ces orbitales. Les exposants valables pour les atomes libres ne sont pas un bon choix pour les atomes liés , on les détermine par minimisation de l’énergie , seul critère de choix possible dans les méthodes ab-initio. En pratique, on constate que ces exposants varient peu d’une molécule à l’autre , on se sert donc de valeurs standards . • B- Bases double zeta : Le nombre d’OA est doublé : chaque OA de la base minimale est remplacé par 2 OA d’exposants différents. Celle de plus grand exposant est dite contractée et celle de faible exposant est dite diffuse. On parle alors de base double zeta ou DZ. • Les calculs utilisant ce type de base reproduisent beaucoup mieux les observables expérimentales. La base DZ apporte de la flexibilité à la cours de chimie théorique. fonction d’onde. N. Komiha

C- Bases polarisées : • Se dit d’une base à laquelle on ajoute des OA de polarisation , c-à-d. de nombre quantique l supérieur à ceux des OA d’une base minimale. • Exemple : orbitales 3 d pour les éléments de la deuxième période: Be, B, C, N, O, F, Ne ou 2 p pour H, He et Li. • D- Bases diffuses : • Ce sont des orbitales de très faible exposant(0. 1 à 0. 03) , elles sont indispensables à la description des anions (description des affinités électroniques). • E- Orbitales de Rydberg : • Leur exposant est encore plus faible que celui des orbitales diffuses. Elles servent à décrire les états Rydberg ( ceux de NH 4 par exemple qui peut être considérée comme formée d’un électron gravitant dans le champ cours de chimie théorique. d’un cation ammonium NH 4+, l’électron est donc très lointain et nécessite N. Komiha une orbitale étalée dans l’espace ).

F- Limite Hartree-Fock : • On peut agrandir indéfiniment la taille de la base d’OA en ajoutant toujours plus d’orbitales de polarisation et d’orbitales diffuses ; • cependant l’énergie des molécules calculées ne baisse pas indéfiniment mais atteint rapidement une limite appelée limite Hartree-Fock • c’est le meilleur calcul que l’on peut faire dans l’approximation Hartree-Fock. • Il faut trouver un compromis entre la taille des calculs et la précision des résultats. cours de chimie théorique. N. Komiha

II-Bases de gaussiennes contractées: • Les intégrales bi-électroniques (pq, rs) sont difficiles à calculer en base d ’OA de Slater , elles le sont bien plus facilement en base de gaussiennes. • On remplace donc chaque orbitale de Slater par une combinaison linéaire de gaussiennes. • L ’orbitale ainsi construite est sensée ressembler le plus possible à une OA de Slater. • Ces combinaisons linéaires sont fixées une fois pour toute, quelque soit la valeur des exposants choisis : 1 S ( r)= K d 1 S, K exp(- 1 S, K ² r²) • les d 1 S, K sont appelés coefficients de contraction(déterminés par la méthode des moindres carrés ). Ces coefficients restent fixes pendant toute la durée du calcul. cours de chimie théorique. N. Komiha

Remarques : • Pour diminuer le nombre de gaussiennes dans le calcul, on prend souvent les mêmes exposants de gaussiennes pour les orbitales 2 s et 2 p : • 2 S, K = 2 P, K • Plus le nombre N de gaussiennes pour représenter est grand , plus le calcul est précis (en général N est compris entre 1 et 6). • Des bases standards ont été déterminées , il est devenu inutile , sauf dans des cas très particulier , de déterminer soimême les meilleurs exposants et les meilleurs coefficients de cours de chimie théorique. contractions. N. Komiha

III-Bases standard : • Ce sont des bases de gaussiennes contractées. • A-Bases de Pople : • Les bases minimales sont dénommées STO-NG où N est le nombre de gaussiennes par OA. Exemple : STO-2 G, STO-3 G, STO-6 G. • Dans les bases double-dzeta, les orbitales de la couche de valence sont dédoublées, celles de cœur sont traitées au niveau simple dzeta. Le premier chiffre désigne le nombre de gaussiennes pour chaque OA de cœur , le suivant concerne la OA de valence la plus contractée, le dernier (en général 1)concerne l’orbitale la plus diffuse . • Ainsi dans la base 4 -31 G : les orbitales 1 s du carbone , par exemple, sont représentées par une contraction de 4 gaussiennes et chaque orbitale 2 s et 2 p est dédoublée en 2 orbitales , l’une représentée par 3 gaussiennes et l’autre par 1 seule gaussienne. cours de chimie théorique. N. Komiha

Autres bases classiques : 6 -31 G, 4 -31 G, 3 -21 G. Bases de qualités triple dzeta : 6 -311 G. • Les bases polarisées sont désignée par * , si les atomes de la deuxième période ont des fonctions de polarisation , et par ** si les atomes d’hydrogène ou de He ont aussi des fonctions de polarisation. Ex : 6 -31 G* ou 6 -31 G**. • Si des orbitales diffuses sont ajoutées , on ajoute le signe + et ++ si H et He sont aussi dotées. Ex : 6 -31+G, 6 -31++G** etc… • B- Notation plus générale : • Une notation plus générale est employées pour les bases autres que celles de Pople. Elle consiste à employer deux séries de chiffre séparées par un /. La première série décrit le nombre de gaussiennes (dite parfois gaussiennes primitives ) et la seconde le nombre d’OA contractées . Exemple : 6 -31 G* se noterait : (9 s 4 p 1 d/3 s 2 p 1 d) et (4 S/2 s) pour les cours de chimie théorique. hydrogènes. N. Komiha

IV-Concept de pseudo-potentiel de cœur : • Les calculs ab-initio peuvent devenir extrêmement couteux pour des molécules comportant des atomes lourds. • Or ces atomes comportent de nombreuses orbitales ‘de cœur’ (par opposition aux orbitales de valence ) qui ne jouent aucun rôle dans les réactions chimiques et peuvent être considérées comme invariantes d’une molécule à l’autre. • La méthode des pseudo-potentiels consiste à remplacer ces orbitales par des fonctions analytiques déterminées une fois pour toute. Le processus variationnel est alors réduit aux orbitales de valence. Les performances de ces cours de chimie théorique. méthodes sont en général satisfaisantes. N. Komiha

THEORIE DE LA FONCTIONNELLE DENSITE (D. F. T) cours de chimie théorique. N. Komiha

• En chimie théorique le nombre d ’intégrale à calculer devient vite énorme : N 4 au niveau Hartree-Fock monodéterminantal et N 6 ou N 7 quand on introduit la corrélation électronique , N étant la dimension de la base d ’OA. • Pour cette raison, la formulation d ’autres méthodes moins dépendante de la dimension ont été recherchées. • La DFT remporte un grand succès actuellement car elle peut traiter des grands systèmes, en incluant la corrélation électronique, avec une size dépendance inférieure à N 4. • Elle représente une réelle alternative à la théorie Hartree-Fock. • La DFT est fondée sur le théorème de Hohenberg et Kohn qui établit que toute propriété de l ’état fondamental est uniquement déterminée par sa densité électronique . • L ’énergie totale est donc une fonctionnelle de , la nature exacte de cette fonctionnelle n ’est pas connue. • Kohn et Sham ont proposé la partition suivante : cours de chimie théorique. N. Komiha

E( )=T( )+U( )+Exc ( ) • T( ) : énergie d’un système de particules U( ) : énergie électrostatique (e-e, e-N, N-N) Exc ( ) : énergie d’échange et de corrélation. • Si la densité de charge est donnée par : ( r)= ni | i (r)|² où { i (r)} est ensemble de n orbitales orthogonales occupées . • On a alors : T( ) = ni < i (r)|-1/2 | i (r)> • les composantes de U sont : U( ) = ni < i (r)|- Na. Za/(Ra-ri) | i (r)>+1/2 ni nj[< i (r) j(r)|1/(ri-rj)| i (r ’)>]+ Na Nb. Za. Zb/(Ra-Rb) cours de chimie théorique. N. Komiha • où Za représente la charge nucléaire de l ’atome a.

L ’énergie d ’échange et de corrélation est donnée par l ’expression: • Exc= ( r) xc ( (r) ) dr où xc est l ’énergie d ’échange et de corrélation par électron appartenant à un gaz d ’électron de densité uniforme . • - soit xc est une fonctionnelle qui ne dépend que de la densité électronique de chaque spin (fonctionnelle locale ou LSD) • -Soit la densité présente des fluctuations , on développe xc ( ) en série qui fait apparaître des corrections dépendant des gradients successifs de la densité(fonctionnelle non locale). cours de chimie théorique. N. Komiha

• Pour un calcul LSD , la fonctionnelle de Vosko, Wilk et Nusair (VWN) est souvent utilisée. • Pour un calcul non local, on a souvent recours aux fonctionnelles non locales de corrélations de Perdew ou de Perdew et Wang ou bien encore celle de Becke. • Il est connu qu ’avec l ’approximation LSD, l ’énergie de corrélation est surestimée de 100%, tandis que l ’ énergie d ’échange est sous-estimée de 10%. • Cependant, les propriétés telles que la géométrie moléculaire et les fréquences de vibration sont bien décrites en LSD , par contre , les énergies de dissociation sont mal décrites(trop grandes) ainsi que les faibles liaisons ( liaisons hydrogène). • Une partie de l ’erreur est due à la self-interaction (le potentiel vu par un électron est produit par lui-même et par les autres électrons ). • Il faut remarquer que le coût d ’un calcul SCF non local est beaucoup plus cours de chimie théorique. grand(3 fois) qu ’un calcul LSD. N. Komiha

• Dans la méthode DFT , les orbitales électroniques(un jeu pour chaque spin) sont aussi prises comme combinaisons linéaires d ’OA • i (r)= c i (r) • où { } est une base de gaussiennes contractées centrées sur les atomes. • Ces bases sont similaires à celles utilisées dans la méthode Hartree-Fock (Husinaga, Dolg etc. . ), elles sont simplement réoptimisée pour la DFT. • Si ces bases sont suffisamment grandes et flexibles , il n ’est pas nécessaire de les réoptimiser. cours de chimie théorique. N. Komiha

• La densité électronique : ( r) = (r) + (r) est fonction de l ’ensemble des coefficients {c i }. • Ces coefficients sont obtenus à partir des équations de Kohn-Sham qui sont analogues aux équations de Roothaan dans la théorie Hartree-Fock : • F c i = i S c i • où S = < | > • F est un élément de la matrice de Fock de spin : F =h +< |1/r 12| > + < |v xc| > • v xc : potentiel d ’échange et de corrélation , • i : énergies orbitalaires (dont la signification est différentes de celles de la méthode Hartree-Fock). • L ’ensemble de ces équations est obtenus en minimisant l ’énergie totale par rapport aux coefficients c i sous contraintes des conditions d ’orthonormalisation. cours de chimie théorique. N. Komiha

• Analyse de la solution SCF : • • énergies orbitalaires , population de recouvrement , charges, ordres de liaison et valence cours de chimie théorique. N. Komiha

• L’énergie totale et le moment dipolaire sont parmi les propriétés calculées vérifiables expérimentalement. • Il existe, cependant, des quantités extraites de calculs qui ne peuvent être déterminées expérimentalement. Parmi ces quantités : • • l’énergie d’une orbitale, l’ordre de liaison entre deux centres, la valence d’un centre , la charge ponctuelle d’un centre. • Ces concepts permettent d’approfondir la connaissance des systèmes calculés. cours de chimie théorique. N. Komiha

A- Les énergies orbitalaires : • Les énergies orbitalaires obtenues par résolution des équations de Kohn. Sham ne peuvent être interprétées de la même façon que dans la théorie Hartree-Fock : • le théorème de Koopmans n’est pas applicable , i ne représente pas l’énergie d’ionisation. L’énergie i est plutôt liée à une dérivée de l’énergie totale : i = E/ ni : nombre d’occupation. • Pour rendre compte des énergies d’ionisation avec la DFT , on utilise la théorie de l’état de transition de Slater. • Dans cette méthode , un demi électron est enlevé de l’orbitale moléculaire i , créant ainsi un système fictif , un état de transition qui se situe entre l’ion et la molécule parente. • Après un calcul SCF sur cet état de transition , l’énergie i devient une bonne approximation de l’énergie d’ionisation (voir exemple). cours de chimie théorique. N. Komiha

• La méthode de l’état de transition permet aussi de prédire les énergies d’excitation entre deux orbitales i et j : • un demi électron demeure dans i et l’autre demi électron est placé dans j ; • après un calcul SCF sur cet état , la différence des énergies orbitalaires i et j est une bonne approximation de l’énergie d’excitation. • Exemple : pour les états excités singulet et triplet de H 2 O , on obtient 8. 14 et 7. 89 e. V respectivement alors que les valeurs expérimentales sont 7. 49 et 7. 14. • Cependant, on ne doit oublier que la seule manière correcte de calculer ces grandeurs sont le calcul de l’état initiale et de l’état final. • Les énergies orbitalaires permettent aussi de prédire d’autres phénomènes chimiques : • - la distortion Jahn-Teller du radical CH 3 O : un seul électron dans une orbitale doublement dégénérée au niveau de Fermi; cours de chimie théorique. • -système métallique : forte densité d’OM autour du niveau de Fermi. N. Komiha

B-Population électronique : • La densité électronique est donnée par l’expression : • ( r) = (r) + (r) = i ni [ i(r) ]² + i ni [ i (r) ]² • L’analyse de population de Mulliken permet de partitionner cette densité : • [ i(r) ]² dr= c i (r) dr= c i S car : i (r)= c i (r) • On définit les éléments : • qi (A, B)= A B c i S de la matrice de population de recouvrement pour l’OM i. • Même si cette matrice n’a pas vraiment de signification physique rigoureuse , on peut définir le caractère de l’OM : cours de chimie théorique. N. Komiha

• qi (A, B)>0 indique l’OM est liante, • qi (A, B)<0 indique l’OM est anti-liante, • qi (A, B)= 0 indique l’OM est non liante. • La population assignée au centre A est donné par : QA = i ni Q i(A) + i ni Qi (A) avec Q i (A)= B qi (A, B) • les Charges de Mulliken sont alors obtenus par: q. A=ZA-QA où ZA est la charge du noyau A (réactivité…) cours de chimie théorique. N. Komiha

C-Ordre de liaison et valence : • Ces deux concepts sont indispensables à décrire la structure d’une molécule : lorsque l’ordre d’une liaison augmente, la longueur de la liaison diminue. • La valence de l’atome détermine le nombre de liaisons qu’il chera à former. • Même si on parle souvent de liaisons simples, doubles ou triples et d’une valence 4 pour le carbone , 3 pour l’azote et 2 pour l’oxygène , il n’y a pas de définition rigoureuse en chimie quantique pour l’ordre d’une liaison ainsi que la valence d’un atome. • Les ordres de liaison et les valences de Mayer (définis plus bas) sont souvent utilisés afin d’interpréter les solutions SCF en terme de concepts plus familiers aux chimistes. cours de chimie théorique. N. Komiha

• L’ordre de liaison BAB entre deux atomes A et B est selon Mayer : • BAB= A B [(P S) +(P S) ] • Tandis que la valence VA de l’atome A est donné par : VA = 2 QA- , A (PTS) où P et P sont les matrices densité correspondant aux deux spins et QA la population de Mulliken. • On démontre la relation entre ordre de liaison de Mayer et valence: VA = B(B A) BAB • Avec ces définitions les valeurs obtenues ne sont forcément cours de chimie théorique. exactement entières comme pour les valeurs classiques. N. Komiha

Exemples : • BC-C BC-H VC C 2 H 6 0. 93 0. 97 3. 89 C 6 H 6 1. 42 0. 97 3. 89 C 2 H 4 1. 97 0. 97 3. 89 C 2 H 2 2. 84 0. 95 3. 81 • Lors de calculs sur CH 4, NH 3, H 2 O et HF les valences de 3. 87, 2. 88, 1. 91 et 0. 92 sont respectivement obtenues pour les atomes C, N, O, F , valeurs proches des valeurs classiques entières. • Une mauvaise valeur de la valence peut révéler une lacune de la base d’OA. cours de chimie théorique. N. Komiha

CONCLUSION cours de chimie théorique. N. Komiha

Définition de la modélisation moléculaire: • Application des méthodes théoriques et méthodes de calcul pour résoudre des problèmes de structures et de réactivité chimique. • Ces méthodes peuvent être simples et rapides ou , au contraire , être extrêmement complexes demandant de nombreuses heures de calculs sur super-ordinateur. . cours de chimie théorique. N. Komiha

• Ces méthodes utilisent souvent des moyens infographiques très sophistiqués qui en facilitent l’utilisation et l’interprétation de la quantité impressionnante de nombres obtenus à l’issue de ces calculs. • Transformations de ces nombres en représentations graphiques facilement interprétables. cours de chimie théorique. N. Komiha

La modélisation par ordinateur d’une molécule implique : • Une présentation graphique de la géométrie, pour cela on utilise un logiciel infographique: Gaussview, Molden, Chemdraw. . • Suivie de l’ application d’une méthode théorique : méthodes quantiques ab-initio, semi-empiriques ou encore la mécanique moléculaire pour déterminer les propriétés physiques et chimiques de la molécule. • Ces méthodes sont implantées dans des logiciels commerciaux: Gaussian, Gamess, Molpro, turbomole , Spartan. . cours de chimie théorique. N. Komiha

• Avec les méthodes quantiques, on a accès à un ensemble de grandeurs qui aide à élucider la structure électronique de systèmes chimiques. • Les concepts de : l’énergie orbitalaire , de recouvrement, de charges atomiques , d’ordre de liaison et de valence permettent d’interpréter et de comparer la solution SCF en termes d’idées bien connues de tous les chimistes. • Il ne faut , cependant, pas oublier qu’en chimie quantique, certains de ces concepts sont définis à l’aide de formules arbitraires non vérifiables expérimentalement. • Ils peuvent être utilisés pour étudier l’évolution d’une propriété dans une série de composés mais leur valeurs absolues doivent être interprétées avec circonspection. cours de chimie théorique. N. Komiha

Bibliographie • • • A. Szabo, NS Ostlund, Modern Quantum Chemistry (1989) JA Polple , DL Bevridge, Approximate Molecular Orbital theory (1970) PW Atkins, Molecular Quantum Mechanics, Oxford University Press. WJ Hehre, L Radom, P Schleyer , JA Pople, Ab initio Molecular Orbital theory, Wiley(1986) JL Rivail , Eléments de chimie quantique à l’usage des chimistes, Editions CNRS(1989) JB Foresman, A. Frisch, Exploring chemistry with Electronic Structure Methods, Gaussian Inc. , Pittsburgh(1993) P. Hohenberg, W. Kohn, Phys. Rev. B. , 136, 864, (1964) W. Kohn, LJ Sham, Phys. Rev. A, 140, 1133 (1965) SH Vosko, L. Wilk, M. Nusair, Can. J. Phys. 58, 1200, (1980) C. Lee, W. Yang, RG. Parr, Phys. Rev. B, 37, 785, (1988) cours de chimie théorique. N. Komiha
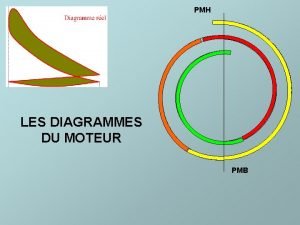
 Pmh pmb
Pmh pmb Partie theorique
Partie theorique Cadre théorique définition
Cadre théorique définition Attribuzione interna ed esterna
Attribuzione interna ed esterna Calore specifico metallo
Calore specifico metallo Teorema newton leibniz
Teorema newton leibniz Prima relazione fondamentale della goniometria
Prima relazione fondamentale della goniometria Ente geometrico definizione
Ente geometrico definizione Angoli notevoli
Angoli notevoli Prima legge della termologia
Prima legge della termologia Permutazioni circolari
Permutazioni circolari Legge fondamentale della termologia
Legge fondamentale della termologia Principio fondamentale calcolo combinatorio
Principio fondamentale calcolo combinatorio Norme humanitaire fondamentale
Norme humanitaire fondamentale Uqtr pp2c
Uqtr pp2c Congruence cours
Congruence cours Montage base commune
Montage base commune Cours interactif
Cours interactif Dialyse péritonéale
Dialyse péritonéale Compteur avec bascule jk
Compteur avec bascule jk Réponse
Réponse Psychologie analytique cours
Psychologie analytique cours Capteur et conditionneur cours
Capteur et conditionneur cours Data mining cours
Data mining cours Introduction aux relations internationales s1
Introduction aux relations internationales s1 Cours pharmacie constantine
Cours pharmacie constantine Connexion au serveur dynamic link en cours
Connexion au serveur dynamic link en cours Business plan cours
Business plan cours Acide base cours
Acide base cours Code vhdl
Code vhdl Grisaille abdominale
Grisaille abdominale Méthode hay grille
Méthode hay grille Dendrologie cours
Dendrologie cours Cytosquelette cours
Cytosquelette cours Fiche technique culinaire
Fiche technique culinaire Cours sur la perception en psychologie
Cours sur la perception en psychologie Vision par ordinateur cours
Vision par ordinateur cours Pum emg
Pum emg Cours architecture web
Cours architecture web Parkour meaning in french
Parkour meaning in french Hormone thyroïdienne
Hormone thyroïdienne Traitement automatique des langues
Traitement automatique des langues Vih cours ifsi
Vih cours ifsi En quoi consiste le bilan thermique du corps humain
En quoi consiste le bilan thermique du corps humain Antiseptique et désinfectant cours
Antiseptique et désinfectant cours Riahla cours
Riahla cours Robotique - cours et exercices
Robotique - cours et exercices 88 cours victor hugo cenon
88 cours victor hugo cenon Les anticoagulants cours ifsi
Les anticoagulants cours ifsi Ihm cours
Ihm cours Cours sur les trames
Cours sur les trames Aone cours
Aone cours Stratégie corporate cours
Stratégie corporate cours Ciblage indifférencié exemple
Ciblage indifférencié exemple Cours secondaire 5
Cours secondaire 5 Cod 1 pompier
Cod 1 pompier Politique commerciale cours
Politique commerciale cours Cours ihm
Cours ihm Cours introductif
Cours introductif Cours l2 neuchâtel
Cours l2 neuchâtel Cours présentation assistée par ordinateur
Cours présentation assistée par ordinateur Les suites du cours
Les suites du cours Cours sainte marie de hann piscine
Cours sainte marie de hann piscine Approche gar
Approche gar Cem cours
Cem cours Cours de narration
Cours de narration Cours traitement de texte
Cours traitement de texte Cours de communication professionnelle ppt
Cours de communication professionnelle ppt Gestion de projet cours résumé
Gestion de projet cours résumé Cours stmg
Cours stmg Audio numérique cours
Audio numérique cours Cours pl sql
Cours pl sql Glycemie a jeun
Glycemie a jeun Corporate finance cours
Corporate finance cours Cours d'orl
Cours d'orl Hydrologie cours
Hydrologie cours Probabilité cours
Probabilité cours Sadt
Sadt Ses versailles cours inversés
Ses versailles cours inversés E marketing planning process
E marketing planning process Identitovigilance définition oms
Identitovigilance définition oms Communication médiatique cours
Communication médiatique cours Chirurgie thoracique infirmier
Chirurgie thoracique infirmier Cours emarketing
Cours emarketing Evolution de l'aspirateur au cours du temps
Evolution de l'aspirateur au cours du temps Cours sévigné abidjan
Cours sévigné abidjan Cours sur les antennes
Cours sur les antennes Tableau de perte de charge
Tableau de perte de charge Distance interréticulaire monoclinique
Distance interréticulaire monoclinique Dut abb
Dut abb Les parties du texte narratif
Les parties du texte narratif Commentaire jsp
Commentaire jsp Stratégie de développement des ressources humaines
Stratégie de développement des ressources humaines Cours premier principe de la thermodynamique
Cours premier principe de la thermodynamique Guillaume villemaud
Guillaume villemaud L'équilibre alimentaire cours ifsi
L'équilibre alimentaire cours ifsi Les incoterms cours
Les incoterms cours Cned 360
Cned 360 Aéraulique cours
Aéraulique cours Crise biologique
Crise biologique Cours technologie charcuterie
Cours technologie charcuterie La tectonique des plaques - cours
La tectonique des plaques - cours Cours anthropologie infirmier
Cours anthropologie infirmier Psychologie expérimentale - cours
Psychologie expérimentale - cours