LA CHIMIE PHYSIQUE Chapitre 1 La chimie sa




















- Slides: 22

LA CHIMIE PHYSIQUE Chapitre 1 La chimie : sa genèse Guy COLLIN, 2014 -12 -28

Préambule • • La compréhension de notre environnement physique, chimique ou biologique, repose sur le concept de la théorie atomique de la matière. Comment cette théorie a-t’elle pris naissance ? Comment a-t’elle évolué ? Qu’elles en sont les limites ? 2014 -12 -29

L’Antiquité n n n Les chinois connaissaient la poudre à canon et fabriquaient des céramiques. Les égyptiens savaient extraire un certain nombre de métaux dont l’or et l’argent. Le sol était déjà source de minium, de vert de gris, d’ocre de fer, … Les phytomédecines étaient à la mode tout comme les huiles parfumées. La macération de fleurs déposées dans de l’huile chaude de même que le procédé d’enfleurage étaient également connus. 2014 -12 -29

L’Antiquité n Les premiers essais de théorisation de la matière sont le fait d’une série de philosophe grecs. u Pourquoi et comment tout ce qui existe s’est-il produit ? u Quelles sont les origines et la finalité de la matière ? n Pour THALÈS (625 -547 avant J. -C. ) : rien ne vient de rien, tout vient et retourne à l’eau. 2014 -12 -29

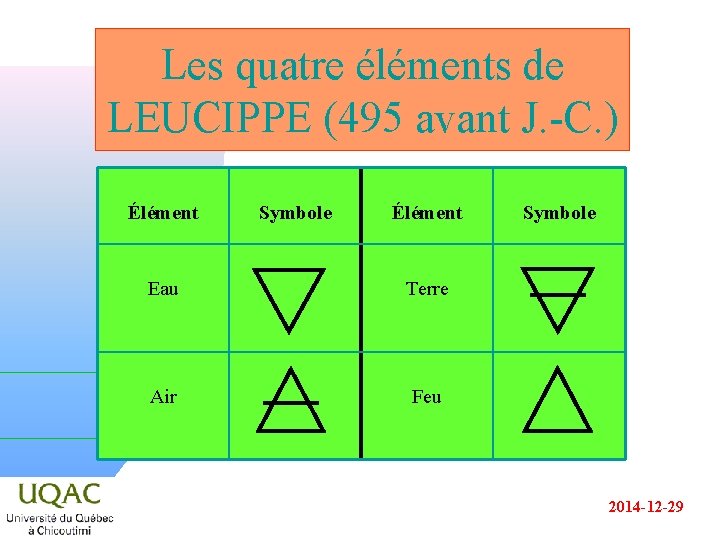
Les quatre éléments de LEUCIPPE (495 avant J. -C. ) Élément Symbole Élément Eau Terre Air Feu Symbole 2014 -12 -29

DÉMOCRITE (450 -390 avant J. -C. ) n n n Si tout corps est divisible à l’infini, de deux choses l’une : ou il ne restera rien ou il restera quelque chose. Dans la première éventualité, la matière n’a qu’une existence virtuelle. Dans la seconde, on doit se poser la question : que reste-til ? La réponse la plus logique réside dans l’existence d’éléments réels, indivisibles appelés atomes. Le concept de l’atome est né ! 2014 -12 -29

L’Antiquité … et les Romains n n PLATON (429 -349 avant J. C. ) puis ARISTOTE (381 -322 avant J. C. ) ne retinrent pas cette approche atomistique. Ce dernier ajouta l’éther, sorte de quintessence de la matière. Les romains avaient un esprit beaucoup plus pratique philosophique. La réflexion philosophique va alors céder le pas à l’observation. Il s’ensuit une longue période de stagnation pour l’évolution de la chimie… 2014 -12 -29

L’alchimie n n L’alchimie, la chimie du Moyen-âge, fut assimilée par les arabes vers le milieu du VIIe siècle. Ce n’est qu’après le XIe siècle qu’elle s’est développée au sein de l’Occident chrétien. La préoccupation majeure des alchimistes était de découvrir la pierre philosophale. Cette pierre philosophale devait permettre la fabrication de l’or et devait aussi procurer jeunesse, santé, longue vie … 2014 -12 -29

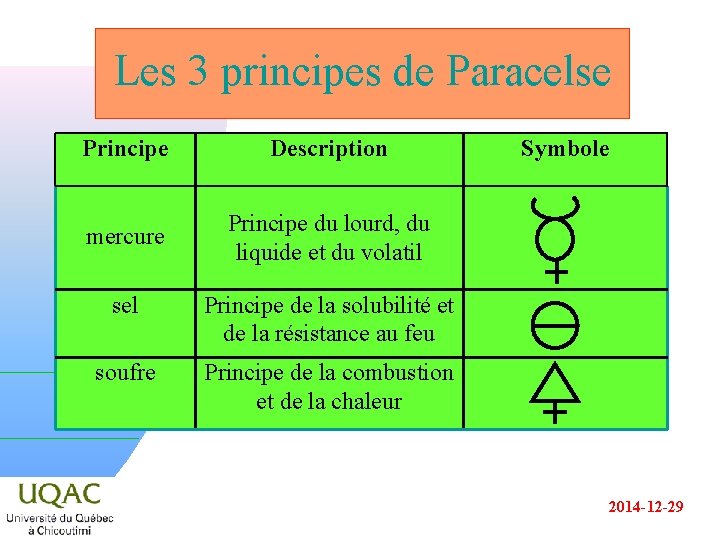
Le passage vers la chimie (XVIe siècle) n n n PARACELSE (1493 -1541), médecin suisse fut le créateur de la théorie selon laquelle tous les phénomènes physiologiques et pathologiques sont dus à des réactions chimiques : c’est l’iatrochimie. Il prétendait disposer de la recette de création d’un être humain. Le sel, le soufre et le mercure viennent s’ajouter aux éléments d’ARISTOTE. 2014 -12 -29

Les 3 principes de Paracelse Principe Description mercure Principe du lourd, du liquide et du volatil sel Principe de la solubilité et de la résistance au feu soufre Principe de la combustion et de la chaleur Symbole 2014 -12 -29

Les percées du XVIe siècle n n Les premières études systématiques des minerais et la minéralogie sont le fait d’un allemand : AGRICOLA (1494 -1555). LIBAVIUS (1550 -1616) classe les métaux en deux groupes : les vrais métaux (or, argent, fer, …) et les demi-métaux (antimoine, arsenic, …). Bernard PALISSY (1510 - 1590) verrier de profession, découvre le secret de la fabrication des émaux. Francis BACON (1561 -1626) expose les principes d’une méthode inductive et expérimentale… 2014 -12 -29

Le XVIIe : le siècle de la Raison n n J. B. Van HELMONT (1577 -1644) distingue les gaz ininflammables comme le « gaz sylvestre » , le gaz carbonique, des gaz inflammables comme le gaz des marais, le méthane, On doit à R. BOYLE (1627 -1691) plusieurs nouveaux réactifs : le nitrate d’argent, l’ammoniac, un indicateur coloré, le sirop de violette, pour distinguer les acides bases, la séparation du méthanol de l’acide acétique sans oublier la loi de compressibilité des gaz que découvrit indépendamment le moine français MARIOTTE (1620 -1684). Jean REY (1583 -1645) est sans doute le premier à avoir imaginé et proposé le principe de conservation de la matière. J. R. GLAUBER (1604 -1668) peut être considéré comme le fondateur de l’industrie chimique. 2014 -12 -29

Le XVIIIe siècle n n n Ce siècle est dominé par la théorie du phlogistique Élaborée par E. STAHL (1660 -1734) cette la théorie essai de rendre compte des observations obtenues lors de la calcination des métaux, de la combustion et de la respiration. Le phlogistique, selon cette théorie, était contenu dans tout composé combustible et transformable sous l’action de la chaleur. le phlogistique se dégagerait au cours d’une réaction d’oxydation : un métal, en brûlant, devrait donc perdre du poids. CAVENDIH, PRIESTLEY, … continueront de faire référence à la théorie du phlogistique, seule théorie disponible en ce début du XVIIIe siècle. 2014 -12 -29

La fin de la théorie du phlogistique n n M. LOMONOSSOV (1711 -1765) récrivit le principe de conservation de la matière déjà énoncé par REY : « tous les changements se font de telle sorte que ce qu’on enlève à un corps, on l’ajoute à l’autre » . C. -W. SCHEELE (1742 -1786), brillant par son sens de l’observation, associera le phlogistique au calorique. J. BLACK (1728 -1799) et H. CAVENDISH (1731 -1810) vont créer les premiers rudiments de la future thermodynamique chimique. LAVOISIER aura le mérite d’introduire l’usage systématique de mesures quantitatives dans ses travaux de laboratoire en plus d’avoir un esprit de généralisation sans équivalent. . 2014 -12 -29

Lavoisier (1743 -1793) § LAVOISIER pouvait affirmer que l’eau n’était pas l’élément simple admis depuis l’Antiquité mais bien une composition d’oxygène et d’hydrogène. § Cette approche qualifiée de théorie « antiphlogistique » par les tenants de la théorie du phlogistique rencontra un grand nombre de détracteurs tout particulièrement en Allemagne. § LAVOISIER allait cependant faire de nombreux adeptes dans la presque totalité des pays européens et ailleurs. 2014 -12 -29

Le XIXe siècle : l’explosion de la chimie § J. L. PROUST (1754 -1826) énonçait en tout début de ce siècle (en fait en 1801) la loi des proportions définies. § La loi des proportions multiples énoncée par DALTON en 1804 vient étendre la loi des proportions définies aux éléments qui se combinent de diverses manières. § J. B. RICHTER (1762 -1807) expose entre 1792 et 1793 sa théorie de poids de combinaison invariable. § A. AVOGADRO (1776 -1856) réinterprète les lois des rapports volumétriques. § L. J. GAY-LUSSAC ( 1778 -1850) formule l’hypothèse selon laquelle des volumes égaux de gaz différents contiennent le même nombre de molécules. 2014 -12 -29

Le XIXe siècle : l’explosion de la chimie § Plusieurs sous-disciplines de la chimie vont se développer: § La thermochimie profite largement des travaux de J. R. von MAYER (1814 -1878) et de J. P. JOULE (1818 -1889) énonçant (1842) et confirmant (1843) le premier principe de la thermodynamique. § Michael FARADAY (1791 -1867) qui, en plus de la théorie, introduit le vocabulaire et surtout décrit les lois de l’électrolyse. § J. J. BERZÉLIUS (1799 -1848) a marqué singulièrement le développement de la cinétique chimique. § L. BOLTZMANN (1844 -1906) est le créateur de la théorie cinétique des gaz. 2014 -12 -29

Le XIXe siècle : l’explosion de la chimie § Plusieurs sous-disciplines de la chimie vont se développer (suite et fin): § D. I. MENDÉLEIEV (1834 -1907) et son célèbre tableau périodique. § H. BESSEMER (1813 -1898) met au point son procédé de fabrication de l’acier. § Énoncé de la loi d’action de masse (1867) fait par deux norvégiens : C. M. GULBERG (1836 -1902) et P. WAAGE (1833 -1900). § N. L. SADI CARNOT (1796 -1822) décrit son célèbre cycle. . . 2014 -12 -29

Le concept de la mole § AVOGADRO avait formulé l’hypothèse que deux volumes égaux deux composés gazeux différents contiennent le même nombre de molécules. § On a ainsi proposé la notation ambiguë de l’ « atome-gramme » et de « molécule-gramme » pour bien indiquer qu’il s’agit du nombre d’entités chimiques dans une masse donnée. § On adopte maintenant la notion beaucoup plus claire qu’est la mole, un nombre invariable (indépendant de tout paramètre). Ce nombre appelé le nombre d’Avogadro: il est égal à 6, 022 141 1023. § Par définition, c’est le nombre d’atomes de carbone présents dans 12, 000 g de carbone 12. 2014 -12 -29

Le symbolisme de DALTON Élément Symbole Composé Symbole hydrogène OH O azote NO oxygène O CO carbone N 2 O soufre O NO 2 2014 -12 -29

L’équation chimique § BERZÉLIUS propose d’utiliser une ou deux lettres pour représenter les éléments. § Be pour béryllium, H pour hydrogène, etc. § La combinaison des lois des proportions définies, des compositions multiples et du nombre d’Avogadro trouve son application dans l’écriture représentant une réaction chimique. § On écrit à gauche du signe égal (cas de l’équation) ou de la flèche orientée vers la droite (cas de la réaction) les composés réagissant et à droite des mêmes signes les composés chimiques formés. § 2 H 2 (gaz) + O 2 (gaz) 2 H 2 O (liquide). 2014 -12 -29

Conclusion n n L’Antiquité avait déjà imaginé la nature insécable de l’atome. Le monde romain n’en a pas retenu l’idée. Le Moyen-âge a surtout essayé de donner corps à la pierre philosophale tout en évacuant l’observation expérimentale et le sens critique. Au XVIIe siècle énonce la théorie du phlogistique, une théorie fausse qui a le mérite de provoquer les scientifiques invités à se compromettre. LAVOISIER mettra un terme à cette théorie : la chimie moderne a le terrain libre pour s’épanouir. 2014 -12 -29
 Physique chimie
Physique chimie Pourquoi choisir la chimie
Pourquoi choisir la chimie Physique chimie terminale
Physique chimie terminale Physique chimie
Physique chimie Calcul d'incertitude
Calcul d'incertitude Physique chimie
Physique chimie Physique chimie
Physique chimie Matire
Matire Physique chimie
Physique chimie Sti 2 d
Sti 2 d Résumé chapitre par chapitre tirez pas sur le scarabée
Résumé chapitre par chapitre tirez pas sur le scarabée Le petit prince chapitre 1
Le petit prince chapitre 1 Le petit prince chapitre 24 analyse
Le petit prince chapitre 24 analyse Petit pays chapitre par chapitre
Petit pays chapitre par chapitre 5 composantes de la condition physique
5 composantes de la condition physique Transceivers ethernet à couche physique
Transceivers ethernet à couche physique International hospital
International hospital Les matrices
Les matrices Oracle smon
Oracle smon Préparation physique patinage artistique
Préparation physique patinage artistique Grandeurs fondamentales
Grandeurs fondamentales Besoin physique
Besoin physique Portrait moral
Portrait moral