CHIMIE ORGANIQUE DESCRIPTIVE LES STRUCTURES ORGANIQUES La chimie

























- Slides: 32

CHIMIE ORGANIQUE DESCRIPTIVE

LES STRUCTURES ORGANIQUES La chimie organique est la chimie des composés du carbone (structures organiques). Ces structures regroupent: carburants/combustibles, polymères, colles, vernis, peintures , médicaments, textiles, produits agroalimentaires et cosmétiques, insecticides, pesticides, engrais… NB: Le carbone occupe 18% du corps humain

LES HYDROCARBURES

Généralité Les hydrocarbures sont des composés organiques constitués uniquement de C et de H. On les classifie d’après les structures de la chaîne carbonée et d’après le degré de saturation de l’atome de carbone: (alcanes, alcènes, alcynes et benzéniques). Acyclique = aliphatique (nom ancien)

LES ALCANES I- Définition Les alcanes sont des hydrocarbures saturés ou paraffines (peu réactifs) de formule brute Cn. H 2 n+2 (acycliques linéaires ou ramifiés) et Cn. H 2 n (monocycliques). Ils sont représentés par R-H, R étant le groupe alkyle (ou alcoyle). R = Cn. H 2 n+1 Dans leurs molécules on ne rencontre que des liaisons simples C-C et C-H (liaisons s ). Le plus simple des alcanes est le méthane (n=1) CH 4 Pour n=2 on a C 2 H 6 éthane pour n=3 on a C 3 H 8 (alcane linéaire) ou C 3 H 6 (alcane cyclique)

2 -Représentations des alcanes 2 -1 Formules développées planes. Elles font apparaitre toutes liaisons C-C et C-H. Pour ces formules, respecter la valence de C qui est 4, et celle de H qui est 1. Ex: Une formule développée de C 6 H 14 est: Les formules développées sont rarement utilisées. On préfère les formules semi-développées moins encombrantes 2 -2 Formules semi-développées (ou combinées). Elles ne représentent pas les liaisons C-H. Seules apparaissent les liaisons C-C. EX: C 6 H 14 CH 3 -CH 2 -CH 3 2 -3 Formules condensées. Les liaisons C-C et C-H n’apparaissent pas. EX: C 6 H 14 CH 3 CH 2 CH 2 CH 3 2 -4 Formules stylisées (ou topologiques). Les atomes de C sont éludés et l’enchaînement carboné est représenté en zig-zag. Les atomes de H sont supprimés. Seul apparait le squelette carboné en zig-zag. EX: C 6 H 14 on suppose un C à chaque bout de segment

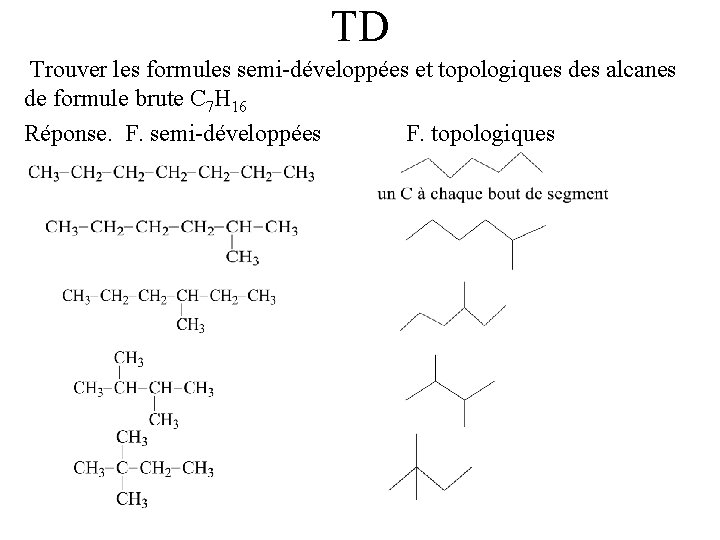
TD Trouver les formules semi-développées et topologiques des alcanes de formule brute C 7 H 16 Réponse. F. semi-développées F. topologiques

3 -NOMENCLATURE 3 -1 - Nomenclature des alcanes à chaîne linéaire non ramifiée Ils n’auront pas de préfixe. Selon l’UICPA, à l’exception des quatre 1 ers termes, le nom est constitué d’un radical exprimant le nombre d’atomes de carbone et de la terminaison -ane. Ils sont aussi désignés comme alcanes normaux Les 4 premiers alcanes conservent les noms consacrés par l’usage: CH 4 méthane; C 2 H 6 éthane; C 3 H 8 propane; C 4 H 10 butane EX: Pentane ou pentane normal ou n-Pentane Octane ou n-Octane NB: Si on ne précise pas, il s’agit de l’alcane normal

Tableau de quelques alcanes normaux

3 -2 - Alcanes à chaînes linéaires ramifiées 3 -2 -1 Groupes alkyles normaux ou substituants normaux. Il s’agit de l’alcane normal par enlèvement d’un atome d’H. Alcane normal: Cn. H 2 n+2 Substituant correspondant : Cn. H 2 n+1 Leurs noms dérivent de l’alcane correspondant par remplacement de la terminaison -ane par –yle Cn. H 2 n+2 alcane Cn. H 2 n+1 - alkyle CH 4 Méthane CH 3 - Méthyle Me C 2 H 6 Ethane C 2 H 5 - ou Ethyle Et C 3 H 8 propane C 3 H 7 - ou CH 3 -CH 2 - Propyle Pr ou n-Pr etc.

Règle Pour nommer un alcane à chaîne ramifiée on détermine: 1°)- La chaîne la plus longue présente dans la molécule: c’est la chaîne principale; c’est celle qui contient le plus grand nombre d’atomes de carbone 2°)- Le ou les substituants (ou chaîne latérale) non pris en compte dans la chaîne principale; on nomme ce ou ces groupes alkyles avec élision de « e » 3°)-On numérote les carbones de la chaîne principale d’un bout à l’autre, dans la direction telle que le ou les carbones portant le ou les groupes alkyles aient le ou les numéros les plus petits possibles.

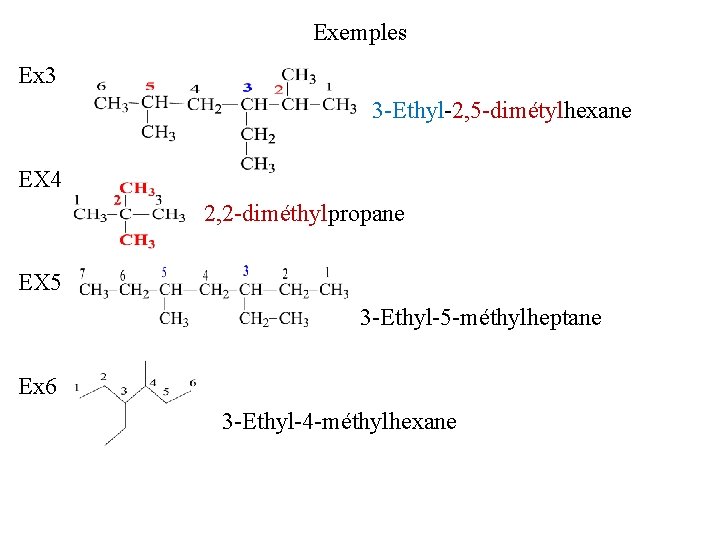
Exemples Ex 1: 3 -Méthylhexane Ex 2 3 -Ethylhexane Remarques 1 -S’il existe 2, 3, 4, …groupes substituants identiques, on utilise les préfixes di, tri, tétra, … 2 - S’il existe plusieurs groupes alkyles tous différents , ils sont énoncés dans l’ordre alphabétique 3 - lorsque les indices des groupes alkyles sont les mêmes dans les 2 sens de numérotations le premier nommé recevra l’indice le plus petit.

Exemples Ex 3 3 -Ethyl-2, 5 -dimétylhexane EX 4 2, 2 -diméthylpropane EX 5 3 -Ethyl-5 -méthylheptane Ex 6 3 -Ethyl-4 -méthylhexane

3 -2 -2 Groupes alkyles complexes (ou substituants complexes ) Définition Les groupes alkyles complexes sont des groupes alkyles portant eux-mêmes des groupes alkyles plus petits. Exemples Isopropyle ou 1 -méthylpropyle isobutyle ou 2 -méthylpropyle Ils ont des noms usuels, sinon, ils sont nommés en choisissant la chaîne latérale la plus longue, le carbone attaché à la chaîne principale portant le numéro 1. NB: Carbone primaire, secondaire, tertiaire et quaternaire C primaire = lié à un seul C C secondaire= lié à 2 autres C C tertiaire = lié à 3 autres C C quaternaire = lié à 4 autres C

Tableau de quelques groupes alkyles complexes Groupes alkyles complexes courants

Exemples EX 1 3 -Ethyl-2 -méthylpentane NB: La chaîne principale est celle qui a le maximum de substituants EX 2 3 -Ethyl-2 -méthyl-4 -isopropylheptane ou 3 -Ethyl-2 -méthyl-4 -(1 -méthyl)heptane EX 3 2 -méthyl-5, 6 -diisopropyl-nonane ou 2 -méthyl-5, 6 -bis(1 -méthyl)nonane

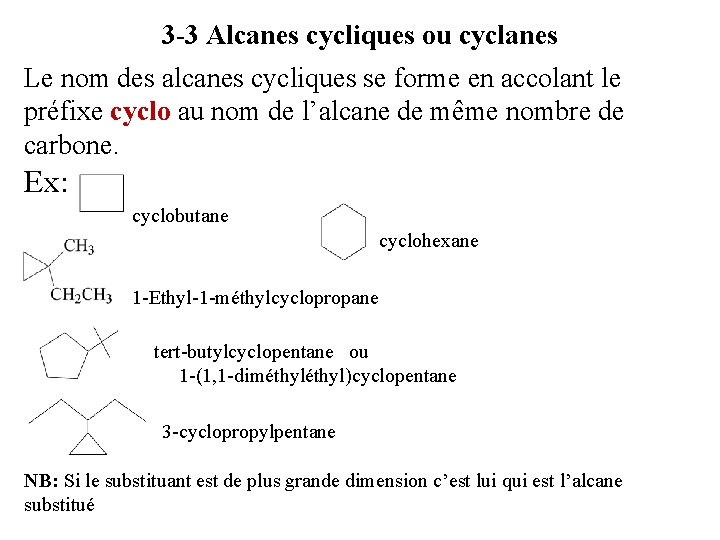
3 -3 Alcanes cycliques ou cyclanes Le nom des alcanes cycliques se forme en accolant le préfixe cyclo au nom de l’alcane de même nombre de carbone. Ex: cyclobutane cyclohexane 1 -Ethyl-1 -méthylcyclopropane tert-butylcyclopentane ou 1 -(1, 1 -diméthyl)cyclopentane 3 -cyclopropylpentane NB: Si le substituant est de plus grande dimension c’est lui qui est l’alcane substitué

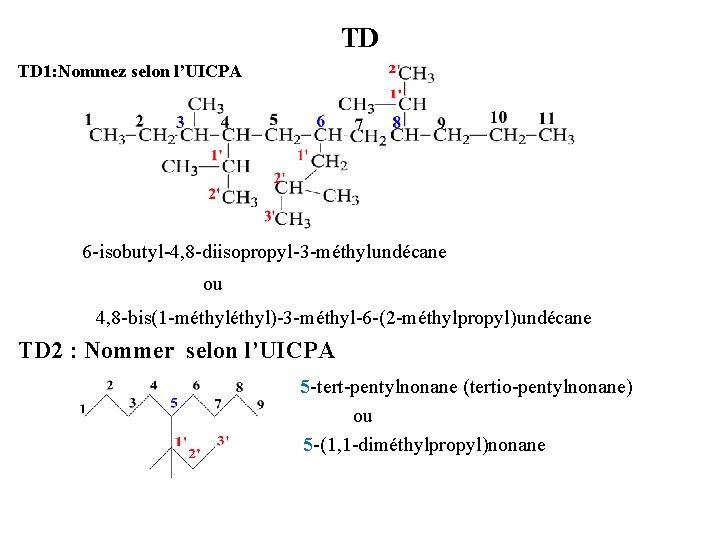
TD TD 1: Nommez selon l’UICPA 6 -isobutyl-4, 8 -diisopropyl-3 -méthylundécane ou 4, 8 -bis(1 -méthyl)-3 -méthyl-6 -(2 -méthylpropyl)undécane TD 2 : Nommer selon l’UICPA 5 -tert-pentylnonane (tertio-pentylnonane) ou 5 -(1, 1 -diméthylpropyl)nonane

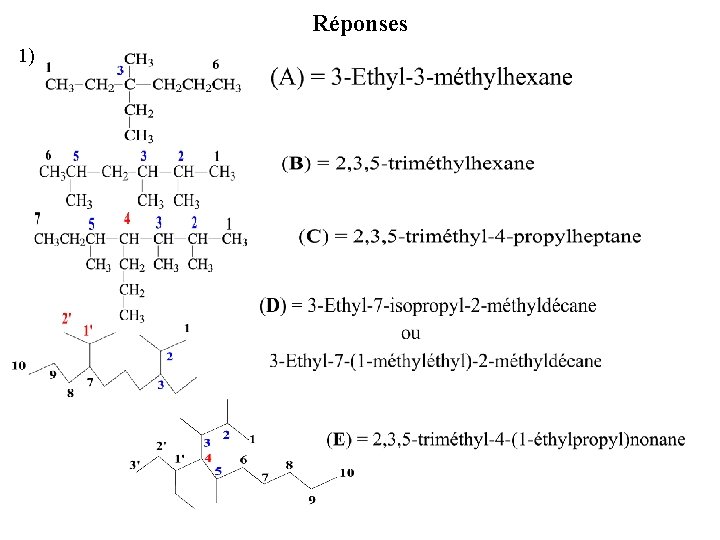
EXERCICES 1 - Nommez selon l’UICPA: 2 - Ecrire la formule des composés suivants: (I): 2, 2, 4 -triméthylpentane ; (II): 3, 3 -diméthylpentane ; (III): 3 -Ethyl-2 -méthylpentane; (IV): 4 -(1 -Méthyl)heptane; (V): 2, 7 -diméthyl-5 -(1, 1 -diméthylpropyl)nonane

Réponses 1)

Réponses (suite) 2 -Structures des composés (I): 2, 2, 4 -triméthylpentane (V): 2, 7 -diméthyl-5 -(1, 1 -diméthylpropyl)nonane

4 - Propriétés physiques Les alcanes de C 1 à C 4 sont gazeux de C 5 à C 15 liquides supérieurs à C 15 solides Les tf augmentent avec le nombre d’atomes de C, mais s’abaissent quand la chaîne est plus ramifiée et que la molécule s’approche de la forme sphérique. Les alcanes sont pratiquement insolubles dans l’eau.

5 - Propriétés chimiques 5 -1 Structure et réactivité Les alcanes ne contiennent que des liaisons covalentes simples C-C et C-H (liaisons s ). Ces liaisons sont fortes donc difficiles à rompre. D’où la stabilité des alcanes et leurs grandes inerties chimiques (ils sont dits paraffines = peu réactifs). A t° élevée ou sous l’action de la lumière ou des peroxydes, par cassure des liaisons s , les alcanes se prêtent à des réactions de combustion (cassure homolytique de C-C vers 350 k. J. mol-1) et des réactions de substitution ( cassure homolytique de C-H vers 400 k. J. mol-1). Les réactions de substitution sont dits radicalaires.

5 -2 Réactions de substitution a) Halogénation - Fluoration : dégradation , car trop énergique: EX: ; X = Halogène= F, Cl, Br, I - Iodation: énergiquement défavorisé : Ex: HI formé a le rôle de réducteur - La chloration, plus facile que la bromation, sont les seules utilisées en pratique. La chloration est anarchique; la bromation nettement plus sélective. Le mécanisme des réactions de chloration et de bromation est radicalaire et se déroule en 3 étapes: - La liaison Cl-Cl est la plus faible (58 kcal/mole) que C-C (82, 6 kcal/mole) ou C-H (89 kcal/mole) - -

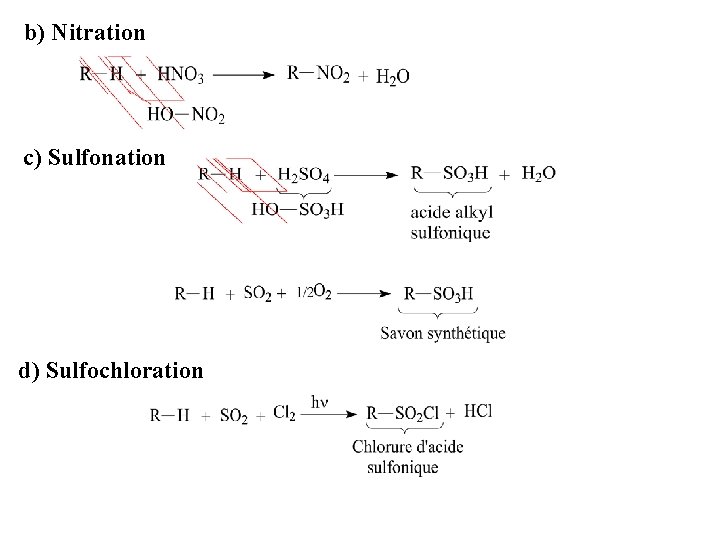
b) Nitration c) Sulfonation d) Sulfochloration

5 -3 Combustions a) Combustion incomplète : Quand la quantité d’O 2 est insuffisante Le CO toxique des gaz d’échappement et des suies crachées abondamment par les camions à moteurs diesels sont le prix à payer pour nos sociétés motorisées (pollution de l’environnement). b) Combustion complète. Dans un excès d’O 2 on a : Cette quantité importante d’énergie est mise à profit pour source d’énergie: chauffage (gaz naturel et mazout); et dans les moteurs (carburants). Les alcanes sont utilisés comme combustibles. Le CO 2 et le H 2 O(gaz à effet de serre) formés lors de la combustion dans les moteurs et rejetés dans l’atm en quantité, sont en partie responsables du réchauffement climatique (pollutions)

6 - Etat naturel - Préparation Les alcanes sont très répandus dans la nature. Le méthane est le constituant essentiel des gaz naturels. On le trouve dans les marais (gaz des marais). Les 2 plus importantes sources naturelles d’alcanes sont les pétroles et les gaz naturels. Le pétrole (le mot pétrole est du latin petra =roche et oleum =huile d’où pétrole= huile de roche) est un mélange liquide complexe de composés organiques, dont beaucoup sont des alcanes ou des cyclanes. Préparations Il est rare qu’un chimiste de labo ait à préparer un hydrocarbure saturé, car un tel composé, surtout à cause de son inertie , présente souvent peu d’intérêt. Leurs préparations sont essentiellement industrielles. Par contre, on peut les obtenir à partir d’autres composés organiques. 3 groupes de méthodes d’obtention des alcanes: - méthodes dans laquelle il n’y a pas de modification de la chaîne - méthodes de rallongement de la chaîne - méthodes de dégradation de la chaîne

6 -1 Pas de modification de la chaîne a) Hydrogénation – Hydrohalogénation b) Réduction des aldéhydes et des cétones

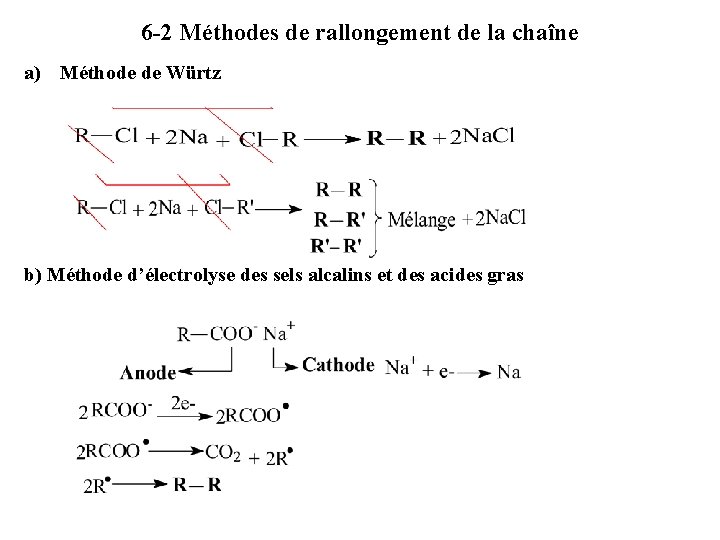
6 -2 Méthodes de rallongement de la chaîne a) Méthode de Würtz b) Méthode d’électrolyse des sels alcalins et des acides gras

6 -3 Méthode de dégradation de la chaîne Dégradation des acides gras par pyrogénation des sels de sodium en présence de soude

TD Déterminer la structure d’alcane de la formule brute C 6 H 14 formé par la réaction de Wurtz sans produit secondaire. La monobromation de cet alcane donne majoritairement un dérivé tertiaire de formule brute C 6 H 13 Br. Ecrire les réactions et nommer les produits. Rép. 1 - Ecrivons tous les alcanes ayant pour formule brute C 6 H 14 2 -Strucure de l’alcane La monobromation donnant un dérivé tertiaire; (A) et (D ) exclus car pas de carbone tertiaire dans leur structure. (C) exclu car donnant des produits secondaires par Wurtz comme: R-R, R-R’, R’-R’. La structure de l’alcane est donc celle de ( E)

(suite) 3 - Structure de l’alcane et réactions Obtention de E par la réaction de Würtz ; pour éviter le mélange de produits, il faut scinder Réaction: Réaction de monobromation:
 Alcane formule brute
Alcane formule brute Exemple de situation-problème en chimie organique
Exemple de situation-problème en chimie organique Microangiopathie organique
Microangiopathie organique Loi de chimie
Loi de chimie Analogous structure
Analogous structure Tija planta
Tija planta Les lettres en français
Les lettres en français Le volcan le plus dangereux du monde
Le volcan le plus dangereux du monde La nouvelle réaliste la ficelle
La nouvelle réaliste la ficelle Les constellations les plus connues
Les constellations les plus connues Pronom convenable
Pronom convenable Parts de les fulles
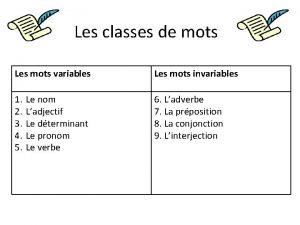
Parts de les fulles Mots variable et invariable
Mots variable et invariable Classe de mots variables
Classe de mots variables Trouvez les réponses. écrivez-les en chiffres (numbers).
Trouvez les réponses. écrivez-les en chiffres (numbers). Grand corps malade histoire d'amour
Grand corps malade histoire d'amour Allez vous en sur les places et sur les parvis
Allez vous en sur les places et sur les parvis Les actionneurs et les préactionneurs
Les actionneurs et les préactionneurs Les trois obstacles et les quatre démons
Les trois obstacles et les quatre démons Un appel vient pour des soldats
Un appel vient pour des soldats Podc management
Podc management Qu'est-ce que tu aimes manger
Qu'est-ce que tu aimes manger Les mots qu'on ne dit pas sont les fleurs du silence
Les mots qu'on ne dit pas sont les fleurs du silence Organisateurs textuels
Organisateurs textuels Dragibus soft calories
Dragibus soft calories Texte expressif exemple
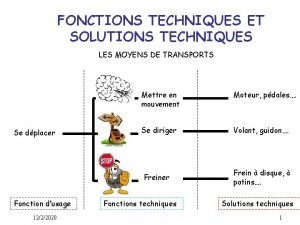
Texte expressif exemple Fonctions et solutions techniques
Fonctions et solutions techniques Les voitures les plus rapides du monde
Les voitures les plus rapides du monde Definiti concentratia procentuala
Definiti concentratia procentuala Legea periodicitatii
Legea periodicitatii Analyse qualitative chimie
Analyse qualitative chimie Grille compétences socle commun collège cycle 4
Grille compétences socle commun collège cycle 4 Pourquoi choisir la chimie
Pourquoi choisir la chimie