Rle de la Chimie Analytique Analyse qualitative identifier










































- Slides: 59

Rôle de la Chimie Analytique ü Analyse qualitative : identifier une molécule (analyse moléculaire, analyse structurale) ou un élément (analyse élémentaire) dans un échantillon ü Analyse quantitative : mesurer la concentration de molécules ou d’éléments dans un échantillon ü 1

Rôle de la Chimie Analytique ü Dans l’industrie : relier les propriétés d’un matériau ou d’un produit manufacturé à sa composition (élémentaire, moléculaire…) ü Dans le monde médical et des organismes de contrôle : présence ou l’absence d’éléments toxiques dans des tissus biologiques, les eaux (surface, sous-terraines …) ü Contrôle : contrôle de qualité ou de pureté d’un produit manufacturé 2

Rôle l’Analyse élémentaire ü ü Analyse quantitative : détermination des concentrations d’un grand nombre d’éléments dans des échantillons très variés Les échantillons : Eaux naturelles, eaux de captage ou de rejet d’une industrie, les fluides biologiques le sang, urines…, plantes, produits alimentaires, l’air, les matériaux (polymères, verres, métaux …), les sols (naturels, sols industriels)… 3

Exemple de demande en analyse Archéologie : Provenance d’objets manufacturés ? Procédé de fabrication? Analyse d’alliages (fer, de l’argent de l’or…), de céramiques (poteries, argiles …) Utilisation de l’empreinte chimique élémentaire et de certains rapports isotopiques 4

Exemple de demande en analyse Environnement : Pollutions provenant des aciéries, fonderies diverse (Al, Cu, Pb…)? Surveillance des pollutions provenant de l’automobile (Pb, Pt (PGE) …) Surveillance de la pollution en fonction du temps? Détermination des niveaux de polluants (Pb, Cd …) dans tous les compartiments de l’environnement (eau, air, sols, biomasse) 5

Analyses dans le domaine de l’environnement Analyse de la concentration de certains éléments dans les anneaux de croissances des arbres Analyse de la concentration de certains éléments dans la coralite (squelette) du corail 6

Exemple de demande en analyse : l’eau de surface L'eau qui se trouve dans les rivières, dans les ruisseaux, dans les lacs et dans les océans. eau pluviale L'eau qui s'écoule des terres pendant et après les précipitations. eau souterraine L'eau qui occupe les pores, les crevasses et les fissures de la roche et du sol; l'eau située en dessous du niveau de la terre. L'eau souterraine est habituellement obtenue d'un puits ou d'une source. eau usée Effluent industriel, municipal et domestique qui comprend les eaux usées, les eaux ménagères et l'eau industrielle. eau usée domestique Les eaux usées transportées par l'eau provenant des cuisines, des salles de 7 bain, des buanderies, des drains de sol. . .

Qualité de l’eau distribuée Normes : Valeurs réglementées par le décret n° 2001 -1220 du 20 décembre 2001 relatif aux eaux destinées à la consommation humaine, à l'exception des eaux minérales. Directive européenne 98/83/CE du Conseil du 3 novembre 1998 relative à la qualité des eaux destinées à la consommation humaine. Le texte fixe des limites et références de qualité pour les eaux de consommation et les eaux brutes destinées à la production d'eau, à partir de paramètres biologiques et chimiques. 8

Les Normes : exemples Le plomb Effets du plomb sur la santé : neurotoxique (troubles du comportement, épilepsie, retards dans le développement intellectuel). Accumulation du plomb dans l’organisme (os) L'eau est l'un des facteurs d'exposition. teneur limite autorisée dans l'eau destinée à la consommation humaine progressivement abaissée de 50 µg (Pb)/L à 10 µg/L d'ici le 24 décembre 2013. Valeur transitoire de 25 µg/l doit être respectée à partir du 24 décembre 2003 Les concentrations sont relevées au robinet de l'usager. L'arsenic Toxique communément présent dans les eaux Effets de l’As sur la santé : cancérigène Abaisser les limites de qualité à 10 µg/L 9

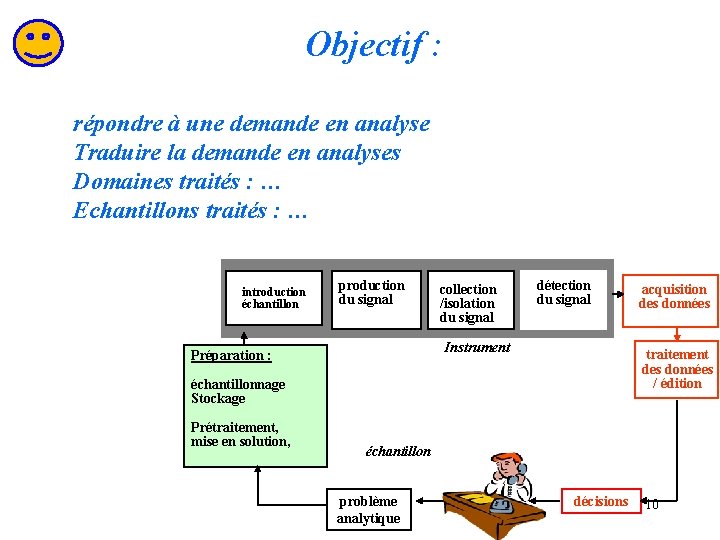
Objectif : répondre à une demande en analyse Traduire la demande en analyses Domaines traités : … Echantillons traités : … introduction échantillon production du signal collection /isolation du signal détection du signal Instrument Préparation : traitement des données / édition échantillonnage Stockage Prétraitement, mise en solution, acquisition des données échantillon problème analytique décisions 10

Quel type d’échantillon J EAU DE SURFACE/SOUS-TERRAINE Fortes teneurs en sels dissous Matières en suspension, gaz dissous. . . L SOLIDE Minéral (roches, sables ) Métallique Organique (polymères, tissus organiques…) M MILIEUX COMPLEXES Résidus (boues…), Sédiments. . . Nécessité d’avoir un minimum d’information sur l’échantillon : p. H … nature des majeurs (analyse semi-quanti) => Sélection du pré-traitement nécessaire 11

Méthodes employées en analyse élémentaire ü ü ü Dosage à la burette C’est long, on ne peut pas mesurer des traces ! Méthodes Instrumentales : l’évolution est irréversible ü remarques : La chimie des solutions reste un domaine essentiel du traitement de l’échantillon (extraction, préconcentration). En spectrométrie atomique en particulier certaine méthodes sont basées sur des réactions en solution. 12

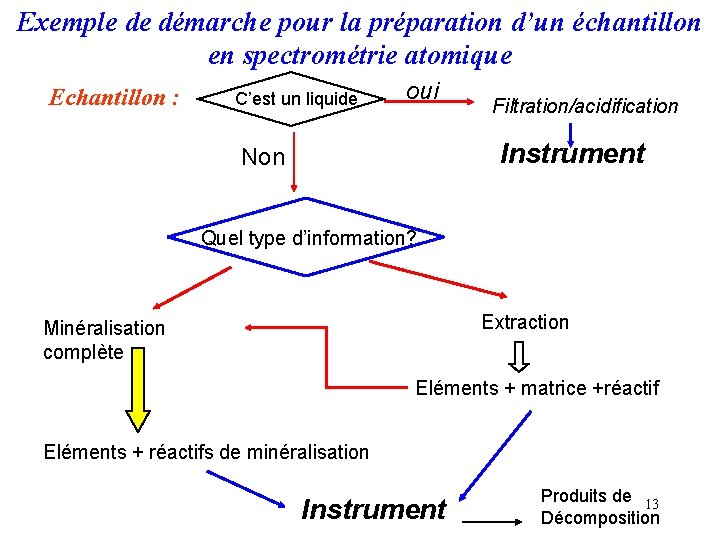
Exemple de démarche pour la préparation d’un échantillon en spectrométrie atomique Echantillon : C’est un liquide oui Filtration/acidification Instrument Non Quel type d’information? Extraction Minéralisation complète Eléments + matrice +réactif Eléments + réactifs de minéralisation Instrument Produits de 13 Décomposition

Rappels - Vocabulaire 14

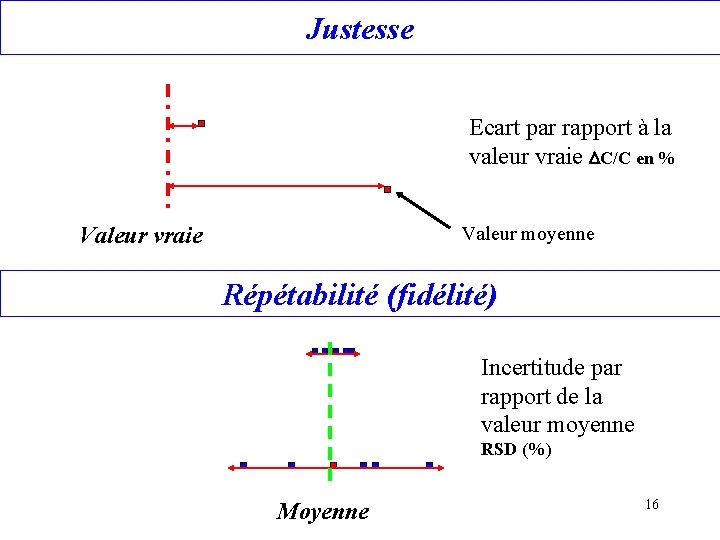
Vocabulaire de l’analyse chimique Exactitude, justesse : étroitesse de la moyenne des résultats d’un mesurage et de la valeur vraie d’un mesurande. Nécessité de disposer de matériaux de référence. Répétabilité, reproductibilité, Precision Répétabilité = étroitesse de l’accord entre plusieurs mesurages successifs d’un même mesurande dans les mêmes conditions de mesure. - plusieurs répliques, calcul de l’écart type relatif (RSD %) Réproductibilité = étroitesse de l’accord entre plusieurs mesurages successifs d’un même mesurande en faisant varier les conditions de mesure. (Jour, opérateur, allumages …) - calcul de l’écart type relatif (RSD %) Le terme anglais precision reprend ces deux notions 15

Justesse Ecart par rapport à la valeur vraie DC/C en % Valeur vraie Valeur moyenne Répétabilité (fidélité) Incertitude par rapport de la valeur moyenne RSD (%) Moyenne 16

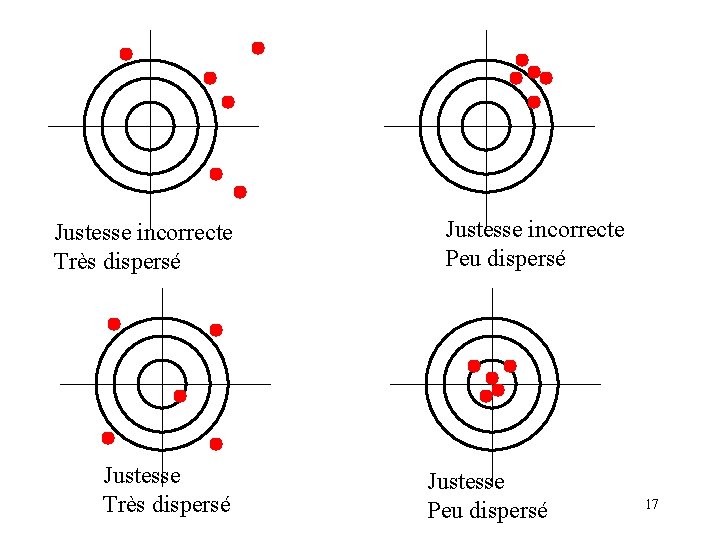
Justesse incorrecte Très dispersé Justesse incorrecte Peu dispersé Justesse Peu dispersé 17

Rappels – Vocabulaire et notions importantes Concentrations Masse d’élément par masse d’échantillon Masse d’élément par volume d’échantillon m/m 10 -2 10 -3 10 -6 10 -9 10 -12 10 -15 mg/g µg/g ng/g pg/g fg/g g/kg mg/kg µg/kg ng/kg pg/kg m/v 1% 10/00 ppm ppb ppt ppq mg/m. L µg/m. L ng/m. L pg/m. L fg/m. L Notion de trace g/L mg/L µg/L ng/L pg/L 18

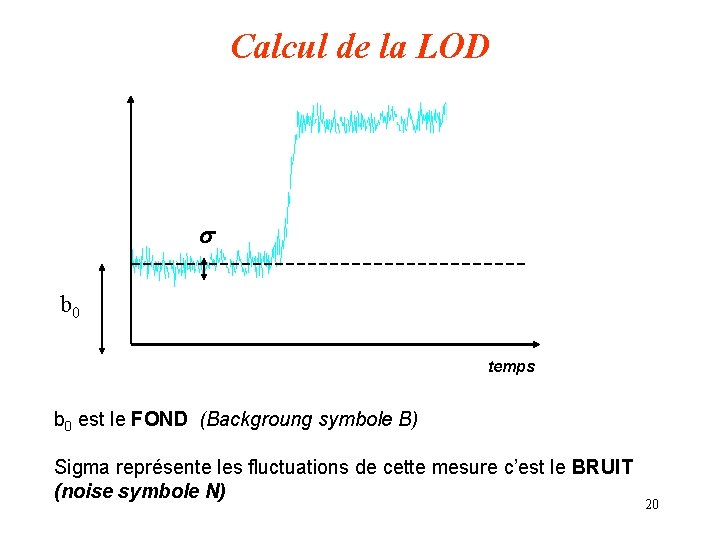
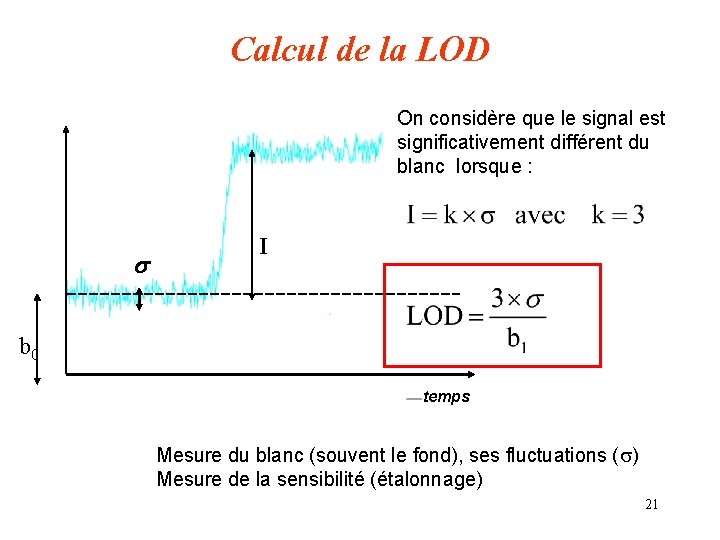
Sensibilité - limite de détection Sensibilité : c’est la pente de la droite d’étalonnage c’est à dire l’intensité du signal en fonction de la concentration Un étalonnage : I = f(C ) = b 0 + b 1 c b 0 est l’ordonnée à l’origine en l’absence de correction de fond c’est la mesure du blanc ou du fond spectral (C =0) b 1 est la pente de la droite d’étalonnage Limite de détection : LDD ou LOD C’est la plus petite concentration déterminée à partir du signal de l’analyte et qui est significativement différent du blanc 19

Calcul de la LOD s b 0 temps b 0 est le FOND (Backgroung symbole B) Sigma représente les fluctuations de cette mesure c’est le BRUIT (noise symbole N) 20

Calcul de la LOD On considère que le signal est significativement différent du blanc lorsque : s I b 0 temps Mesure du blanc (souvent le fond), ses fluctuations (s) Mesure de la sensibilité (étalonnage) 21

SPECTROSCOPIE ATOMIQUE 22

Les méthodes spectrales ü Classées suivant la détection : üRayonnement électromagnétique (photons, photons. X) üParticules (ions, électrons) 23

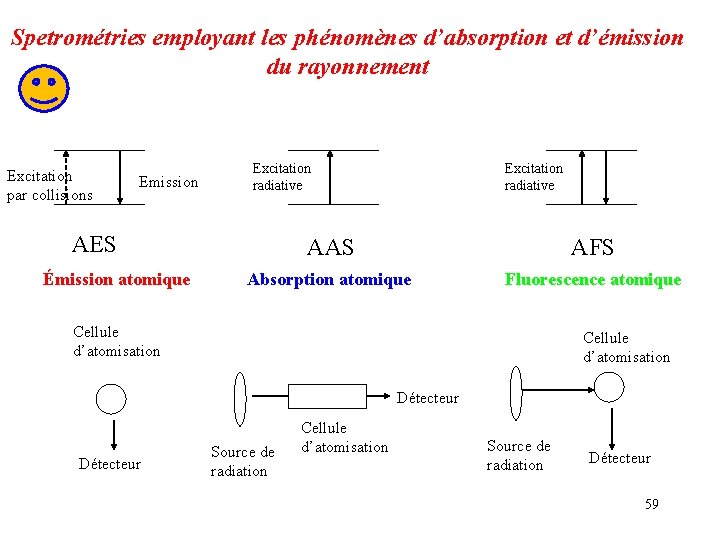
Méthodes spectrales fondées sur les photons ü Spectrométrie d’émission atomique AES : (atomic emission spectromery) (optique) ü Spectrométrie d’absorption atomique AAS : ü Spectrométrie de fluorescence Atomique (AFS) 24

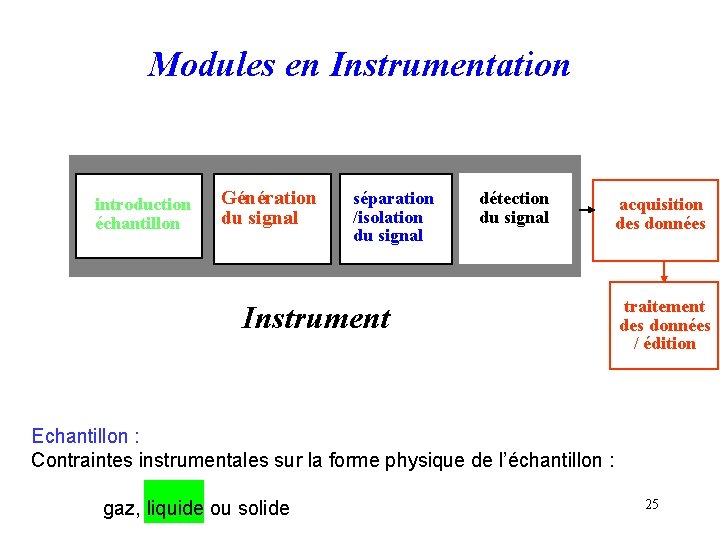
Modules en Instrumentation introduction échantillon Génération du signal séparation /isolation du signal détection du signal Instrument acquisition des données traitement des données / édition Echantillon : Contraintes instrumentales sur la forme physique de l’échantillon : gaz, liquide ou solide 25

Couplage de Méthodes Afin de répondre à une demande particulière en analyse il est parfois nécessaire d’associer plusieurs méthodes instrumentales 26

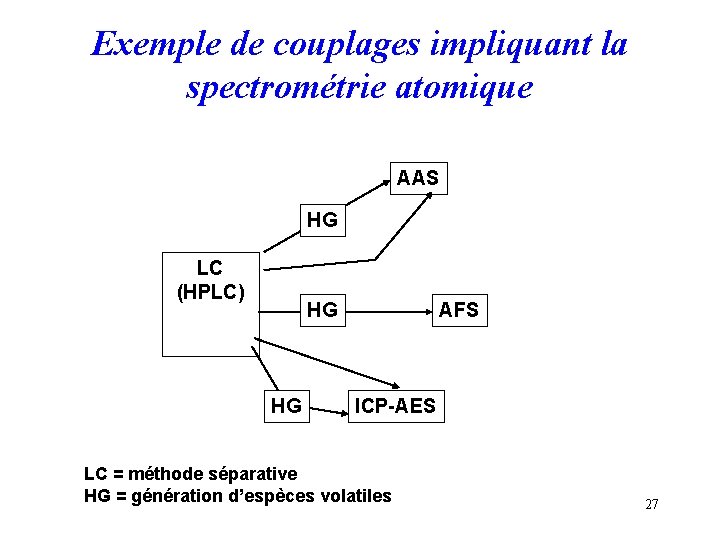
Exemple de couplages impliquant la spectrométrie atomique AAS HG LC (HPLC) HG HG AFS ICP-AES LC = méthode séparative HG = génération d’espèces volatiles 27

Production du signal Séparation du signal Système de détection Le Logiciel 28

Production du signal ü Toute méthode d’analyse est fondée sur des phénomènes physiques liés aux propriétés spécifiques des composés que l’on souhaite analyser : ü La génération de l’information physique comporte deux étapes : absorption d’une énergie production de l’information physique (émission ou absorption d’ondes ou de particules) 29

Exemple d’apport d’énergie et de production de signal physique Apport d’énergie Signal physique Spectrométrie Photons X Électrons Ions photons X électrons Électrons ions Photons photons Énergie thermique Champ électrique photons ions photons Champ électrique ions Électrons photons X XRF fluorescence X XPS Électrons Augers SIMS de masse à électrons secondaires fluorescence induite par laser (LIFS) émission atomique (AES) thermo ionisation (TIMS) décharge luminescente (GD + AES) décharge luminescente (GD + MS) émission de rayons X 30

Séparation du signal üInformation physique complexe (un spectre est constitué d’un nombre important de longueur d’ondes) : ücomporte des informations spécifiques à l’élément que analyser et des informations inutiles (interférences) l’on souhaite üNécessité de filtrer l’information produite, de séparer (extraire) l’information spécifique ü On utilisera donc un module permettant cette filtration : filtre interférentiel spectromètre dispersif en longueur d’onde ou dans le domaine des masses (ions m/z) ü On utilisera une séparation en énergie des particules chargées par accélération électrostatique et déflection 31

Système de détection ü Seul un signal électrique peut être traité il est donc indispensable de convertir l’information physique en signal électrique C’est le rôle du détecteur Photocathode : photons en électron Détecteur de Faraday : ions en électrons 32

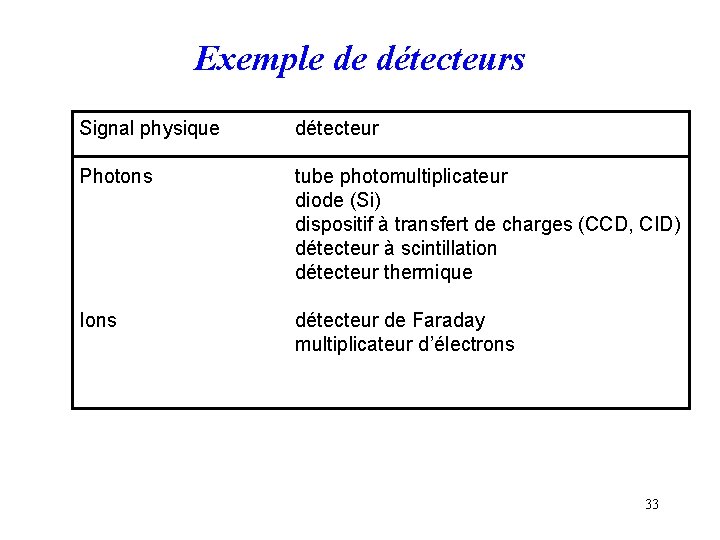
Exemple de détecteurs Signal physique détecteur Photons tube photomultiplicateur diode (Si) dispositif à transfert de charges (CCD, CID) détecteur à scintillation détecteur thermique Ions détecteur de Faraday multiplicateur d’électrons 33

Le Logiciel ü Son rôle est de piloter les fonctions de l’appareillage ü Son rôle est également de faire l’acquisition et le traitement des données (remplace l’enregistreur ou l’intégrateur) ü En amont du logiciel se trouve un convertisseur analogue/décimal dont le rôle est de rendre l’information «lisible» par le logiciel 34

Remarques ü La qualité de l’analyse n’est pas une fonction du degré de sophistication de l’instrument ü Un instrument analyse l’échantillon fourni, il est donc important de maîtriser l’étape d’échantillonnage et de préparation de l’échantillon ü Pour tout instrument il existe un certain nombre de limitations (interférence, tolérance vis-à-vis de la forme de l’échantillon) ü Il indique un signal, il appartient ensuite à l’analyste d’établir un étalonnage de ce signal dans les conditions appropriées 35

Méthodes Spectrales Principe : Transitions 36

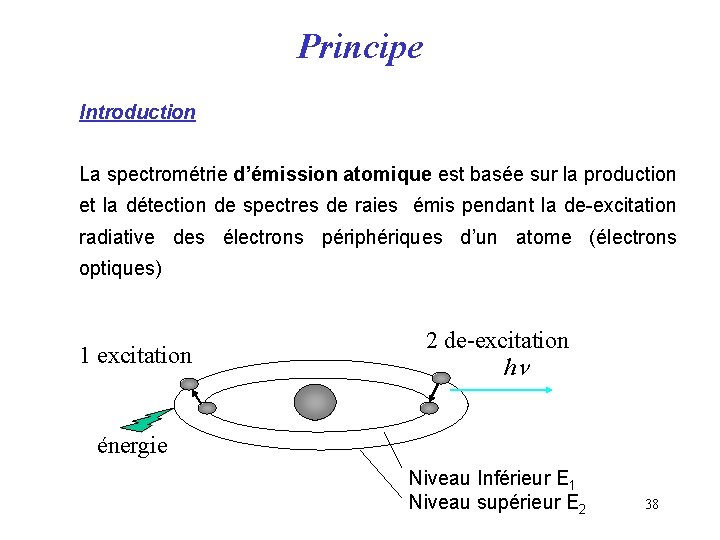
Principe Introduction Un atome est stimulé par une énergie pour passer d’un état d’énergie à un autre. Un atome dans un état d’énergie élevé peut spontanément retourner à un niveau d’énergie plus faible. La probabilité de transition d’un état à l’autre est fonction de la nature de ces deux états. 37

Principe Introduction La spectrométrie d’émission atomique est basée sur la production et la détection de spectres de raies émis pendant la de-excitation radiative des électrons périphériques d’un atome (électrons optiques) 1 excitation 2 de-excitation hn énergie Niveau Inférieur E 1 Niveau supérieur E 2 38

Energie et longueur d’onde h est la constante de Planck l est la longueur d’onde c la vitesse de la lumière E est l’énergie exprimée soit en e. V soit en cm-1 Conversion : 1 e. V = 8065. 54 cm-1 = 96. 4853 k. J mol-1 Domaine d’énergie pour les raies employées analyse : 1, 6 à 16 e. V Unité de longueur d’onde : le nm, (historiquement l’Å, nombreuses tables en Å) 39

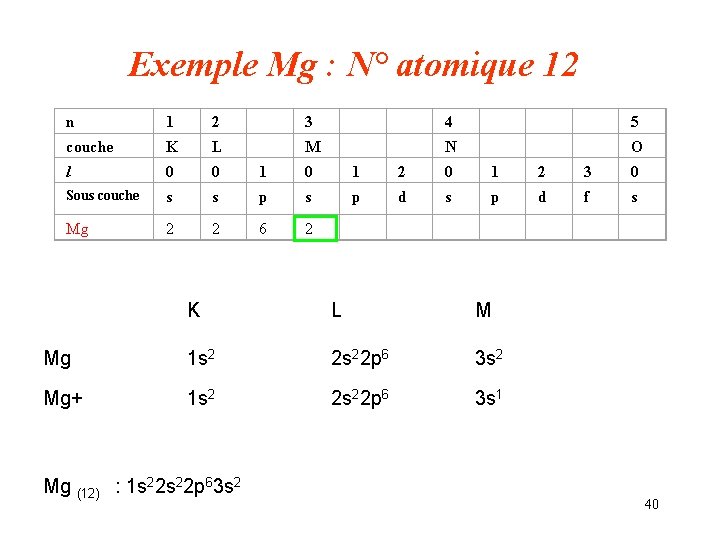
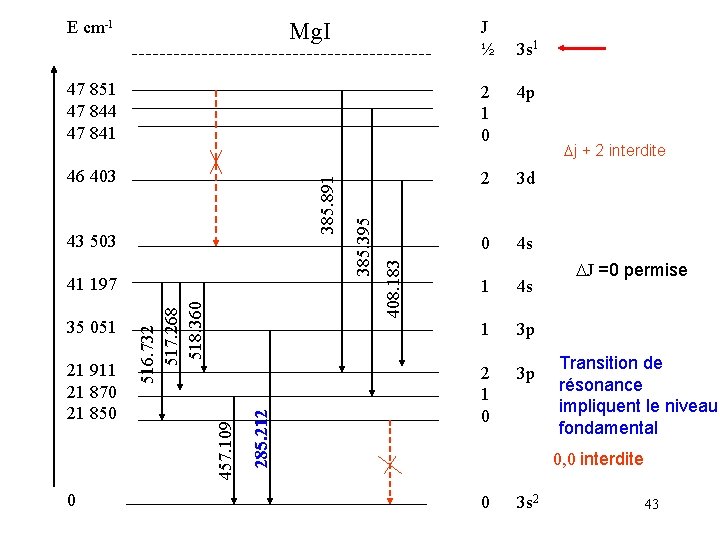
Exemple Mg : N° atomique 12 n 1 2 3 4 5 couche K L M N O l 0 0 1 2 3 0 Sous couche s s p d f s Mg 2 2 6 2 K L M Mg 1 s 2 2 s 22 p 6 3 s 2 Mg+ 1 s 2 2 s 22 p 6 3 s 1 Mg (12) : 1 s 22 p 63 s 2 40

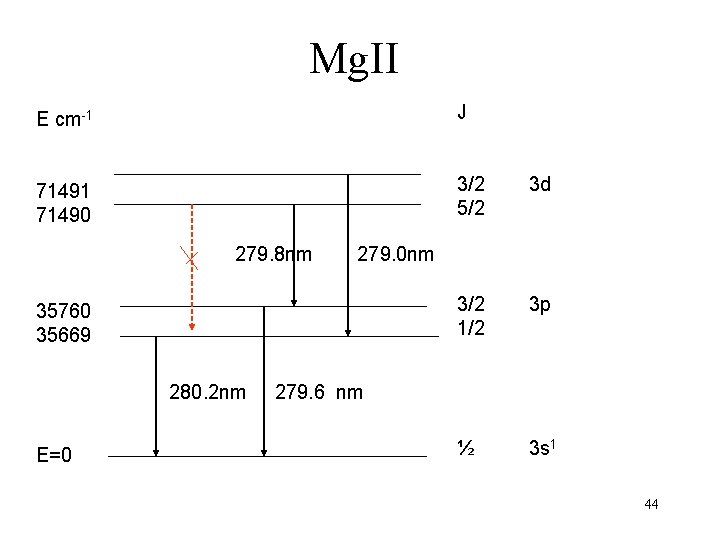
Excitation de Mg Mg 1 s 22 p 63 s 2 Mg+ 1 s 22 p 63 s 1 Mg+* 1 s 22 p 63 s 03 p 1 Notation : Raies de l’atome excité Mg. I Raies de l’ion excité Mg. III ionisé deux fois Mg I 285. 2 nm Mg. II 280. 2 nm 41

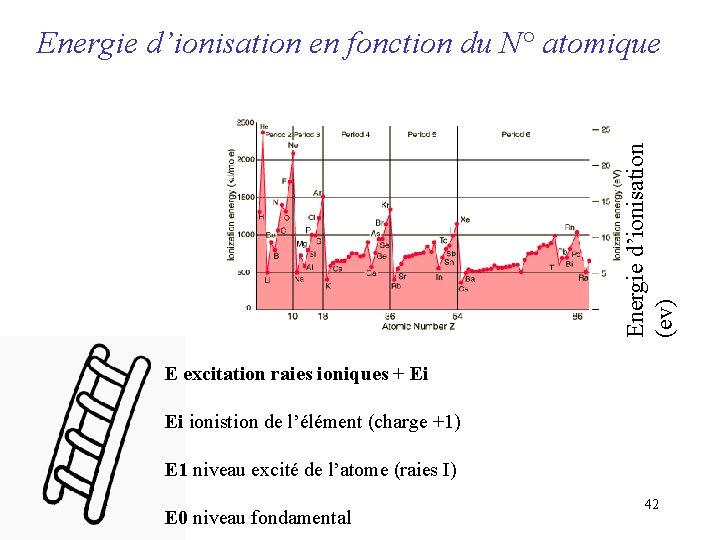
Energie d’ionisation (ev) Energie d’ionisation en fonction du N° atomique E excitation raies ioniques + Ei Ei ionistion de l’élément (charge +1) E 1 niveau excité de l’atome (raies I) E 0 niveau fondamental 42

E cm-1 J ½ Mg. I 3 s 1 46 403 2 3 d 0 4 s 43 503 0 285. 212 21 911 21 870 21 850 457. 109 35 051 516. 732 517. 268 518. 360 41 197 408. 183 4 p 385. 395 2 1 0 385. 891 47 851 47 844 47 841 Dj + 2 interdite 1 4 s 1 3 p 2 1 0 3 p DJ =0 permise Transition de résonance impliquent le niveau fondamental 0, 0 interdite 0 3 s 2 43

Mg. II E cm-1 J 71491 71490 3/2 5/2 3 d 3/2 1/2 3 p ½ 3 s 1 279. 8 nm 279. 0 nm 35760 35669 280. 2 nm 279. 6 nm E=0 44

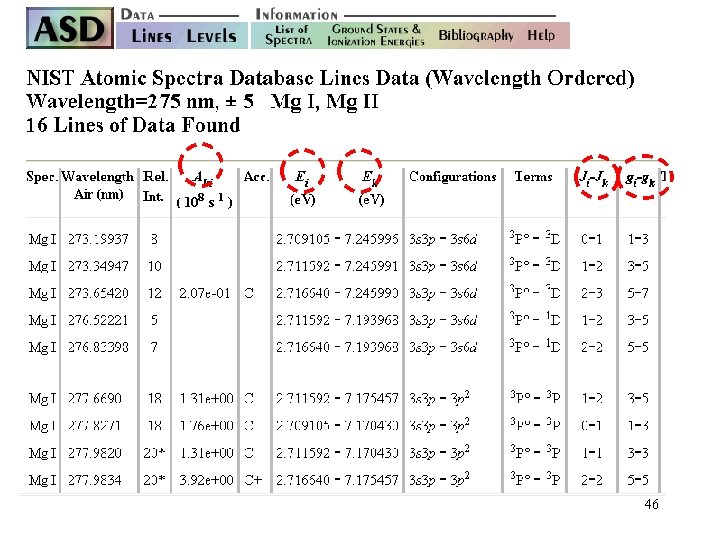
Nombre de raie par Elément Pour l’atome de magnésium : Mg. I 200 -300 raies Mg. II 150 raies répertoriées dans des tables Eléments très riches en raies : Fe et U plusieurs milliers de raies 45

46

Intensité des raies I = cte. (Em - Ek). Amk. nm Em Ek nm est la population d’électron du niveau supérieur Em et A la probabilité de transition entre Em et Ek (Amk nombre de transitions possibles par unité de temps) 47

Intensité d’une raie : population des niveaux La relation entre la population de deux niveaux différents a été décrite par Boltzmann : k est la constante de boltzmann T la température de la source de radiation gk le poids statistique (gk = 2 J+1) 48

Population des niveaux N étant le nombre total d’atomes N = n 0 + n 1 + n 2 + …. . nm + … Le nombre d’atomes d’un niveau d’énergie particulier est donné par On peut sommer tous les termes gm. exp(-Em/k. T) et ainsi définir la fonction de partition Z : Z = g 0 + g 1. exp(-E 1/k. T) + … + gm. exp(-Em/k. T) + …. 49

Intensité d’une raie Si on combine les expression I = cte. Amk. (Em - Ek). nm üLa constante est / 4 et tient compte de l’émission dans un angle solide de 4 stéradiants ü Pour une raie donnée : A, g, l Z et E sont constants donc I est proportionnel à N et par suite C la concentration 50

Intensité d’une raie Si l’on veut comparer l’intensité de raies d’un même élément : I est proportionnel à : 51

Intensité d’une raie : exemple de Mg Mg I Longueur d’onde (nm) A 108 s-1 E 516. 732 517. 268 518. 360 0. 116 0. 346 0. 575 41 197 cm-1 285. 212 5. 3 35 051 cm-1 Pour ces raies gi = 3 52

Expression du rapport de deux raies d’un même élément dans le même état d’ionisation § Mg. I à 285. 2 nm est plus sensible § Mg 517. 268 aura toujours une intensité triple de celle de Mg 516. 732 (A 1/A 2 = 2. 98) (Jid, E 2 id) § Le rapport de 285/518 est fonction de T : 53

Température de la source d’émission § En spectrométrie d ’émission la stabilité de température de la source est importante § prenons l’exemple de Mg. I à 285. 2 nm Eex = 35051 cm-1 § pour T = 3000 K une variation de température de 100 K provoque une variation du terme exponentiel de 70% § pour T = 8000 K la même variation de T de 100 K provoque une augmentation de 8% du terme exponentiel 54

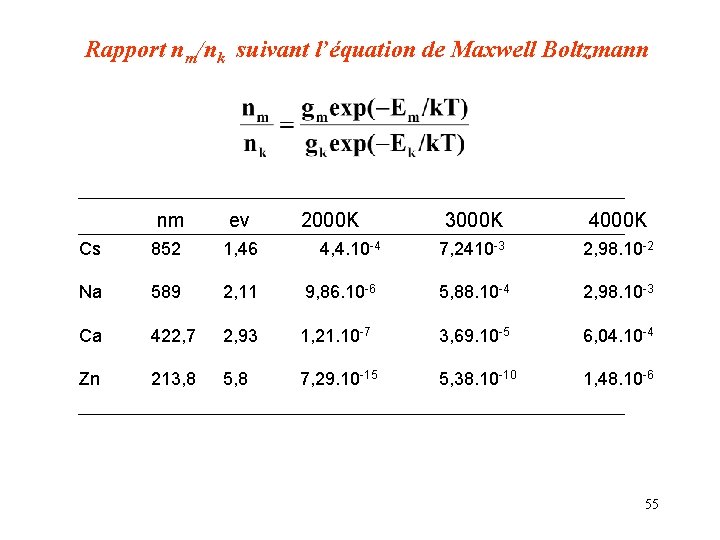
Rapport nm/nk suivant l’équation de Maxwell Boltzmann nm ev 2000 K 3000 K 4000 K Cs 852 1, 46 4, 4. 10 -4 7, 2410 -3 2, 98. 10 -2 Na 589 2, 11 9, 86. 10 -6 5, 88. 10 -4 2, 98. 10 -3 Ca 422, 7 2, 93 1, 21. 10 -7 3, 69. 10 -5 6, 04. 10 -4 Zn 213, 8 5, 8 7, 29. 10 -15 5, 38. 10 -10 1, 48. 10 -6 55

Intensité d’une raie absorbée en spectrométrie d’absorption atomique ü Lorsqu’on irradie un atome à la même longueur d’onde que la raie de résonance d’un analyte et présentant une largeur de raie plus fine que la largeur de résonance, il est possible d’évaluer l’absorption du faisceau ü Le facteur de transmission T est le rapport de I intensité transmise sur I 0 intensité incidente ü La valeur de l’absorbance est reliée à la concentration des atomes à l’état fondamental (dans la flamme ou la source d’atomisation) et par suite à la concentration de l’élément dans l’échantillon 56

Intensité d’une raie absorbée en spectrométrie d’absorption atomique ü L’intensité d ’absorption est quantifiée par la loi de Beer. Lambert : ü T = facteur de transmission = I/I 0 On définit un facteur d ’absorption a = 1 -T a = 1 -exp(kl. l) kl est le coefficient d’absorption et l est le trajet optique 57

Intensité d ’une raie absorbée en spectrométrie d’absorption atomique üLe facteur d’absorption s’écrit également en fonction de la probabilité de transition A, la population de l’état d’énergie initial n 0 (l’état d’énergie à partir duquel se produit la transition), de g Dleff est la largeur à mi-hauteur de la raie de l’élément affectée d’un facteur de forme Abs = - log(T) =- log(1 -a) 58

Spetrométries employant les phénomènes d’absorption et d’émission du rayonnement Excitation par collisions Emission AES Émission atomique Excitation radiative AAS AFS Absorption atomique Fluorescence atomique Cellule d’atomisation Détecteur Source de radiation Cellule d’atomisation Source de radiation Détecteur 59