Chimia apelor naturale APA Elementul Esenial al Vieii












































































- Slides: 117


Chimia apelor naturale

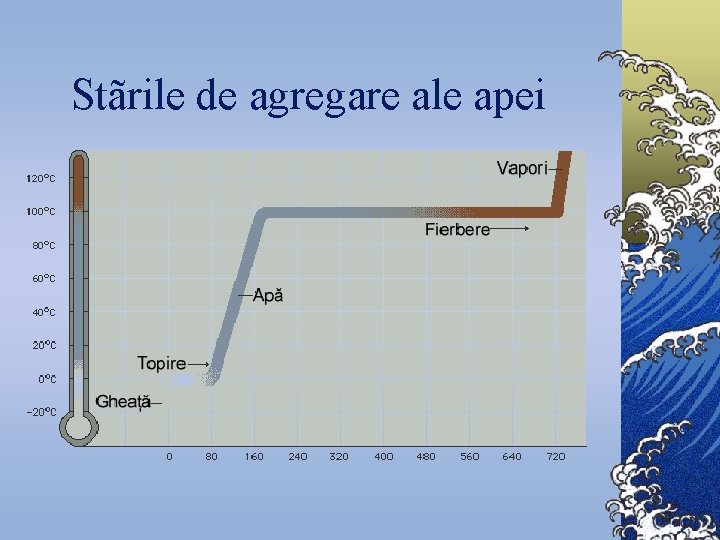
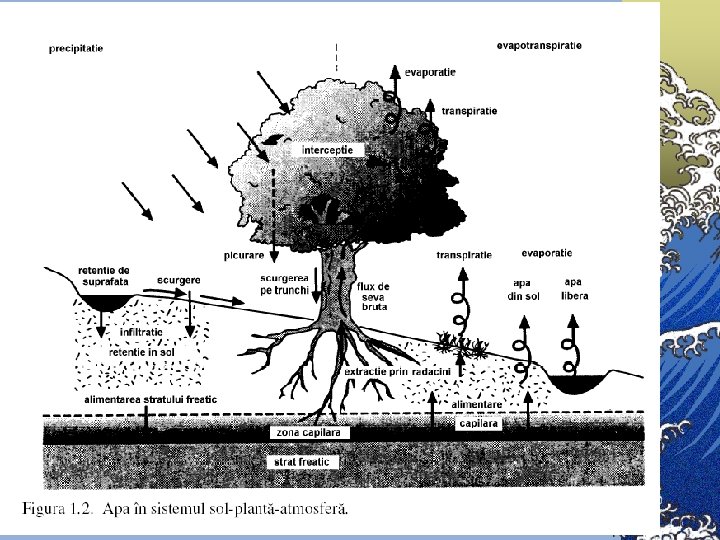
APA Elementul Esenţial al Vieţii Apa este foarte răspîndită în toate trei forme de agregare: ©Sub formă de gaz sau vapori de apă - ceaţa, aburi şi nori - în atmosferă, ©Sub formă lichidă - în rîuri, mlaştini, lacuri, mări sau oceane, ©Sub formă solidă - gheaţă.

Importanţa apei pentru organismul viu © Apa este principalul compus chimic din organismul unui om, reprezentand aproximativ 60% din greutatea noastra. © Este la fel de importanta pentru metabolismul nostru ca si sangele, deoarece apa: 1. ne elibereaza corpul de toxine, 2. duce nutrientii la celule, 3. mentine temperatura corpului constanta, 4. lubrifiaza articulatiile, 5. constituie principalul mediu in care au loc majoritatea reactiilor chimice din organism si 6. ajuta la digestie.

Stãrile de agregare ale apei

Trecerea apei dintr-o stare în alta duce la apariţia: ©norilor, ©ceţii, ©ploii, ©grindinei, ©rouăi, ©brumei, ©zãpăzii, ©lapoviţei ©poleiului.

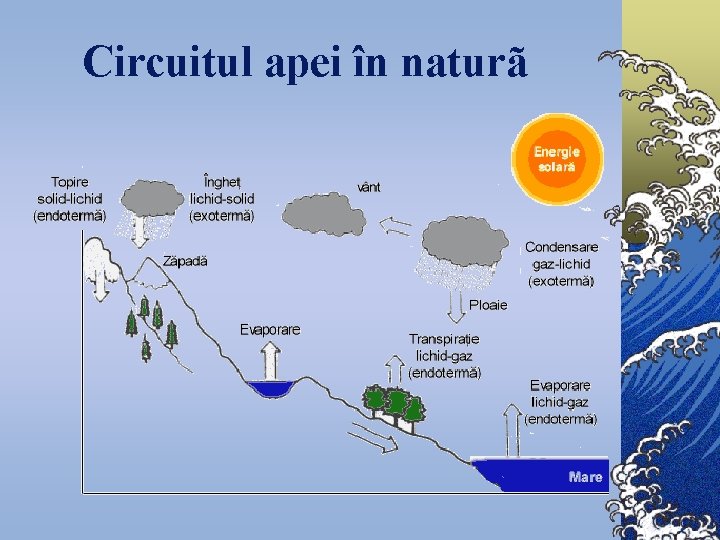
Datoritã circuitului rapid, apa constituie o resursã renovabilă ©Timpul de existenţă în diferite faze ale circuitului variazã foarte mult: © Apa poate exista în atmosferã doar câteva ore; © într-un lac sau rîu - zile sãptãmîni sau luni; ©în calote glaciare, gheţari sau oceane - mii de ani.

Molecula de apã Formula a fost propusă de italianul Stanislau Cannizzarro.

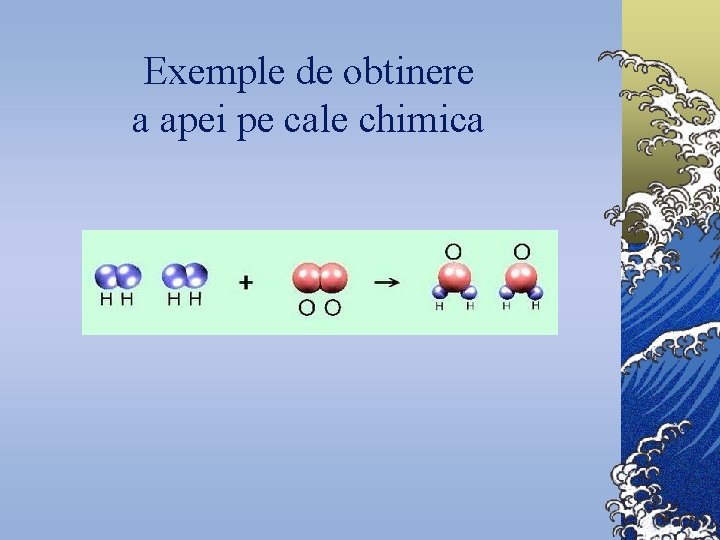
Istoria Chimica a APEI © Multe secole apa a fost consideratã ca un element: (apa, focul, pamintul, aerul). © În 1781, fizicianul englez H. Cavendish a arãtat cã apa se formeazã prin explozia unui amestec de hidrogen si oxigen, cu ajutorul scânteii electrice. © În 1783, Lavoisier a repetat experienţa, realizînd pentru prima dată sinteza cantitativã a apei. S-a stabilit atunci cã 2 g de hidrogen se combinã cu 16 g oxigen pentru a da 18 g apã. © În 1805, Humboldt si Gay-Lussac au arãtat cã apa este formatã din douã volume de hidrogen si un volum de oxigen. © Apa naturalã constã în amestecul speciilor de izotopi ai oxigenului: 16 O, 17 O, 18 O, cu cei trei izotopi ai hidrogenului: 1 H, 2 H, 3 H. Combinarea acestora genereazã 18 specii de molecule de apã. © Apa purã este întotdeauna un amestec de apã usoarã (H 2 O) si de cantitãti extrem de mici de apã grea (D 2 O) si apã hipergrea (T 2 O).

Exemple de obtinere a apei pe cale chimica

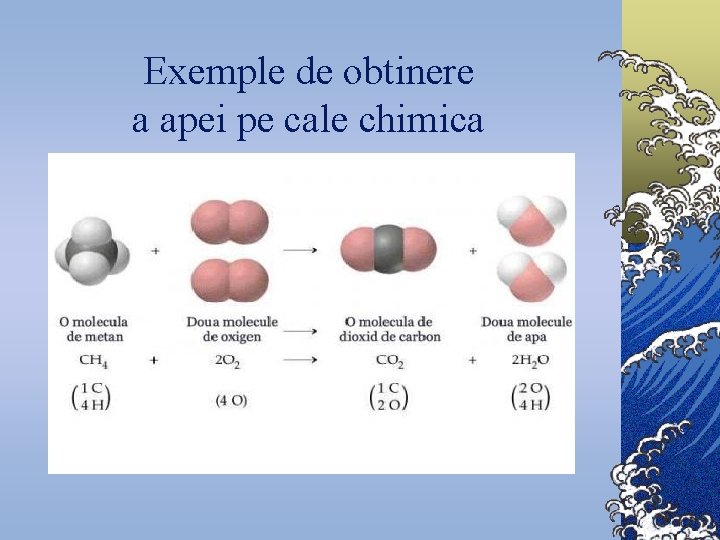
Exemple de obtinere a apei pe cale chimica









Curiozitati chimice © OXIGENUL DIN ATMOSFERA , FIXAT PRIN DIFERITE PROCESE DE OXIDARE , ESTE REINOIT PRIN FOTOSINTEZA O DATA LA 2000 DE ANI , IN TIMP CE DIOXIDUL DE CARBON DIN ATMOSFERA SI DIN APELE OCEANELOR ESTE REINOIT PRIN RESPIRATIE SI DESCOMPUNEREA MATERIEI ORGANICE O DATA LA CIRCA 300 ANI © ELECTRONUL GRAVITEAZA IN JURUL NUCLEULUI ATOMULUI CU O VITEZA DE 2000 KM/S, CU O ASTFEL DEVITEZA ELECTRONUL AR INCONJURA PAMANTUL IN 20 DE SECUNDE © - APA DE PLOAIE POLUATA (PLOAIA ACIDA)POATE AVEA UN p. H=2, 4 (ACELASI CU SUCUL DE LAMAIE) CEATA SI ZAPADA POT FI CHIAR MAI ACIDE. ©

Alimente care contin apa ©salate, castraveti (95%) © rosii, morcovi (90%). ©mere (85%) ©cartofii 80%)

Apa este eliminataa din organism ©prin transpiratie (200 – 300 ml/zi), ©prin urina (1. 000 si 1. 500 ml/zi), ©prin secretia lacrimala care contine 98% apa si 2% proteine, electroliti.

Apele naturale ©Apele naturale reprezintă nişte soluţii ale diferitelor substanţe

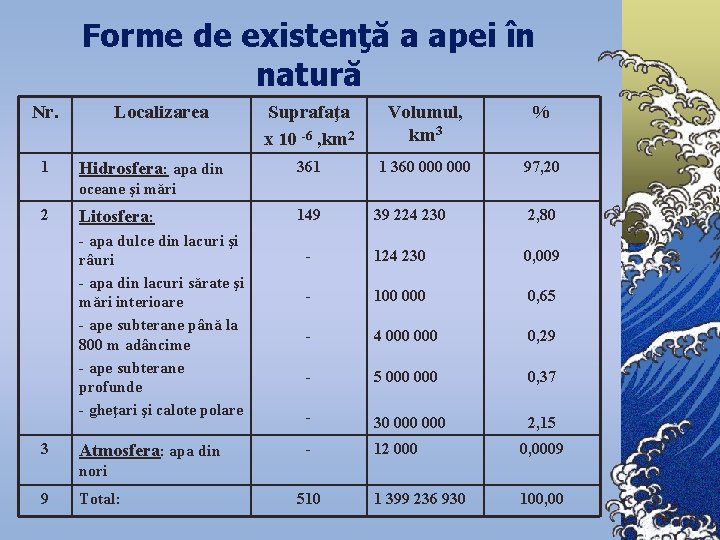
Forme de existenţă a apei în natură Nr. 1 Localizarea Hidrosfera: apa din Suprafaţa x 10 -6 , km 2 Volumul, km 3 % 361 1 360 000 97, 20 oceane şi mări 2 Litosfera: - apa dulce din lacuri şi râuri - apa din lacuri sărate şi mări interioare - ape subterane până la 800 m adâncime - ape subterane profunde - gheţari şi calote polare 3 Atmosfera: apa din 149 39 224 230 2, 80 - 124 230 0, 009 - 100 0, 65 - 4 000 0, 29 - 5 000 0, 37 - 30 000 2, 15 - 12 000 0, 0009 1 399 236 930 100, 00 nori 9 Total: 510

Circuitul apei în naturã

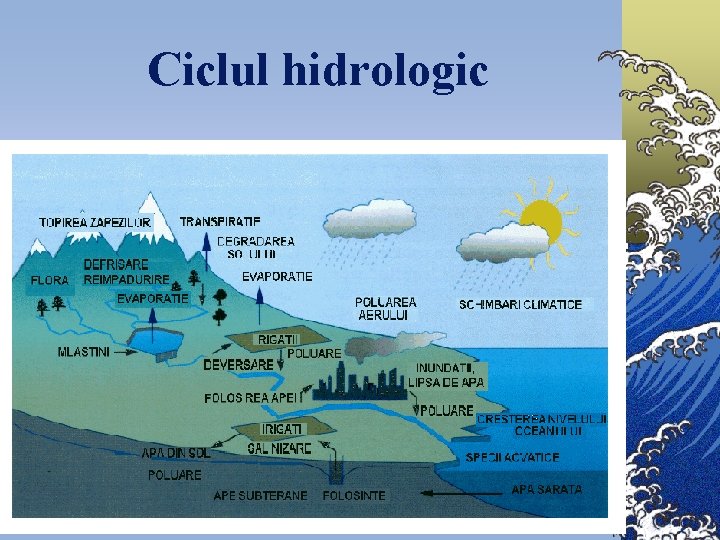
Ciclul hidrologic

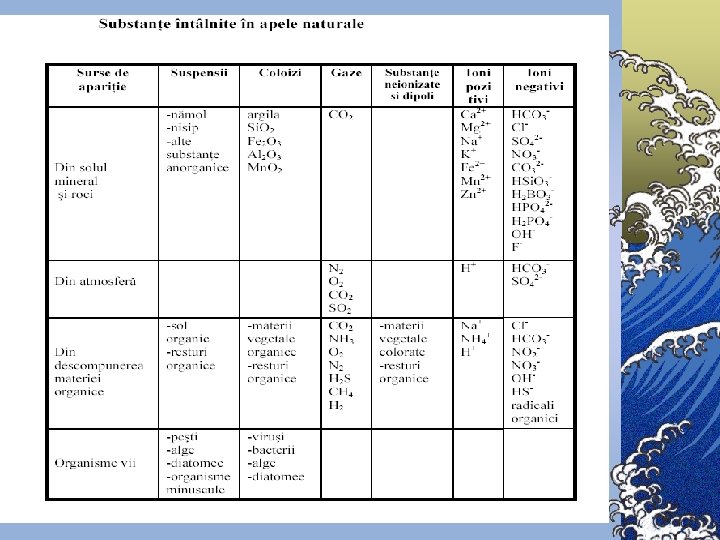
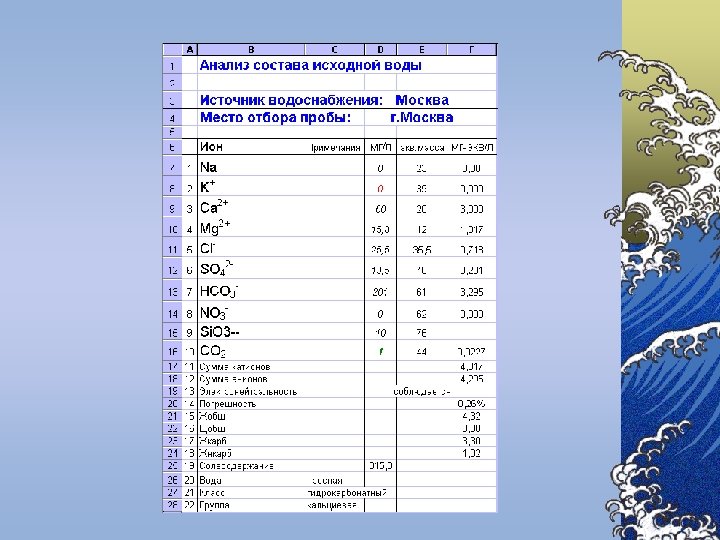
Compoziţia chimică a apelor naturale ©Prin compoziţia chimică a apelor naturale se subînţelege totalitatea gazelor dizolvate, a sărurilor minerale şi a substanţelor organice

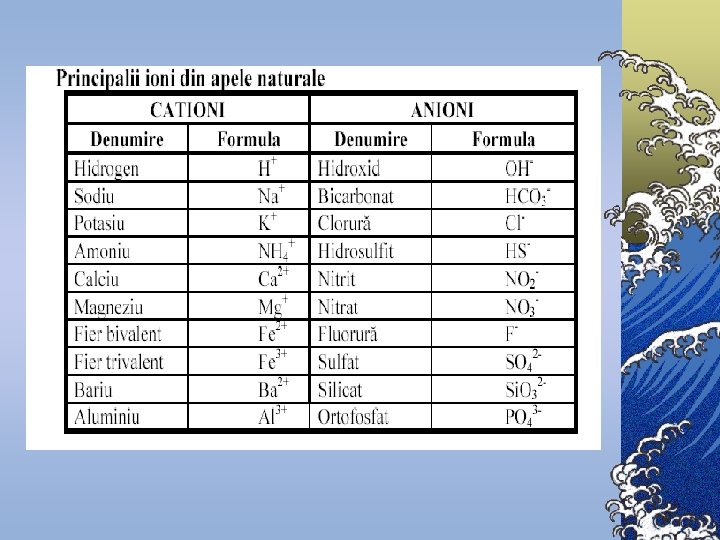
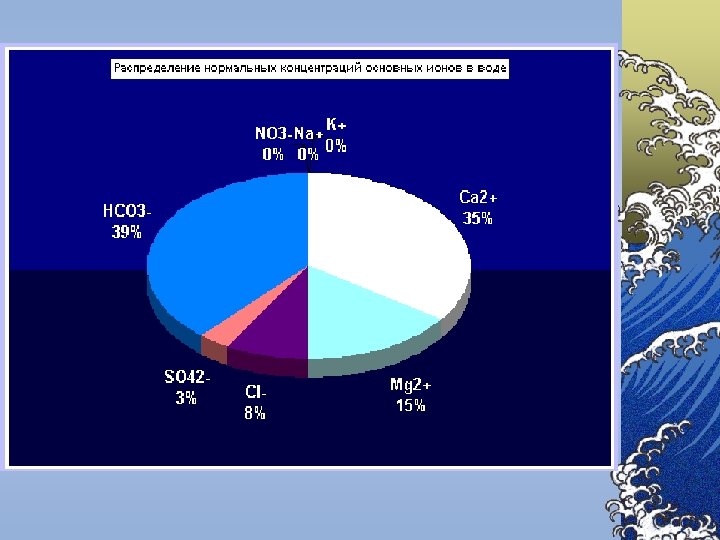
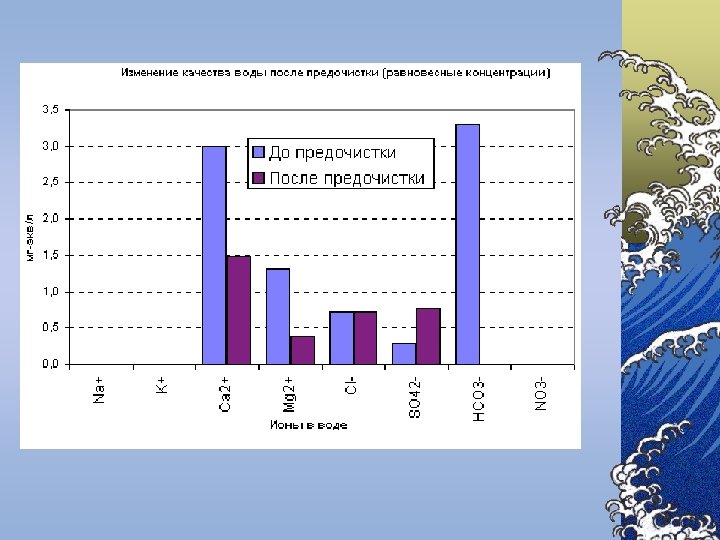
Componenţii chimici principali Componenţii chimici ai apelor naturale se împart în 6 grupe: 1. Ionii principali (macrocomponenţii) – K+, Na+, Mg 2+, Ca 2+, Cl-, SO 42 -, HCO 3 -, CO 32© Conţinutul macrocomponenţilor variază în limite largi © Tăria ionică a apelor dulci de suprafaţă nu depăşeşte 0, 01 2. Gazele dizolvate – O 2, N 2, H 2 S, CH 4 ş. a. 3. 4. 5. 6. © Concentraţia gazelor din apă se apreciază după presiunea parţială şi constanta lui Henry Substanţele biogene – compuşii azotului, fosforului, siliciului şi fierului Microelementele – toate metalele în afară de ionii principali şi de fier © Prezenţa acestor substanţe este necesară pentru funcţionare normală a organismelor vii Substanţele organice dizolvate – formele organice ale elementelor biogene Substanţele poluante toxice – metalele grele, produse petroliere, compuşii clororganici, agenţii activi de suprafaţă sintetici (AASS), fenolii ş. a.


Calitatea apei naturale ©Calitatea apelor naturale este determinată, în general, de totalitatea substanţelor minerale sau organice, gazele dizolvate, particulele în suspensie şi organismele vii prezente.

Calitatea apei naturale Calitatea apei se poate defini ca un ansamblu conventional de caracteristici fizice, chimice, biologice şi bacteriologice, exprimate valoric, care permit încadrarea probei într-o anumită categorie , ea căpătând astfel însuşirea de a servi unui anumit scop

Calitatea apei naturale © Sistemul mondial de supraveghere a mediului ambiant prevede monitorizarea calităţii apelor prin trei categorii de parametri : - parametri de bază : temperatură, p. H, conductivitate, oxigen dizolvat, colibacili ; - parametri indicatori ai poluării persistente: cadmiu, mercur, compuşi organo - halogenaţi şi uleiuri minerale ; - parametri opţionali : carbon organic total (COT), consum biochimic de oxigen (CBO) detergenţi anionici, metale grele, arsen, bor, sodiu, cianuri , uleiuri totale, streptococi.

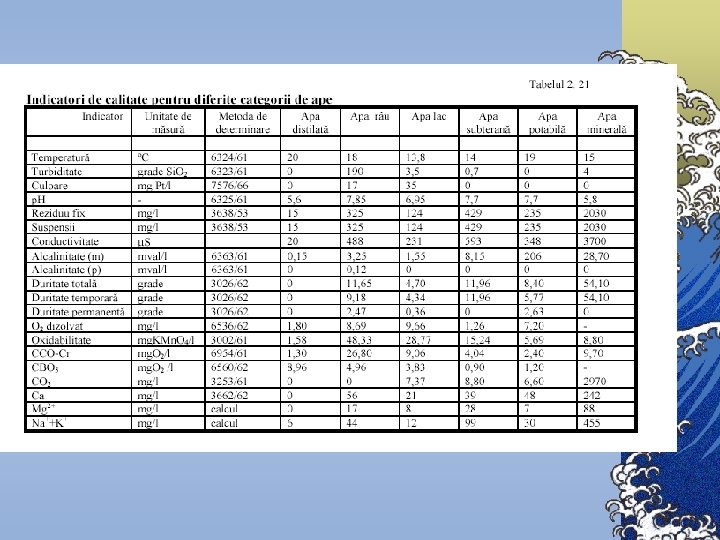
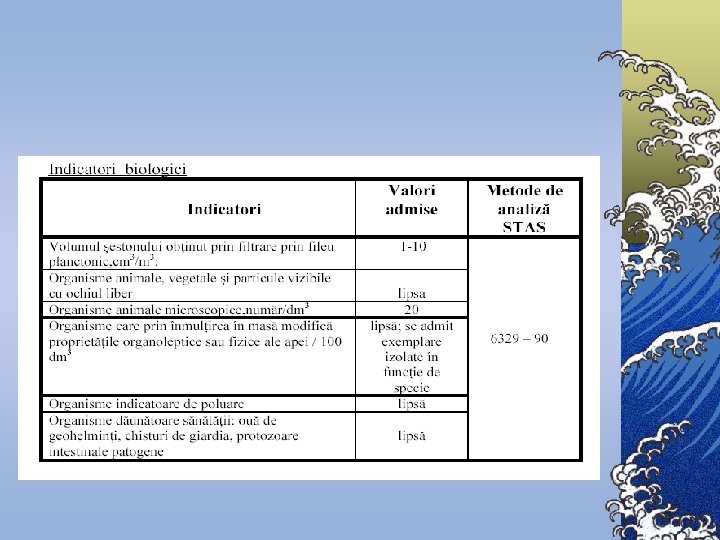
Indicatori de calitate a apei 1. 2. 3. 4. 5. Indicatori organoleptici Indicatori fizici Indicatori chimici Indicatori biogeni Indicatori biologici şi bacteriologici

Indicatori organoleptici 1. Culoarea 2. Mirosul 3. Gustul

Indicatori fizici 1. Turbiditatea se datorează particulelor solide sub formă de suspensii sau în stare coloidală. 2. Temperatura 3. Radioactivitatea este proprietatea apei de a emite radiaţii permanente alfa , beta sau gama. 4. Conductivitatea se utilizază în aprecierea gradului de mineralizare 5. Concentraţia ionilor de hidrogen, p. H

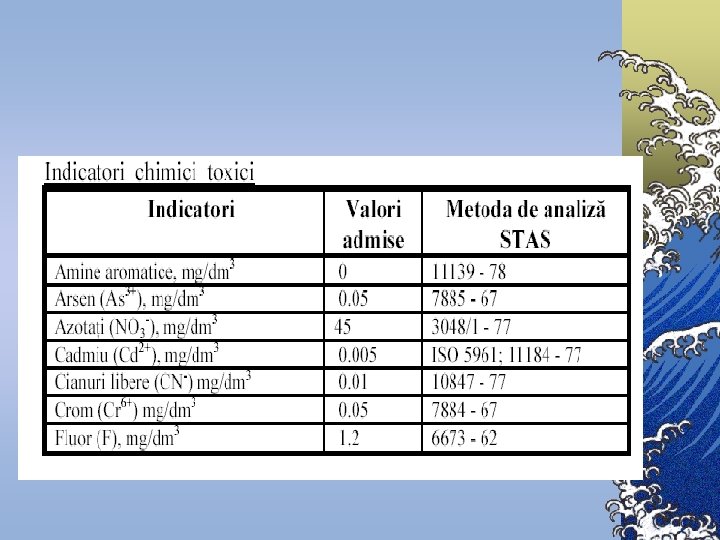
Indicatori chimici A. Indicatori ai regimului de oxigen 1. Oxigenul dizolvat (OD) 2. Consumul chimic de oxigen (CCO) 3. Consumul biochimic de oxigen (CBO) 4. Carbonul organic total (COT).

Indicatori chimici B. Săruri dizolvate ©In majoritatea cazurilor, sărurile aflate în apele naturale sunt formate din următorii cationi: Ca 2+, Mg 2+, Na+, K+ ©anioni: HCO 3 -, SO 42 -, Cl-.


Indicatori chimici C. Reziduul fix © Reziduul fix reprezintă totalitatea substanţelor dizolvate în apă, stabile după evaporare la 105°C, marea majoritate a acestora fiind de natură anorganică.

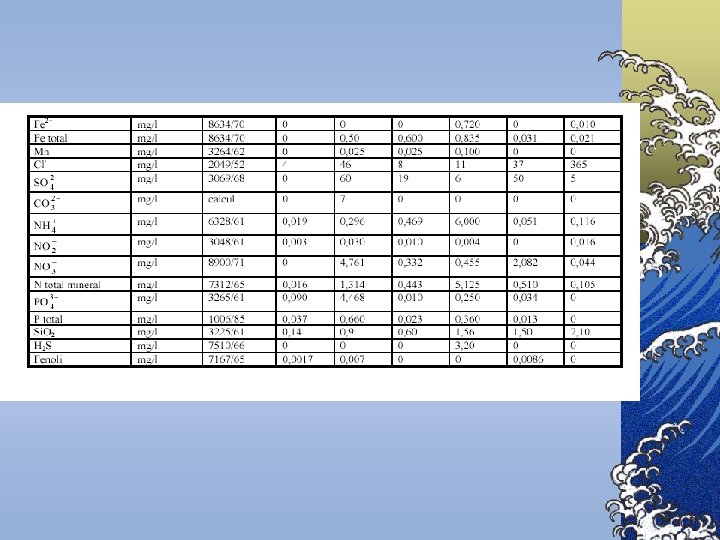
Indicatori biogeni 1. Compuєi ai azotului: . Amoniacul Nitriţii Nitraţii 2. Compuşi ai fosforului Fosfaţii

Duritatea apei © Duritatea totală reprezintă totalitatea sărurilor de Ca 2+ şi Mg 2+ © Duritatea temporară reprezintă conţinutul ionilor de Ca 2+ şi Mg 2+ legaţi de anionul HCO 3 -, care prin fierberea apei se poate înlătura deoarece dicarbonaţii se descompun în CO 2 şi în carbonaţi care precipită; © Duritatea permanentă reprezintă diferenţa dintre duritatea totală şi duritatea temporară, fiind atribuită ionilor de Ca 2+ şi Mg 2+ legaţi de anionii Cl-, SO 42 - şi NO 3#Acest tip de duritate persistă în apă, chiar după fierbere.

Indicatori biologici şi bacteriologici ©În analiza bacteriologică a apei au fost adoptaţi ca indicatori bacteriologici: 1. Numărul total de germeni 2. Bacilul coli.










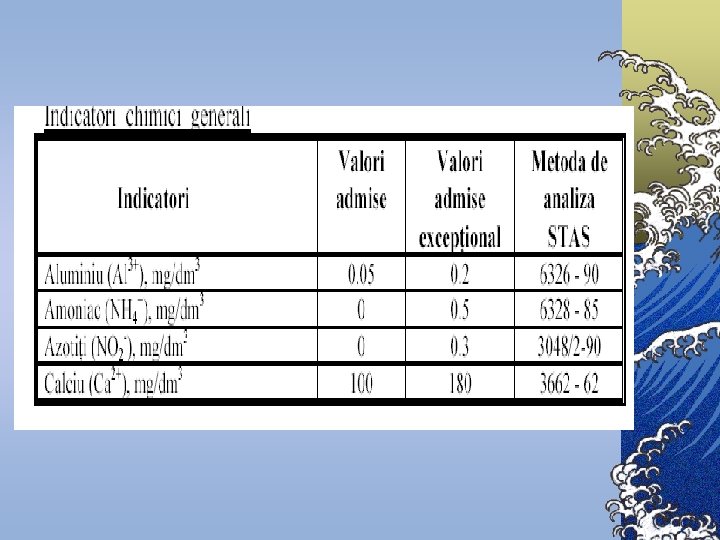
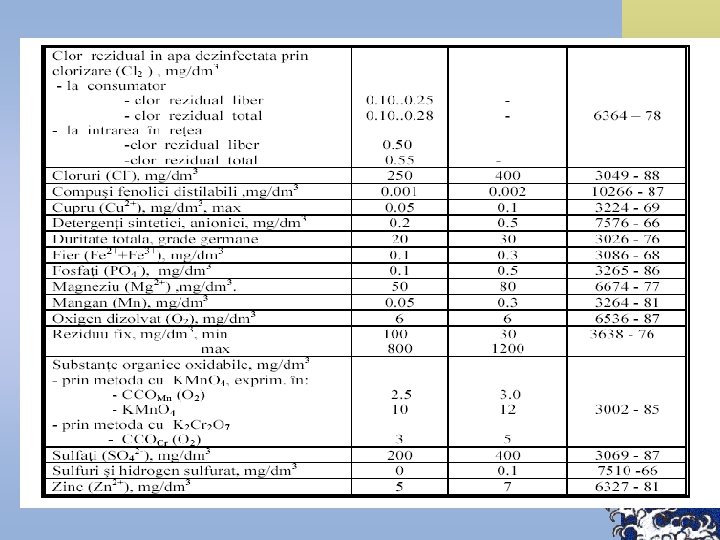
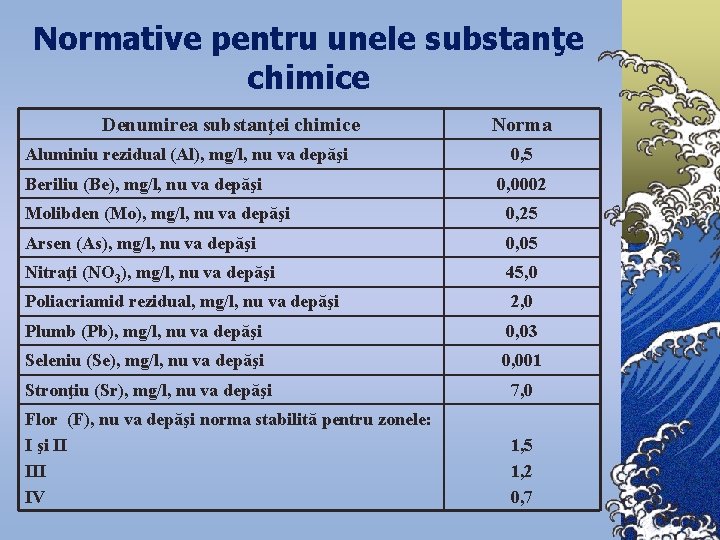
Normative pentru unele substanţe chimice Denumirea substanţei chimice Norma Aluminiu rezidual (Al), mg/l, nu va depăşi 0, 5 Beriliu (Be), mg/l, nu va depăşi 0, 0002 Molibden (Mo), mg/l, nu va depăşi 0, 25 Arsen (As), mg/l, nu va depăşi 0, 05 Nitraţi (NO 3), mg/l, nu va depăşi 45, 0 Poliacriamid rezidual, mg/l, nu va depăşi 2, 0 Plumb (Pb), mg/l, nu va depăşi 0, 03 Seleniu (Se), mg/l, nu va depăşi 0, 001 Stronţiu (Sr), mg/l, nu va depăşi 7, 0 Flor (F), nu va depăşi norma stabilită pentru zonele: I şi II III IV 1, 5 1, 2 0, 7

Ionii de hidrogen în apele naturale © Ionii de hidrogen există permanent în apă ca rezultat al autoionizării apei, conform reacţiei: H 2 O H+ + OH© Concentraţia ionilor de hidrogen determină caracterul acid sau bazic al apei prin indicele de hidrogen (p. H) © Valoarea p. H-lui pentru apele de suprafaţă se schimbă în funcţie de intensitatea iluminării şi de temperatură ©Fiecărei ape naturale îi sunt caracteristice anumite limite de variaţie ale p. H-lui

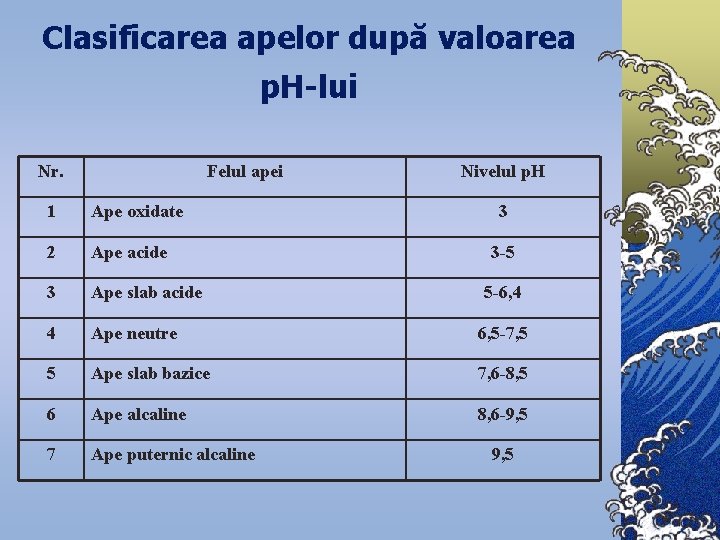
Clasificarea apelor după valoarea p. H-lui Nr. Felul apei Nivelul p. H 1 Ape oxidate 3 2 Ape acide 3 Ape slab acide 4 Ape neutre 6, 5 -7, 5 5 Ape slab bazice 7, 6 -8, 5 6 Ape alcaline 8, 6 -9, 5 7 Ape puternic alcaline 3 -5 5 -6, 4 9, 5

Clasificarea apelor naturale după salinitatea lor Nr. Felul apelor Salinitatea g/dm 3 1 Dulci până la 1, 0 2 Saline Între 1, 0 şi 25, 0 3 Sărate Între 25, 0 şi 50, 0 4 Soluţii de săruri sau saramuri peste 50, 0

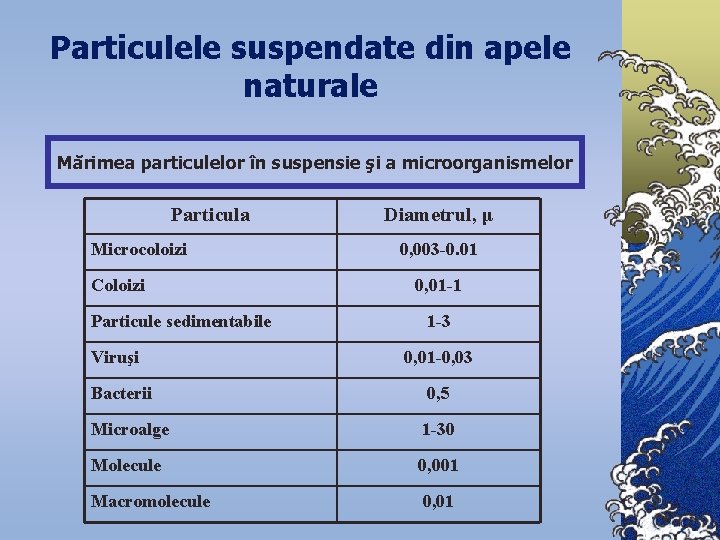
Particulele suspendate din apele naturale Mărimea particulelor în suspensie şi a microorganismelor Particula Microcoloizi Coloizi Particule sedimentabile Viruşi Diametrul, μ 0, 003 -0. 01 0, 01 -1 1 -3 0, 01 -0, 03 Bacterii 0, 5 Microalge 1 -30 Molecule 0, 001 Macromolecule 0, 01

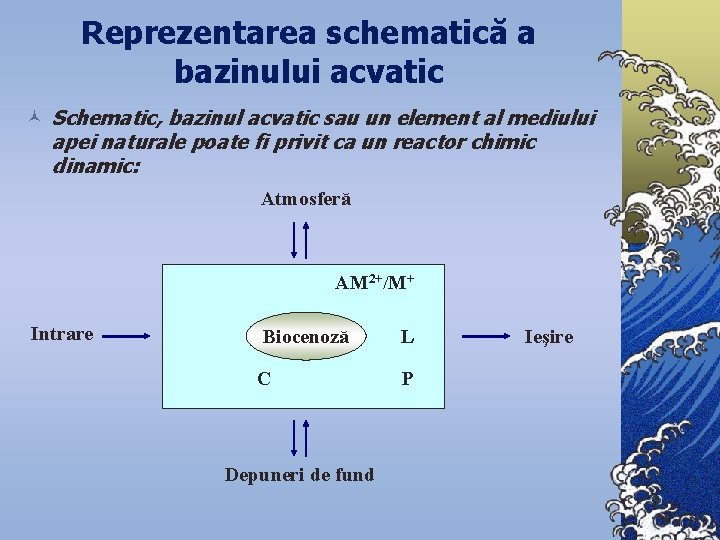
Reprezentarea schematică a bazinului acvatic © Schematic, bazinul acvatic sau un element al mediului apei naturale poate fi privit ca un reactor chimic dinamic: Atmosferă AM 2+/M+ Intrare Biocenoză L C P Depuneri de fund Ieşire

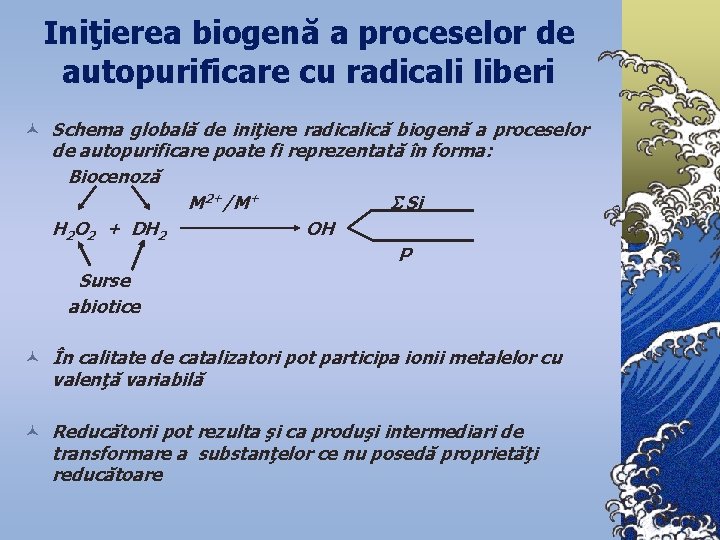
Iniţierea biogenă a proceselor de autopurificare cu radicali liberi © Schema globală de iniţiere radicalică biogenă a proceselor de autopurificare poate fi reprezentată în forma: Biocenoză M 2+/M+ Si H 2 O 2 + DH 2 OH P Surse abiotice © În calitate de catalizatori pot participa ionii metalelor cu valenţă variabilă © Reducătorii pot rezulta şi ca produşi intermediari de transformare a substanţelor ce nu posedă proprietăţi reducătoare

Nivelurile trofice © În ecosistemele acvatice, nivelul trofic inferior îl ocupă algele Ø Fitoplanctonul Ø Macrofitele © Următorul nivel trofic este reprezentat de către bacteriile heterotrofe © Bacteriile sunt consumate de către zooplanctonul filtrator © Bacteriile reprezintă componentul hrănitor principal şi al detritului © Cu cât organismul se află mai sus pe scara evoluţiei, cu atât sunt mai mari dimensiunile lui şi intensitatea specifică a schimbului de substanţe cu mediul exterior este mai mică


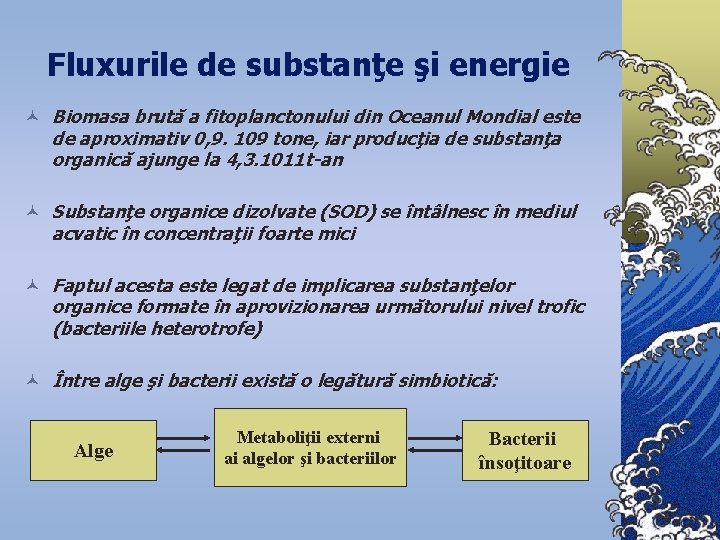
Fluxurile de substanţe şi energie © Biomasa brută a fitoplanctonului din Oceanul Mondial este de aproximativ 0, 9. 109 tone, iar producţia de substanţa organică ajunge la 4, 3. 1011 t-an © Substanţe organice dizolvate (SOD) se întâlnesc în mediul acvatic în concentraţii foarte mici © Faptul acesta este legat de implicarea substanţelor organice formate în aprovizionarea următorului nivel trofic (bacteriile heterotrofe) © Între alge şi bacterii există o legătură simbiotică: Alge Metaboliţii externi ai algelor şi bacteriilor Bacterii însoţitoare

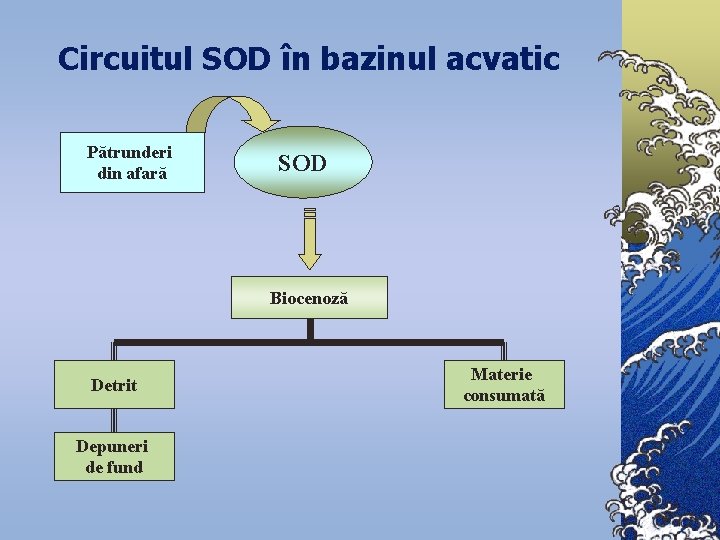
Circuitul SOD în bazinul acvatic Pătrunderi din afară SOD Biocenoză Detrit Depuneri de fund Materie consumată

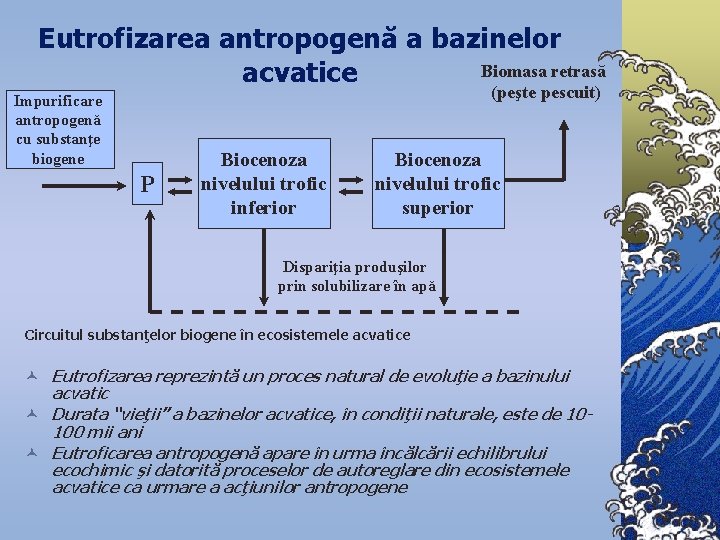
Eutrofizarea antropogenă a bazinelor Biomasa retrasă acvatice (peşte pescuit) Impurificare antropogenă cu substanţe biogene P Biocenoza nivelului trofic inferior Biocenoza nivelului trofic superior Dispariţia produşilor prin solubilizare în apă Circuitul substanţelor biogene în ecosistemele acvatice © Eutrofizarea reprezintă un proces natural de evoluţie a bazinului acvatic © Durata “vieţii” a bazinelor acvatice, în condiţii naturale, este de 10100 mii ani © Eutroficarea antropogenă apare în urma încălcării echilibrului ecochimic şi datorită proceselor de autoreglare din ecosistemele acvatice ca urmare a acţiunilor antropogene

Cauzele principale apariţiei “înfloririi” 1. Schimbarea regimului hidrologic al râurilor 2. Schimbarea regimului termic 3. Suprasaturarea bazinului acvatic cu compuşi ai azotului şi fosforului – explozia de “înflorire” începe la un raport N/P≈10

Ionii metalelor tranzitionale în apele naturale © Ionii metalelor sunt componenţii obligatorii ai apelor naturale © Proprietăţile catalitice ale metalelor ca şi permeabilitatea pentru microorganismele acvatice depind de forme de existenţă ale acestora în ecosistemul acvatic © Trecerea metalelor din mediul acvatic în forma metal-complexă are trei urmări: 1. 2. 3. Poate avea loc creşterea concentraţiei totale a ionilor metalici pe seama trecerii lor în soluţie din depunerile de fund Permeabilitatea membranară a ionilor complecşi se poate deosebi esenţial de permeabilitatea ionilor hidrataţi În urma formării complecşilor, toxicitatea metalelor se poate schimba radical

Ionii metalelor tranzitionale în apele naturale © Dacă în apă este prezentă faza solidă a metalului, atunci particulele microcoloidale se află într-un echilibru dinamic cu formele dizolvate ale metalului: (MXn)s (Mn )aq n. X unde X- - ligandul anionic care formează complecşi insolubili © Astfel de liganzi pot fi OH-, Cl-, fosfat, carbonat, sulfură ş. a. © Acest echilibru este caracterizat prin produsul de solubilitate: Ps [Mn ][X-]n © Ecuaţia bilanţului pentru metalul M în prezenţa fazei solide Ms poate fi redată sub forma: M 0 (Mn )aq (ML) (MXn)s unde (ML) - totalitatea formelor complexe ale metalului în mediul acvatic

Aqua-ionii metalici din apă Concentraţia unor aqua-ioni metalici în apă, la p. H 7, 6 Forma redox a metalului Concentraţia, g ion/l Cu 2+/Cu+ 10 -7/10 -8 Fe 3+/Fe 2+ 10 -19/10 -2 Mn 3+/Mn 2+ 10 -17/10 -1 Co 3+/Co 2+ 10 -25/10 -8 Cr 3+/Cr 2+ 10 -11/10 -7

Influenţa p. H-ului asupra formelor de existenţă a Fe © În mediul acvatic se întâlnesc mai des compuşii Fe(III), fiind mai stabili termodinamic; Fe(II) se întâlneşte de obicei în apele subterane © Mărimea Ps pentru Fe(OH)3 este de 3, 8. 10 -38 © La p. H 4, concentraţia formei aqua a fierului în echilibru cu hidroxidul este foarte mică © În intervalul de p. H 4, 5 - 5 fierul omogen din soluţie se găseşte, prioritar, sub forma bis-hidroxocomplexă Fe(OH)� 2 © La p. H>6 Fe 3+ există sub forma tris-hidroxocomplexă: Fe 3+ + OH- Fe(OH)2+ Fe 3+ + 2 OH- Fe(OH)2+ Fe 3+ + 3 OH- Fe(OH)3 Concentraţia maximă a formei dizolvate de Fe(OH)3 este de numai 2. 10 -7 mol/l

Influenţa p. H-ului asupra formelor de existenţă a Cu © În apele naturale se întâlnesc mai des compuşii Cu(II) © Dintre compuşii Cu(I), cei mai răspândiţi sunt Cu 2 O, Cu 2 S, Cu. Cl, care sunt greu solubili în apă © În cazul Cu 2+, mărimea Ps a hidroxidului este de 2, 2, . 10 -20 © Transformările acido-bazice ale formelor omogene de Cu pot fi reprezentate prin reacţiile: © Cu 2’ + OH- Cu. OH� © Cu 2+ + 2 OH- Cu(OH)2 © La p. H 9, când este favorizată formarea hidroxidului de cupru, concentraţia maximă atinsă de formele omogene este de 10 -6 M [Cu(OH)2] © În condiţiile p. H-ului mediu al apelor naturale, concentraţia totală a cuprului fiind 10 -6 mol/l, tot cuprul se va găsi în stare omogenă © În regiunea 7 < p. H < 9 se formează, de obicei, monohidroxocomplexul

Proprietatea de a forma complecşi (PFC) © Una din caracteristicile principale apelor naturale, legată de formele de existenţă ale metalelor, este proprietatea de a forma complecşi (PFC) © Aprecierea cantitativă a PFC se face prin cantitatea de ioni metalici pe care o poate lega apa sub formă de complecşi, exprimată în ioni gram/l © PFC depinde de: © natura metalului © prezenţa în apă a metalelor concurente care formează complecşi cu liganzii naturali © natura şi concentraţia liganzilor prezenţi în apă © p. H-ul mediului acvatic © Concentraţiile tipice ale liganzilor micromoleculari din apele naturale sunt următoarele: © © © HCO 3 - (CO 32 -) - 3. 10 -3 M; CH 3 COOH- 10 -4 M; NH� 4(NH 3) - 10 -5 M; Si(OH)4 (Si. O(OH)-3) - 5. 10 -4 M; H 2 PO 4 -(HPO 42 -) - 10 -5 M; H 2 S(SH-) - 10 -5 M

Fulvoacizii Liganzii naturali principali sunt fulvoacizii (FA) Datorită prezenţei în compoziţia FA a grupelor fenolice şi carboxilice, aceste substanţe formează cu ionii metalelor complecşi chelaţi stabili În regiunea de p. H 5 -9 fulvoacizii se găsesc în apă sub formă de asociaţii alcătuite din câteva unităţi monomere cu masa moleculară de circa 300 Masa moleculară a FA creşte odată cu creşterea p. H-ului, ajungând la câteva mii. Complecşii metalici formaţi cu acizi humici sunt de tip salicilic (a) sau ftalic (b):

Liganzi de suprafaţă © În apele naturale mai sunt prezente diferite grupe de liganzi care se află la suprafaţa particulelor şi a biocenozei – liganzi de suprafaţă © Astfel de particule minerale, care conţin grupe hidroxil ca ligand, sunt: OH HO Si OH Al OH Fe OH OH © Grupe funcţionale cu rol de ligand sunt prezente şi la suprafaţa humusului insolubil, detritului, celulelor microorganismelor: -R-OH, -R-COOH. © Echilibrul de formare a complecşilor ionilor metalici cu liganzii de suprafaţă Ls este descris formal de aceeaşi ecuaţie ca şi cu liganzii tipici: Ks (Mn+)aq + Ls (Mn+Ls)supr.

Formarea H 2 O 2 în apele naturale © 1. 2. Procesele care duc la formarea H 2 O 2 în apele naturale: Pătrunderea H 2 O 2 din atmosferă Formarea radicalului superoxid sub acţiunea luminii solare HO 2 + O-2 O 2 + HO-2 © Reducerea bi-electronică a O 2 până la H 2 O 2 în procese redoxcatalitice după o reacţie de tipul: Cu 2+/Cu+ O 2 + DH 2 D + H 2 O 2 © Emisia biologică de către alge şi unele bacterii © La formarea H 2 O 2 pot contribui şi unii hidroperoxizi care rezultă din procesele fotochimice şi catalitice la oxidarea substanţelor organice cu oxigen singlet sau cu radicali liberi: H 2 O ROOH ROH + H 2 O 2 Conţinutul de ROOH din apele naturale este de aproape 10 ori mai mic decât al H 2 O 2

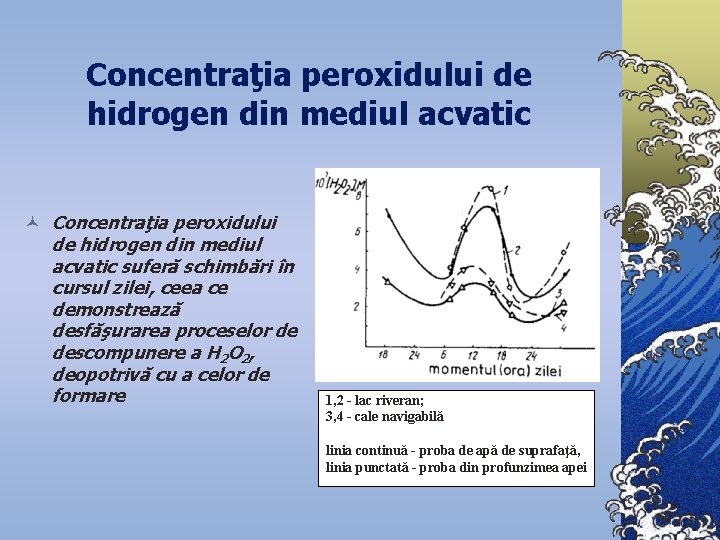
Concentraţia peroxidului de hidrogen din mediul acvatic © Concentraţia peroxidului de hidrogen din mediul acvatic suferă schimbări în cursul zilei, ceea ce demonstrează desfăşurarea proceselor de descompunere a H 2 O 2, deopotrivă cu a celor de formare 1, 2 - lac riveran; 3, 4 - cale navigabilă linia continuă - proba de apă de suprafaţă, linia punctată - proba din profunzimea apei

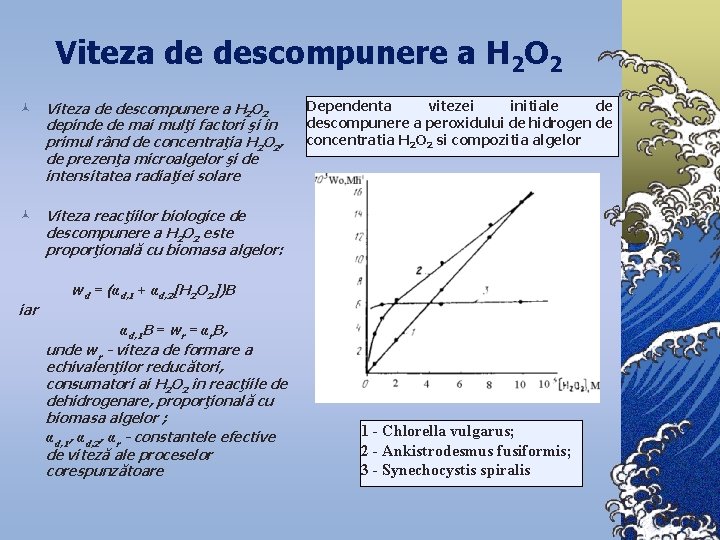
Viteza de descompunere a H 2 O 2 © Viteza de descompunere a H 2 O 2 depinde de mai mulţi factori şi în primul rând de concentraţia H 2 O 2, de prezenţa microalgelor şi de intensitatea radiaţiei solare Dependenta vitezei initiale de descompunere a peroxidului de hidrogen de concentratia H 2 O 2 si compozitia algelor © Viteza reacţiilor biologice de descompunere a H 2 O 2 este proporţională cu biomasa algelor: iar wd = (αd, 1 + αd, 2[H 2 O 2])B αd, 1 B = wr = αr. B, unde wr - viteza de formare a echivalenţilor reducători, consumatori ai H 2 O 2 în reacţiile de dehidrogenare, proporţională cu biomasa algelor ; αd, 1, αd, 2, αr - constantele efective de viteză ale proceselor corespunzătoare 1 - Chlorella vulgarus; 2 - Ankistrodesmus fusiformis; 3 - Synechocystis spiralis

Curba cinetică a prelucrării si degradării H 2 O 2 in prezenţa algelor Microcystis aeruginosa © Dacă apa naturală şi o cultură de alge sunt supuse acţiunii radiaţiilor solare UV şi se adaugă la această probă diferite concentraţii de H 2 O 2, după un timp oarecare, indiferent de concentraţia iniţială a H 2 O 2, în apă se stabileşte aproximativ aceeaşi concentraţie staţionară a H 2 O 2 1 - cinetica formării H 2 O 2 sub acţiunea luminii filtrate (hν=300 nm); 2, 3 - cinetica distrugerii H 2 O 2 la lumină

Schimbarea stării redox a mediului acvatic © Cea mai importantă urmare a schimbării stării redox a mediului acvatic constă în apariţia, în apă, a factorilor toxici, până atunci necunoscuţi Starea redox sezonieră a mediului acvatic (Volga inferioară) si iesirea puietului de nisetru în iazurile CNV: © În calitate de bioindicatori pot servi infuzorii şi puietul de peşte în cele mai timpurii stadii de dezvoltare I - oxidantă; II - cvasi-reducătoare; III - instabilă

Intoxicarea mediului acvatic poate fi legată de acţiunea unuia sau a câtorva factori redox de toxicitate: 1. 2. 3. 4. 5. Acţiunea nemijlocită a reducătorului ca toxic Trecerea cuprului într-o formă biologic inaccesibilă şi, ca urmare, apariţia sistemelor enzimatice defecte Lipsa din mediu a H 2 O 2 ca oxidant exogen Micşorarea proprietăţii de autopurificare a mediului acvatic şi acumularea substanţelor toxice Formarea condiţiilor favorabile pentru apariţia şi înmulţirea microflorei patogene

Procese de autopurificare a ecosistemelor acvatice

Tipuri de poluări ale sistemelor acvatice Impurităţile pot fi împărţite în trei grupe: 1. Substanţe conservatoare, care nu se descompun sau se descompun foarte lent Ø ioni metalici, săruri minerale, compuşi hidrofobi de tipul pesticidelor sau hidrocarburilor din petrol; autopurificarea are un caracter aparent Ø 2. Substanţe biogene ce iau parte la circuitul biologic Ø Ø formele minerale azotului şi fosforului, compuşi organici uşor asimilabili autopuruficarea are loc pe seama proceselor biochimice 3. Substanţe dizolvate în apă şi care nu sunt incluse în circuitul biologic Ø Ø toxine de provenienţa industrială sau agricolă autopurufucarea se realizează prin transformarea lor chimică şi microbiologică

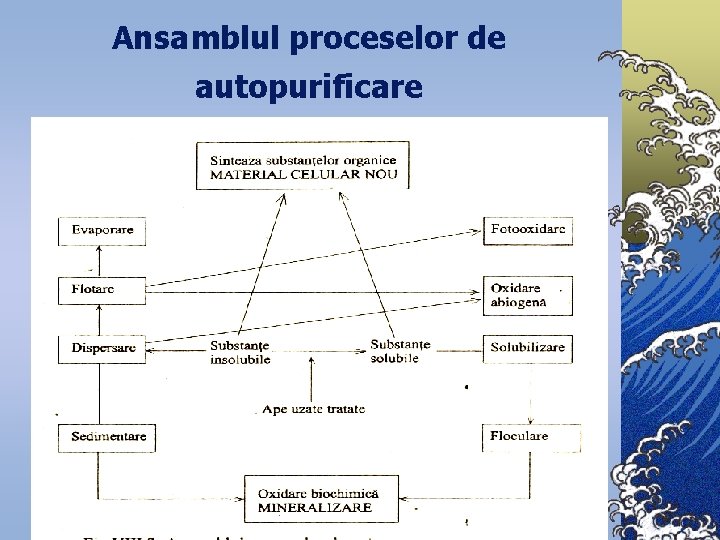
Ansamblul proceselor de autopurificare

Procesele importante pentru autopurificarea mediului acvatic Deosebit de importante pentru autopurificarea mediului acvatic sunt: a) Procesele fizice cu transport de masă: - diluarea (agitarea) transportul SP în bazinele de apă învecinate evaporarea adsorbţia (pe particule în suspensie şi depuneri de fund) agregarea biologică b) Transformarea microbiologică c) Transformarea chimică: - hidroliza - fotoliza - oxidarea

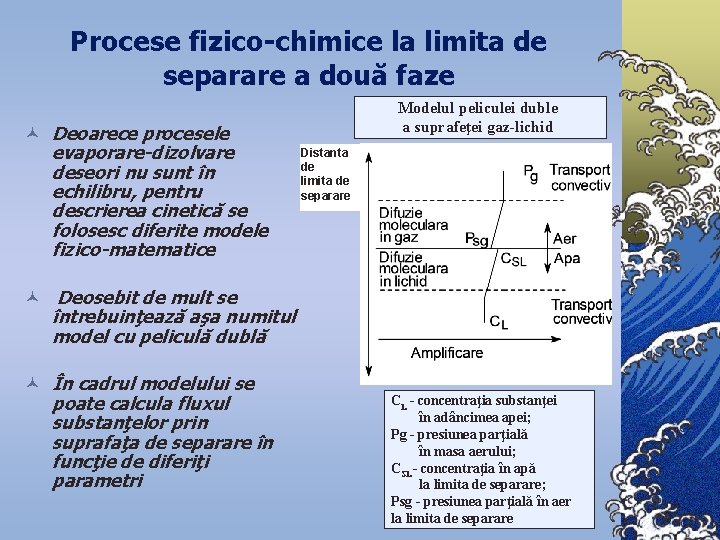
Procese fizico-chimice la limita de separare a două faze © Deoarece procesele evaporare-dizolvare deseori nu sunt în echilibru, pentru descrierea cinetică se folosesc diferite modele fizico-matematice Modelul peliculei duble a suprafeţei gaz-lichid Distanta de limita de separare © Deosebit de mult se întrebuinţează aşa numitul model cu peliculă dublă © În cadrul modelului se poate calcula fluxul substanţelor prin suprafaţa de separare în funcţie de diferiţi parametri CL - concentraţia substanţei în adâncimea apei; Pg - presiunea parţială în masa aerului; CSL- concentraţia în apă la limita de separare; Psg - presiunea parţială în aer la limita de separare

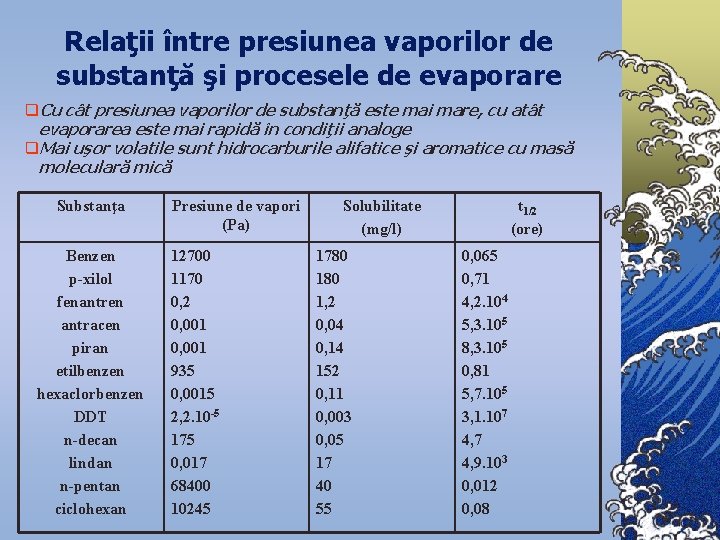
Relaţii între presiunea vaporilor de substanţă şi procesele de evaporare q. Cu cât presiunea vaporilor de substanţă este mai mare, cu atât evaporarea este mai rapidă în condiţii analoge q. Mai uşor volatile sunt hidrocarburile alifatice şi aromatice cu masă moleculară mică Substanţa Benzen p-xilol fenantren antracen piran etilbenzen hexaclorbenzen DDT n-decan lindan n-pentan ciclohexan Presiune de vapori (Pa) 12700 1170 0, 2 0, 001 935 0, 0015 2, 2. 10 -5 175 0, 017 68400 10245 Solubilitate (mg/l) 1780 1, 2 0, 04 0, 14 152 0, 11 0, 003 0, 05 17 40 55 t 1/2 (ore) 0, 065 0, 71 4, 2. 104 5, 3. 105 8, 3. 105 0, 81 5, 7. 105 3, 1. 107 4, 9. 103 0, 012 0, 08

Procesele de sorbţie la limita de separare © Studiul cineticii proceselor de sorbţie a arătat existenţa a două stadii: K 1 K 2 PW Ps 1 Ps 2 © În prima etapă, sorbţia substanţei decurge repede şi reversibil (sorbţia la suprafaţă) © Pătrunderea în continuare a substanţei în interiorul particulei macromoleculare solide de solvent organic este un proces lent şi poate decurge câteva zile © Partea de substanţă adsorbită pe suprafaţă variază de obicei în intervalul 0, 35 - 0, 6 © Sorbţia multor impurităţi, cu o solubilitate în apă mai mică de 10 -3 M, reprezintă unul din procesele principale de îndepărtare a lor din faza lichidă © Pentru pesticidele clororganice, policlorbifenolii, hidrocarburile poliaromatice , sorbţia este cel mai eficient proces de autopurificare a mediului

Autopurificarea microbiologică © Transformarea microbiologică a SP este socotită una din principalele căi de autopurificare a mediului apos natural © Procesele microbiologice biochimice includ câteva tipuri de reacţii cu participarea enzimelor oxidoreducătoare şi hidrolitice (oxidaza, oxigenaza, dehidrogenaza, hidrolaza ş. a. ) © Temperatura optimă pentru desfăşurarea proceselor de biodegradare a SP este de 25 -30 °C © De regulă, constanta vitezei de transformare microbiologică a impurităţii se corelează cu constanta vitezei de hidroliză a substanţei în mediu bazic: lg k. B = a + b lg k. OH

Autopurificarea chimică Hidroliza © De regulă, se supun hidrolizei esterii, amidele acizilor carboxilici şi a diferiţilor acizi ce conţin fosfor; în acest caz apa participă în reacţie ca reactiv: R 1 XR 2 + H 2 O R 1 XH + R 2 OH © Drept catalizatori pot funcţiona acizii şi bazele dizolvaţi în apa naturală © Ca urmare, constanta vitezei de hidroliză a impurităţilor poate fi reprezentată sub forma: kh = k. W + k. H[H] unde kh- constanta bimoleculară a vitezei de hidroliză în prezenţa catalizatorului H ; k. W-constanta vitezei de hidroliză a substanţei date în apă distilată Relativ uşor hidrolizează compuşii organici ce conţin fosfor şi care posedă o activitate insecticidă mare

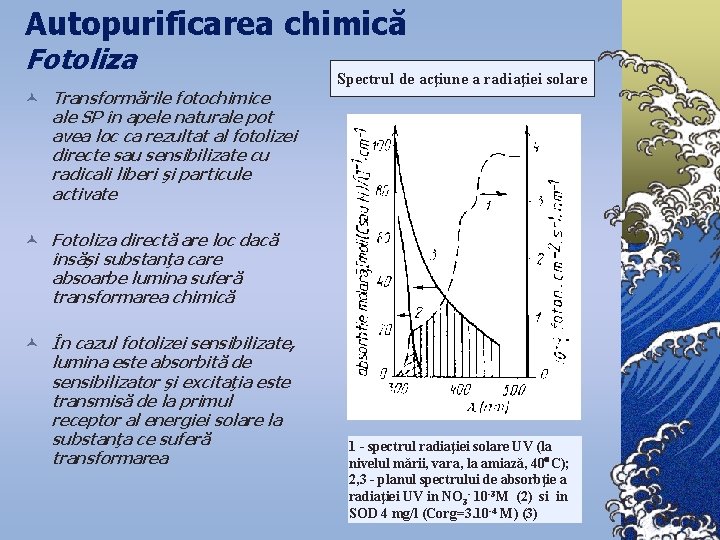
Autopurificarea chimică Fotoliza © Transformările fotochimice ale SP în apele naturale pot avea loc ca rezultat al fotolizei directe sau sensibilizate cu radicali liberi şi particule activate Spectrul de acţiune a radiaţiei solare © Fotoliza directă are loc dacă însăşi substanţa care absoarbe lumina suferă transformarea chimică © În cazul fotolizei sensibilizate, lumina este absorbită de sensibilizator şi excitaţia este transmisă de la primul receptor al energiei solare la substanţa ce suferă transformarea 1 - spectrul radiaţiei solare UV (la nivelul mării, vara, la amiază, 40 C); 2, 3 - planul spectrului de absorbţie a radiaţiei UV in NO 3 - 10 -3 M (2) si in SOD 4 mg/l (Corg=3. 10 -4 M) (3)

Formarea oxigenului singlet în reacţii fotosensibilizate © În soluţii oxigenate, drept particule active intermediare de natură neradicalică, pentru reacţiile fotosensibilizate, servesc particulele excitate electronic ale sensibilizatorului şi oxigenul singlet © Ultimul se formează prin transmiterea excitării de la molecula sensibilizatorului S: S + h 1 S 3 S + O 1 O + S 2 2 1/ 0 1 O O ( 2. 10 -6 s) 2 2 0 © Între concentraţia particulelor excitate triplet 3 S şi oxigenul singlet există relaţia [3 S ] 0, 67[1 O 2]

Autopurificarea chimică Oxidarea © Procesele de oxidare a impurităţilor în apele naturale pot fi de două tipuri: 1. Primul tip cuprinde procesele în care ionii metalici, aflaţi în formă oxidată, servesc drept reactivi de oxidare 2. Al doilea tip cuprinde procesele în care se realizează oxidarea impurităţilor de către radicali liberi şi alte particule reactive

Constante efective de viteză a oxidării © Constanta efectivă de viteză a oxidării catalitice a impurităţilor (k. K) : k. K = k. M [M] M unde [M] - concentraţia efectivă a formei catalitic active a metalului M în apa naturală © Constanta efectivă de viteză a reacţiei de transformare a impurităţilor P sub acţiunea radicalilor: kr = k. R[R] R unde k. R - constanta de viteză a reacţiei bimoleculare de interacţiune a radicalului R cu substanţa P © Constanta efectivă de viteză a reacţiei de autopurificare a mediului acvatic, în raport cu substanţa P: k. P = ki( ) = kb+ kh + f + k. K + kr i © unde - parametrii mediului (indicii b, h, , k, r corespund căilor de transformare a impurităţilor P: microbiologică, hidrolitică, fotochimică, catalitică şi radicalică)

Chimia ecologică a apelor reziduale

Definiţia © Apele reziduale sunt apele folosite pentru necesităţile casnice sau industriale şi care, datorită impurităţilor adăugate, şi-au schimbat componenţa chimică iniţială sau proprietăţile fizice. © În aceeaşi categorie intră şi apele care se scurg de pe teritoriile urbane, suprafeţele industriale şi câmpurile agricole în urma căderii precipitaţiilor atmosferice

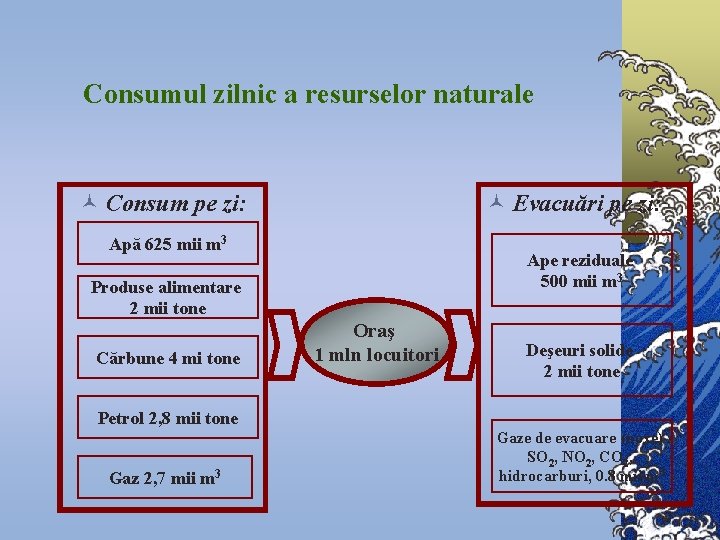
Consumul zilnic a resurselor naturale © Consum pe zi: © Evacuări pe zi: Apă 625 mii m 3 Ape reziduale 500 mii m 3 Produse alimentare 2 mii tone Cărbune 4 mi tone Oraş 1 mln locuitori Deşeuri solide 2 mii tone Petrol 2, 8 mii tone Gaz 2, 7 mii m 3 Gaze de evacuare (noxe) SO 2, NO 2, CO 2, hidrocarburi, 0. 8 mii m 3

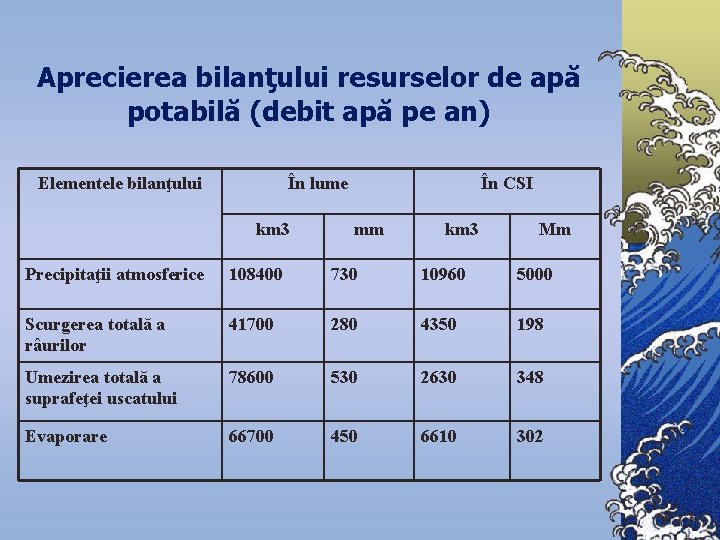
Aprecierea bilanţului resurselor de apă potabilă (debit apă pe an) Elementele bilanţului În lume km 3 În CSI mm km 3 Mm Precipitaţii atmosferice 108400 730 10960 5000 Scurgerea totală a râurilor 41700 280 4350 198 Umezirea totală a suprafeţei uscatului 78600 530 2630 348 Evaporare 66700 450 6610 302

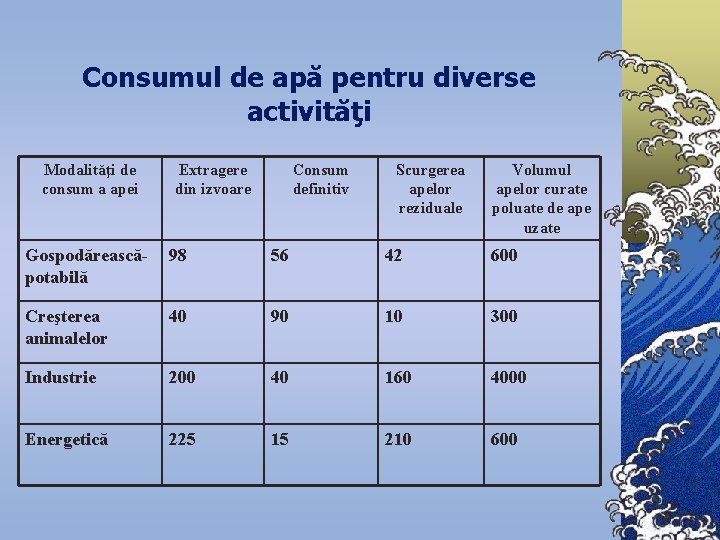
Consumul de apă pentru diverse activităţi Modalităţi de consum a apei Extragere din izvoare Consum definitiv Scurgerea apelor reziduale Volumul apelor curate poluate de ape uzate Gospodăreascăpotabilă 98 56 42 600 Creşterea animalelor 40 90 10 300 Industrie 200 40 160 4000 Energetică 225 15 210 600

Cheltuielile de apă pentru obţinerea diferitelor tipuri de produse Tipuri de produse Consum de apă (tone) la 1 t de produs Produse vegetale 1 Amoniac 1000 Oţel 270 Hârtie 400

Categorii de ape uzate Ape uzate menajere Ape uzate publice Ape uzate industriale Ape uzate de la unităţi agrozootehnice şi piscicole Ape uzate rezultate din satisfacerea necesităţilor tehnologice proprii de apă ale sistemelor de canalizare © Ape uzate de la spălatul şi stropitul străzilor şi incintelor de orice natură © Ape meteorice © © ©

Categorii de ape uzate Apele uzate industriale după caracterul de poluare se împart: 1. Ape uzate convenţional curate (nepoluate) necesită de a fi reutilizate în procesele tehnologice sau îndreptate în sisteme cu circuit închis de utilizare a apei 2. Ape uzate poluate necesită epurare în instalaţiile respective şi îndreptate, de regulă pentru utilizare repetată a apei 3. Evacuarea apelor epurate în reţelele de canalizare sau în receptorii de apă naturali necesită argumentare despre neputinţa utilizării lor la procesul de producţie

Categorii de ape uzate © Apele uzate din industria chimică, organică, şi de sinteză © Apele uzate de la fabricarea coloranţilor şi a produşilor de sinteză fină © Apele uzate de la fabricarea unor produşi petrochimici © Apele uzate de la fabricarea substanţelor explozive © Apele uzate de la industrializarea lemnului © Apele uzate din industria petrolului © Apele uzate din industria textilă © Apele uzate din industria prelucrării pielii © Apele uzate din industria alimentară © Apele uzate de la fabricarea produselor de fermentaţie © Apele uzate de la prelucrarea deşeurilor animale şi vegetale © Apele uzate din industria minieră © Apele uzate de la extracţia şi prepararea minereurilor © Apele uzate din industria metalurgică şi siderurgică © Apele uzate din industria materialelor de construcţii © Apele uzate de la centralele termoelectrice

Forme de poluare a apelor După felul acţiunii asupra bazinelor acvatice se pot distinge următoarele forme de poluare: 1. 2. 3. 4. 5. 6. 7. 8. Poluarea termică Poluarea cu săruri minerale Poluarea cu particule în suspensie Poluarea apei cu metale grele Poluarea apelor cu compuşi macromoleculari, în special lignină Poluarea apelor cu produse petroliere Poluarea apelor cu substanţe organice Poluarea apelor cu elemente biogene

Cerinţele ecochimice de epurare a apelor uzate Trebuie respectate următoarele condiţii: 1. La deversarea în bazin, apele uzate nu trebuie să încalce sistemul de autopurificare a mediului acvatic 2. Apa uzată nu trebuie să aibă toxicitate în raport cu vieţuitoarele mediului acvatic 3. Apele uzate nu trebuie să încalce procesele oxidoreducătoare, din interiorul bazinului, care determină starea redox a mediului acvatic natural

Diluarea apelor uzate cu apă curată © O metodă de bază pentru aprecierea calităţii apei este biotestarea ei prin observarea acţiunii acesteia asupra anumitor organisme-test © Pe baza datelor de biotestare, în scopul atingerii valorii biologice depline a apei în bazinele acvatice este necesară diluarea apelor reziduale cu apă curată după curăţirea lor biologică, în proporţia următoare: - apele reziduale casnice şi gospodăreşti care conţin detergenţi fără amestec de ape industriale - de 10 ori - apele reziduale industriale, care conţin substanţe specifice deosebit de toxice - de 25 ori - industria de celuloză şi hârtie - până la 100 sau, după o prelucrare specială, până la 50 ori - unele ape din industria de producere a cauciucului - până la 1000 ori

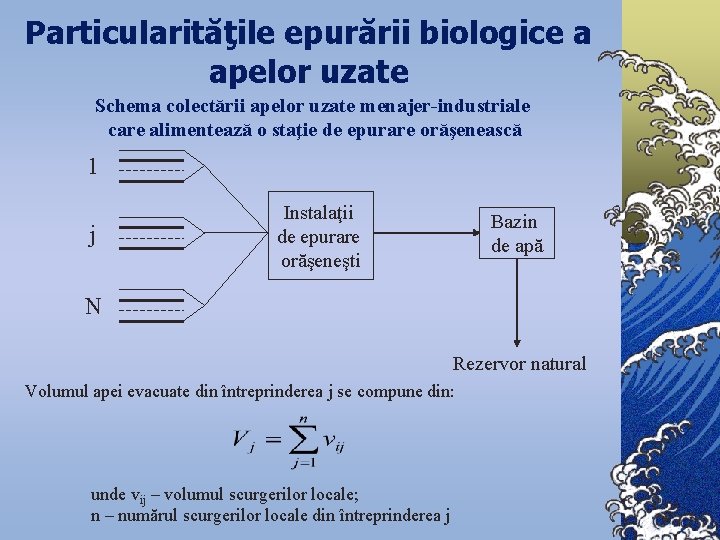
Particularităţile epurării biologice a apelor uzate Schema colectării apelor uzate menajer-industriale care alimentează o staţie de epurare orăşenească 1 j Instalaţii de epurare orăşeneşti Bazin de apă N Rezervor natural Volumul apei evacuate din întreprinderea j se compune din: unde vij – volumul scurgerilor locale; n – numărul scurgerilor locale din întreprinderea j

Diluarea apelor uzate © Însumând toate întreprinderile N, apa care ajunge în colectorul instalaţiei de epurare orăşeneşti (IEO) corespunde volumului: © Rezultă că, prin amestecarea cu alte ape, fiecare scurgere locală se diluează de Kij ori: © Dacă apa uzată vij are în ea substanţe toxice şi diluarea ei de Kij ori nu duce la detoxifiere, atunci se impune epurarea selectivă a apei din scurgerea locală ij

Metode biologice de epurare ©Metodele biologice de epurare a apelor uzate cu conţinut ridicat de substanţe organice, cu ajutorul microorganismelor: ©Aerobe ©Anaerobe ©Combinate

Procese aerobe de epurare © Aceste metode se aplică pentru mineralizarea substanţelor organice dizolvate în apele uzate © Cea mai simplă metodă biologică aerobă de epurare se derulează în condiţii naturale (bazinul acvatic sau sol) © În rezultatul oxidării substanţelor organice de către microorganisme: © Hidraţii de carbon CO 2 + H 2 O © Azotul din proteine: © R–CHNH 2–COOH NO 3 - + CO 2 + H 2 O © S SO 42© P PO 43 -

Lacurile biologice © Lacurile biologice sunt nu prea adânci, create artificial pentru epurarea biologică a apelor uzate pe seama proceselor de autopurificare © Condiţii favorabile pentru oxidarea substanţelor organice: © Adâncime mică © Încălzire şi insolaţie © Plante acvatice şi microalge (satură stratul de apă cu oxigen) © Animale inferioare (mănâncă bacteriile) © Neajunsurile lacurilor biologice: © Necesitatea existenţei de terenuri pentru organizarea lor © Costul ridicat © Posibilitate limitată de curăţire © Caracter sezonier de epurare efectivă

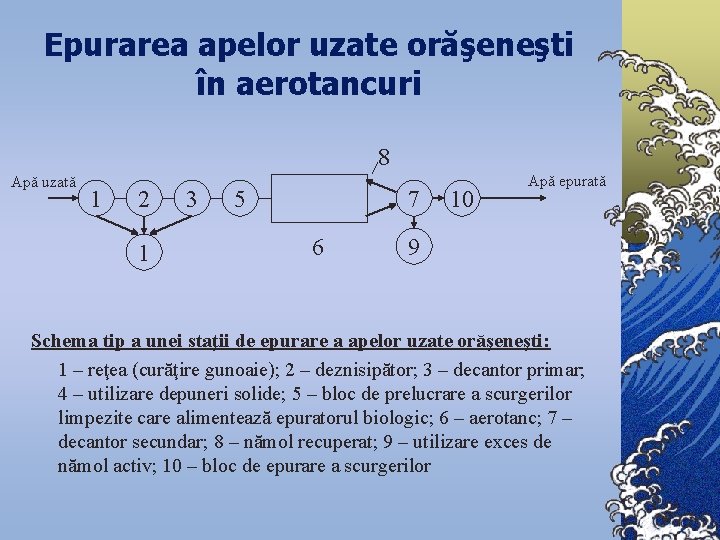
Epurarea apelor uzate orăşeneşti în aerotancuri 8 Apă uzată 1 2 1 3 5 7 6 10 Apă epurată 9 Schema tip a unei staţii de epurare a apelor uzate orăşeneşti: 1 – reţea (curăţire gunoaie); 2 – deznisipător; 3 – decantor primar; 4 – utilizare depuneri solide; 5 – bloc de prelucrare a scurgerilor limpezite care alimentează epuratorul biologic; 6 – aerotanc; 7 – decantor secundar; 8 – nămol recuperat; 9 – utilizare exces de nămol activ; 10 – bloc de epurare a scurgerilor

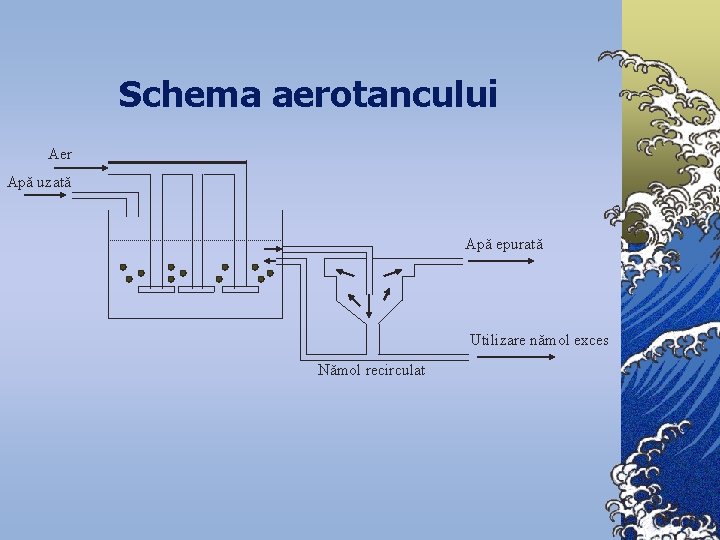
Schema aerotancului Aer Apă uzată Apă epurată Utilizare nămol exces Nămol recirculat

Detoxifierea anaerobă a nămolurilor © Etapele procesului anaerob: © Hidroliza compuşilor organici © Transformarea combinaţiilor organice complexe în acizi graşi, alcooli, aldehide © Fermentarea compuşilor organici simpli, cu formarea metanului, acidului carbonic, apei, hidrogenului, oxidului de carbon © Procesele anaerobe se desfăşoară în bazine de sedimentare obişnuite şi cu două nivele 1 1 – sediment putrezit; 2 – jgheab de decantare 2

Procese biologice cu participarea formelor minerale azotului © Transformarea compuşilor cu azot are loc ca rezultat al proceselor biologice: Nitrosomonas NH 4+ + 3/2 O 2 NO 2 - + 2 H+ + H 2 O Nitrobacter NO 2 - + ½ O 2 NO 3 © În condiţii anaerobe are loc reducerea microbiologică a nitraţilor în procesele de denitrificare. În prezenţa alcoolului metilic ca donor de hidrogen această reacţie poate fi scrisă sub forma: NO 3 - + CH 3 OH N 2 + CO 2 + H 2 O

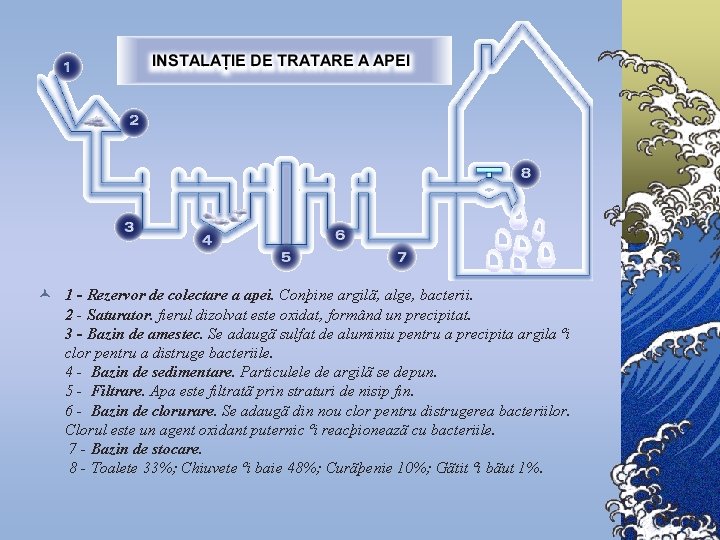
© 1 - Rezervor de colectare a apei. Conþine argilã, alge, bacterii. 2 - Saturator. fierul dizolvat este oxidat, formând un precipitat. 3 - Bazin de amestec. Se adaugã sulfat de aluminiu pentru a precipita argila ºi clor pentru a distruge bacteriile. 4 - Bazin de sedimentare. Particulele de argilã se depun. 5 - Filtrare. Apa este filtratã prin straturi de nisip fin. 6 - Bazin de clorurare. Se adaugã din nou clor pentru distrugerea bacteriilor. Clorul este un agent oxidant puternic ºi reacþioneazã cu bacteriile. 7 - Bazin de stocare. 8 - Toalete 33%; Chiuvete ºi baie 48%; Curãþenie 10%; Gãtit ºi bãut 1%.



