Lexcs de formalisme tuetil le formalisme Julien Lalande



























- Slides: 33

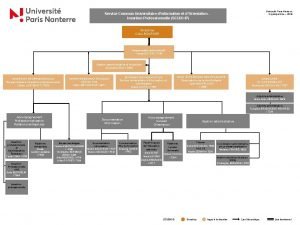
L’excès de formalisme tue-t-il le formalisme ? Julien Lalande, Lycée Chaptal, Paris Julien Lalande Lycée Chaptal – Paris

Quelquestions n Vocabulaire n n Symbolisme n n Précision, concision, exactitude (? ), cohérence Éviter l’ambiguïté Notations n n n Cohérence Précision / lourdeur Homogénéité… 2

Vocabulaire n n n Oxonium ou hydronium ? Nombre de moles ? Solution d’acide chlorhydrique, acide fort ? « K zéro » ? Réaction, équation, transformation ? … 3

L’ion hydrogène en solution aqueuse n Hydronium ou oxonium ? n n De quoi parle-t-on ? Sûrement pas hydronium… n ce serait au mieux l’ion H 2+ n n Oxonium ? C’est l’ion H 3 O+ n n n (Robert Panico, maître es nomenclature…) à comparer à ammonium, alkyloxonium, dialkyloxonium Isolé à l’état solide : perchlorate d’oxonium (encapsulé dans un éthercouronne) En solution aqueuse ? Mouais………… C’est l’ion H+(aq) : ion hydrogène ! Analogue à l’ion fer Fe 2+(aq), l’ion sodium… 4

Titrage acide fort – base forte n n n « solution d’acide chlorhydrique » … Pléonasme ! L’acide chlorhydrique est la solution aqueuse de chlorure d’hydrogène L’acide chlorhydrique est-il un acide fort ? 5

Grandeurs standard n n n Notations : K ° ; K 0 ; K , Les seules acceptables (IUPAC) : K ° ; K Prononciation : « K zéro » ? NON !!! n , K standard ! 6

Réaction / Transformation / équation ? n Bien définir les termes… n n n Partir de la transformation n n Niveau macroscopique Mais distinguo franco-français… Modélisée par une (ou plusieurs !) équations de réaction La « réaction chimique » : chemin particulier que suivrait le système en évoluant « selon l’équation » … voir plus loin 7

Transformation réversible / renversable n n Renversable : le retour à l’état initial est possible, mais par un chemin qui peut être différent du chemin direct Réversible : le retour à l’état initial est effectué par le même chemin, avec les mêmes échanges énergétiques. n n n Très contraignant ! Contexte de thermodynamique Toute transformation chimique est irréversible ! 8

Totale, non totale, « équilibrée » n n De quoi parle-t-on ? De la transformation, évidemment… (voir plus loin) n n n Ne pas parler de « réaction totale » Pas de corrélation générale avec les grandeurs standard (constante d’équilibre, par exemple) Bien définir les termes… 9

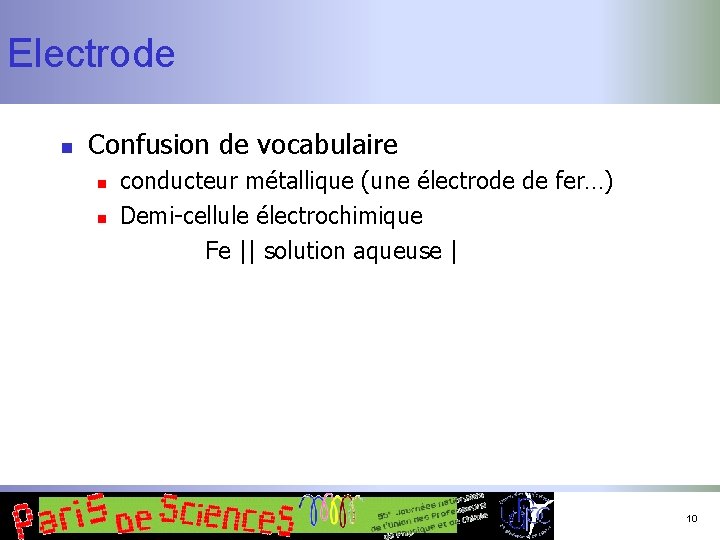
Electrode n Confusion de vocabulaire n n conducteur métallique (une électrode de fer…) Demi-cellule électrochimique Fe || solution aqueuse | 10

« Équilibrer une réaction » n Provocateur ! On dit : « ajuster les nombres stœchiométriques d’une équation de réaction » (to balance an equation) n Ne pas confondre… n n n Transformation Équation Réaction 11

Chimie organique n Nomenclature systématique à jour n n Éviter « tertiobutylate » … pour… tert-butanolate Noms triviaux : oui, nous ne sommes pas déconnectés de la vie courante… 12

Symbolisme n Flèches, doubles flèches, signe égal n Le signe égal (voir plus loin) : n n dans une équation de réaction, description modélisée à l’échelle macroscopique de la transformation chimique Les flèches : dans les mécanismes réactionnels (description à l’échelle moléculaire) des phénomènes chimiques « La réaction est totale » donc simple flèche ? « La réaction est équilibrée » donc double flèche ? 13

Comment faire… n n Recommandations (IUPAC, BO) Être clair… 14

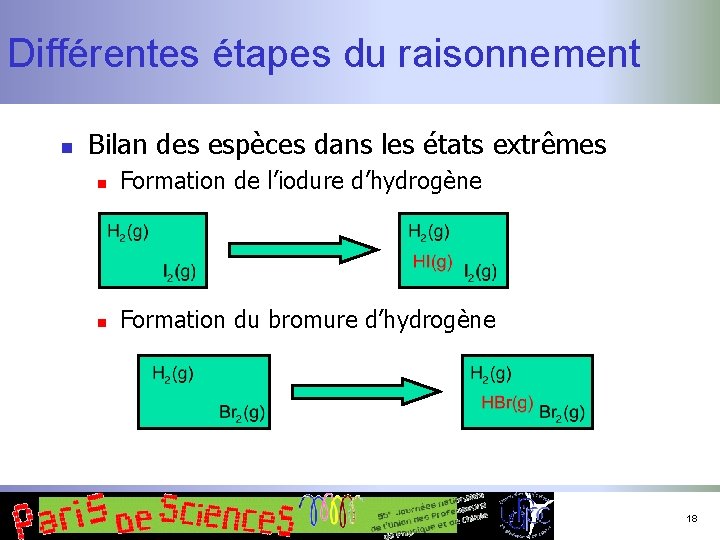
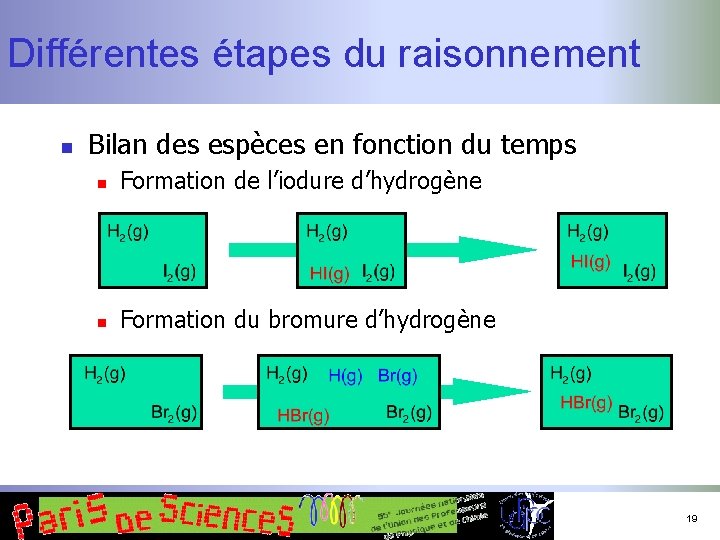
Différentes étapes du raisonnement n Caractériser la transformation n n Passage d’un état initial à un état final Recensement des espèces (modélisation !) n n n Dans les états extrêmes (thermodynamique) En cours de transformation (cinétique) Aspect essentiel : conservation de la matière (des atomes) ! 15

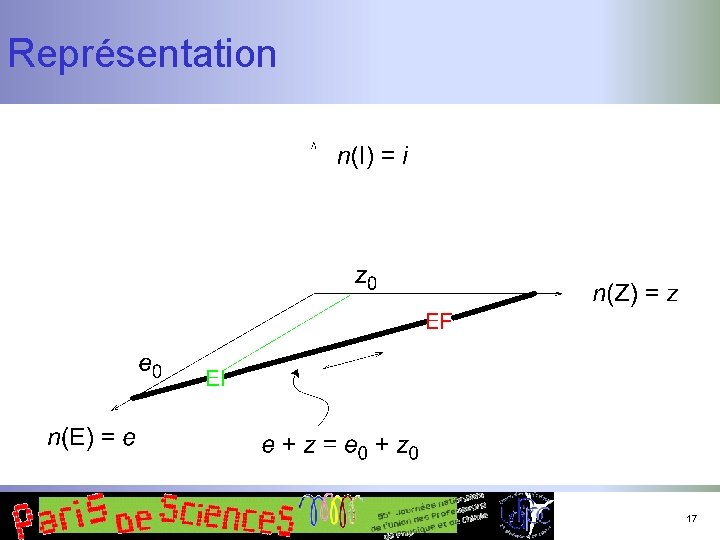
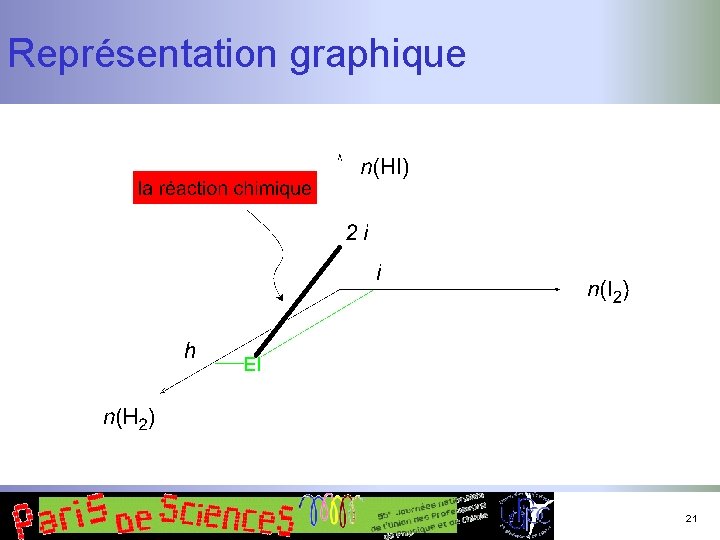
Un exemple simple n n Isomérisation de Z en E États extrêmes : n n n Z quantité z 0 Equantité e 0 Au cours du temps : n n n Z E quantité z quantité e et un intermédiaire réactionnel I quantité i 16

Représentation 17

Différentes étapes du raisonnement n Bilan des espèces dans les états extrêmes n Formation de l’iodure d’hydrogène n Formation du bromure d’hydrogène 18

Différentes étapes du raisonnement n Bilan des espèces en fonction du temps n Formation de l’iodure d’hydrogène n Formation du bromure d’hydrogène 19

Modélisation : équation de réaction n Iodure d’hydrogène n n n Conservation de la matière Ce sont deux équations de plans… donc celle d’une droite (variété linéaire affine de dimension 1… oui, c’est de l’algèbre linéaire !) Conclusion : toutes les quantités de matière s’expriment à l’aide d’une seule variable… l’avancement de l’équation de réaction ! 20

Représentation graphique 21

Nombre de variables indépendantes n n Cas de l’iodure d’hydrogène : c’est simple (une seule) donc pas besoin des outils complexes… Si l’on veut quand même : n n une espèce physicochimique = un vecteur… écrire la matrice des composantes dans la base des éléments chimiques (ou une autre base de groupes d’éléments) : matrice d’une application linéaire Chercher le rang de la matrice (taille du déterminant non nul le plus petit) : c’est le nombre d’équations indépendantes (de variables…) critère de JOUGUET L’équation : H 2 + I 2 = 2 HI 22

Plus complexe… n Pour le bromure d’hydrogène HBr n n Conservation de la matière : Il faut plusieurs variables indépendantes… plusieurs équations de réaction (au minimum, de quoi faire apparaître les espèces physicochimiques…) ! 23

Recherche des équations indépendantes n n Empirique… on procède par tâtonnement, souvent à partir des processus physiques élémentaires (actes élémentaires) Méthodique : outils de l’algèbre linéaire 24

Symbolisme… les flèches ! n Idées générales n n Le discours doit accompagner le schéma… (au moins quelques mots) On est en cinétique chimique… (on a quitté l’aspect macroscopique pour la vision moléculaire de la transformation chimique) En thermodynamique : le signe = s’accompagne d’un commentaire (la transformation est totale, ou peu avancée…) Rappel : caractère total de la transformation vs constante d’équilibre ! 25

Symbolisme… les flèches ! 26

Les recommandations n n n Simple flèche : processus élémentaire unidirectionnel (vitesse sens 2 nulle) Double flèche : processus élémentaire bidirectionnel (deux vitesses non nulles) Double harpon : processus élémentaire bidirectionnel avec équilibre chimique établi – deux vitesses non nulles mais égales 27

Notations n Exemples ambigus 28

Une solution : n N’écrire que des équations littérales 29

Une solution géniale : Guggenheim n N’écrire que des équations numériques ! 30

Et l’on retrouve « le nombre de moles » 31

Bibliographie succincte n Thermodynamique de la chimie L. Jullien, H. Lemarchand et al, Éd. Hermann n La réaction chimique M. Laffitte et F. Rouquérol, Éd. Masson n Modélisation macroscopique des transformations physicochimiques M. Soustelle, Éd. Masson n La réaction créatrice H. Lemarchand, Ch. Vidal, Éd. Hermann n La réaction chimique, moteur, description et symbolisme A. Gilles, BUP 817, Oct 1999, p 1503 ff 32

Y’a pas que la chimie dans la vie… Merci de votre attention ! 33
 Julien lalande chimie
Julien lalande chimie Formalisme ansi
Formalisme ansi Formalisme quantique
Formalisme quantique Ms. ria julien
Ms. ria julien Lidyl
Lidyl Slicer
Slicer Jullien de paris educacion comparada
Jullien de paris educacion comparada Julien seiler
Julien seiler Julien likert
Julien likert Julien boucharel
Julien boucharel Julien vassallo
Julien vassallo Julien thibieroz
Julien thibieroz Simon lacoste julien
Simon lacoste julien Julien mieral
Julien mieral Conqurir
Conqurir Nanterre universit
Nanterre universit Julien carter
Julien carter Julien mazieres pneumologue
Julien mazieres pneumologue à quoi sert une chanson si elle est désarmée
à quoi sert une chanson si elle est désarmée Dployer
Dployer Minizinc diffn
Minizinc diffn Julien aymeric simonnet
Julien aymeric simonnet Julien jomier
Julien jomier Julien hostettler jura
Julien hostettler jura Julien froustey
Julien froustey Julien conti
Julien conti Henri julien rousseau
Henri julien rousseau Julien herr
Julien herr Julien van geertsom
Julien van geertsom Ggi florence
Ggi florence Mariette julien
Mariette julien