TIPURI DE REACII CHIMICE LECIE PENTRU CLASA A






















- Slides: 29

TIPURI DE REACŢII CHIMICE LECŢIE PENTRU CLASA A VII A

CLASIFICAREA REACŢIILOR CHIMICE Reacţiile chimice pot fi clasificate după mai multe criterii, cum ar fi: - modul de desfăşurare - modul în care se realizează schimbul de căldură cu mediul - viteza de desfăşurare

CLASIFICAREA REACŢIILOR CHIMICE După modul de desfăşurare, reacţiile se împart în patru categorii: - reacţii de combinare - reacţii de descompunere - reacţii de înlocuire (substituţie) - reacţii de schimb (dublă înlocuire)

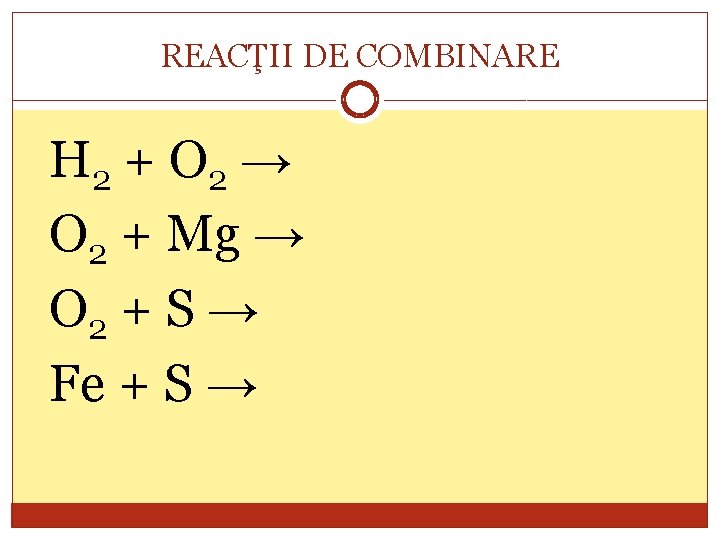
REACŢII DE COMBINARE Reacţia în care din doi sau mai mulţi reactanţi se obţine un singur produs de reacţie, se numeşte reacţie de combinare. A+B→C

CLASIFICAREA REACŢIILOR CHIMICE După modul în care se realizează schimbul de căldură cu mediul, reacţiile chimice pot fi: - reacţii exoterme - reacţii endoterme

CLASIFICAREA REACŢIILOR CHIMICE După viteza de desfăşurare, reacţiile chimice pot fi: - reacţii rapide - reacţii lente

REACŢII DE COMBINARE Cele mai întâlnite reacţii de combinare din chimia anorganică sunt: - Combinarea oxigenului cu alte elemente cu formare oxizi; - Combinarea oxizilor cu apa, cu formare de acizi sau baze; - Obţinerea unor săruri prin reacţii de combinare.

REACŢII DE COMBINARE H 2 + O 2 → O 2 + Mg → O 2 + S → Fe + S →

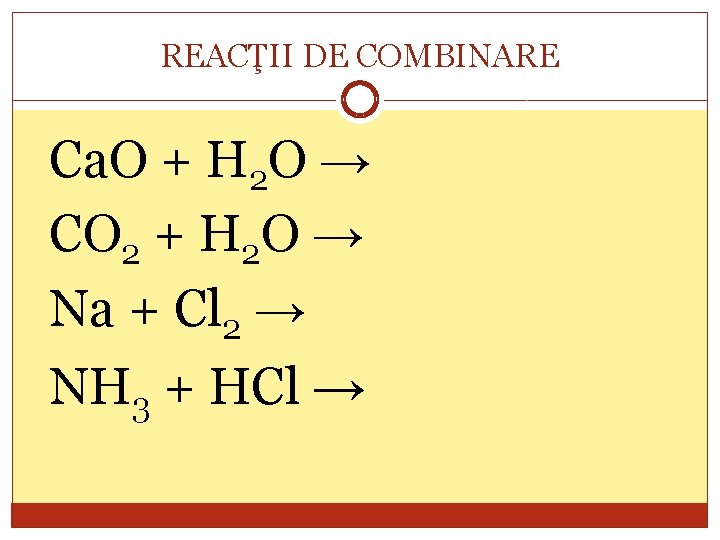
REACŢII DE COMBINARE Ca. O + H 2 O → CO 2 + H 2 O → Na + Cl 2 → NH 3 + HCl →

REACŢII DE COMBINARE A+B→C Reactanţii, A şi B pot fi substanţe simple sau compuse, iar produsul de reacţie, C este întotdeauna o substanţă compusă.

REACŢII DE DESCOMPUNERE Reacţia în care dintr-un singur reactant se obţin doi sau mai mulţi produşi de reacţie, se numeşte reacţie de descompunere. A→B+C

REACŢII DE DESCOMPUNERE Cele mai întâlnite reacţii de descompunere din chimia anorganică sunt: - Descompunerea hidroxizilor, cu formare de oxizi şi apă; - Descompunerea unor acizi; - Descompunerea termică a unor oxizi; - Descompunerea termică a unor săruri; - Alte descompuneri.

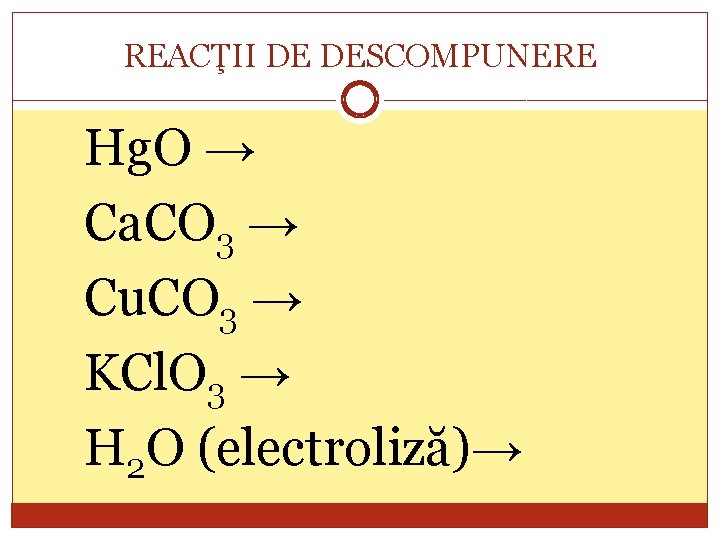
REACŢII DE DESCOMPUNERE Hg. O → Ca. CO 3 → Cu. CO 3 → KCl. O 3 → H 2 O (electroliză)→

REACŢII DE DESCOMPUNERE A→B+C Reactantul, A o substanţă compusă, iar produşii de reacţie, B şi C pot fi substanţe simple sau compuse.

REACŢII DE ÎNLOCUIRE Reacţia în care un element dintr-o substanţă simplă ia locul unui alt element dintr-o substanţă compusă este o reacţie de înlocuire. A + BC → AC + B Reactantul A şi produsul B sunt substanţe simple, iar reactantul BC şi produsul AC sunt substanţe compuse.

REACŢII DE ÎNLOCUIRE Cele mai întâlnite reacţii de înlocuire din chimia anorganică sunt: - Reacţia metalelor cu apa; - Reacţia metalelor cu acizii; - Reacţia metalelor cu compuşi ai altor metale mai puţin active (oxizi sau săruri).

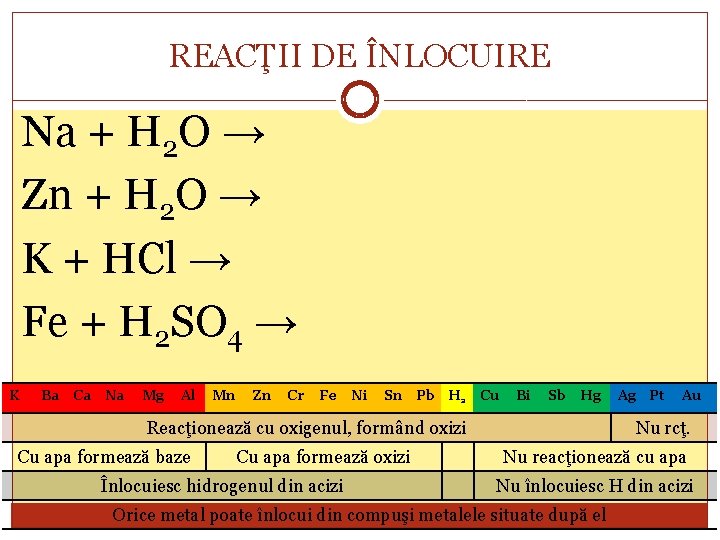
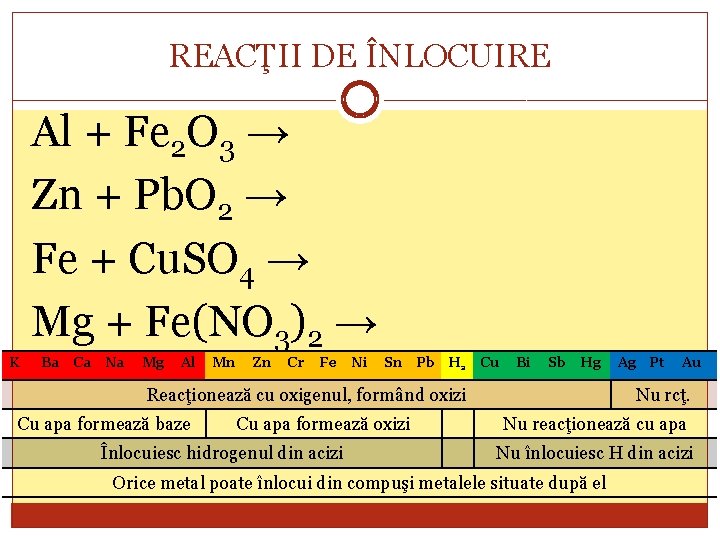
REACŢII DE ÎNLOCUIRE Toate reacţiile menţionate anterior sunt determinate de reactivitatea diferită a metalelor cu diverşi reactanţi. La aşezarea metalele în ordine descrescătoare a reactivităţii lor se obţine seria activităţii metalelor. K Ba Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H 2 Cu Bi Sb Hg Reacţionează cu oxigenul, formând oxizi Cu apa formează baze Cu apa formează oxizi Înlocuiesc hidrogenul din acizi Ag Pt Au Nu rcţ. Nu reacţionează cu apa Nu înlocuiesc H din acizi Orice metal poate înlocui din compuşi metalele situate după el

REACŢII DE ÎNLOCUIRE Na + H 2 O → Zn + H 2 O → K + HCl → Fe + H 2 SO 4 → K Ba Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H 2 Cu Bi Sb Hg Reacţionează cu oxigenul, formând oxizi Cu apa formează baze Cu apa formează oxizi Înlocuiesc hidrogenul din acizi Ag Pt Au Nu rcţ. Nu reacţionează cu apa Nu înlocuiesc H din acizi Orice metal poate înlocui din compuşi metalele situate după el

REACŢII DE ÎNLOCUIRE Al + Fe 2 O 3 → Zn + Pb. O 2 → Fe + Cu. SO 4 → Mg + Fe(NO 3)2 → K Ba Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H 2 Cu Bi Sb Hg Reacţionează cu oxigenul, formând oxizi Cu apa formează baze Cu apa formează oxizi Înlocuiesc hidrogenul din acizi Ag Pt Au Nu rcţ. Nu reacţionează cu apa Nu înlocuiesc H din acizi Orice metal poate înlocui din compuşi metalele situate după el

REACŢII DE SCHIMB Reacţia în care două substanţe compuse schimbă atomi sau grupe de atomi, se numeşte reacţie de schimb. AB + CD → AD + CB Toţi participanţii la reacţie sunt substanţe compuse.

REACŢII DE SCHIMB Cele mai întâlnite reacţii de schimb din chimia anorganică sunt: - Reacţia acizilor cu sărurile; - Reacţia bazelor cu sărurile; - Reacţia acizilor cu bazele (reacţia de neutralizare); - Reacţia oxizilor metalici cu acizii; - Reacţia oxizilor nemetalici cu bazele.

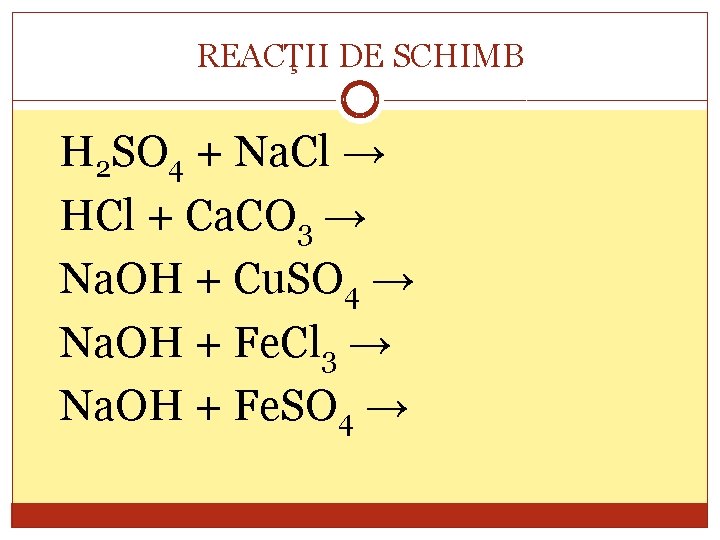
REACŢII DE SCHIMB H 2 SO 4 + Na. Cl → HCl + Ca. CO 3 → Na. OH + Cu. SO 4 → Na. OH + Fe. Cl 3 → Na. OH + Fe. SO 4 →

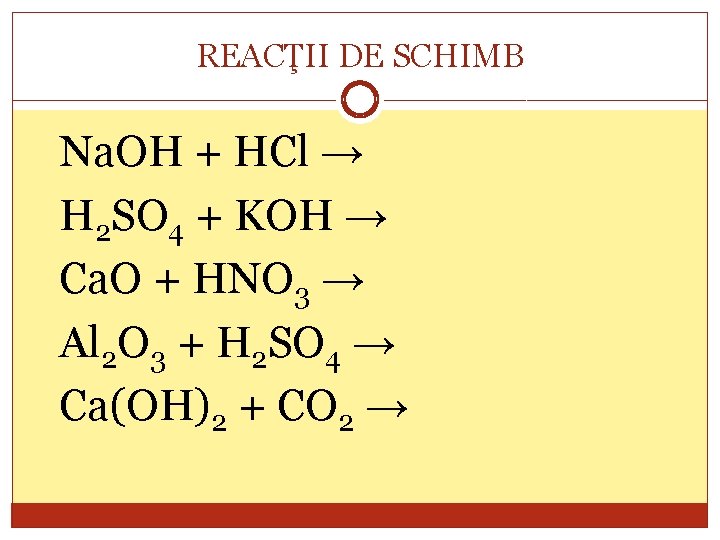
REACŢII DE SCHIMB Na. OH + HCl → H 2 SO 4 + KOH → Ca. O + HNO 3 → Al 2 O 3 + H 2 SO 4 → Ca(OH)2 + CO 2 →

REACŢII DE SCHIMB H 2 SO 4 + Ba. Cl 2 → HCl + Ag. NO 3 → KBr + Ag. NO 3 → KI + Ag. NO 3 →

REACŢII EXOTERME Reacțiile exoterme sunt reacții chimice care au loc cu degajare de căldură. Aluminotermia: 2 Al + Fe 2 O 3 → Al 2 O 3 + 2 Fe (topit) Stingerea varului: Ca. O + H 2 O→ Ca(OH)2

REACŢII EXOTERME Reacţiile de ardere: C + O 2 → CO 2 CH 4 + O 2 → CO 2 + H 2 O Reacţiile de neutralizare: Na. OH + HCl → Na. Cl + H 2 O H 2 SO 4 +2 KOH → K 2 SO 4 + 2 H 2 O

REACŢII ENDOTERME Reacțiile endoterme sunt reacții chimice care au loc cu absorbţie de căldură. Descompunerea oxizilor metalici: 2 Hg. O → 2 Hg + O 2 ↑ Descompunerea unor săruri: Ca. CO 3 → Ca. O + CO 2 ↑ Descompunerea unor hidroxizi: Cu(OH)2 → Cu. O + H 2 O ↑

REACŢII RAPIDE Reacţiile rapide sunt reacţii chimice care au loc practic instantaneu. � Explozii; � Reacţii de neutralizare; � Arderea panglicii de magneziu; � Colorarea indicatorilor acido-bazici.

REACŢII LENTE Reacţiile lente sunt reacţii chimice care au loc cu viteză mai mică. � Coroziunea metalelor; � Râncezirea grăsimilor; � Fermentaţia alcoolică; � Oţetirea vinului.
 Lecie cachorro
Lecie cachorro Clasificarea reactiilor chimice
Clasificarea reactiilor chimice Reactia chimica de combinare
Reactia chimica de combinare Arderea panglicii de magneziu
Arderea panglicii de magneziu Scrie aproximarea prin adaos a numărului
Scrie aproximarea prin adaos a numărului Definitia basmului clasa a 5 a
Definitia basmului clasa a 5 a Cromoproteinele
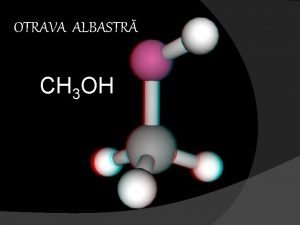
Cromoproteinele Metanol ardere
Metanol ardere Izopropilbenzen oxidare
Izopropilbenzen oxidare Baze
Baze Configuratia electronica a oxigenului
Configuratia electronica a oxigenului Combinatii chimice
Combinatii chimice Cuso4 denumire
Cuso4 denumire Efectul termic al reactiei chimice
Efectul termic al reactiei chimice Aditia hidracizilor la alcadiene
Aditia hidracizilor la alcadiene Formule chimice oxizi
Formule chimice oxizi Seria activitatii chimice a metalelor
Seria activitatii chimice a metalelor Florinviu
Florinviu Proprietatile chimice ale apei ppt
Proprietatile chimice ale apei ppt Omologii benzenului
Omologii benzenului Acizi grasi clasificare
Acizi grasi clasificare Energia cinetica se masoara in
Energia cinetica se masoara in Metoda lui newton
Metoda lui newton Tratament naturist meningiom
Tratament naturist meningiom Mersi pentru atentie
Mersi pentru atentie Omepta
Omepta Tema basmului praslea cel voinic si merele de aur
Tema basmului praslea cel voinic si merele de aur Modelul lui porter
Modelul lui porter Multumesc pentru atentie medicina
Multumesc pentru atentie medicina Autoritatea nationala pentru protectia consumatorului
Autoritatea nationala pentru protectia consumatorului