PATOLOGIE PRSU Z Kol Literatura l Rosen PP





























































- Slides: 109

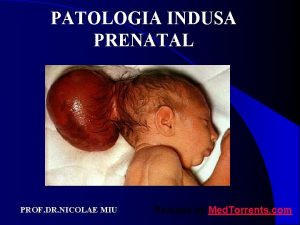
PATOLOGIE PRSU Z. Kolář

Literatura l Rosen PP: Breast Pathology. Lippincott-Raven Publishers, Philadelphia, New York 1996 l Rosen PP, Oberman HA: Tumors of the Mammary Gland. AFIP, Bethesda 1993 l Sokol LA: Biopsia mammy I a II. HIS-Dg, Košice 2000 l Abrahámová J, Povýšil C, Horák J a kol. : Atlas nádorů prsu. Grada/Avicenum, Praha 2000 l Sloane JP: Biopsy Pathology of the Breast. Arnold, London 2001 l Lester SC: Manual of Surgical Pathology. Churchill Livingstone, New York 2001

Obsah 1. Vývojové odchylky 2. Záněty 2. 1. Nespecifické 2. 2. Specifické 3. Fibrózní a fibroepiteliální nenádorové léze 4. Epiteliální nenádorové léze (cystická mastopatie, epitelióza, adenóza, hyperplasie, atypická hyperplasie) 5. Myoepiteliální a myofibroblastické léze 6. Papilární léze 7. Metaplasie 8. Benigní epiteliální nádory 9. Maligní epiteliální nádory 10. Smíšené nádory 11. Mesenchymální nádory 12. Pseudonádory 13. Patologie mužského prsu 14. Vyšetřovací metody v patologii prsu 15. Prognostické a prediktivní znaky včetně genetických 16. Specifické diagnostické znaky nádorů mammy 17. Morfologické přístupy pro stanovení prognózy nádorů mammy a predikci reakce na léčbu 18. Změny nádorů mammy po léčbě


Vývojové a získané odchylky Amastia (chybění jednoho nebo obou prsů včetně bradavky – u mužů i žen), aplasia, hypoplasia (kongenitální nebo získaná např. po ozáření), macromastia (jednostranná i oboustranná), macromastia adolescentní – příčina: pseudoangiomatózní stromální hyperplasie, nemá ER ale má PR, m. gravidární, m. penicillaminem indukovaná (při léčbě revmatoidní artritidy), ektopický prs (akcesorní mléčná žláza), kdekoliv v průběhu mléčné lišty.

Záněty nespecifické v Reaktivní změny v Puerperální mastitis: 2. -3. týden laktace, Staphylococus aureus, velká v v v bolestivost, obvykle vznikají abscesy, pokud není léčen přechází do chronického stadia, tvorba píštělí. Plasmocytární mastitis: Varianta periduktální mastitidy spojená s hyperplasií duktální výstelky a většinou difusní infiltrací plasmocyty. Granulomatózní lobulární mastitis: Neznámá etiologie, různá nespecifická bakteriální flóra, asi buňkami zprostředkovaná imunitní reakce, granulomatózní zánětlivá reakce (lymfocyty, plasmocyty, eosinofily) kolem lobulů, nález epiteloidních bb. a Langhansoidních elementů. Granulomatózní periduktální mastitis: Zánětlivé změny různého charakteru kolem duktů. Sarkoidóza: Obvykle systémová. Silikonová mastitis: Granulomatózní léze obdobná reakci kolem cizích těles (obdobně polyuretanová mastitis). Mastitis vyvolaná plísněmi a parazity (aktinomycosis, histoplasmosis, blastomykosis, cryptococosis, aspergilosis, coccidiosis, filariasis).

Záněty specifické v Tuberkulóza (klasický obraz) v Syfilis (klasický obraz, možnost primární lokalizace tvrdého vředu)

Fibrózní a fibroepiteliální nenádorové léze v Fibrózní a fibrocystická mastopatie (fibrocystická nemoc), někdy splývá s dříve používaným termínem mammární dysplasie, chronickou mastitidou, fibroadenózou apod. Základním obrazem je rozsáhlá fibróza, která může vznikat z nejrůznějších příčin, ta může být doprovázena přítomností cyst nebo hyperplasií duktálního nebo lobulárního epitelu. Ke zvýšení rizika pro vznik maligního nádoru dochází jen tehdy, lze-li hyperplasii klasifikovat jako atypickou. v Radiální jizva/komplexní sklerotizující léze: benigní, často mnohočetná léze makroskopicky napodobující karcinom hvězdicového tvaru s fibroelastickou centrální částí, ke které se radiálně sbíhají skupiny vývodů a lobulů. Ve vývodech může být výstelka hyperplastická, atypicky hyperplastická až DCIS nebo LCIS. Léčba není nutná, pokud není zjištěn CIS.



Epiteliální nenádorové léze v v Zřídka bez současné fibrózy. Cysta (solidní i mnohočetná): Dilatované vývody jejichž výstelka může být metaplastická, v okolí mohou být zánětlivé změny. Epitelióza (dříve mazoplasie): intraduktální hyperplasie, často mikropapilární nebo papilární. Někdy jsou popisovány 3 stupně této hyperplasie. (a) lehká – 3 až 4 vrstvy epitelu, (b) střední – 5 a více vrstev, (c) těžká, tzv. floridní, lumen je obliterováno solidními nebo fenestrovanými ložisky epitelu. Častá apokrinní metaplasie, vždy přítomnost myoepiteliální vrstvy buněk, někdy buněčné atypie. Adenóza: lobulární hyperplasie charakterizovaná zmnožením lobulů s hyperplasií jak luminální, tak i myoepiteliální vrstvy buněk a často i stromální složky. K prosté adenóze dochází např. z hormonálních příčin v časné graviditě. Floridní adenóza: uzlovité formace hyperplastických lobulů s hypercelulárním stromatem, často zjistitelné pohmatem. Je-li vazivová komponenta výrazná, připomínající fibroadenom, označuje se někdy jako fibroadenomatóza.

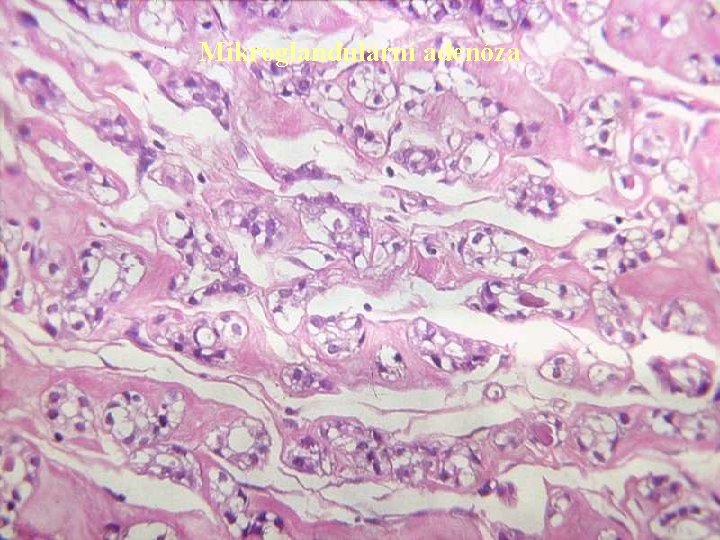
Epiteliální nenádorové léze v Sklerozující adenóza: léze se zachovalou lobulární úpravou ohraničená výrazným vazivovým lemem spolu se zmnožením intralobulárního vaziva. Bazální membrány duktulů jsou nápadně ztluštělé. V dif. dg. je významné chybění jakýchkoliv buněčných atypií a existence myoepiteliální vrstvy. V ložiscích SA se však mohou vyskytovat LCIS i DCIS. v Mikroglandulární adenóza: četné drobné mikrotubuly nepravidelně rozptýlené ve vazivu, takže vzniká dojem infiltrativního růstu. Chybí však atypie. Diagnostickým problémem je fakt, že zpravidla chybí myoepitelie, avšak bazální membrána je většinou patrná. Byly ovšem popsány případy, kdy se v souvislosti s touto lézí vyvinul karcinom. v Duktální adenóza: léze vzniká z distálních oblastí vývodového systému. Je charakterizována nahromaděním vývodů, které však nezačínají v lobulech. Formace vývodů mohou imitovat tubulární karcinom. V časných fázích vývoje mají zřetelné dvě vrstvy epitelu, později se epitel oplošťuje a myoepiteliální vrstva může téměř vymizet.

Epiteliální nenádorové léze v Hyperplasie prostá: Všechny výše uvedené jednotky jsou v podstatě hyperplasií duktálního nebo lobulárního epitelu doprovázeného někdy hyperplasií pojiva. Pokud nejsou nalezeny cytologické a zejména nukleární změny ve smyslu abnormity či atypie, nepředstavují riziko pro vznik karcinomu. v Atypická hyperplasie: Je vždy spojena se zvýšením rizika pro vznik karcinomu, které bývá odhadováno podle různých pramenů jako 2× až 10× vyšší. Pokud se v ložisku kombinují změny typu AH s CIS, je možné dg. AH stanovit tehdy, nejsou-li změny CIS přítomny v ložisku větším než 2 mm.

Myoepiteliální a myofibroblastické léze v Adenomyoepiteliální hyperplasie: zmnožení myoepiteliálních buněk kolem lobulárních acinů. v Adenomyoepiteliom: ohraničený uzel, ve kterém kromě známek hyperplasie myoepitelií mohou být nalezeny známky papilární intraduktální proliferace a lobulární hyperplasie. Základní strukturou jsou malé, kulaté nebo oválné žlázky tvořené kubickými buňkami, obkroužené polygonálními nebo vřetenitými myopepiteliemi s jasnou cytoplasmou a zřetelou bazální membránou. Někdy přítomnost buněčných atypií. Benigní. v Myoepiteliom: velmi vzácný tumor z myoepiteliálních bb. , které podléhají myoidní transformaci (hladkosvalový aktin+, ER+), někdy storiformní uspořádání vřetenitých buněk, jindy bb. se světlou cytoplasmou. Zřídka mohou bb. růst invazivně. v Myofibroblastom: Aktin+, CK-. v Myoepiteliální karcinom: invazivní růst, metastázy.

Papilární léze ¬ Intraduktální papilom ¬ Kolagenózní sferulóza ¬ Subareolární papilární sklerozující hyperplasie ¬ Cystická a papilární apokrinní metaplasie ¬ Juvenilní papilomatóza ¬ Floridní papilomatóza bradavky ¬ Dif. dg. k papilokarcinomu ¬ Invazivní mikropapilární karcinom

v Metaplasie Dlaždicobuněčná, apokrinní (GCDFP-15+), mesenchymoidní. v Benigní epiteliální nádory Papilomy, adenomy.

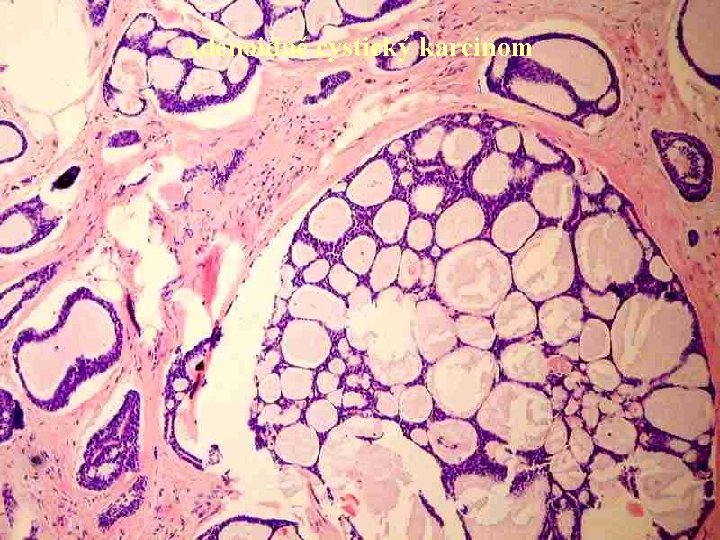
Maligní epiteliální nádory Neinvazivní: DCIS, LCIS, nesplňují základní kritérium malignity – invazivní růst, sem řazeny jen formálně, důležitý grading Invazivní: IDC – varianty – mikroinvazivní (ložisko do 1 mm), s minimální invazí (do 1 cm) , s invazí (větší než 1 cm), grading např. dle Page (mitózy, morfologie jader, přítomnost tubulárních struktur), prognostické znaky. ILC – varianty – klasická, solidní, solidně alveolární, tubulolobulární, z prstencových buněk, pleiomorfní včetně tzv. histiocytoidní. Tubulární ca, papilární ca, medulární ca (atypický medulární), ca s metaplasií (mucinózní, epidermoidní, apokrinní, s endokrinní diferenciací, osteoklastům podobný), malobuněčný, cystický hypersekreční, adenoidně cystický (kromě kribriformního růstu obsahuje cylindromatózní složku složenou z materiálu obdobného bazální membráně), kribriformní (jen cylindromatózní struktury), bohatý na tuky, bohatý na glykogen, invazivní mikropapilární, Pagetova choroba.

Některé nověji popsané jednotky v Karcinom z acinárních buněk: drobné aciny, granulární uspořádání cytoplasmy, EMA+, GCDFP-15+ v 50 % případů, laminin- (tím se liší od mikroglandulární adenózy, která je laminin+ a buňky nemají granulární charakter). v Onkocytární karcinom: tzv. maligní onkocytom, buňky s eosinofilně se barvící cytoplasmou, která nemá granulární charakter, GCPFP-15, aktin často +, mitochondrie četné (detekce pomocí ELMI nebo antimitochondriálních protilátek), velmi časté nekrózy. Má podobné vlastnosti jako onkocytom štítné žlázy nebo adenomyoepiteliom slinných žlaz. Je rovněž podobný apokrinnímu karcinomu (GCDFP 15+, mitochondrie+-, chromogranin-, CD-68 -, granularita buněčné cytoplasmy).

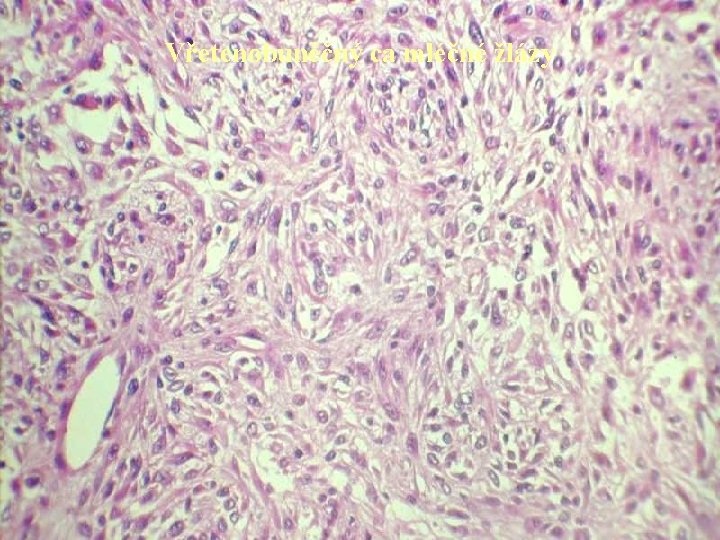
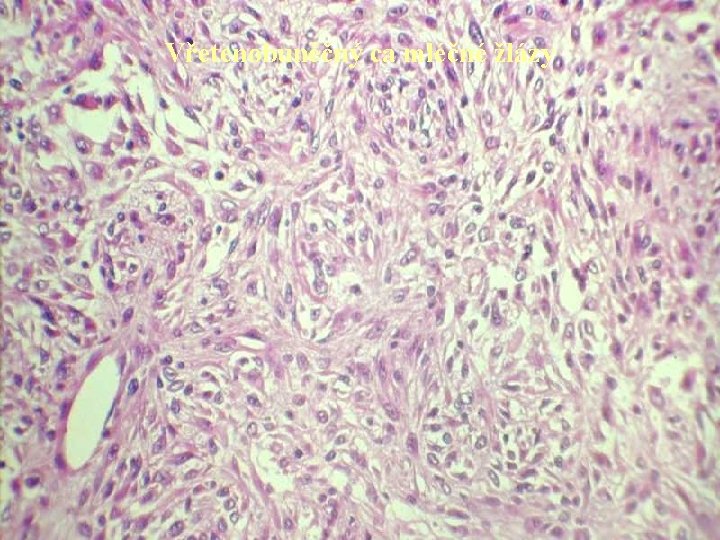
Vřetenobuněčný ca mléčné žlázy

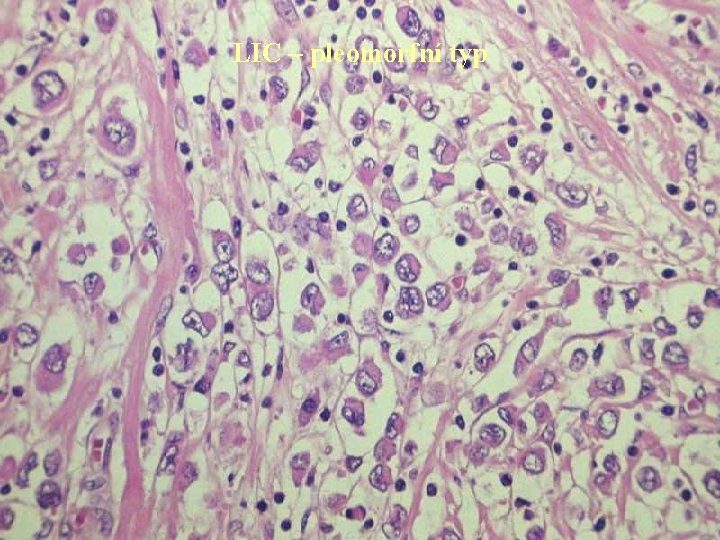
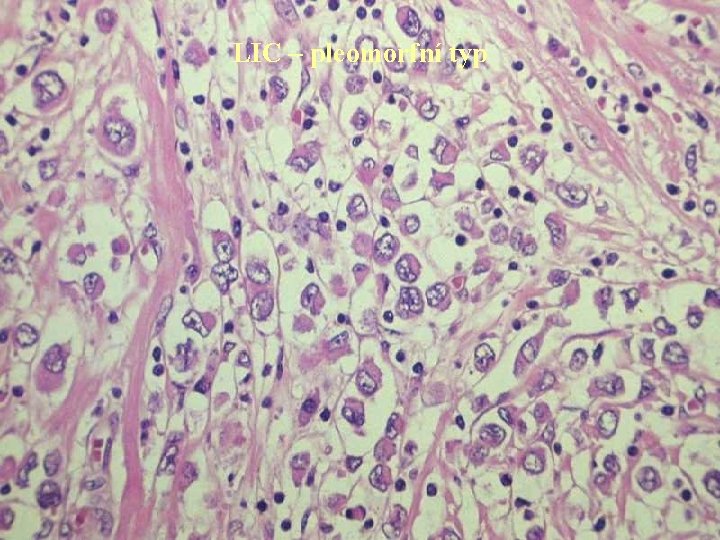
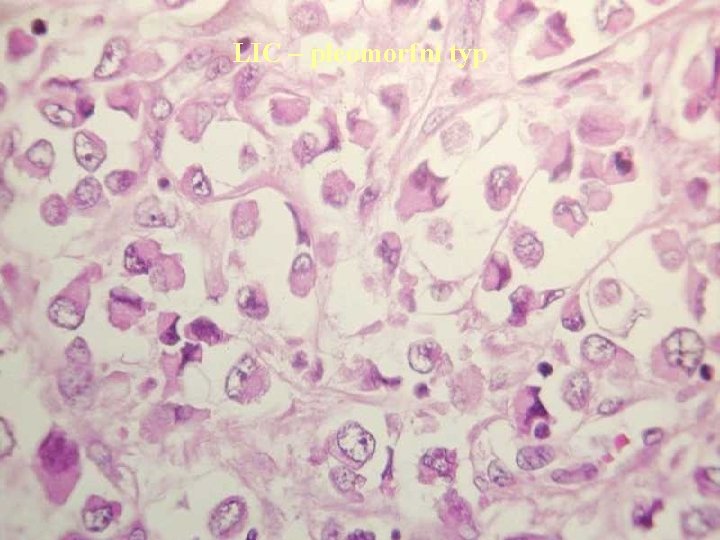
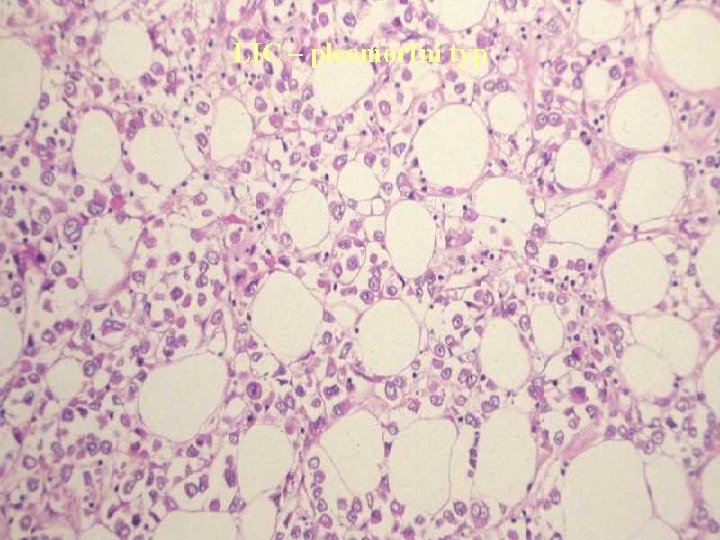
LIC – pleomorfní typ

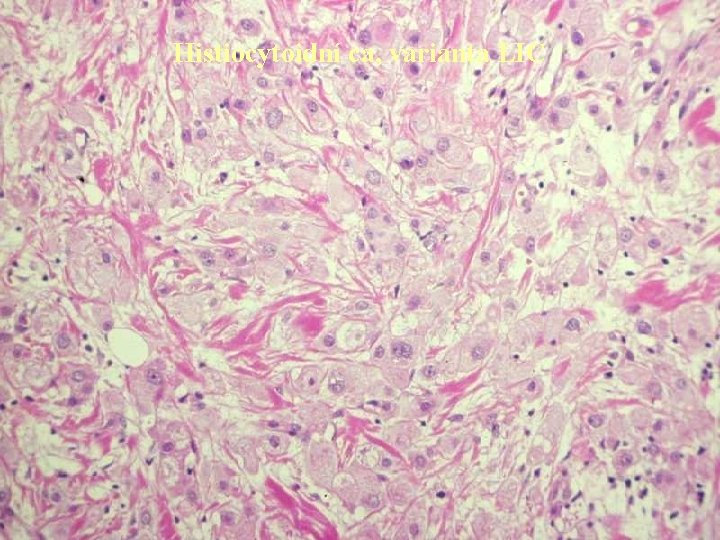
Histiocytoidní ca, varianta LIC

Vyšetřovací metody v patologii prsu Aspekce, palpace, zobrazovací metody, aspirační cytologie tenkou jehlou, punkční biopsie silnou jehlou (tru cut), vzorek získaný excisí, extirpát tumoru, kvandrantektomie, ablace celého prsu, sentinelová uzlina, axilární uzliny, fascie pektorálního svalu, pomocné metody (vyšetření onkomarkerů v séru, prognostické a prediktivní znaky).

Multistep model of the genetic alterations leading to breast cancer Dr. Van de Vijver, Amsterdam normální epitel hyperplasie atypická hyperplasie DCIS, LCIS DCIS (dobře) DCIS (stř. ) DCIS (málo) IDC, ILC „low grade” ILC IDC (G 1) IDC (G 2) IDC (G 3) pleomorf. ILC IDC, ILC „high grade” Za změny jsou odpovědné mutace a translokace genů odpovědných za regulaci proliferace a invazivního růstu. Jde především o změny způsobující overexpresi nebo amplifikaci protoonkogenů a inaktivaci supresorových genů.

DCIS ¬ v minulosti diagnostikován jen velmi zřídka ¬ není jednotnou patologickou jednotkou ¬ jde o heterogenní lézi, pro kterou je třeba hledat i nová diagnostická kritéria ¬ biologické chování různých typů DCIS je rozdílné


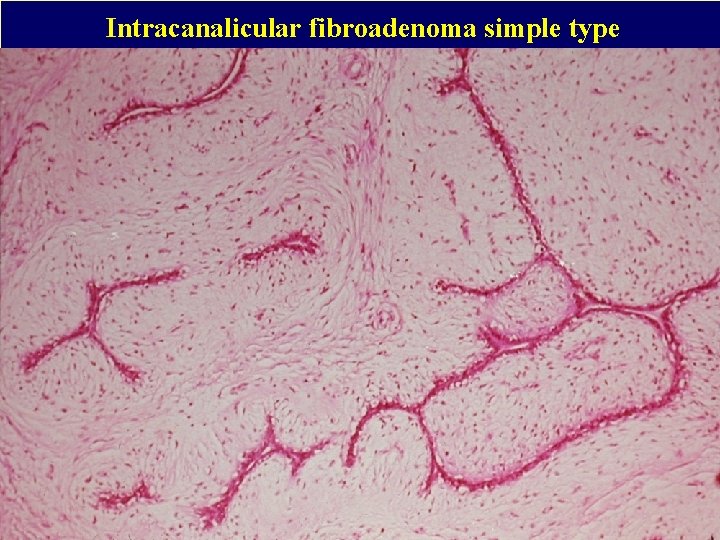
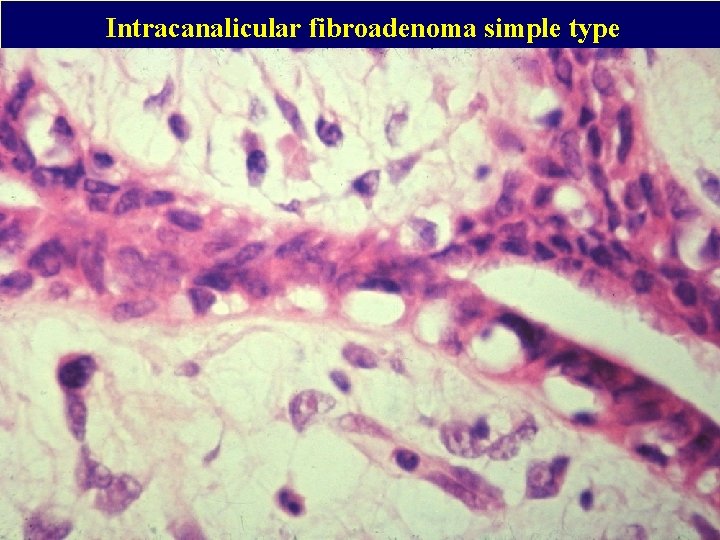
Smíšené nádory Fibroadenom: Benigní, ohraničený, většinou u mladých žen, nejčastější mammární nádor této skupiny. Poměrně vzácně se vyskytuje multifokálně a bilaterálně. Dva typy – perikanalikulární a intrakanalikulární, neexistuje mezi nimi prognostický rozdíl. Epiteliální struktury někdy projevují sekreční změny podobně jako v graviditě nebo laktaci. Během první poloviny gravidity se sekreční změny zpravidla zvýrazňují. Může to vést k rychlému růstu tumoru a podezření na karcinom. V nádoru se mohou formovat cysty, ložiska apokrinní metaplasie, kalcifikace, sklerozující adenózy, atypické hyperplasie i karcinomu (zvýšení rizika 2 -4 x). Fibroadenomům s těmito nálezy se říká komplexní fibroadenomy. Stromální složka nádoru může být více buněčná – tzv. celulární fibroadenom (možná záměna s fyloidním nádorem), stroma může podléhat hyalinizaci, myxoidní přeměně a pseudoangiomatózní hyperplasii, vyjímečně nekrotizaci. Někdy se popisuje výskyt mnohojaderných obrovských buněk, které mohou být velmi početné (jde však o zcela benigní léze), nebo výskyt SMA+ myoidních buněk. Termín juvenilní fibroadenom se někdy používá pro celulární a rychle rostoucí nádor, převážně u mladých žen.

Intracanalicular fibroadenoma simple type

Intracanalicular fibroadenoma simple type

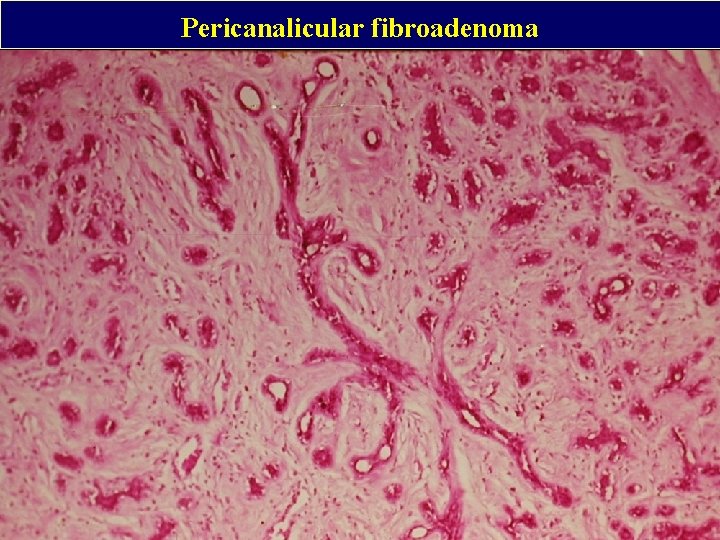
Pericanalicular fibroadenoma

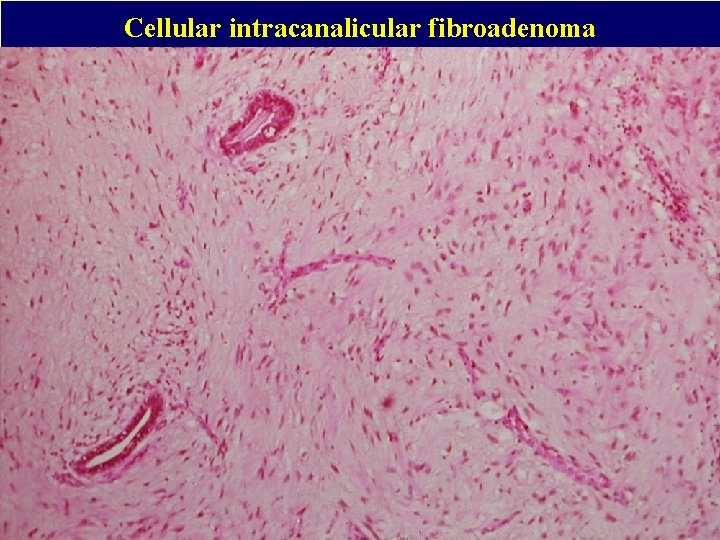
Cellular intracanalicular fibroadenoma

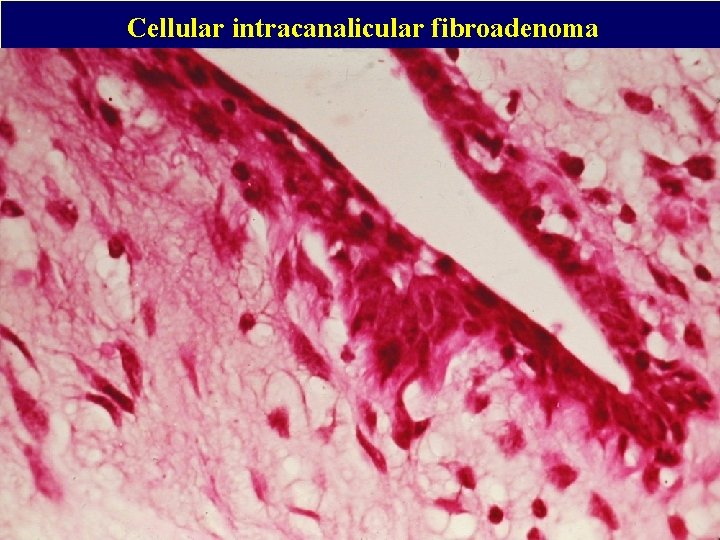
Cellular intracanalicular fibroadenoma

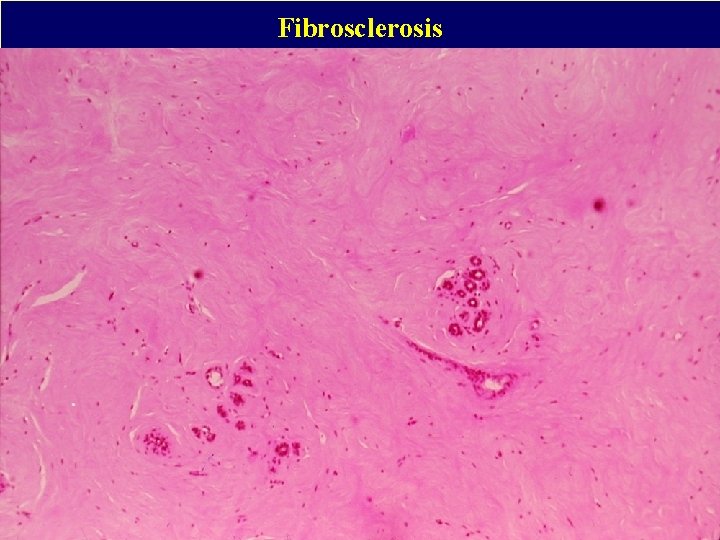
Fibrosclerosis

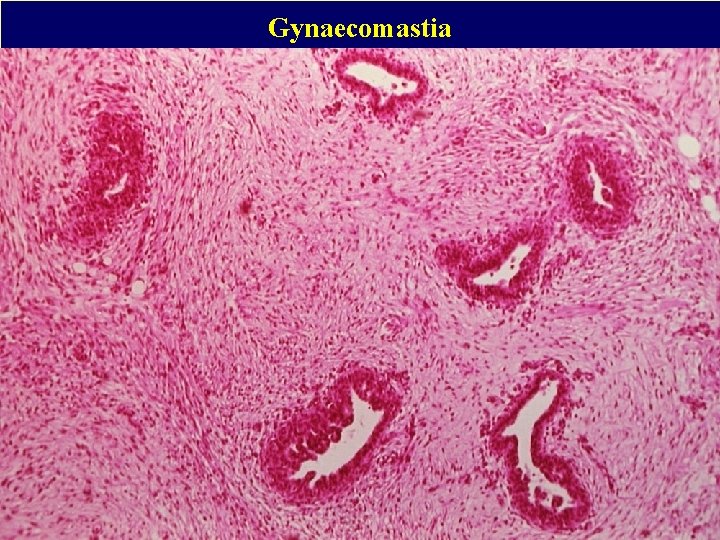
Gynaecomastia

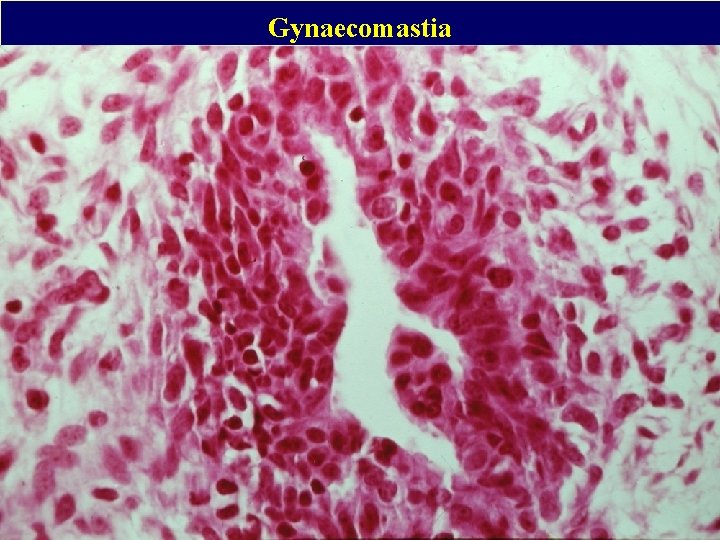
Gynaecomastia

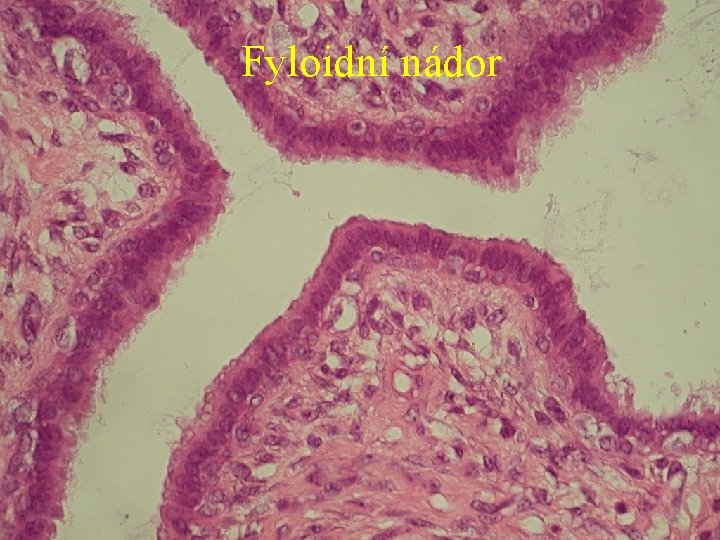
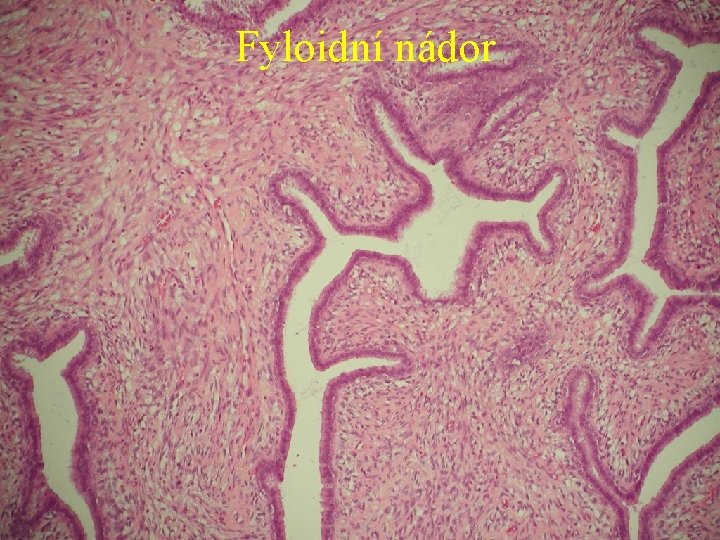
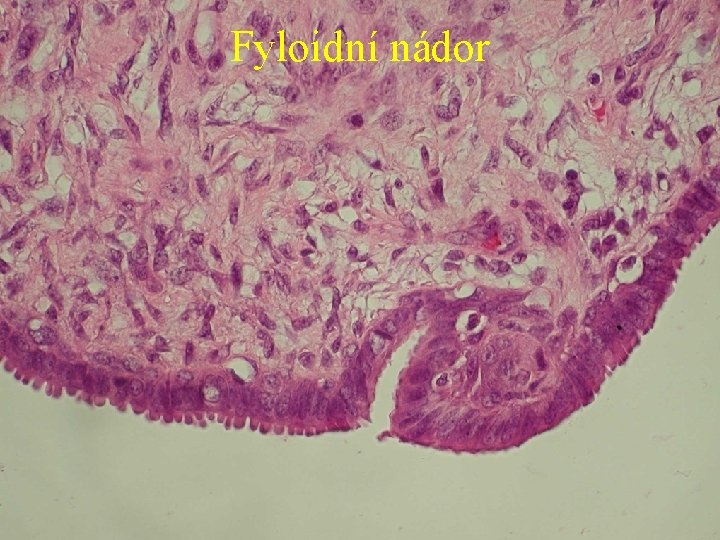
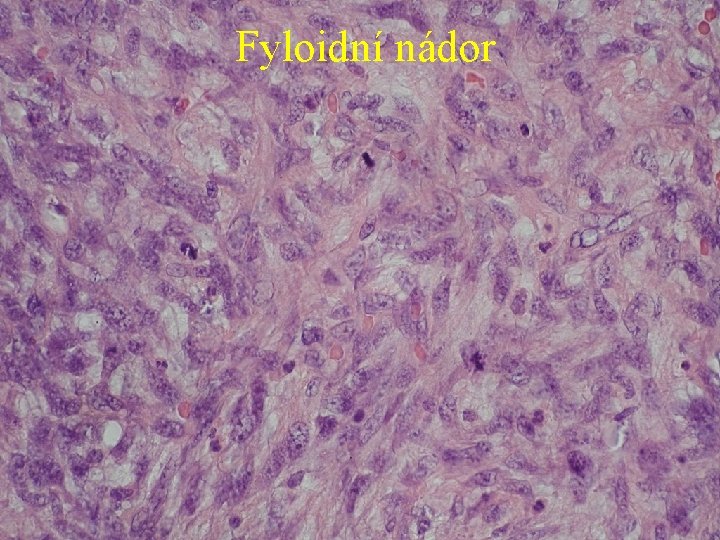
Smíšené nádory Fyloidní nádor: Může mít stejnou architekturu jako fibroadenom (zpravidla intrakanalikulární), avšak má potenciál pro lokální recidivu a metastazování. Nejdůležitějším znakem pro odlišení od fibroadenomu je vysoce celulární stroma, které může mít, ale častěji nemá, cytologické atypie. Dále se ve stromatu mohou nacházet hemoragie a nekrózy, někdy rozsáhlejší ložiska hlenu a myxoidní přestavby. Výjímečně zde probíhá diferenciace směrem k hladké svalovině, chrupavce, kosti, tukové tkáni, fibrohistiocytárním elementům. Epitelová složka je normálního vzhledu, podobně jako v normálním prsu. Okraje nádoru mohou být neohraničené a buňky mohou invadovat okolí. Zpravidla dosahuje větších rozměrů než fibroadenom. Bylo potvrzeno, že malá velikost tumoru (do 4 cm) a nízký mitotický index (méně než 3 mitózy v 10 HPF) byly indikátory dobré prognózy a nízké rekurence. Vyskytuje se v každém věku (medián 45 let). Za efektivní léčbu se považuje kompletní excise ve vzdálenosti minimálně 1 cm od okraje.

Fyloidní nádor

Fyloidní nádor

Fyloidní nádor

Fyloidní nádor

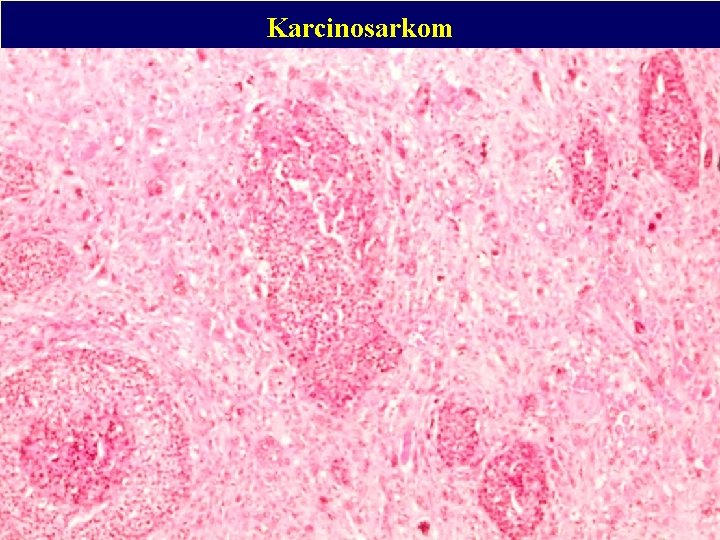
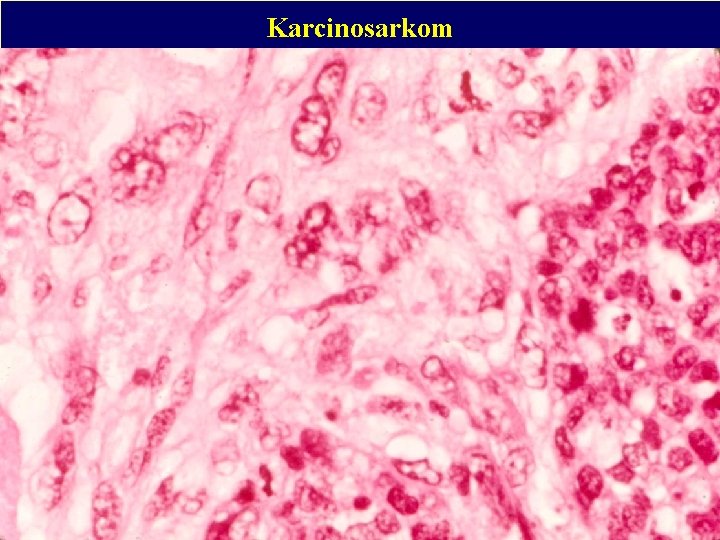
Smíšené nádory Karcinosarkom: Vývoj karcinomu v epitelových strukturách fyloidního nádoru. Důležitá je diferenciální dg. smíšených nádorů vůči: Myoepiteliálním a myofibroblastickým lézím

Karcinosarkom

Karcinosarkom

Smíšené nádory – dif. dg. Adenomyoepiteliom: Ohraničený uzel, hyperplasie myoepitelií, papilární intraduktální proliferace, lobulární hyperplasie. Základní strukturou jsou malé, kulaté nebo oválné žlázky obkroužené polygonálními nebo vřetenitými myoepiteliemi se světlou cytoplasmou. Bazální membrána zřetelná. Benigní Myoepiteliom: Velmi vzácný tumor z myoepiteliálních bb. , které podléhají myoidní transformaci (hladkosvalový aktin+, ER+), někdy storiformní uspořádání vřetenitých buněk, jindy bb. se světlou cytoplasmou. Zřídka mohou bb. růst invazivně. Myofibroblastom: Aktin+, CK-, ER+, PR+, AR+ Myoepiteliální karcinom: Invazivní růst, metastázy.

Klasifikace myoepiteliálních lézí Tavassoli, F. T. , Am. J. Surg. Pathol. 15: 554 -568, 1991 V mléčné žláze se může vyskytovat 5 typů lézí, které jsou odvozeny nebo převážně složeny z myoepiteliálních buněk: l adenoidně cystický karcinom l pleomorfní adenom l multifokální myoepitelióza l adenomyoepiteliom l myoepiteliální karcinom Imunohistochemických markerem myoepiteliálního původu buněk je hladko-svalový aktin (S-100) Jiné typy lézí se mohou vyvíjet z myofibroblastů - myofibroblastom (desmin+, aktin+, ER+, PR+, AR+, u epiteolidní varianty i CK+). J

Klasifikace myoepiteliálních lézí – pokračování I. Myoepitelióza (multifokální a periferně lokalizovaná) A) Intraduktální typ B) Periduktální typ (spojen se SA, považován za variantu SA) II. Adenomyoepiteliom A) Vřetenobuněčný typ B) Tubulární typ (jasné nebo eosinofilní buňky bb. ) III. Myoepiteliální karcinom (vřetenobuněčný, z jasných bb. , invazivní)

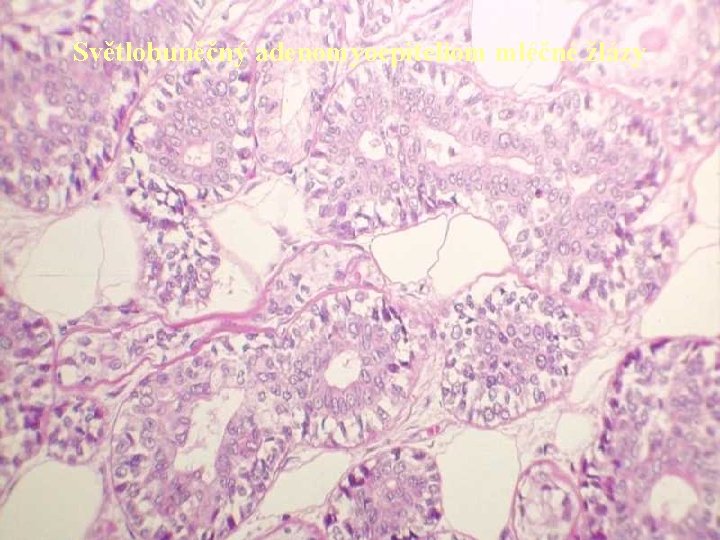
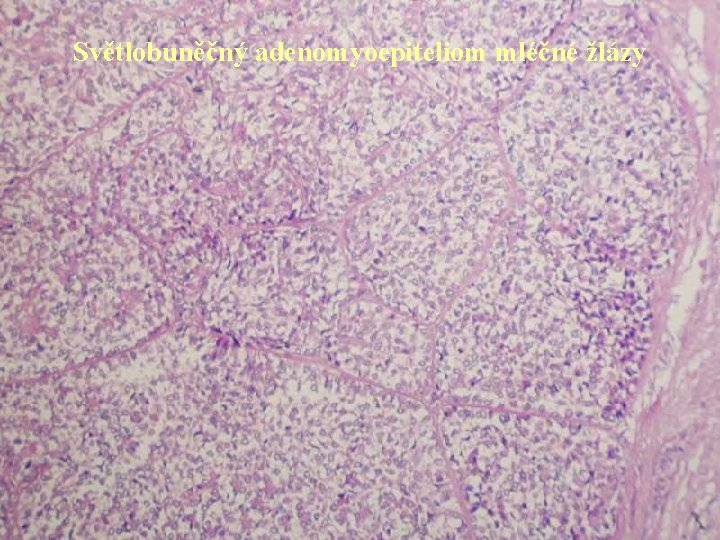
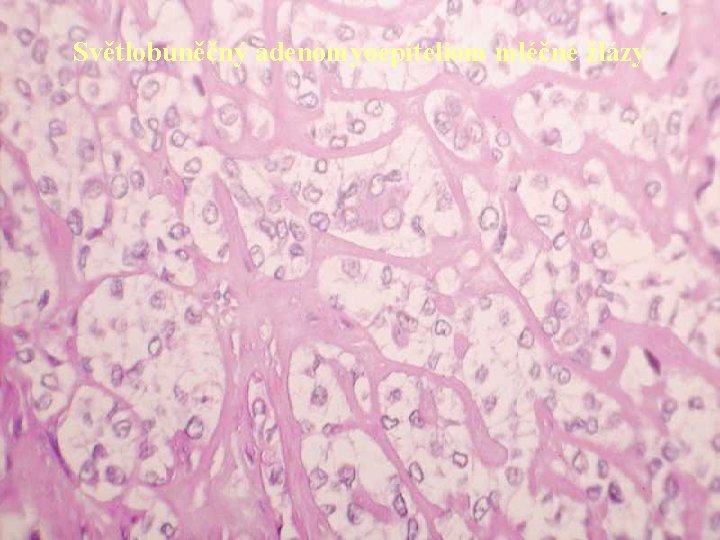
Světlobuněčný adenomyoepiteliom mléčné žlázy

Světlobuněčný adenomyoepiteliom mléčné žlázy

Světlobuněčný adenomyoepiteliom mléčné žlázy

Mesenchymální nádory Benigní: Fibrózní tumor (kolagenózní stroma s málo nebo žádnými dukty a lobuly), myofibroblastom (klasický typ, kolagenizovaná varianta, epiteloidní varianta, celulární varianta, infiltrativní varianta, s myoidní diferenciací), nádor z granulárních buněk, leiomyom, myoidní hamartom, myxom, lipom, adenohibernom (hamartom s hnědou tukovou tkání), hemangiom, Rosai-Dorfmanova nemoc – histiocytóza s fagocytózou lymfocytů, extranodálně v prsu. Maligní: Stromální sarkom, leiomyosarkom, liposarkom, osteosarkom, chondrosarkom, maligní fibrózní histiocytom, fibrosarkom, rhabdomyosarkom, hemangiopericytom, angiosarkom, lymfomy (myxoidní varianta folikulárního sarkomu dendritických buněk – možnost záměny s karcinomem, pomůže imunohistochemie: LCA+ , CD 1+, CD 20+, CD 40+).

Newly described entites in breast pathology Dr. Eusebi, Bologna Rosai-Dorfmanova nemoc (histiocytóza s fagocytózou lymfocytů) extranodálně v prsu Adenohibernom (hamartom s hnědou tukovou tkání)

Pseudonádory Fibromatóza, pseudoangiomatózní hyperplasie mammárního stromatu (dobře ohraničená masa většinou zjistitelná palpačně, vyjímečně bilaterální, může být i součástí fibroadenomů i fyloidních nádorů a téměř ve 2/3 mammárních hamartomů, proces napodobuje vaskulární proliferaci, proliferace může být zvýšená, některé buňky obliterující cévní lumina mohou mít vřetenatý tvar – nebezpečí záměny s angiosarkomem, nikdy tam však nebývají hemoragie, nekrózy nebo známky endoteliální diferenciace, IHC: vimentin +, SMA+, CD 34+, ER+, PR+, FVIII-, UEA-, cytokeratiny, S 100 -), angiomatóza, cysty, duktální ektázie, pozánětlivé pseudotumory, hamarcie, asynchronní gravidární hyperplasie, asynchronní involuce laktující mammy, virginální (juvenilní) hyperplasie.


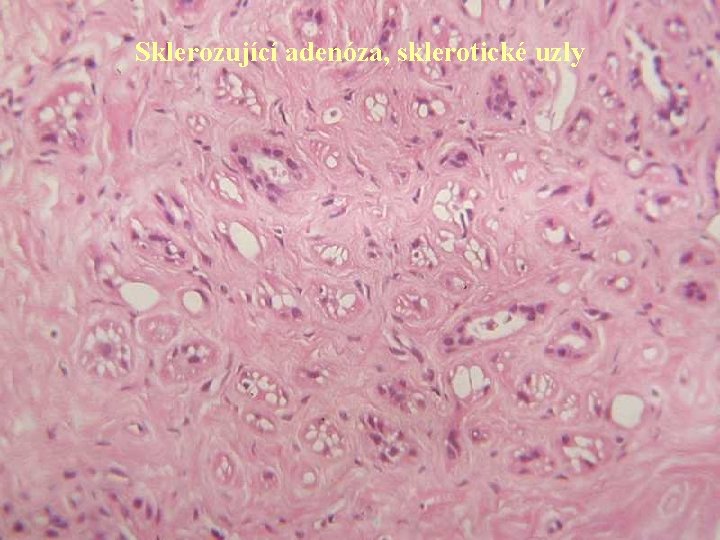
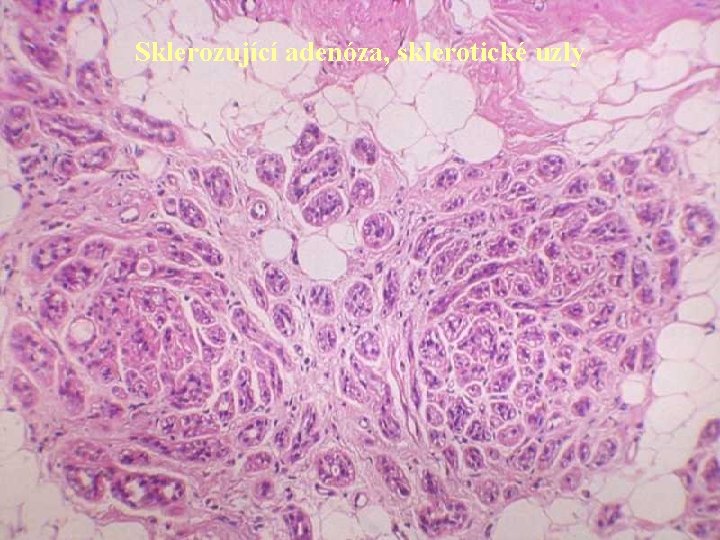
Sklerozující adenóza, sklerotické uzly

Sklerozující adenóza, sklerotické uzly

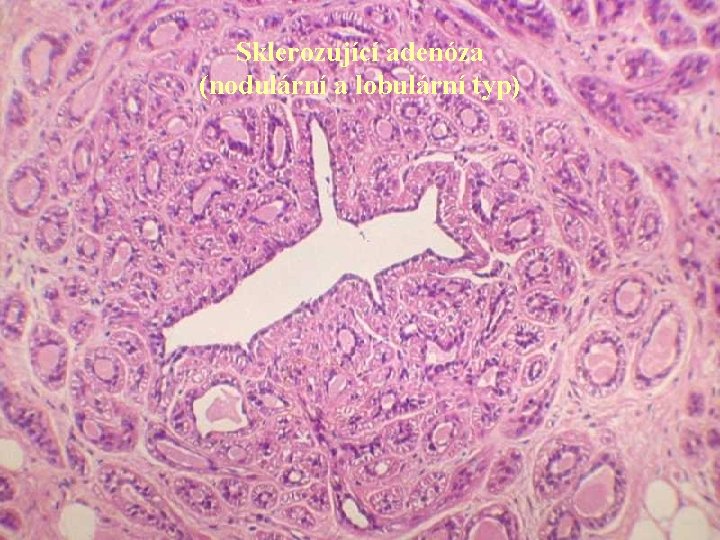
Sklerozující adenóza (nodulární a lobulární typ)

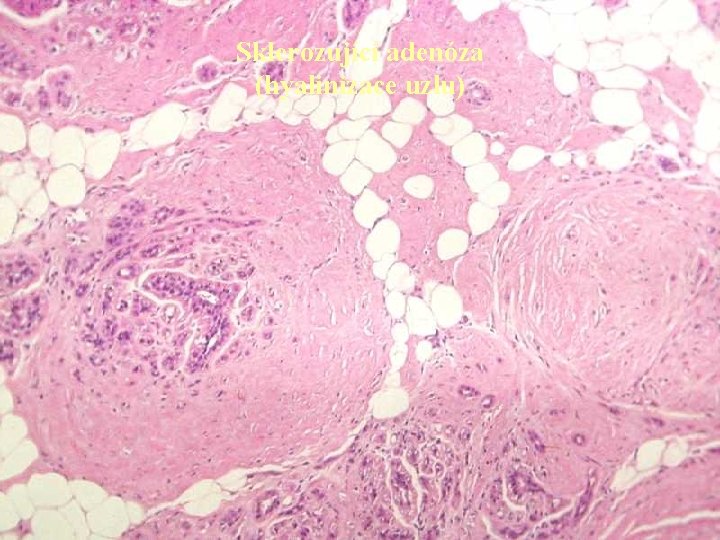
Sklerozující adenóza (hyalinizace uzlu)

Mikroglandulární adenóza

Specifické diagnostické znaky nádorů mammy Týkají se převážně invazivních (infiltrujících) karcinomů: Typing, grading, velikost primárního nádoru, apokrinní metaplasie. Jiné znaky jsou platné pro širší okruh mammárních nádorů: Postižení uzlin, invaze do krevních cév a lymfatik, angiogeneze, charakter okraje, nekrotizace, infiltrace zánětlivými elementy. Některé níže uvedené prognostické a prediktivní znaky mohou být rovněž důležitými znaky diagnostickými.

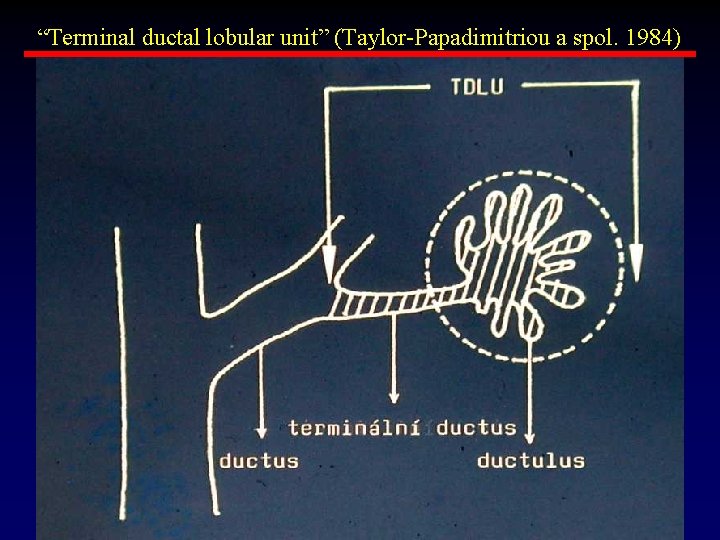
“Terminal ductal lobular unit” (Taylor-Papadimitriou a spol. 1984)


Specifické morfologické diagnostické znaky nádorů mammy U maligních epiteliálních nádorů se určuje histologický „grade“ (grading). Existuje celá řada klasifikačních systémů. Nejjednodušší je subjektivní dělení na dobře, středně a málo diferencovaný karcinom. Jiné systémy využívají více méně přesně definovaná kritéria. Jedním z „grading“ systémů, který můžeme pro jeho jednoduchost doporučit, je histologický grading dle Page, v modifikaci dle Rejthara. Je založen na hodnocení stupně zachování tvorby žlazových tubulů, na stupni atypie a polymorfie jader a mitotické aktivitě. Princip je uveden v tabulce.

Specifické morfologické diagnostické znaky nádorů mammy Histologický grading karcinomů mléčné žlázy (Page a spol. , v modifikaci dle Rejthara a spol. ) Body 1 Tvorba tubulů ve více než 75% plochy nádoru 1 v 10 – 75% plochy nádoru 2 méně než 10% plochy nádoru 3 2 Atypie a pleomorfie jader jádra uniformní 1 jádra zvětšená (mírná variabilita) 2 jádra zvětšená (výrazná variabilita) 3 3 Mitotická aktivita 0 - 8 mitóz 1 (2, 5 mm 2, 5 HP polí) 9 – 17 mitóz 2 18 a více mitóz 3 skóre 3 -5 = grade 1, skóre 6 -7 = grade 2, skóre 8 -9 = grade 3

Specifické morfologické diagnostické znaky nádorů mammy Na podobném principu je založen v dnešní době v Evropě nejpoužívanější „Nottingham“ systém (Elston a Ellis 1991). Vychází z dříve publikovaných návrhů autorů Black a Speer (1957), Bloom a Richardson (1957). Obsahuje následující kriréria: Body 1 Tvorba tubulů ve více než 75% plochy nádoru v 10 – 75% plochy nádoru méně než 10% plochy nádoru 1 2 3 2 Pleomorfie jádra malá, uniformní jádra zvětšená, vesikulární s nukleoly (mírná variabilita velikosti a tvaru) jádra veliká , vesikulární s prominujícími nukleony (výrazná variabilita) 1 3 Mitotická aktivita 0 – 6 mitóz (poč. mitóz, 10 HP polí, 7 – 14 mitóz periferie) 14 a více mitóz 1 2 3 skóre 3 -5 = grade 1, skóre 6 -7 = grade 2, skóre 8 -9 = grade 3 2 3

Specifické morfologické diagnostické znaky nádorů mammy o Existují i speciální „grading“ systémy pro fyloidní nádory !!! Od „Nottingham grading“ systému musíme odlišit tzv. „Nottingham“ prognostický index. Jde o pokus číselně vyjádřit prognózu pacienta s nádorem z hlediska délky přežití. Výpočet: 0, 2 x velikost nádoru + stadium + „grade“ velikost nádoru v cm, stadium podle počtu pozitivních uzlin (1 - žádná uzlina, 2 - 1 -3 uzliny, 3 - 4 a více 3 uzlin), grade – podle Nottingham systému. Index 2, 1 -3, 4 znamená dobrou prognózu (více než 90% přežívá 5 let), 3, 41 -5, 4 střední prognózu (75% přežívá 5 let), více než 5, 4 špatnou prognózu (20% přežívá 5 let).

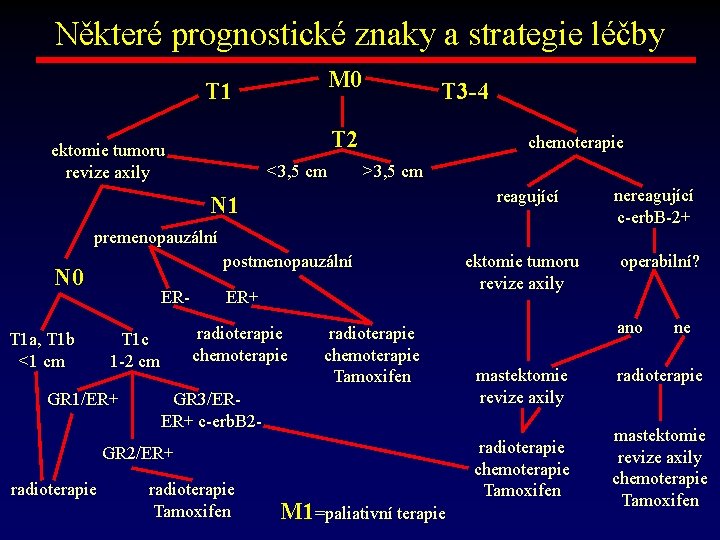
Některé prognostické znaky a strategie léčby M 0 T 1 T 3 -4 T 2 ektomie tumoru revize axily <3, 5 cm chemoterapie >3, 5 cm reagující N 1 nereagující c-erb. B-2+ premenopauzální postmenopauzální N 0 T 1 a, T 1 b <1 cm ER- ER+ T 1 c 1 -2 cm radioterapie chemoterapie Tamoxifen GR 1/ER+ GR 3/ER ER+ c-erb. B 2 - GR 2/ER+ radioterapie Tamoxifen M 1=paliativní terapie ektomie tumoru revize axily operabilní? ano ne mastektomie revize axily radioterapie chemoterapie Tamoxifen radioterapie mastektomie revize axily chemoterapie Tamoxifen

Karcinomy mléčné žlázy Přehled nejčastěji užívaných prognostických znaků Morfologické znaky Proliferační znaky Molekulární znaky velikost nádoru MI/SI/AI aktivátory transkripce metastázy obsah DNA/ploidita regulátory CDK počet metastáz Ag. NOR signální transduktory grading/staging PCNA/Ki-67 index regulátory typizace TUNEL/ISNTA metastazování a inv. růstu mdr telomeráza BRCA geny

Morfologické přístupy pro stanovení prognózy nádorů mammy a predikci reakce na léčbu Hormonální receptory: Imunohistochemické stanovení receptorů dnes zcela překonalo biochemické metody, důležitost kontroly kvality. Existují různé způsoby vyhodnocování pozitivity/negativity. Obyčejně se používají různá „H skóre“, která berou v úvahu % pozitivních buněk a intenzitu jejich zbarvení (vyjádřenou 4 stupni: 0 – negativita, 1 – slabá pozitivita, 2 – střední pozitivita, 3 – silná pozitivita).

Morfologické přístupy pro stanovení prognózy nádorů mammy a predikci reakce na léčbu l Sloane uvádí H skóre kalkulované následujícím způsobem: % slabě pozitivních buněk x 1 + % středně pozitivních buněk × 2 + % silně pozitivních buněk × 3, skóre tak může kolísat od 0 do 300, nevýhodou je pracnost tohoto hodnocení, l používá se i „Quickovo skóre“, je založeno na sledování intenzity barvení (0 -3) a proporce pozitivních buněk (0 – žádná pozitivní buňka, 1 – 1 -25% pozitivních bb. , 2 – 26 -50% pozitivních bb. , 3 – 51 -75% pozitivních bb. , 4 – 76 -100% pozitivních bb. ), intenzita a proporce se sčítají, takže skóre můře kolísat od 0 -7,

Morfologické přístupy pro stanovení prognózy nádorů mammy a predikci reakce na léčbu l podobný systém navrhl Harvey (proporce pozitivních buněk se skóruje následujícím způsobem: 0 - žádné, 1 – méně než 1%, 2 - 1 -10%, 3 – 10 -33%, 4 – 33 -67%, 5 – více než 67%, k tomu se přičítá intenzita barvení stupňovaná 0 – 4, skóre proto může kolísat od 0 do 8 s vynecháním 1, l my používáme skóre založené na základě srovnání procenta pozitivních buněk a výsledků terapie antiestrogeny: 0 -5% pozitivních buněk – negativita, 5 -25% – nízká pozitivita, 25 -50% – střední pozitivita, více než 50% – vysoká pozitivita, klademe daleko větší důraz na posouzení funkčnosti ER pomocí sledování koexprese PR, Bcl-2, ERRP (hsp 27), proliferační aktivity, výsledkem je predikce reakce na léčbu antiestrogeny, která je u 3/4 pacientů správná, u zbývající 1/4 případů se uplatňují jiné regulační faktory.


Imunohistochemické přístupy pro stanovení prognózy nádorů mammy a predikci reakce na léčbu Jiné prognostické a prediktivní znaky: Proliferace (MI, LI, PCNA, Ki-67), apoptóza (apoptotická tělíska, TUNEL, proapoptotické znaky – Bax, Fas-L, lamin, PARP, caspázy atd. , antiapoptotické znaky – Bcl-2, exprese cerb. B-2 (Her 2/neu), EGFR, topoisomerázy 2 , ER receptorů, androgenních receptorů AR, TGF/TGFR, telomerázy, p 53, BRCA 1, ERRP (p. S 2, katepsinu D, Hsp 27) atd.

Specificita, senzitivita a pozitivní prediktivní hodnota biochemických onkomarkerů CA 15 -3 MCA CEA TPA CA 15 -3 + CEA CA 15 -3 + MCA + CEA TPA + MCA CA 15 -3 + TPA + CEA SF 90% 86% 93% 90% 81% 84% 81% 80% SN 75% 66% 48% 59% 87% 77% 82% 77% 72% 80% 85% PV+ 89% 85% 90% 87% 84% 86% 83% 85%

c-erb. B-2/neu/HER-2 – gen kóduje transmembránový protein s funkcí receptorové tyrosin kinázy o m. h. 185 k. Da – protein se podílí na regulaci invazivity nádorových buněk – protein funguje jako „orphan” receptor, který zesiluje signály předané dalšími receptory rodiny erb. B (erb. B-1, erb. B-3 a erb. B-4) tím, že s nimi vytváří heterodimery

c-erb. B-2/neu/HER-2 Amplifikace/overexprese: – koreluje se špatnou prognózou a relapsem – je častější u adenokarcinomů – vyskytuje se u 20 -30% karcinomů mléčné žlázy – má prognostický a prediktivní význam pro výsledek chemoterapie nebo pro léčbu Herceptinem – je spojena s dobrou reakcí na léčbu doxorubicinem, cyklofosfamidem, methotrexatem, fluorouracilem a paclitaxelem, zatímco léčba tamoxifenem je neúčinná

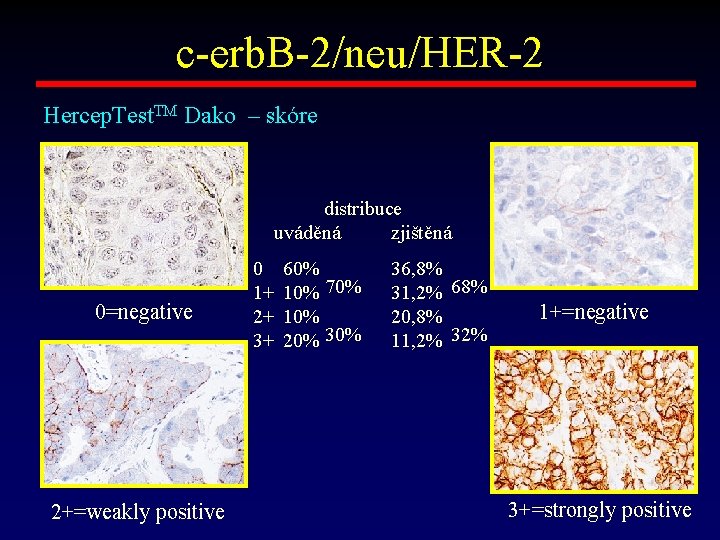
c-erb. B-2/neu/HER-2 Hercep. Test. TM Dako – skóre distribuce uváděná zjištěná 0=negative 2+=weakly positive 0 1+ 2+ 3+ 60% 10% 70% 10% 20% 36, 8% 31, 2% 68% 20, 8% 11, 2% 32% 1+=negative 3+=strongly positive

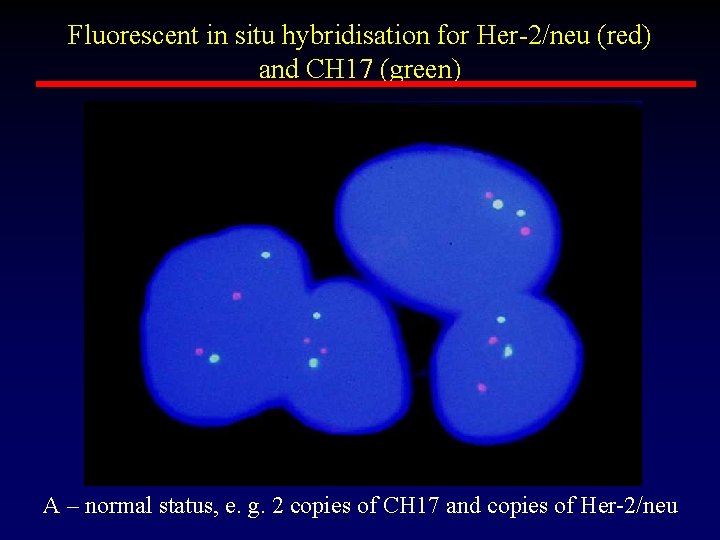
Fluorescent in situ hybridisation for Her-2/neu (red) and CH 17 (green) A – normal status, e. g. 2 copies of CH 17 and copies of Her-2/neu

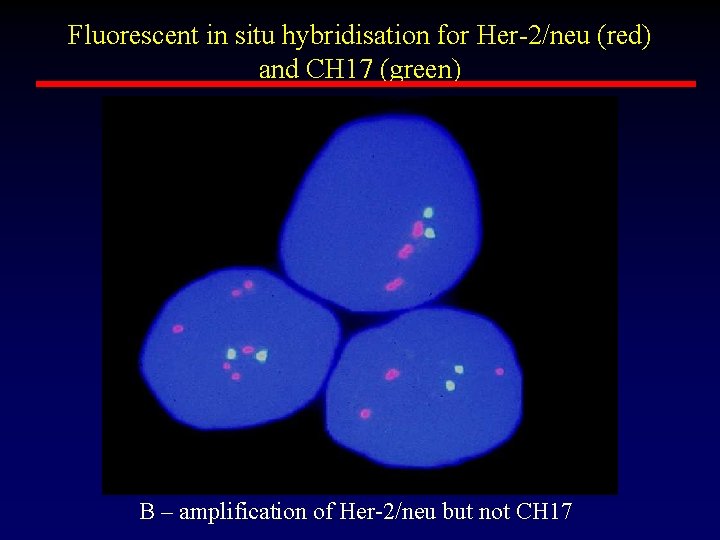
Fluorescent in situ hybridisation for Her-2/neu (red) and CH 17 (green) B – amplification of Her-2/neu but not CH 17

ONKOGENY A TUMOR SUPRESOROVÉ GENY

Změny nádorů mammy po léčbě Ložiskové hyperplasie a pseudolaktační změny po podávání hormonů a trankvilizérů: Ložiska vzhledu adenózy, duktální hyperplasie nebo stromální hyperplasie, někdy s hypersekrečními (pseudolaktačními) změnami v souvislosti s podáváním estrogenů, gestagenů, ale i některých trankvilizérů. Změny po tamoxifenu: Popisuje se regrese cyst, redukce objemu jader a mitotické aktivity, redukce množství lysosomů, atrofie struktur normální mléčné žlázy.

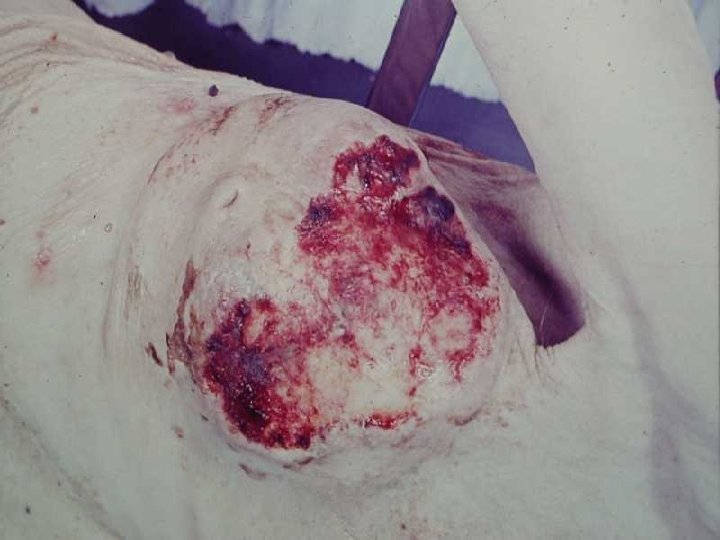
Změny nádorů mammy po léčbě Nekróza mammy po antikoagulační terapii: komplikace léčby s deriváty kumarinu nebo warfarinu. Častěji postiženy starší obézní ženy. Nekróza se vyskytuje pod kůží prsu asi 3 -10 dní od zahájení léčby a rozšiřuje se do hlubších partií mammy. Obyčejně na ni navazuje gangréna. Pokud se zhojí, vznikají hluboké jizvy, často je však nebytná mastektomie. V okolí nekrotických ložisek bývají známky akutní nekrotizující vaskulitidy. Mechanismus není jasný, snad hypersensitivní reakce. Spontánní nekróza v těhotenství a laktaci: Vzácná komplikace, vyšší incidence u černochů. Kolem centrálního ložiska koagulační nekrózy (průměr nejčastěji 1 -2 cm) je lem lymfocytů, plasmocytů, mikrofágů obsahujících hemosiderin a fibróza. Za příčinu se považuje vaskulární insuficience při zvýšené metabolické a proliferační aktivitě.

Změny nádorů mammy po léčbě Změny po radioterapii a chemoterapii: Vznikají atrofie a fibrózy rezultující ze zvýšeného počtu buněk podléhajících nekróze a apoteóze. Po určité době se objevují cytologické atypie epitelu i stromatu. Dále subintimální fibróza cév a fragmentace elastiky arterií. Změny po punkčních biopsiích: Hemoragie s případnou organizací, depozita hemosiderinu. Raritně se popisuje zavlečení oddrolených maligních buněk podél punkčního kanálu, do podkoží nebo do cév.

Změny nádorů mammy po léčbě Změny po silikonových implantátech: V současné době se již neužívá přímá aplikace tekutého silikonového nebo parafínového oleje do tkáně, ale silikonový olej nebo fyziologický roztok je uzavřen ve vaku z různých polymerů (silikonový elastomer). Po čase je vak obkroužen vazivovou kapsulou, jejíž tloušťka může být různá od tenké flexibilní membrány po densní kolagenní vazivo. Někdy může být příčinou pozdních deformit prsu. Typická kapsula má 3 vrstvy. Vnitřní vrstva je tvořena epiteloidními buňkami, často tvořícími kolem implantátu palisádu (histiocytární/makrofágový původ), střední vrstva sestává z densního kolagenu a často obsahuje globule silikonu, vnější vrstva je tvořena dobře vaskularizovanou tukovou tkání obsahující lymfocyty a histiocyty s pěnitou cytoplasmou. Mohou se zde nacházet rovněž obrovské mnohojaderné buňky typu kolem cizího materiálu. Dojde-li k ruptuře, vznikají tumorům podobná ložiska granulomů (silikonomy) obstoupená volným silikonem a velkým počtem lymfocytů a plasmocytů. Někdy se vyvíjí regionální silikonová lymfadenopatie.


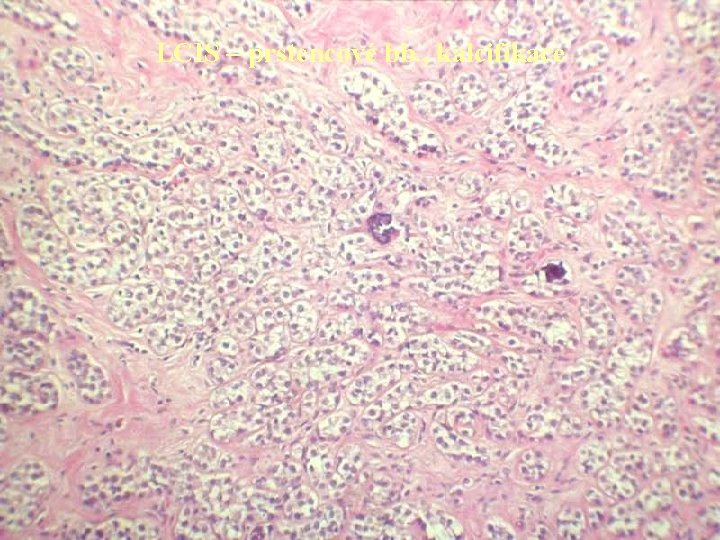
LCIS – prstencové bb. , kalcifikace

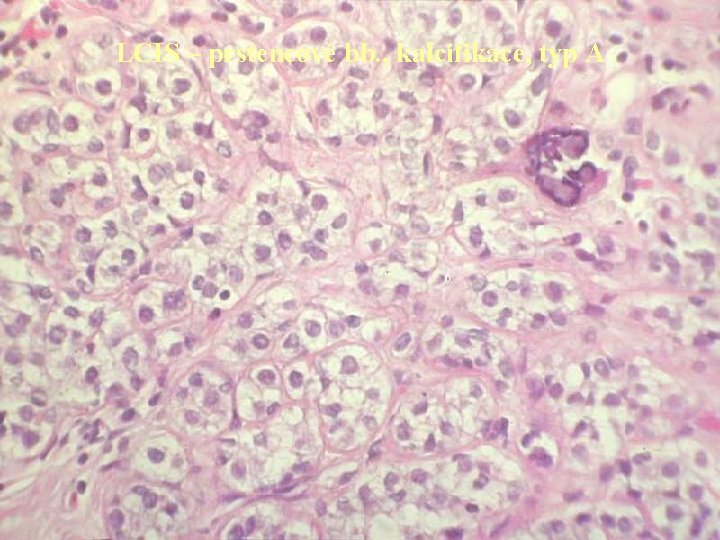
LCIS – prstencové bb. , kalcifikace, typ A

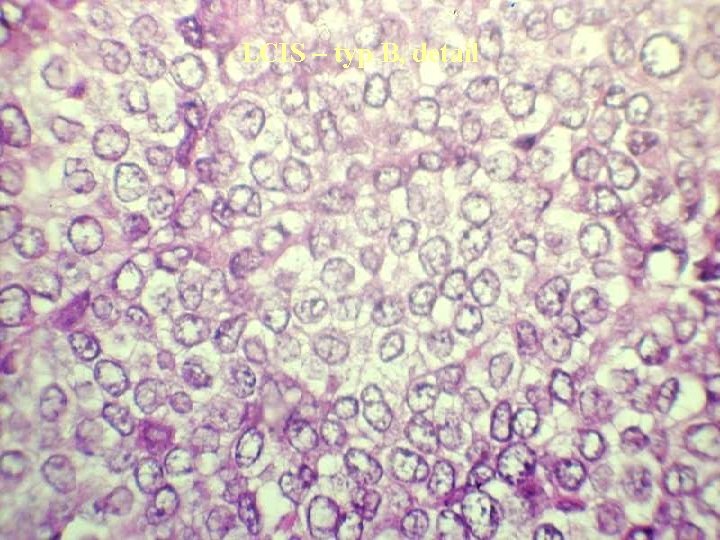
LCIS – typ B, detail

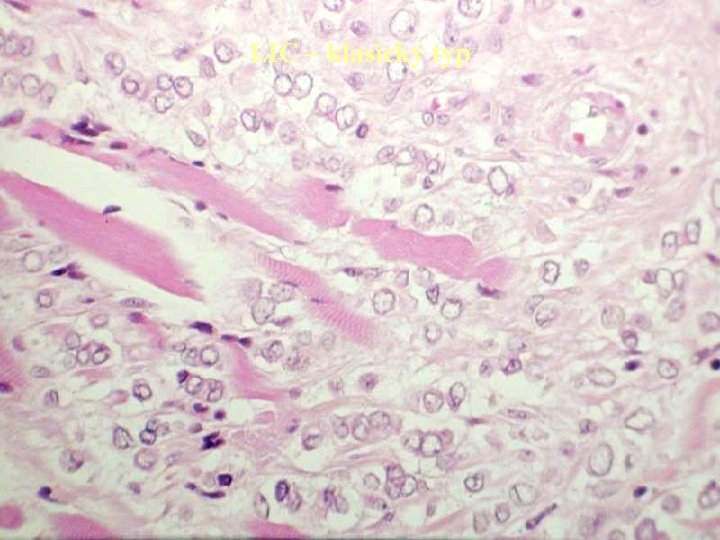
LIC – klasický typ

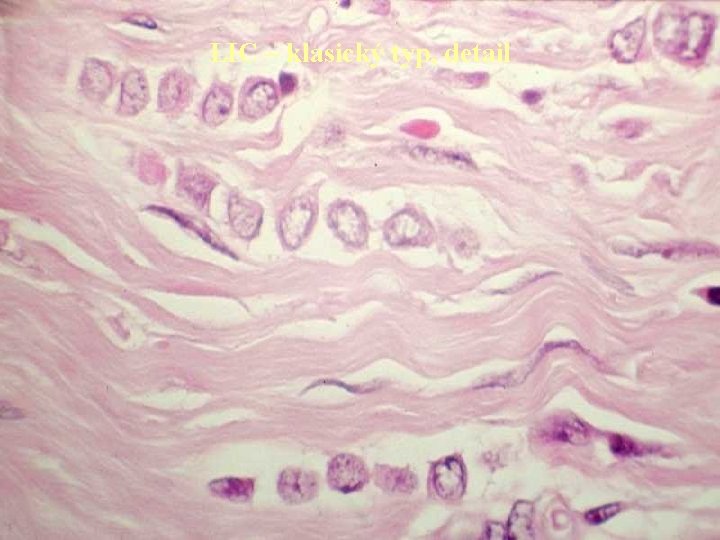
LIC – klasický typ, detail

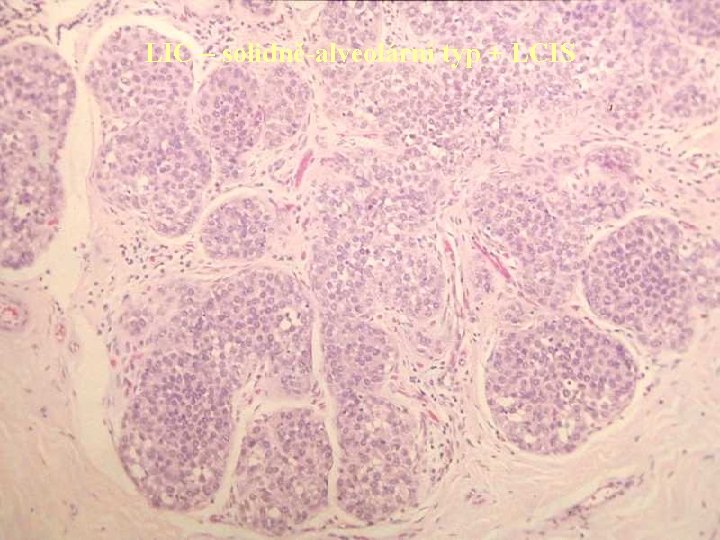
LIC – solidně-alveolární typ + LCIS

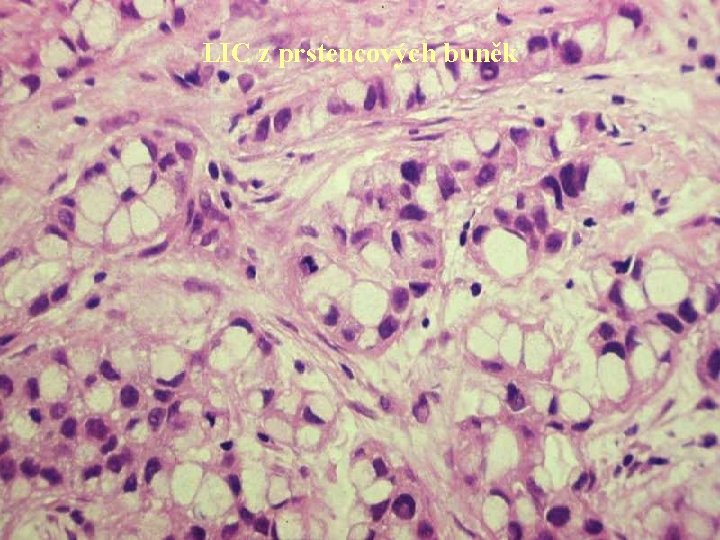
LIC z prstencových buněk

LIC – pleomorfní typ

LIC – pleomorfní typ

LIC – pleomorfní typ

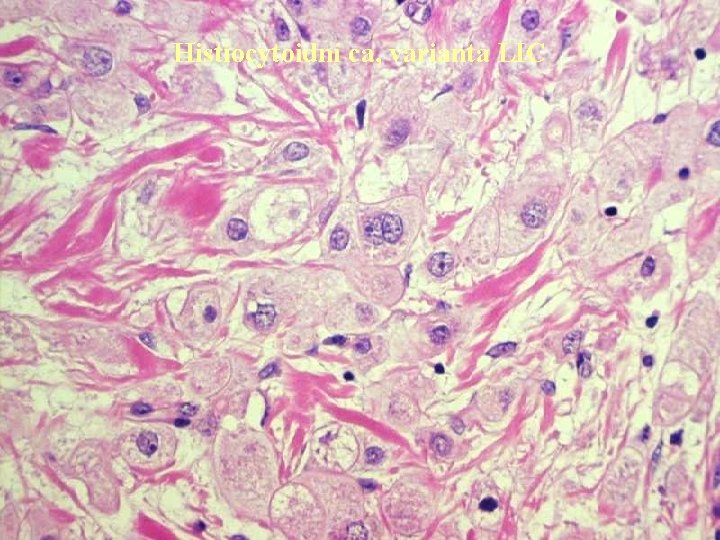
Histiocytoidní ca, varianta LIC

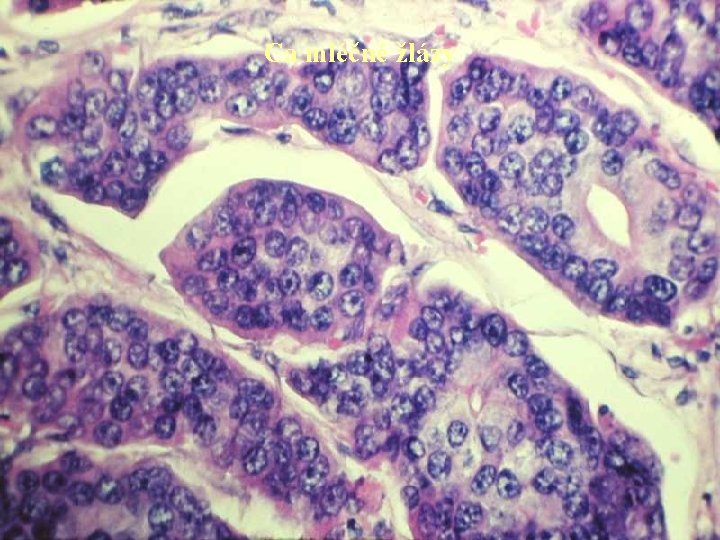
Ca mléčné žlázy

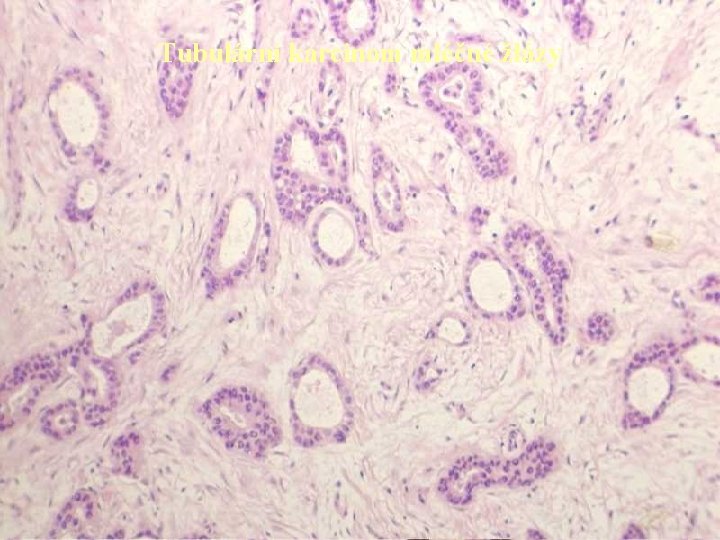
Tubulární karcinom mléčné žlázy

Adenoidně cystický karcinom

Vřetenobuněčný ca mléčné žlázy

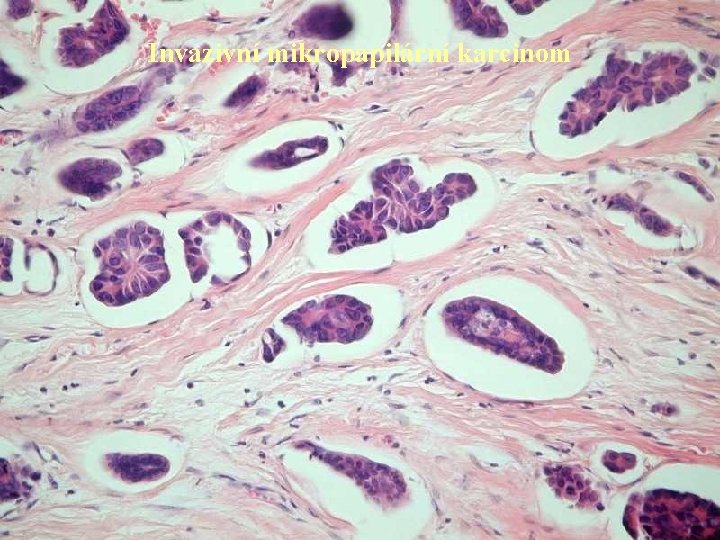
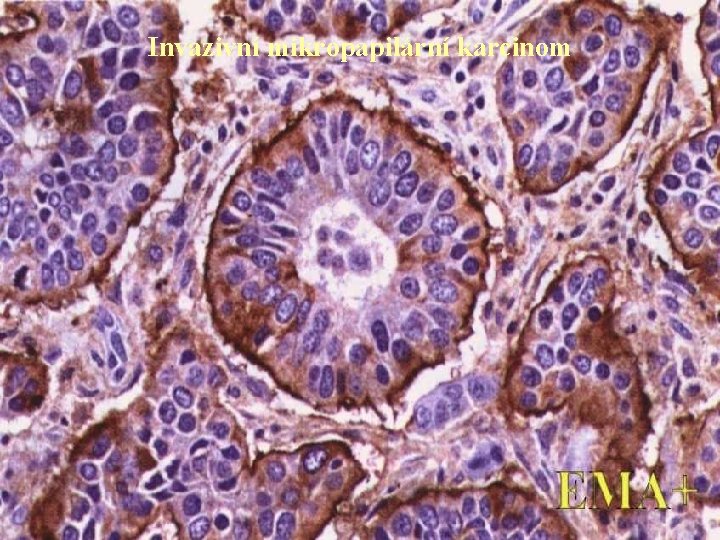
Invazivní mikropapilární karcinom

Invazivní mikropapilární karcinom









 Bartolomeo pepe tumore
Bartolomeo pepe tumore Dr miu nicolae
Dr miu nicolae Eddie rosen brian rosen
Eddie rosen brian rosen Rot rot rot sind die rosen rosen die ich an dich verschenke
Rot rot rot sind die rosen rosen die ich an dich verschenke Pletivova kost
Pletivova kost Fibroadenom v prsu
Fibroadenom v prsu Gpk fn brno
Gpk fn brno Bryant triangle normal range
Bryant triangle normal range Eaton-rosen phenomenon
Eaton-rosen phenomenon Alpha and beta angle in ddh
Alpha and beta angle in ddh Einstein rosen bridge equation
Einstein rosen bridge equation The car trip michael rosen
The car trip michael rosen Schwarze rose bedeutung türkei
Schwarze rose bedeutung türkei David rosen sega
David rosen sega Epr einstein podolsky rosen
Epr einstein podolsky rosen Sophie rosen
Sophie rosen Gece moldu ortez
Gece moldu ortez Matematika diskrit kenneth rosen pdf
Matematika diskrit kenneth rosen pdf Jacob rosen ucla
Jacob rosen ucla Ncblpc
Ncblpc Aaron bloomfield
Aaron bloomfield Rosenmath
Rosenmath Von rosen line ddh
Von rosen line ddh Quadruple constraint
Quadruple constraint John rosen
John rosen Travel recount
Travel recount Lateral fleksiyon
Lateral fleksiyon Von rosen splint
Von rosen splint Birgitta rosen logoped
Birgitta rosen logoped Mc gayer
Mc gayer Jacob rosen ucla
Jacob rosen ucla Dr carol rosen
Dr carol rosen Pelvis 3 yön grafisi
Pelvis 3 yön grafisi Antikorreliert
Antikorreliert 10 rosen für dich
10 rosen für dich Mussa rosen
Mussa rosen Handshaking lemma in graph theory
Handshaking lemma in graph theory What is one one and onto function
What is one one and onto function Walter g. rosen
Walter g. rosen Burnham rosen group
Burnham rosen group Planum cutaneum radii
Planum cutaneum radii Vilka olika former av rent kol finns det?
Vilka olika former av rent kol finns det? üst orta kol çevresi nasıl ölçülür
üst orta kol çevresi nasıl ölçülür Kol grundämne
Kol grundämne Ara sahanlıklı merdiven
Ara sahanlıklı merdiven Med kol
Med kol Cut-down damar yolu
Cut-down damar yolu Kol nidrei text
Kol nidrei text Respiratorisk acidose kol
Respiratorisk acidose kol Rmr kol
Rmr kol Barak kol
Barak kol Gillat kol
Gillat kol Pr��ce kol��n
Pr��ce kol��n Kol gücünden makine gücüne geçiş
Kol gücünden makine gücüne geçiş Pazı kemiği kırığı tespiti
Pazı kemiği kırığı tespiti Biyeli kol yırtmacı
Biyeli kol yırtmacı Haşman masajı
Haşman masajı Dirsek fleksörleri
Dirsek fleksörleri Kol skyryba
Kol skyryba Reificering
Reificering Sternoklavikular
Sternoklavikular Alçak kol koruma tekniği
Alçak kol koruma tekniği Trochlea humeri
Trochlea humeri Eklem yüzeylerinin kalıcı olarak ayrılmasına ne denir
Eklem yüzeylerinin kalıcı olarak ayrılmasına ne denir Kol kasları
Kol kasları Järn kol diagram
Järn kol diagram Kol od balevav penima
Kol od balevav penima üst orta kol çevresi ölçümü
üst orta kol çevresi ölçümü Barak kol
Barak kol Pr��ce kol��n
Pr��ce kol��n Ortiqchasini top
Ortiqchasini top Volkman iskemik kontraktürü
Volkman iskemik kontraktürü Cat kol
Cat kol Flexor digitorum profundus siniri
Flexor digitorum profundus siniri Bacak kompartmanları
Bacak kompartmanları M. deltoideus siniri
M. deltoideus siniri Modern kol
Modern kol Deimant
Deimant ön kol kemiği
ön kol kemiği Medüller hipertonisite nedir
Medüller hipertonisite nedir Literatura china caracteristicas
Literatura china caracteristicas Literární žánry
Literární žánry Expresionismus literatura
Expresionismus literatura Literatura maya mapa conceptual
Literatura maya mapa conceptual Eu lírico exemplos
Eu lírico exemplos Figuras retóricas selectividad
Figuras retóricas selectividad Poemas de amor tragico
Poemas de amor tragico Legionářská literatura charakteristika
Legionářská literatura charakteristika El caracter ficcional de la literatura
El caracter ficcional de la literatura Literatura disciplina
Literatura disciplina Autorreflexionar
Autorreflexionar Postmoderna literatura
Postmoderna literatura La narrativa en el barroco
La narrativa en el barroco La literatura precolombina se manifiesta a través de
La literatura precolombina se manifiesta a través de Stožnice
Stožnice Hombre en un mar de nubes
Hombre en un mar de nubes Znaky dekadence
Znaky dekadence Características de la literatura medieval
Características de la literatura medieval Marketing literatura
Marketing literatura Como fue la literatura en la edad media
Como fue la literatura en la edad media Poesia neoclasica caracteristicas
Poesia neoclasica caracteristicas Esquema del romanticismo literatura 4 eso
Esquema del romanticismo literatura 4 eso Robinzonáda literatura
Robinzonáda literatura Diferencias entre el barroco y el renacimiento
Diferencias entre el barroco y el renacimiento Literatura medieval contexto social
Literatura medieval contexto social Literatura del
Literatura del Caracteristicas de la literatura griega
Caracteristicas de la literatura griega Concepto de literatura infantil
Concepto de literatura infantil Sentido del viaje en la literatura
Sentido del viaje en la literatura Baroko ppt
Baroko ppt