ODMRN ANALZA prof Viktor Kanick Analytick chemie I





















































![Výpočty p. H n dosazení (5) za [B-] z (2) do (1) a z Výpočty p. H n dosazení (5) za [B-] z (2) do (1) a z](https://slidetodoc.com/presentation_image/2b5b9349ca10d65daf6b10a5d422603e/image-55.jpg)
![HENDERSONOVA ROVNICE n n zanedbání [H+] a [OH-]: pufry s p. H < 7: HENDERSONOVA ROVNICE n n zanedbání [H+] a [OH-]: pufry s p. H < 7:](https://slidetodoc.com/presentation_image/2b5b9349ca10d65daf6b10a5d422603e/image-56.jpg)
















































![Komplexní sloučeniny – analytický význam [SO 4]2 tetraoxosíran n [S 2 O 3]2 monothiotrioxosíran Komplexní sloučeniny – analytický význam [SO 4]2 tetraoxosíran n [S 2 O 3]2 monothiotrioxosíran](https://slidetodoc.com/presentation_image/2b5b9349ca10d65daf6b10a5d422603e/image-116.jpg)



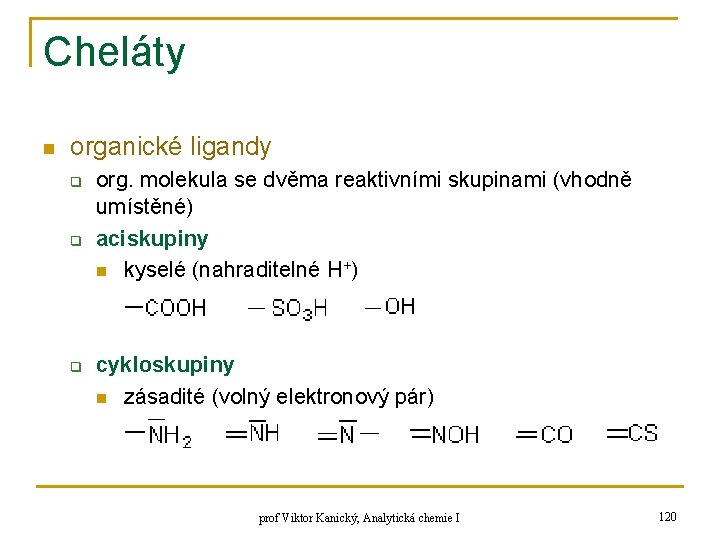







- Slides: 134

ODMĚRNÁ ANALÝZA prof Viktor Kanický, Analytická chemie I 1

Odměrná analýza n n odměrná = volumetrická = titrační analýza odměřuje se V titračního činidla (spotřeba do tzv. ekvivalenčního bodu) B – titrační činidlo, A – titrovaná látka n určení ekvivalenčního bodu n n n vizuálně (indikátory) subj. m. instrumentálně (měřená veličina, fyz. chem. met. ), obj. m. reakce musí být rychlé (ustalování rovnováhy) prof Viktor Kanický, Analytická chemie I 2

Typy reakcí → dělení odm. metody založené na: n 1) kombinaci iontů 2) přenosu elektronů q q 1) neutralizační (titrace) analýza q n n acidimetrie (kyselina) alkalimetrie (báze) srážecí titrace – argentometrie (Ag+) komplexometrické titrace q q n n chelatometrie (H 2 Y 2 -) merkurimetrie (Hg 2+) prof Viktor Kanický, Analytická chemie I 3

Typy reakcí → dělení odm. metod 2) q oxidimetrická titrace n n n q manganometrie (Mn. O 4 -) cerimetrie (Ce 4+) dichromatometrie (Cr 2 O 72 -) bromatometrie (Br. O 3 -) jodometrie (I 2) reduktometrické titrace n n n titanometrie (Ti 3+) chromometrie (Cr 2+) jodometrie (S 2 O 32 -, As. O 33 -) prof Viktor Kanický, Analytická chemie I 4

Odměrné nádobí n n n odměrný válec (ČSN 704117, 704118) na vylití odměrné baňky (ČSN 704106) na dolití pipety (ČSN 704119, 704120) na vylití (15 sekund) nevyfukujeme!!! n n dělené nedělené automatické (s pístem), mikropipety byrety (ČSN 704130) na vylití (30 -60 sekund) q paralaktická chyba, kalibrace od nuly prof Viktor Kanický, Analytická chemie I 5

Kalibrace odměrného nádobí n n objem kalibrován při 20°C při jiné teplotě korekce změna koncentrace roztoku je ± 0, 02% rel. při ∆t = ± 1°C roztažnost skla KS – Kavalier Sázava prof Viktor Kanický, Analytická chemie I 6

Kontrolní kalibrace – pro přesná stanovení n n postup: za dané teploty a atmosférického tlaku v laboratoři zjistíme vážením hmotnost H 2 O, potřebné k naplnění nádoby po značku nebo k vyprázdnění nádoby tuto skutečnou hmotnost srovnáme s tabulkovou hodnotou prof Viktor Kanický, Analytická chemie I 7

Kontrolní kalibrace – pro přesná stanovení n n tabulková hodnota – udává v závislosti na teplotě hmotnost vody, vymezující při 20°C a 760 torr objem 1000 cm 3 údaj zahrnuje: n n n korekci na roztažnost vody s teplotou korekci na vztlak vzduchu (baňka, závaží) hustota vzduchu korig. na teplotu a obsah H 2 O par (50%) korekci na roztažnost skla s teplotou tab. hodnota platí při 760 torr a stejné teplotě vody a vzduchu; liší se tlak a tepl. H 2 O a vzduchu, uplatní se korekce: prof Viktor Kanický, Analytická chemie I 8

Příklad n n Jaký objem má baňka (odměrná) na 250 cm 3 při norm. teplotě (20°C), váží-li voda (17°C) v baňce naplněné po značku 249, 12 g. Teplota vzduchu 21°C, barometrický tlak je 771 torr. Řešení: Tabulky: udávají, že k vymezení V = 250 cm 3 při 20°C je třeba odvážit 997, 631/4 = 249, 408 g vody 17°C teplé; při téže teplotě vzduchu a při tlaku 760 torr. Korekce na teplotu vzduchu a tlak je: prof Viktor Kanický, Analytická chemie I 9

Příklad n pro vymezení správného objemu v odměrné baňce by měla voda mít hmotnost 249, 41 g ……. 250 cm 3 vážením bylo zjištěno 249, 12 g ……. x cm 3 Objem skutečný baňky při 20°C je 250 – 0, 29 = = 249, 71 cm 3 prof Viktor Kanický, Analytická chemie I 10

Jak jsou vypočteny hodnoty m pro kalibraci odměrných nádob v tabulkách? n n Příklad: Vypočtěte, kolik H 2 O by bylo třeba navážit za tlaku 760 torr při teplotě vody i vzduchu 23°C, 50% vlhkost, aby vymezila při 20°C a tlaku 760 torr objem 1000 cm 3? Postup řešení 1) vypočte se hmotnost 1000 cm 3 při 23°C H 2 O z tabulek → prof Viktor Kanický, Analytická chemie I 11

Jak jsou vypočteny hodnoty m pro kalibraci odměrných nádob v tabulkách? 2) zjistíme, jaké hodnoty m 2 mosazného závaží je třeba použít pro odvážení 1000 cm 3 H 2 O 23°C teplé na vzduchu; prázdnou baňku vytárujeme naplníme vodou a zvážíme dle ARCHIMEDOVA ZÁKONA platí prof Viktor Kanický, Analytická chemie I 12

Jak jsou vypočteny hodnoty m pro kalibraci odměrných nádob v tabulkách? Hustota suchého vzduchu při 23°C z tabulek : 1, 19227. 10 -3 g. cm-3. Tenze vodní páry při 23°C je 21, 086 torr. Při 50% vlhkosti je poloviční ≈ 10, 534 torr. Parciální tlak suchého vzduchu je 760 -10, 534 = 749, 466 torr prof Viktor Kanický, Analytická chemie I 13

Jak jsou vypočteny hodnoty m pro kalibraci odměrných nádob v tabulkách? Z tabulek: Hmotnost nasyc. vodní páry v 1 cm 3 při 23°C je 2, 062. 10 -5 g Nyní spočítáme m 2 je třeba na vyvážení 1000 cm 3 H 2 O při 23°C prof Viktor Kanický, Analytická chemie I 14

Jak jsou vypočteny hodnoty m pro kalibraci odměrných nádob v tabulkách? 3) Baňka 1000 cm 3 (20°C) má při (23°C) objem daný roztažností skla: k hodnotě m 2 je třeba přidat Výsledek: 1000 cm 3 při 20°C a 760 torr odpovídá 996, 588 g H 2 O 23°C teplé, odvážené při 23°C tlaku atmosférickém 760 torr a vlhkosti vzduchu 50% prof Viktor Kanický, Analytická chemie I 15

Příprava roztoku o dané koncentraci 1) 2) 3) 4) 5) 6) navážení (hod. sklo, zábrus. váž. , lodička) kvantitativní převod do odměrné baňky po rozpuštění v kádince (po tyčince, nálevkou, nepotřísnit zábrus) temperace baňky a roztoku, promíchání (obj. kontrakce) doplnění po značku promíchání převod roztoku do zásobní lahve prof Viktor Kanický, Analytická chemie I 16

Pipetování 1) 2) 3) 4) nasajeme do čisté pipety roztok (standard, vzorek), opláchneme vnitřní stěny pipety a vypustíme roztok do odpadu (nevracíme!) do propláchnuté pipety nasajeme roztok nad značku, osušíme konec pipety filtr. pap. , nastavíme meniskus na značku, zasuneme pipetu do nádoby (baňka, odměrka) tak, aby se špičkou dotýkala stěny kádinky necháme volně vytéci, počkáme 15 -20 sekund a konec pip. otřeme o stěnu nad, nevyfukujeme!!! nakonec pip. vypláchneme dest. vodou a dáme do stojanu prof Viktor Kanický, Analytická chemie I 17

Titrování 1) 2) 3) 4) 5) 6) 7) 8) byreta se plní nálevkou 2 cm nad nulovou značku po odložení nálevky se kohoutem nebo tlačkou odpustí vzorek do titr. baňky, indikátor, činidla mícháme krouživými pohyby levou rukou, pravou regulujeme přid. titr. činidlo před koncem titrace opláchneme stěny titr. baňky vodou ze střičky a po kapkách dotitrujeme počkáme 20 -30 sekund (stékání roztoku) a odečteme spotřebu, odhadujeme setiny ml opakujeme s alikvotními roztoky 2 x až 3 x (většinou titrač. činidla už přidáváme rychle, pomalu dotitrujeme) vypočteme střední spotřebu a z ní výsledek analýzy prof Viktor Kanický, Analytická chemie I 18

Koncentrace roztoků n obsah složky v roztoku: SI od 1. 1. 1980, ČSN 011300: q q v jednotkách látkového množství [mol], [mmol] v koncentraci n n n q látkové [mol. dm-3] ≈ M [mol. l-1] hmotnostní [g. l-1], [g. dm-3], [mg. l-1] objemové [l. l-1], [dm. dm-3] pomocí zlomků n n n látkových [mol. mol-1] → bezrozměrné hmotnostní [kg. kg-1] → bezr. , x 100 = [%] objemových [dm 3. dm-3] → bezr. , x 100 = [%] prof Viktor Kanický, Analytická chemie I 19

Koncentrace roztoků n n definice látkového množství: 1 MOL – takový počet elementárních částic, jako je počet Catomů v 0, 012 kg nuklidu 126 C elementární částice: atom, molekula, ion, elektron, zlomek molekuly, atomu, iontu, který odpovídá 1 elektronu nebo H (chemický ekvivalent) také násobek … NA = 6, 023. 1023 mol-1 např. : 1 mol (H 2 SO 4 / 2) prof Viktor Kanický, Analytická chemie I 20

Koncentrace roztoků n jednotkové látkové množství má extenzivní vlastnosti: 1 mol má: q q q molární hmotnost – číselně = rel. mol. hm. zápis: M(H 2 SO 4)=98, 08 g. mol-1, 1 mol ≈ 98, 08 g H 2 SO 4 molární objem M/ρ = Vm (dm 3. mol-1) Vm (H 2 O), 25°C, je 18, 07 cm 3 náboj (1 mol iontů Cu 2+ ≈ 1, 93. 105 C. mol-1) prof Viktor Kanický, Analytická chemie I 21

Poměry látkových množství v ekvivalenci Na. OH → poměr lát. množ. v ekvivalenci je nebo také: n molů Na. OH ≈ n molů chem, ekvivalentů (H 2 SO 4/2) ≈ ekvivalentní 1 molu H+ milimol ≈ mmol – při titracích (vhodnější množství) 1000 ml 0, 1 M HCl ≈ 0, 1 mol HCl → 1 ml obsahuje 0, 1 mmol Látkové množství v mmol v daném objemu je pak rovno prof Viktor Kanický, Analytická chemie I 22

Výpočet změny koncentrace látky při reakci Příklad: 100 ml 0, 1 M HCl + 90 ml 0, 1 M Na. OH c (HCl) = ? prof Viktor Kanický, Analytická chemie I 23

Výsledek analýzy n n n hmotnostní jednotky % (m/m, m/v, v/v) ppm = 10 -4 %, ppb = 10 -7 % (pars per million; pars per billion) koncentrace v mol. l-1, mg. l-1 alikvotní část vzorku – alikvotní objem Va z celkového V 0 → prof Viktor Kanický, Analytická chemie I 24

Stechiometrické vztahy a poměry v ekvivalenci u odměrných metod a) def. zlomky at. , iontů, mol. , odpovídající 1 chem. ekvivalentu (1 H+ acidobasické reakce, 1 eredox. ) prof Viktor Kanický, Analytická chemie I 25

Stechiometrické vztahy a poměry v ekvivalenci u odměrných metod b) látková množství v molech celých molekul, atomů, iontů; formulace stechiometrického vztahu rovnici titrační činidlo: c(KMn. O 4) = 0, 02 mol. l-1 prof Viktor Kanický, Analytická chemie I 26

Příklady výpočtů titračních stanovení dle a), b) Stanovení obsahu CO 2 v bezv. Na 2 CO 3 titr. 0, 1 M HCl na m. o. prof Viktor Kanický, Analytická chemie I 27

Stanovení obsahu CO 2 v bezv. Na 2 CO 3 titr. 0, 1 M HCl na m. o. n provedení: spotřeba n a) 1 ml 0, 1 M HCl obsahuje 0, 1 mmol HCl, reaguje s 0, 1 mmol (Na 2 CO 3/2) ≈ 5, 29 mg Na 2 CO 3, odpovídá 0, 1 mmol (CO 2/2) ≈ 2, 2 mg CO 2 → výpočet: v 10 ml alikvotu je při spotř. 10, 5 ml HCl: prof Viktor Kanický, Analytická chemie I 28

Stanovení obsahu CO 2 v bezv. Na 2 CO 3 titr. 0, 1 M HCl na m. o. ve 100 ml původního roztoku: v navážce: prof Viktor Kanický, Analytická chemie I 29

Stanovení obsahu CO 2 v bezv. Na 2 CO 3 titr. 0, 1 M HCl na m. o. n b) poměr lát. množství v ekvivalenci 1 ml 0, 1 M HCl obsahuje 0, 1 mmol HCl, reaguje s 0, 05 mmol Na 2 CO 3 tj. 5, 29 mg Na 2 CO 3, vzniká 0, 05 mmol CO 2 (2, 20 mg) n. A/n. T – poměr látkového množství stanovené látky A a titračního činidla T v ekvivalenci prof Viktor Kanický, Analytická chemie I 30

Stanovení titru odměrných roztoků (standardizace, faktorizace). Standardní látky. Primární standard (základní látka) 1) 2) 3) 4) 5) 6) čistota nejméně 99, 99 % definované a známé složení kvantitativní stechiometrická reakce se standardizovanou látkou stálost složení na vzduchu a při sušení snadná rozpustnost ve vodě velká ekvivalentová hmotnost prof Viktor Kanický, Analytická chemie I 31

Stanovení titru n n 1) větší objem standardního roztoku a opakovaně titrujeme alikvotní podíly 2) pro každou titraci zvláštní navážka std. látky Příklad: Standardizace roztoku Na. OH na kys. šťavelovou c. T – koncentrace titračního roztoku (Na. OH) (n. T/ns)ekv – poměry látkových množství v ekvivalenci Vs, cs – objem a koncentrace rozt. standardní látky VT – spotřeba titračního roztoku prof Viktor Kanický, Analytická chemie I 32

Stanovení titru n faktor odměrného roztoku q q n číslo, kterým se násobí přibližná koncentrace odměrného roztoku a získá se jeho přesná koncentrace např. cca 0, 1 M Na. OH, f(Na. OH) = 1, 0156 → c(Na. OH) = = 0, 1. 1, 0156 = 0, 10156 mol. l-1 vyhodnocení titrací: 1. titrace orientační, 3 x opakujeme, odlehlou hodnotu (statisticky) vyloučíme, titrace opakujeme a počítáme aritmetický průměr ze 3 hodnot a směrodatnou odchylku (přesnost stanovení) prof Viktor Kanický, Analytická chemie I 33

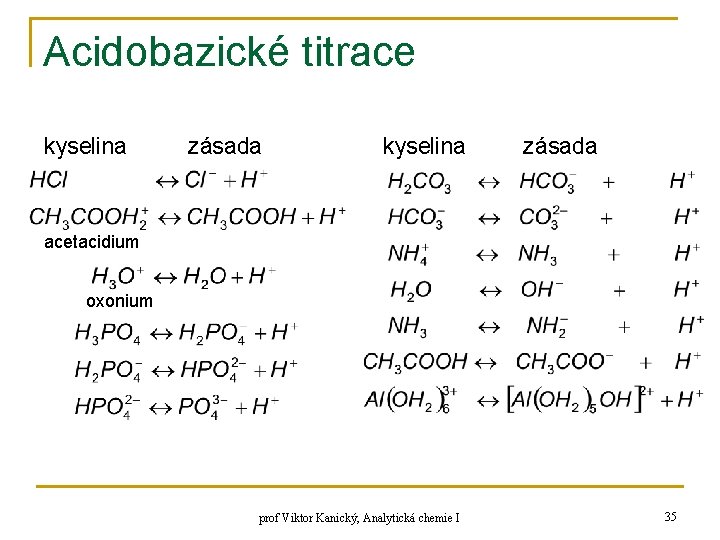
Acidobazické titrace n n vodné prostředí, nevodné prostředí (CH 3)SO, Et. OH, C 6 H 6, HAc voda – vysoká hod. diel. konstanty → dokonalá disoc. elek. Teorie kyselin a zásad: 1) ARRHENIUS (1887) 2) BRÖNSTED, LOWRY (1923) kyselina ↔ H+ + zásada (konjugovaný pár) prof Viktor Kanický, Analytická chemie I 34

Acidobazické titrace kyselina zásada acetacidium oxonium prof Viktor Kanický, Analytická chemie I 35

Acidobazické titrace n acidobazické (protolytické) reakce – mezi dvěma konjugovanými páry q H+ není v roztoku samostatně prof Viktor Kanický, Analytická chemie I 36

Acidobazické titrace n n silná kyselina je konjugována se slabou bazí a naopak silná kyselina silná báze rozpouštědla: q q amfiprotní (H 2 O, Me. OH, Et. OH, HAc, NH 4 Cl) protofilní (zásaditá, zvětš. sílu kyselin; ether ≈ (Et)2 O, dioxan C 4 N 8 O 2, DMF ≈ HCON(CH 3)2, DMSO (CH 3)2 SO) protogenní (kyselá, snižují sílu kyselin, HCl, HF) aprotická (benzen, tetrachlormetan) prof Viktor Kanický, Analytická chemie I 37

Acidobazické titrace n amfiprotní rozpouštědla → autoprotolýza obecně: autoprotolytická konstanta: prof Viktor Kanický, Analytická chemie I 38

Disociace kyselin a zásad n disociace slabé kyseliny termodynamická disociační konstanta kyselosti kyselá disociační konstanta kyseliny prof Viktor Kanický, Analytická chemie I 39

Disociace kyselin a zásad n disociace slabé báze B bazická disociační konstanta zásady n n charakterizace kyselin i zásad kyselou disoc. konstantou báze – kyselá disociační konstanta její konjug. kyseliny kojug. kys. báze iontový součin (produkt) vody Příklad: prof Viktor Kanický, Analytická chemie I 40

Tlumivé roztoky n směsi slabých kyselin a jejich konjugovaných zásad nebo směsi slabých zásad a jejich konjugovaných kyselin n přídavek H+ nebo OH- se spotřebuje na málo významný posun rovnovážného stavu systému slabé kys. a její soli [HA] + [A- ] nebo slabé zásady a její soli [B] + [BH+] → malá změna poměru prof Viktor Kanický, Analytická chemie I 41

Tlumivé roztoky –titrace slabé kyseliny silnou zásadou n c. B – přídavek silné báze, c. A – přídavek silné kyseliny β je poměr infinitezimálního přídavku silné zásady k příslušné změně p. H, která je tím vyvolána q je to převrácená hodnota směrnice závislosti p. H = f (přídavek zásady) prof Viktor Kanický, Analytická chemie I 42

Tlumivé roztoky n n tlumivý kvocient = tlumivá kapacita – počet molů přidané kyseliny nebo zásady, potřebný na změnu p. H o jednotku příklad: Acetátový tlumič: HAc/Na. Ac, c (HAc) = c(Na. Ac) = 0, 1 mol. l-1. p. H = p. KHA = 4, 76 přídavek Na. OH k acet. pufru 0, 1 ml 0, 1 M-Na. OH (tj. 0, 01 mmol Na. OH) 1 ml 0, 1 M-Na. OH (tj. 0, 1 mmol Na. OH) 10 ml 0, 1 M-Na. OH (tj. 1 mmol Na. OH) 50 ml 0, 1 M-Na. OH (tj. 5 mmol Na. OH) prof Viktor Kanický, Analytická chemie I změna p. H + 0, 0009 + 0, 47 β 0, 011 43

Tlumivé roztoky n tlumivé roztoky p. H (βmax) n tlumivě - amfolyty prof Viktor Kanický, Analytická chemie I 44

Tlumivé roztoky n příprava tlumičů q q a) neutralizací slabé kyseliny např. Na. OH slabé zásady např. HCl příklad: b) smícháním ekvivalentního množství slabé kyseliny a její soli se silnou zásadou nebo slabé zásady a její soli se silnou kyselinou příklad: prof Viktor Kanický, Analytická chemie I 45

Výpočty p. H n 1) silné kyseliny a zásady n 2) slabé kyseliny a zásady n 3) hydrolýza solí q q silné kyseliny a slabé zásady slabé kyseliny a silné zásady prof Viktor Kanický, Analytická chemie I 46

Výpočty p. H n 1) p. H silných kyselin a zásad prof Viktor Kanický, Analytická chemie I 47

Výpočty p. H n 2) p. H slabých kyselin a zásad q kyseliny n látková bilance: n ze vztahu pro disociační konstantu: prof Viktor Kanický, Analytická chemie I 48

Výpočty p. H n v roztoku slabé kyseliny obvykle platí nevýznamnost některých příspěvků: n zanedbáme-li jen prof Viktor Kanický, Analytická chemie I 49

Výpočty p. H q zásady n látková bilance: prof Viktor Kanický, Analytická chemie I 50

Výpočty p. H q n zanedbání: kritéria pro zjednodušení: n n n p. H (skutečné) – p. H (změřené) = ± 0, 02 log [H+] (změřené) – log [H+] (skutečné) = ± 0, 02 [H+] (změřené) / [H+] (skutečné) = 1, 05 – 0, 95 (± 5 %) prof Viktor Kanický, Analytická chemie I 51

Výpočty p. H n 3) p. H roztoků hydrolyzovaných solí q soli silných kyselin a slabých zásad protolytická reakce konjugovaná kyselina n výpočet p. H ze vztahu pro p. H slabé kyseliny: prof Viktor Kanický, Analytická chemie I 52

Výpočty p. H q soli slabých kyselin a silných zásad protolytická reakce konjugovaná báze n výpočet p. H ze vztahu pro p. H slabé báze: prof Viktor Kanický, Analytická chemie I 53

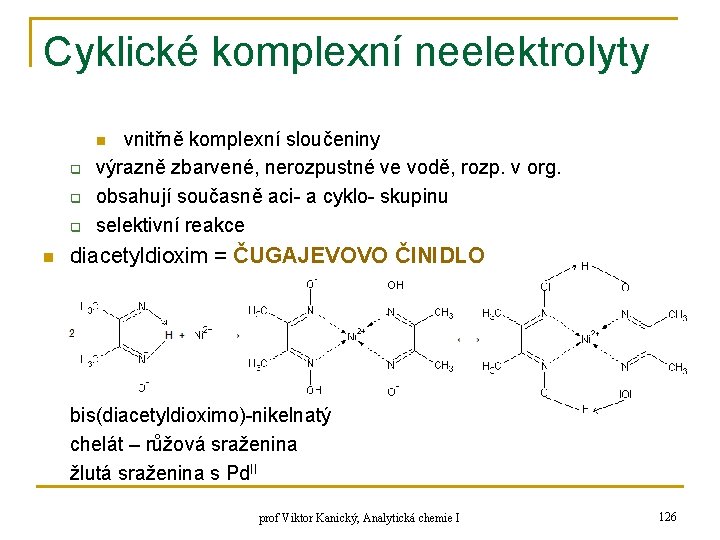
Výpočty p. H n p. H tlumivých roztoků q ve vhodném poměru smíšená: n n q q kyselina + konjugovaná baze + konjugovaná kyselina látková bilance kyseliny protonová bilance (1) (2) látková bilance zásady protonová bilance (3) (4) prof Viktor Kanický, Analytická chemie I 54
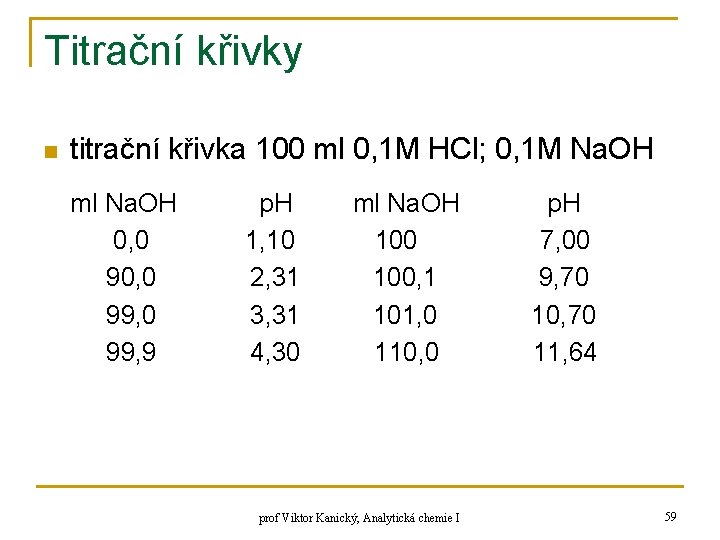
![Výpočty p H n dosazení 5 za B z 2 do 1 a z Výpočty p. H n dosazení (5) za [B-] z (2) do (1) a z](https://slidetodoc.com/presentation_image/2b5b9349ca10d65daf6b10a5d422603e/image-55.jpg)
Výpočty p. H n dosazení (5) za [B-] z (2) do (1) a z (1) se vyjádří [HB]: (6) za [HB] ze (4) do (3) a z (3) se vyjádří [B-]: (7) za [HB] a [B-] se dosadí do (5) z (6) a (7): (8) (9) prof Viktor Kanický, Analytická chemie I 55
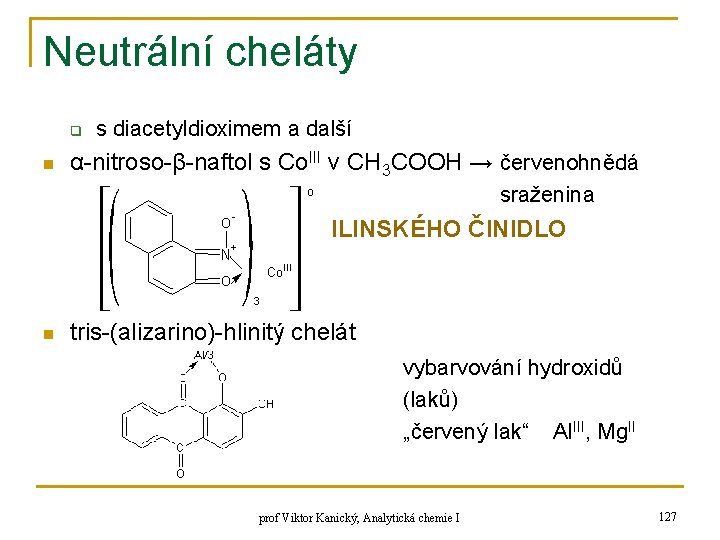
![HENDERSONOVA ROVNICE n n zanedbání H a OH pufry s p H 7 HENDERSONOVA ROVNICE n n zanedbání [H+] a [OH-]: pufry s p. H < 7:](https://slidetodoc.com/presentation_image/2b5b9349ca10d65daf6b10a5d422603e/image-56.jpg)
HENDERSONOVA ROVNICE n n zanedbání [H+] a [OH-]: pufry s p. H < 7: je-li [OH-] < 5% [H+] a dále [H+] < 5% z c(HB) a také [H+] < 5% z c(B-) alkalické tlumivé roztoky: p. H > 7: [H+] < 5% z [OH-], [OH-] < 5% z c(B) a [OH-] < 5% z c(HB+) q kyselina + sůl: q baze + sůl: prof Viktor Kanický, Analytická chemie I z 56

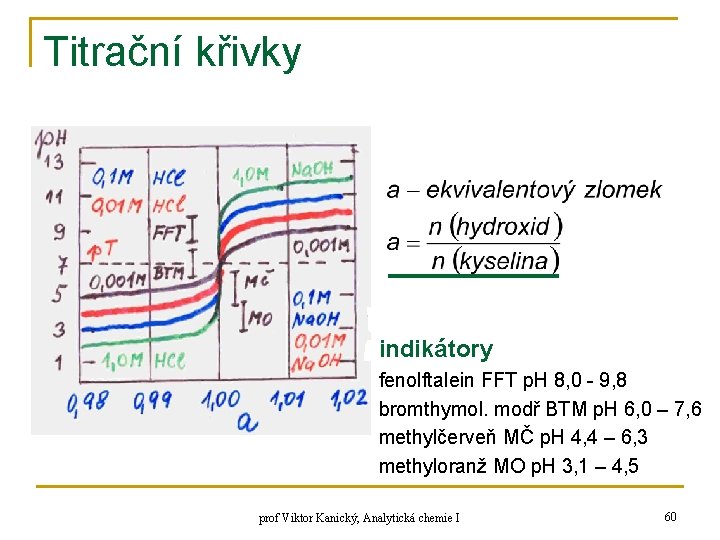
Titrační křivky q q q p. H = f (objem titračního činidla) průběh titrace volba indikátoru zjištění potenciometrickou titrací teoretický výpočet z uvedených vztahů prof Viktor Kanický, Analytická chemie I 57

Titrační křivky n titrace silné kyseliny silnou zásadou A) začátek titrace B) do ekvivalenčního bodu: c 0 – konc. kyseliny, c – konc. hydroxidu C) v bodě ekvivalence roztok obsahuje sůl silné kyseliny a silné zásady p p. H = 7 (p. T) D) za bodem ekvivalence: sůl + nadbytek hydroxidu prof Viktor Kanický, Analytická chemie I 58

Titrační křivky n titrační křivka 100 ml 0, 1 M HCl; 0, 1 M Na. OH ml Na. OH 0, 0 99, 9 p. H 1, 10 2, 31 3, 31 4, 30 ml Na. OH 100, 1 101, 0 110, 0 prof Viktor Kanický, Analytická chemie I p. H 7, 00 9, 70 10, 70 11, 64 59

Titrační křivky indikátory fenolftalein FFT p. H 8, 0 - 9, 8 bromthymol. modř BTM p. H 6, 0 – 7, 6 methylčerveň MČ p. H 4, 4 – 6, 3 methyloranž MO p. H 3, 1 – 4, 5 prof Viktor Kanický, Analytická chemie I 60

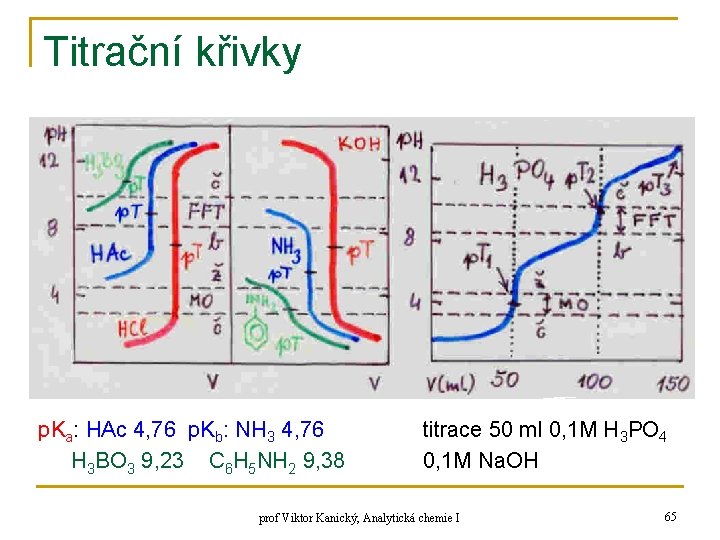
Titrační křivky n titrace slabé kyseliny silnou zásadou A) začátek titrace: B) do ekvivalenčního bodu: tlumivý roztok (sůl sl. kys. + silné zásady) a = 0, 50 (50%-ní ztitrování) (max. tlumivá kapacita) inflexní bod prof Viktor Kanický, Analytická chemie I 61

Titrační křivky C) v bodě ekvivalence: pouze sůl – protolyt ≈ slabá zásada koncentrace soli p. T – titrační exponent inflexní bod D) za bodem ekvivalence: směs soli a slabé kyseliny a hydroxidu (Na. Ac + Na. OH) převažuje c(B-) prof Viktor Kanický, Analytická chemie I 62

Titrační křivky n titrace slabé zásady silnou kyselinou A) začátek titrace: B) před bodem ekvivalence: HENDERSON ekvivalentový zlomek prof Viktor Kanický, Analytická chemie I max. tlumivá kapacita inflexní bod 63

Titrační křivky C) v bodě ekvivalence: pouze sůl – protolyt ≈ slabá kyselina hydrolýza p. T – titrační exponent (inflexní bod) D) za bodem ekvivalence: směs soli sl. zásady a sil. kyseliny prof Viktor Kanický, Analytická chemie I 64

Titrační křivky p. Ka: HAc 4, 76 p. Kb: NH 3 4, 76 H 3 BO 3 9, 23 C 6 H 5 NH 2 9, 38 titrace 50 ml 0, 1 M H 3 PO 4 0, 1 M Na. OH prof Viktor Kanický, Analytická chemie I 65

Titrační křivky p. H = p. Ka titrace slabých kyselin p. H = 14 – p. Kb titrace slabých zásad prof Viktor Kanický, Analytická chemie I 66

Titrační křivky n titrační exponent q silná kyselina + silná zásada: n n q slabá kyselina + silná zásada: n n q 1) p. T = 7, 00 2) p. T nezávisí na: kyselině, bázi, koncentraci 1) p. T > 7 2) p. T = f (p. Ka, c(HB)) – přímo úměrné silná kyselina + slabá zásada: n n 1) p. T < 7 2) p. T = f (p. Kb, c(B)) – nepřímo úměrné titrační kvocient ∆p. H / ∆V čím větší, tím přesnější prof Viktor Kanický, Analytická chemie I 67

Logaritmické diagramy acidobazických titrací n titrace slabé kyseliny silnou zásadou p. Ka = 4, 75 q 1) q 2) 1) + 2) → průsečík prof Viktor Kanický, Analytická chemie I 68

Logaritmické diagramy acidobazických titrací q 3) n a) - rovnoběžka s osou p. H n q b) 4) n n a) b) - rovnoběžka s p. H prof Viktor Kanický, Analytická chemie I 69

Logaritmické diagramy acidobazických titrací systémový bod: 0, 05 M CH 3 COOH bod M: skutečný průsečík 2) → p. H čisté 0, 05 M HAc 1) → p. H čistého 0, 05 M octanu Na prof Viktor Kanický, Analytická chemie I 70

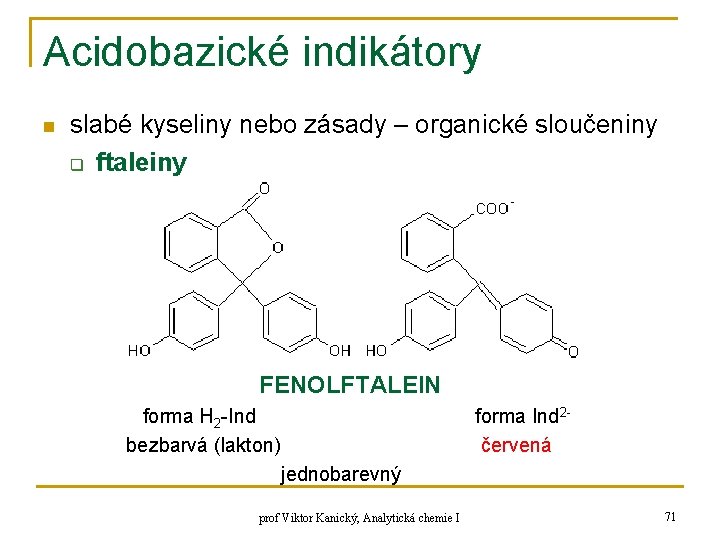
Acidobazické indikátory n slabé kyseliny nebo zásady – organické sloučeniny q ftaleiny FENOLFTALEIN forma H 2 -Ind bezbarvá (lakton) forma Ind 2červená jednobarevný prof Viktor Kanický, Analytická chemie I 71

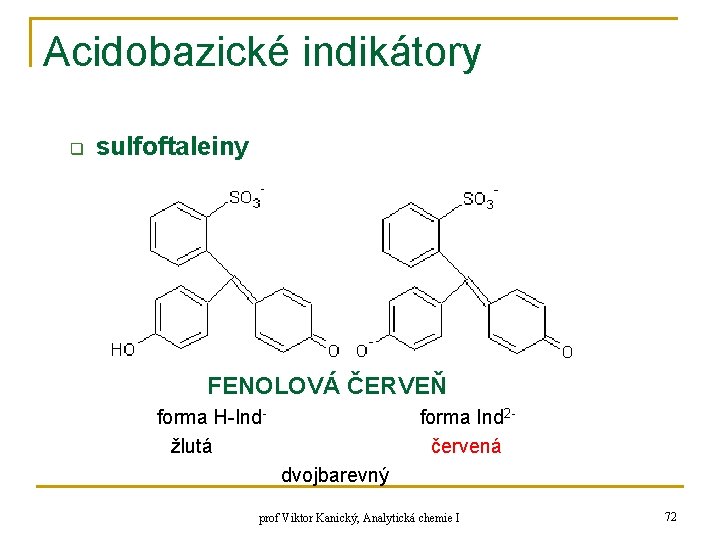
Acidobazické indikátory q sulfoftaleiny FENOLOVÁ ČERVEŇ forma H-Indžlutá forma Ind 2červená dvojbarevný prof Viktor Kanický, Analytická chemie I 72

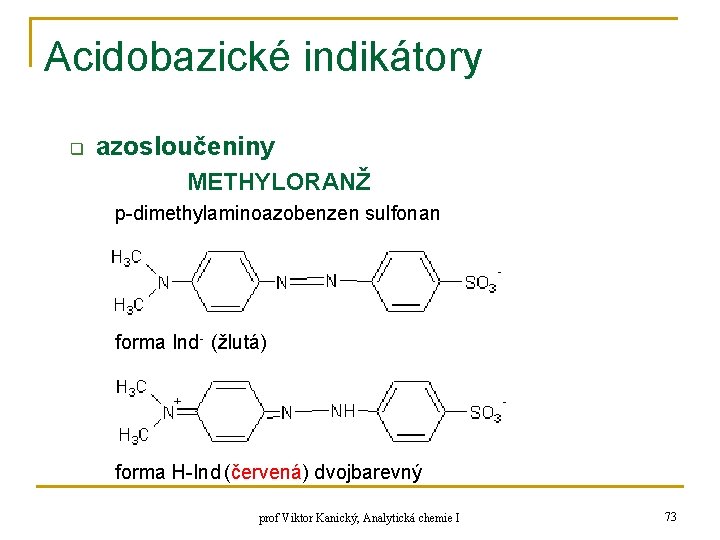
Acidobazické indikátory q azosloučeniny METHYLORANŽ p-dimethylaminoazobenzen sulfonan forma Ind- (žlutá) forma H-Ind (červená) dvojbarevný prof Viktor Kanický, Analytická chemie I 73

Acidobazické indikátory n dvoubarevný indikátor q funkční oblast indikátoru – interval p. H, ve kterém okem lze vnímat barevnou změnu: 10% druhé formy → ∆p. H = 2 indikátorová konstanta p. Kind indikátorový exponent n jednobarevný indikátor q q p. H postřehu zbarvení závisí na koncentraci červená u FFT ≈ 10 -6 M prof Viktor Kanický, Analytická chemie I 74

Acidobazické indikátory n faktory ovlivňující funkční oblast indikátorů q teplota → Kind, KV, p. H, p. OH q soli → aktiv. koeficient a vliv na zbarvení q q proteiny → vazba na Indikátor (změna konc. formy), (proteinová chyba, methyloranž) koloidy rozpouštědla → Kind prof Viktor Kanický, Analytická chemie I 75

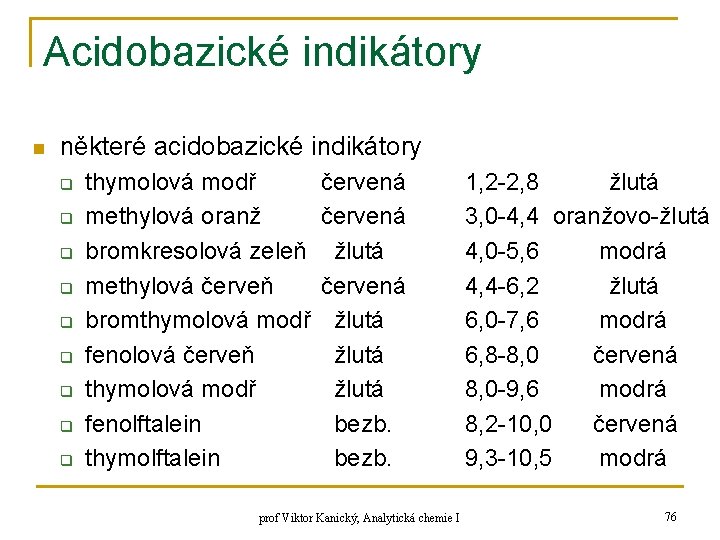
Acidobazické indikátory n některé acidobazické indikátory q q q q q thymolová modř methylová oranž bromkresolová zeleň methylová červeň bromthymolová modř fenolová červeň thymolová modř fenolftalein thymolftalein červená žlutá žlutá bezb. prof Viktor Kanický, Analytická chemie I 1, 2 -2, 8 žlutá 3, 0 -4, 4 oranžovo-žlutá 4, 0 -5, 6 modrá 4, 4 -6, 2 žlutá 6, 0 -7, 6 modrá 6, 8 -8, 0 červená 8, 0 -9, 6 modrá 8, 2 -10, 0 červená 9, 3 -10, 5 modrá 76

Titrační chyba n titrační chyba - barevný přechod indikátoru se odchyluje od teoretické hodnoty q příklad: Výpočet titr. chyby při titraci 100 ml 0, 1 M HCl roztokem 0, 1 M Na. OH, je-li ukončena při p. H=4, 75 p. T=7, q řešení: p. T=7, prof Viktor Kanický, Analytická chemie I 77

Titrační chyba q příklad: Titrace slabé kyseliny silnou zásadou p. T~p. H soli slabé kyseliny a silné zásady 100 ml 0, 1 M CH 3 COOH, 0, 2 M Na. OH, c. B~c(CH 3 COO-) n (Na. OH) V 0 + Vekv p. KV p. Ka log c. B prof Viktor Kanický, Analytická chemie I 78

Hendersonova rovnice pro neúplnou titraci n 1) neutralizace CH 3 COOH z 99 % n 2) neutralizace CH 3 COOH z 99, 9 % → při titraci na FFT 0, 1% neztitrováno (přechod FFT p. H 8 -9, 8) prof Viktor Kanický, Analytická chemie I 79

Metody n a) ALKALIMETRIE q q q základní látka pro standardizaci: HOx. 2 H 2 O, hydrogen ftalan draselný titrační činidlo: Na. OH, KOH stanovení n n n silné kyseliny (methyloranž ind. ) slabé kyseliny (při FFT ruší CO 2 → HCO 3 -) b) ACIDIMETRIE q q q základní látka pro standardizaci: Na 2 B 4 O 7. 10 H 2 O, Na 2 CO 3 titrační činidlo: HCl stanovení: slabé zásady retitrací prof Viktor Kanický, Analytická chemie I 80

Alkalimetrie n n n standardizace odměrného roztoku hydroxidu na kyselinu šťavelovou H 2 C 2 O 4. 2 H 2 O, M = 126, 07 g. mol-1 titrace na FFT → ruší CO 2 → proto před koncem titrace přídavek Ca. Cl 2 → HCl: uvolněná HCl se titruje na methyloranž prof Viktor Kanický, Analytická chemie I 81

Acidimetrie n n standardizace odměrného roztoku kyseliny na uhličitan sodný, M = 105, 99 g. mol-1 titrace na FFT (ruší CO 2 – odstranění povařením) n titrace na methyloranž (oranžová → červená) standardizace kyseliny na tetraboritan sodný M = 381, 37 g. mol-1, Na 2 B 4 O 7. 10 H 2 O n titrace na methyloranž n prof Viktor Kanický, Analytická chemie I 82

Příklady acidobazických titrací q q q n stanovení slabých kyselin stanovení vícesytných kyselin stanovení slabých zásad stanovení slabých kyselin n Na. OH – odměrný roztok přesnost stanovení je ovlivněna přítomností CO 2, tj. uhličitanu v odměrném roztoku hydroxidu uvolněná H 2 CO 3 se převádí na hydrogenuhličitan (rozmezí p. H = 4 -8, 5) dalším přidáváním Na. OH → ovlivnění barevného přechodu indikátoru prof Viktor Kanický, Analytická chemie I 83

Stanovení slabých kyselin q kyselina boritá H 3 BO 3, K = 10 -10 n n nelze titrovat přímo přídavkem manitu nebo glycerinu → komplexní kyselina manitoboritá (glyceroboritá) – 1000 x silnější → titrace na fenolftalein polyol kys. glycerol(manito)boritá prof Viktor Kanický, Analytická chemie I 84

Stanovení slabých kyselin q aminokyseliny n n n amfoterní struktura +NH 3. R. COOkonkurenční vliv bazické aminoskupiny (silná baze) přídavek formaldehydu → SCHIFFOVA BÁZE slabá baze → pak se sníží o 3 až 4 jednotky → titrace Na. OH na FFT: například kyselina aminooctová prof Viktor Kanický, Analytická chemie I 85

Stanovení slabých kyselin q kyselina octová n titrace Na. OH na FFT prof Viktor Kanický, Analytická chemie I 86

Stanovení vícesytných kyselin q kyselina fosforečná H 3 PO 4 - trojsytná n 1) q q q titrace na methyloranž srovnávací roztok 0, 05 M Na. H 2 PO 4 výsledky nejsou ovlivněny CO 2 prof Viktor Kanický, Analytická chemie I 87

Stanovení vícesytných kyselin n 2) q q titrace na fenolftalein přídavek Na. Cl prof Viktor Kanický, Analytická chemie I 88

Stanovení slabých zásad n nepřímá titrace (retitrace) n n q analyzovaná látka reaguje s přebytkem (odměrným) činidla (→ kvantitativní průběh reakce) nadbytek se stanoví titrací odměrným roztokem stanovení amoniaku M (NH 3) = 17, 03 g. mol-1 n n k odměrnému nadbytku 0, 1 M HCl se přidá vzorek obsahující amoniak + methyloranž přebytek HCl se určí retitrací 0, 1 M Na. OH prof Viktor Kanický, Analytická chemie I 89

Stanovení slabých zásad q stanovení uhličitanu (sodného) n titrace do 2. stupně → 2 inflexní body q q n n 1. bod p. H = 8, 46 1 mol kyseliny na 1 mol uhličitanu 2. bod p. H = 3, 96 rozt. obsahuje H 2 CO 3 ekvival. uhličitanu do 1. stupně – fenolftalein do 2. stupně – methyloranž – nejčastěji prof Viktor Kanický, Analytická chemie I 90

Stanovení slabých zásad n nerozpustné uhličitany (ve vodě) q q uhličitan rozpustný v kyselině (odměrný roztok) nadbytek kyseliny se retitruje odměrným roztokem hydroxidu vzorek rozpustný v přebytku HCl, methyloranž, retitrace Na. OH (červená → cibulově oranžová) výpočet: %CO 2, molární hmotnost uhličitanu → lze určit, o který uhličitan (Ca, Ba, Sr, Mg, Pb) se jedná prof Viktor Kanický, Analytická chemie I 91

Stanovení slabých zásad q stanovení alkalického hydroxidu vedle uhličitanu WINKLEROVA metoda n přímá titrace alk. hydroxidu není možná vedle uhličitanu – v rozmezí 1 jednotky p. H → 1) celková alkalita v jedné části vzorku titrací na methyloranž: prof Viktor Kanický, Analytická chemie I 92

Stanovení slabých zásad 2) ve druhé části vzorku se rozpustný uhličitan vysráží hydroxid se titruje na FFT, barevná změna dříve, než se začne rozpouštět Ba. CO 3 prof Viktor Kanický, Analytická chemie I 93

Stanovení slabých zásad q stanovení dusíku v org. látkách dle KJELDAHLA 1) mineralizace org. látek: přídavek katalyzátor: zvýšení bodu varu aminy, aminokyseliny, bílkoviny cca 30 min nitro-, nitroso-, diazosl. – nejdříve redukce na aminosloučeniny prof Viktor Kanický, Analytická chemie I 94

Stanovení slabých zásad 2) uvolnění NH 3 destilací s Na. OH (s vodní parou) do předlohy s nadbytkem stand. kyseliny (HCl) nespotřebovaná kyselina retitrací, Na. OH prof Viktor Kanický, Analytická chemie I 95

Srážecí titrace n n podmínky: rychlost, stechiometrie, kvantitativní průběh reakce RETITRACE (zpětná titrace): nadbytek srážecího odměrného roztoku a stanovení jeho nezreagovaného podílu titrací ARGENTOMETRIE q standardizace: TITRAČNÍ KŘIVKY q bez uvážení podílu 1) před bodem ekvivalence cx, c. M – původní c před titrací 2) v bodě ekvivalence 3) za bodem ekvivalence prof Viktor Kanický, Analytická chemie I 96

Srážecí titrace q bez uvážení podílu 1) zanedbání → 2) 3) prof Viktor Kanický, Analytická chemie I 97

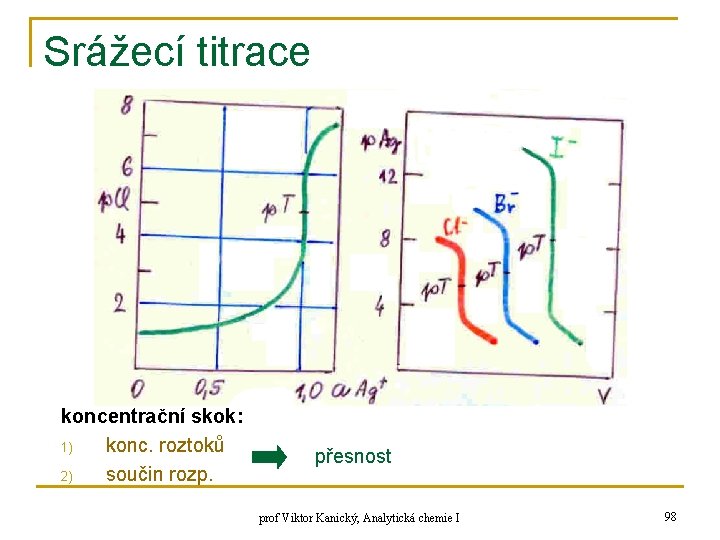
Srážecí titrace koncentrační skok: 1) konc. roztoků 2) součin rozp. přesnost prof Viktor Kanický, Analytická chemie I 98

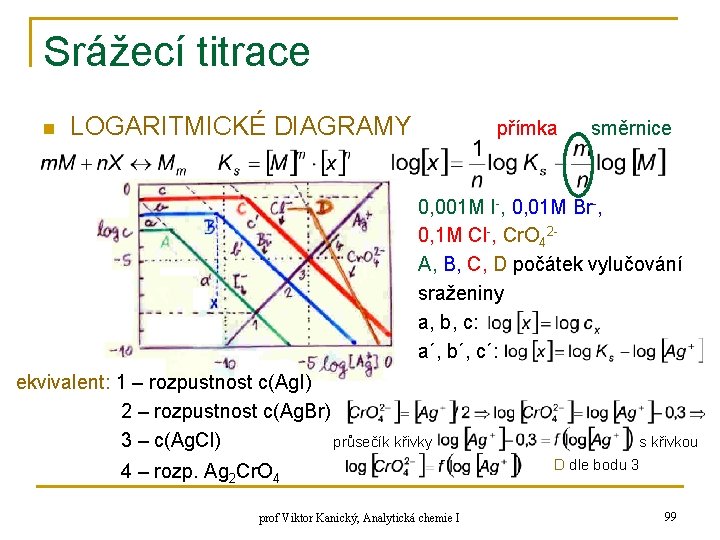
Srážecí titrace n LOGARITMICKÉ DIAGRAMY přímka směrnice 0, 001 M I-, 0, 01 M Br-, 0, 1 M Cl-, Cr. O 42 A, B, C, D počátek vylučování sraženiny a, b, c: a´, b´, c´: ekvivalent: 1 – rozpustnost c(Ag. I) 2 – rozpustnost c(Ag. Br) průsečík křivky 3 – c(Ag. Cl) 4 – rozp. Ag 2 Cr. O 4 prof Viktor Kanický, Analytická chemie I s křivkou D dle bodu 3 99

Srážecí titrace n INDIKÁTORY PRO SRÁŽECÍ TITRACE q 1) MOHROVA METODA princip: n n nejdříve vzniká Ag. X, v bodě ekv. dosáhne při vhodné koncentraci Cr. O 42 - hodnoty tak, aby bylo dosaženo KS(Ag 2 Cr. O 4) příklad: stanovení Ag. Cl prakticky však 5. 10 -3 M – nevadí pak žl. zbarvení Ag+, Cl-, Brp. H 6 -10 x HCr. O 4 - Ag 2 O prof Viktor Kanický, Analytická chemie I 100

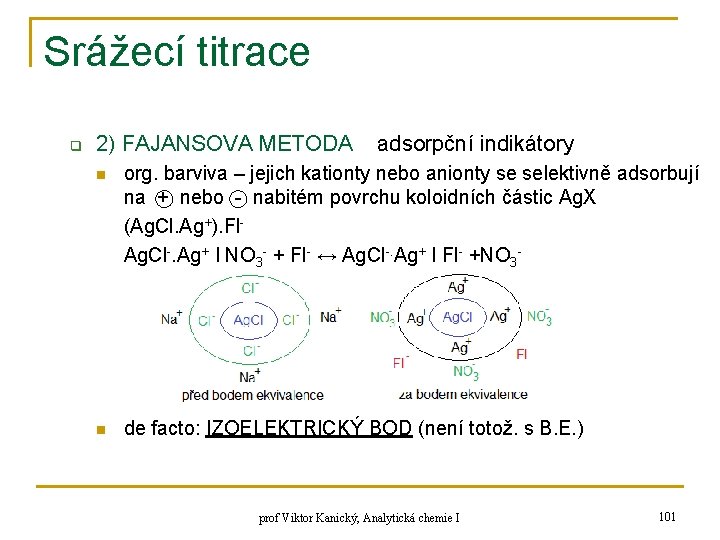
Srážecí titrace q 2) FAJANSOVA METODA adsorpční indikátory n org. barviva – jejich kationty nebo anionty se selektivně adsorbují na + nebo - nabitém povrchu koloidních částic Ag. X (Ag. Cl. Ag+). Fl. Ag. Cl-. Ag+ ǀ NO 3 - + Fl- ↔ Ag. Cl-. Ag+ ǀ Fl- +NO 3 - n de facto: IZOELEKTRICKÝ BOD (není totož. s B. E. ) prof Viktor Kanický, Analytická chemie I 101

Srážecí titrace n n ADSORPČNÍ INDIKÁTOR – jeho ionty adsorbované na sraženinu mají jiné zbarvení než v roztoku (vliv polarizace) vliv podmínek: q q 1) p. H – dostatečná disociace (Fluorescein p. H 6, 5 -10, eosin p. H 1 -10) 2) ochranný koloid (např. dextrin) X koagulace zbarvení indikátor v roztoku adsorbovaný stanovení 1) fluorescein žlutozelený růžovofialový 2) tetrabromfluorescein oranžový fialový Cl-, Br-, SCN-, Fe. II(CN)6 Br-, I-, SCN- prof Viktor Kanický, Analytická chemie I 102

Srážecí titrace q 3) VOLHARDOVA METODA n n indikátor Fe 3+ → Fe. SCN 2+ Fe. III(NH 4)(SO 4)2 titrace iontů Ag+ odměrným roztokem SCNsraženina Ag. SCN a v ekvivalenci červený rozpust. komplex [Fe(SCN)]2+ q q stanovení Ag ve slitinách (ruší Hg 2+, Cu 2+ - málo rozp. SCN-) (Co 2+, Ni 2+ ruší zbarvením rozt. ) zpětná titrace (RETITRACE): k roztoku Cl- nebo Br-, I- se přidá nadbytek odměrného roztoku Ag. NO 3 a nezreag. Ag+ se titruje odměrným roztokem NH 4 SCN prof Viktor Kanický, Analytická chemie I 103

Srážecí titrace q 4) GAY-LUSSACOVA ZÁKALOVÁ METODA n titrace iontů Ag+ odměrným roztokem Na. Cl n před b. ekvivalence – zakalený roztok – koloidní disperze Ag. Cl. Ag+ ǀ NO 3 n v izoelektrickém bodě (blízko b. ekv. ) – sraženina koaguluje – nad ní čirý roztok n přidáním kapky roztoku Na. Cl zákal → pokračovat čirý → ztitrovat prof Viktor Kanický, Analytická chemie I 104

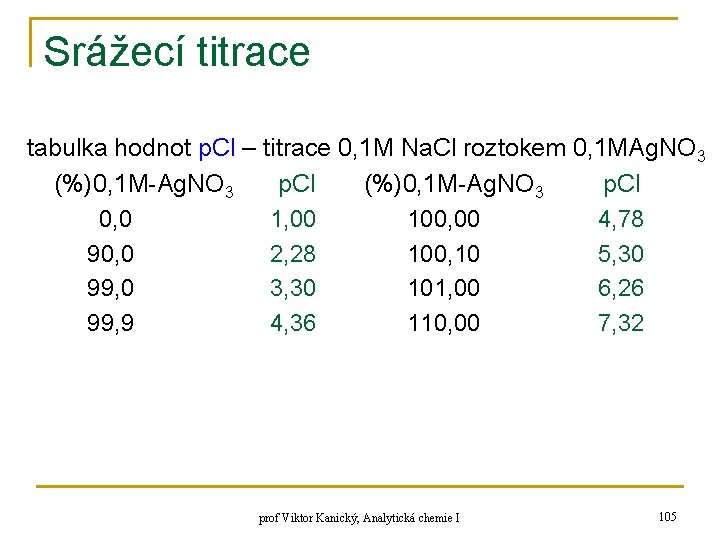
Srážecí titrace tabulka hodnot p. Cl – titrace 0, 1 M Na. Cl roztokem 0, 1 MAg. NO 3 (%)0, 1 M-Ag. NO 3 p. Cl 0, 0 1, 00 100, 00 4, 78 90, 0 2, 28 100, 10 5, 30 99, 0 3, 30 101, 00 6, 26 99, 9 4, 36 110, 00 7, 32 prof Viktor Kanický, Analytická chemie I 105

Komplexometrické (Chelatometrické) titrace n centrální ion – ligand koordinační vazba prof Viktor Kanický, Analytická chemie I 106

Komplexometrické (Chelatometrické) titrace n n koordinační číslo: 1 -12, obvykle 6, 4, 2 polydonorové ligandy → cyklické komplexy CHELÁTY χ η λ ή = CHELÉ = KLEPETO n stupňovitá tvorba komplexů n termodynamická stálost – konstanta stability kinetická netečnost – rychlost ustavení rovnováhy labilní komplexy – ihned inertní komplexy - pomalu n prof Viktor Kanický, Analytická chemie I 107

Komplexotvorné vlastnosti kovů n SCHWARZENBACH q 1) kationty se 2 nebo 8 elektrony Li+, Na+, K+, Rb+, Cs+, Be 2+, Mg 2+, Ca 2+, Sr 2+, Ba 2+, B 3+, Al 3+ A) stabilní el. konfig. , elektrony ligandů nevstupují do el. hladin kationtů → převažují elstat. interakce B) termodynamicky málo stabilní – rovnováha směrem k disociaci a) stabilita klesá v řadě (difosforečnany, polyfosforečnany, aminopolykarb. kys. ) b) (Mg a Ca cheláty) c) stabilita halogenokomplexů s ionty kovů této skupiny KLESÁ (s rostoucím poloměrem ligandu) prof Viktor Kanický, Analytická chemie I 108

Komplexotvorné vlastnosti kovů d) stálé komplexy: M 3+ s malými ligandy: (preferuje se tvorba akvokomplexů) BF 4 -, Al. F 63 -, Al. Cl 4 -, Al(OH)4 e) neposkytují amin- a kyano- komplexy q 2) kationty s 18 elektrony 2 A) Cu+, Ag+, Au+ Zn 2+, Cd 2+, Hg 2+ (snadná deformavatelnost v poli ligandů) a) tvoří se koordinační vazba b) stabilita komplexů je tím větší, čím menší je rozdíl elektronegativit centr. iontu a ligandu → Cu+, Ag+, Au+ > Zn 2+, Cd 2+, Hg 2+ elektronegativnější komplexotvorná schopnost ligandů naopak klesá s rostoucí elektronegativitou: prof Viktor Kanický, Analytická chemie I 109

Komplexotvorné vlastnosti kovů 2 B) Ga 3+, In 3+, Tl 3+ Ge 4+, Sn 4+, Pb 4+ odolávají vlivu ligandů, přednostně OH- (spíše jako 1)) 2 C) (18+2) elektrony Tl+, Pb 2+, Bi 3+ přechod mezi 2 A, 2 B q 3) neúplně obsazené d-orbitaly A) minimální atomové objemy B) velké hodnoty iontových potenciálů prof Viktor Kanický, Analytická chemie I 110

Komplexotvorné vlastnosti kovů C) velká deformabilita neúplných d-orbitalů v poli ligandů q podporuje vznik koordinačních vazeb q nejstabilnější komplexní sloučeniny q komplexy kineticky inertní n nejlépe známá 1. řada přechodných prvků: z nich Mn 2+, Fe 2+, Co 2+, Ni 2+, Cu 2+ stabilita komplexů Co 2+, Ni 2+, Cu 2+: stabilita komplexů: C > N > O > F (elektronegativita) q je-li donorem O, N, S, stoupá stabilita komplexu téhož ligandu s různými kationty: Ca 2+ < Mn 2+ < Fe 2+ < Co 2+ < Ni 2+ ≈ Cu 2+ > Zn 2+ prof Viktor Kanický, Analytická chemie I 111

Ligandy … organické látky s volným elektronovým párem na S, N, O n analyticky zajímavé komplexy q vlastnosti: n n TERMODYNAMICKY STABILNÍ KINETICKY LABILNÍ rychle reagují CN- >> … z anorganických jednodonorových ligandů organické polydonorové ligandy: q aminopolykarboxylové kyseliny: n nitrilotrioctová, ethylendiamintetraoctová, diamincyklohexan tetrakarboxylová n jsou to: tetradonorová až hexadonorová činidla – s kovovými ionty – stále cyklické komplexy (pětičlenné cykly) 1: 1 M+ až M 4+ prof Viktor Kanický, Analytická chemie I 112

Komplexní sloučeniny – analytický význam n komplexace → změna vlastností iontu q q q náboj, zbarvení, reaktivnost citlivější a selektivnější důkaz snazší oddělení zbarvené k. → kvalita, spektrofotometrie stálé rozpustné k. → maskování, odměrné stanovení málo rozpustné k. → dělení, gravimetrie prof Viktor Kanický, Analytická chemie I 113

Komplexní sloučeniny – analytický význam KOMPLEXNÍ KATIONTY 1) kationty: ANIONTY NEELEKTROLYTY akvakomplexy amminkomplexy smíšené komplexy nitrosokomplexy thiokyanátové komplexy prof Viktor Kanický, Analytická chemie I důkaz dusitanů 114

Komplexní sloučeniny – analytický význam 2) anionty: halogenokomlexy (chloro- a bromo- komplexy) kyanokomplexy thiokyanatokomplexy thiosulfátokomplexy hydroxokomplexy thiokomplexy polykyseliny: anionty kyslíkatých kyselin = komplexní sloučeniny prof Viktor Kanický, Analytická chemie I 115
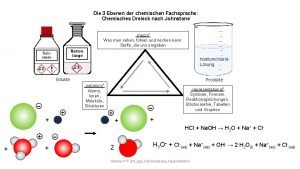
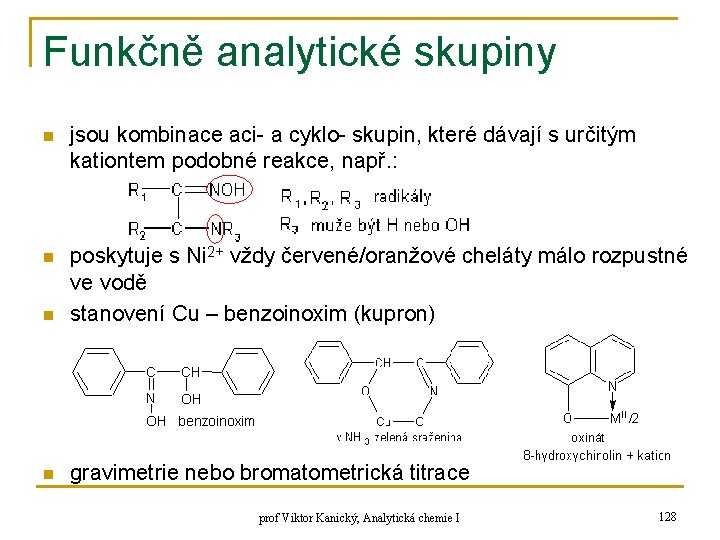
![Komplexní sloučeniny analytický význam SO 42 tetraoxosíran n S 2 O 32 monothiotrioxosíran Komplexní sloučeniny – analytický význam [SO 4]2 tetraoxosíran n [S 2 O 3]2 monothiotrioxosíran](https://slidetodoc.com/presentation_image/2b5b9349ca10d65daf6b10a5d422603e/image-116.jpg)
Komplexní sloučeniny – analytický význam [SO 4]2 tetraoxosíran n [S 2 O 3]2 monothiotrioxosíran thiosíran isopolykyseliny: náhrada O 2 - aniontem téže kyseliny [S 2 O 7]2 sulfatotrioxosíran [Cr 2 O 7]2 chromatotrioxochroman prof Viktor Kanický, Analytická chemie I 116

Komplexní sloučeniny – analytický význam n heteropolykyseliny: od kys. fosforečné, arseničné, křemičité nahrazení kyslíkových aniontů anionty Mo 3 O 102(molybdenan amonný) kyseliny tetrakis-trimolybdato fosforečná důkaz, dělení, stanovení P žlutá krystalická sraženina 3) neelektrolyty prof Viktor Kanický, Analytická chemie I 117

Cheláty n cyklické komplexy (kationty, anionty, neelektrolyty) q q n n velmi výrazná změna vlastností (barva, reaktivita) stabilnější odpovídající necyklické polydonorové komplexy anorganické ligandy prof Viktor Kanický, Analytická chemie I 118

Cheláty n anorganické ligandy q q q komplexní kationty v zásaditých solích vícejaderný komplexní kation – čtyřčlenné kruhy narůstání řetězců = stárnutí hydroxidů → pokles rozpustnosti, podobně sulfidy (stárnutí sulfidů) prof Viktor Kanický, Analytická chemie I 119
Cheláty n organické ligandy q q q org. molekula se dvěma reaktivními skupinami (vhodně umístěné) aciskupiny n kyselé (nahraditelné H+) cykloskupiny n zásadité (volný elektronový pár) prof Viktor Kanický, Analytická chemie I 120

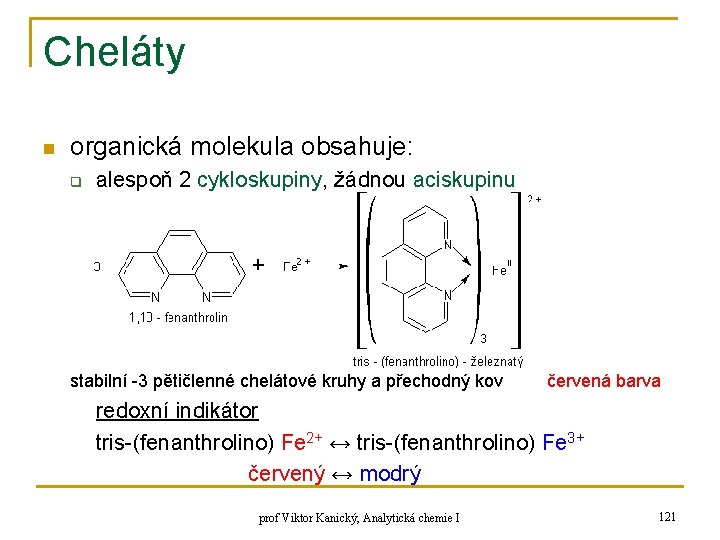
Cheláty n organická molekula obsahuje: q alespoň 2 cykloskupiny, žádnou aciskupinu stabilní -3 pětičlenné chelátové kruhy a přechodný kov červená barva redoxní indikátor tris-(fenanthrolino) Fe 2+ ↔ tris-(fenanthrolino) Fe 3+ červený ↔ modrý prof Viktor Kanický, Analytická chemie I 121

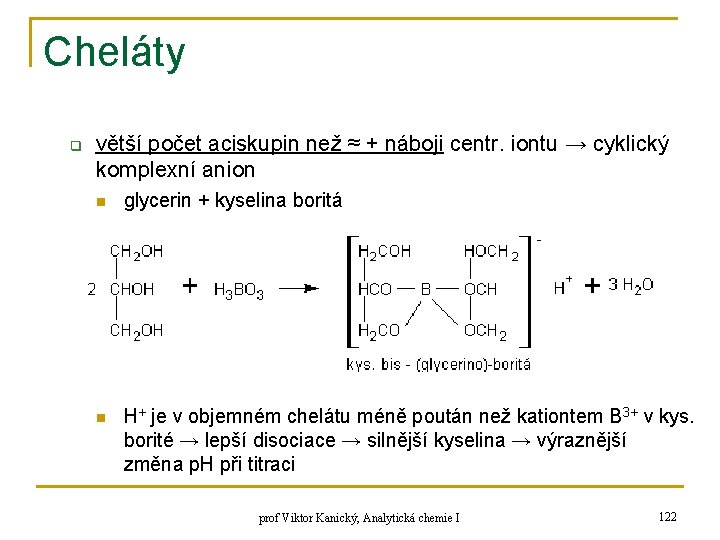
Cheláty q větší počet aciskupin než ≈ + náboji centr. iontu → cyklický komplexní anion n glycerin + kyselina boritá n H+ je v objemném chelátu méně poután než kationtem B 3+ v kys. borité → lepší disociace → silnější kyselina → výraznější změna p. H při titraci prof Viktor Kanický, Analytická chemie I 122

Aminopolykarboxylové kyseliny n n cykloskupiny (-N= a =CO) aciskupiny (-COOH) q s většinou kationů stálé a ve vodě rozpustné komplexy ethylendiamintetraocotvá kyselina H 4 Y, 4 aciskupiny – COOH, 2 cykloskupiny –N=, disodná sůl Na 2 H 2 Y. 2 H 2 O – lépe rozp. prof Viktor Kanický, Analytická chemie I 123

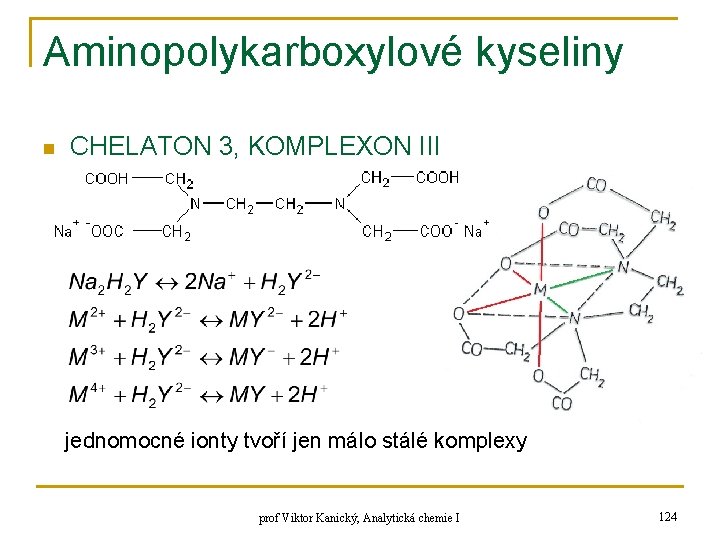
Aminopolykarboxylové kyseliny n CHELATON 3, KOMPLEXON III jednomocné ionty tvoří jen málo stálé komplexy prof Viktor Kanický, Analytická chemie I 124

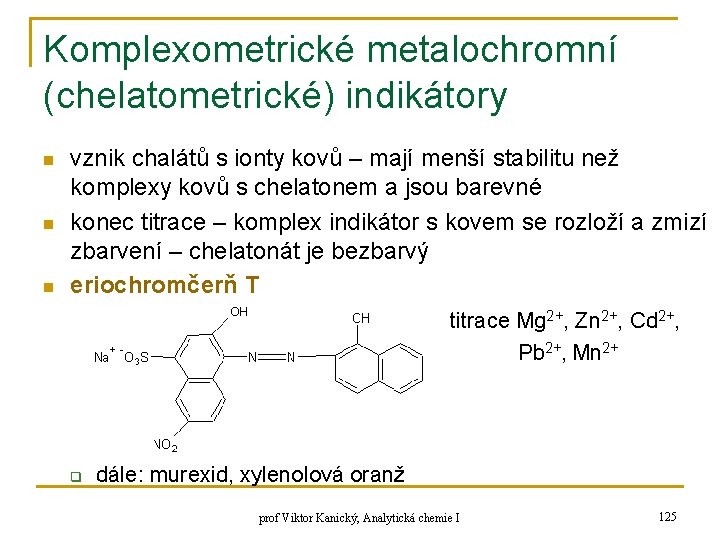
Komplexometrické metalochromní (chelatometrické) indikátory n n n vznik chalátů s ionty kovů – mají menší stabilitu než komplexy kovů s chelatonem a jsou barevné konec titrace – komplex indikátor s kovem se rozloží a zmizí zbarvení – chelatonát je bezbarvý eriochromčerň T titrace Mg 2+, Zn 2+, Cd 2+, Pb 2+, Mn 2+ q dále: murexid, xylenolová oranž prof Viktor Kanický, Analytická chemie I 125

Cyklické komplexní neelektrolyty vnitřně komplexní sloučeniny výrazně zbarvené, nerozpustné ve vodě, rozp. v org. obsahují současně aci- a cyklo- skupinu selektivní reakce n q q q n diacetyldioxim = ČUGAJEVOVO ČINIDLO bis(diacetyldioximo)-nikelnatý chelát – růžová sraženina žlutá sraženina s Pd. II prof Viktor Kanický, Analytická chemie I 126

Neutrální cheláty q n s diacetyldioximem a další α-nitroso-β-naftol s Co. III v CH 3 COOH → červenohnědá sraženina ILINSKÉHO ČINIDLO n tris-(alizarino)-hlinitý chelát vybarvování hydroxidů (laků) „červený lak“ Al. III, Mg. II prof Viktor Kanický, Analytická chemie I 127

Funkčně analytické skupiny n jsou kombinace aci- a cyklo- skupin, které dávají s určitým kationtem podobné reakce, např. : n n poskytuje s Ni 2+ vždy červené/oranžové cheláty málo rozpustné ve vodě stanovení Cu – benzoinoxim (kupron) n gravimetrie nebo bromatometrická titrace prof Viktor Kanický, Analytická chemie I 128

Metalochromní indikátory v roztoku přítomno q q q n n před titrací po přidání indikátoru po přidání chelatonu H 2 Y 2 - v průběhu titrace těsně před b. ekvivalence v bodě ekvivalence eriochromčerň T xylenolová oranž fluorexon murexid prof Viktor Kanický, Analytická chemie I 129

Metalochromní indikátory n n eriochromčerň T q červená modrá žlutozelená při p. H 7 -11 je roztok modrý, kovy zde tvoří červené komplexy q modré červené v bodě ekvivalence xylenolová oranž (sulfoftaleinové barvivo) H 5 Ind q n p. H 1 -6 žlutý, cheláty kovů červené, fialové Bi, Th, p. H 1 -3, Hg, Cd, Zn, Pb, p. H 5 -6 fluorexon (na bázi fluoresceinu) H 6 Ind q n 10 -5, 10 -6 M roztok Mg 2+ Ca 2+ v přítomnosti Mg 2+ (nadbytek) žlutozelená fluorescence → světle růžová (ekv. ) murexid (amonná sůl kys. purpurové) q Ca při p. H 10 červená → modrofialová (ekv. ) prof Viktor Kanický, Analytická chemie I 130

Chelatometrické titrace q q q n disodná sůl EDTA – chelaton 3 p. K 1 = 1, 99 p. K 2 = 2, 67 p. K 3 = 6, 16 p. K 4 = 10, 26 s kationty tvoří málo disociované, stabilní, rozpustné komplexy podmíněné konstanty stability, závislost na p. H TITRAČNÍ KŘIVKY koeficienty vedlejších reakcí závislost na konst. stability prof Viktor Kanický, Analytická chemie I 131

Chelatometrické titrace v ekvivalenci platí n průběh titrace: q q vizuálně (metalochromní indikátor) potenciometricky (elektrody) prof Viktor Kanický, Analytická chemie I 132

Chelatometrické titrace n standardizace odměrného roztoku 0, 05 M chelatonu 3 q q n Pb. Cl 2, urotropin (tlumič), xylenolová oranž fialově červená → citrónově žlutá 1 cm 3 0, 05 M chelatonu 3 ≈ 0, 05 mmol H 2 Y 2 - ≈ 0, 05 mmol Pb ≈ 13, 91 mg Pb stanovení Mg 2+ q q 1 cm 3 0, 05 M chelatonu 3 ≈ 0, 05 mmol H 2 Y 2 - ≈ 1, 21 mg Mg 2+ vzorek (Mg 2+) + tlumič NH 4 Cl/NH 4 OH + eriochromčerň T vínově červená → modrá prof Viktor Kanický, Analytická chemie I 133

Chelatometrické titrace n stanovení Ca 2+ a Mg 2+ vedle sebe v jednom vzorku q princip: n n 1. část vzorku – titruje se selektivně Ca 2+ ne fluorexon: -zelená → růžová, 2 M KOH 2. část vzorku – Ca + Mg na eriochromčerň žluto 1. titrace Ca: fluorexon, 2 M KOH 2. titrace Ca + Mg: eriochromčerň, NH 4 Cl/NH 4 OH obsah Mg se počítá z rozdílu spotřeb prof Viktor Kanický, Analytická chemie I 134
 Analza
Analza Analuza
Analuza Objective of swot analysis
Objective of swot analysis Korelan
Korelan Analza
Analza Analza
Analza Entitno-relačný model databázy
Entitno-relačný model databázy Analza
Analza Analza
Analza Ssreg
Ssreg Analuza
Analuza Analzy
Analzy Swot analza
Swot analza Analza
Analza Swot analisys
Swot analisys Post hoc definition
Post hoc definition Výnosy z variabilního vstupu
Výnosy z variabilního vstupu Analza
Analza Analza
Analza Swot analza
Swot analza Analza
Analza Swot analza
Swot analza Swot analza
Swot analza Analza
Analza Analza
Analza Analza
Analza Novodob 500
Novodob 500 Analza
Analza Gnomus hartmann
Gnomus hartmann Viktor mizo wikipedia
Viktor mizo wikipedia Viktor bergen
Viktor bergen Viktor binzberger
Viktor binzberger Viktor dyk literární směr
Viktor dyk literární směr Powerpoint viktor frankl
Powerpoint viktor frankl Interpretace
Interpretace Cofactor matrix matlab
Cofactor matrix matlab Zsiday viktor
Zsiday viktor Viktor emil frankl
Viktor emil frankl Advanced persistent threat assessment
Advanced persistent threat assessment Rhoda kellogg wikipedia
Rhoda kellogg wikipedia Geng viktor
Geng viktor Viktor balema
Viktor balema Viktor pestov
Viktor pestov Viktor haase
Viktor haase Viktor mikhaylovich
Viktor mikhaylovich Viktor öwall
Viktor öwall Viktor frankl gestalt
Viktor frankl gestalt Viktor binzberger
Viktor binzberger Viktor staroverov
Viktor staroverov Jozef jurko karikaturista
Jozef jurko karikaturista Viktor maier
Viktor maier Viktor marko
Viktor marko Dr viktor christiansen
Dr viktor christiansen Arany viktor
Arany viktor Viktor arhipov
Viktor arhipov Arany viktor
Arany viktor Viktor frankl teori
Viktor frankl teori Viktor pocajt
Viktor pocajt Teori viktor frankl
Teori viktor frankl Viktor dyk současníci
Viktor dyk současníci Metodo descriptivo en psicologia
Metodo descriptivo en psicologia Krysař hlavní myšlenka
Krysař hlavní myšlenka Opel viktor
Opel viktor Acs functions
Acs functions Dr viktor christiansen
Dr viktor christiansen Sucha chemie
Sucha chemie Chemie
Chemie Chemie
Chemie Spiegelbeeldisomerie
Spiegelbeeldisomerie Rony grooten
Rony grooten Fehlvorstellungen chemie
Fehlvorstellungen chemie Ppp chemie
Ppp chemie Kmn chemie
Kmn chemie Impuls chemie 4
Impuls chemie 4 Chemie
Chemie Freie enthalpie und gleichgewichtskonstante
Freie enthalpie und gleichgewichtskonstante Organická chemie
Organická chemie Sbr6 chemie
Sbr6 chemie Impuls chemie
Impuls chemie Ilias hhu
Ilias hhu Vis vitalis chemie
Vis vitalis chemie Burgerlijk ingenieur chemie
Burgerlijk ingenieur chemie Predchodkyňa chémie
Predchodkyňa chémie Jodometrie
Jodometrie Skelettschreibweise chemie
Skelettschreibweise chemie Koncovky chemie
Koncovky chemie Atoomeconomie
Atoomeconomie Chemie
Chemie Katedra fyziky chemie a odborného vzdělávání
Katedra fyziky chemie a odborného vzdělávání Chemie
Chemie Stöchiometrische wertigkeit
Stöchiometrische wertigkeit Impuls chemie 4 lösungen pdf
Impuls chemie 4 lösungen pdf Chemie teilgebiete
Chemie teilgebiete Hochofen beschriftung
Hochofen beschriftung Chemie einfach alles
Chemie einfach alles Soli koncovky
Soli koncovky Lnky
Lnky Concept cartoon chemie
Concept cartoon chemie Impuls chemie
Impuls chemie Mechanismus
Mechanismus Prinzip von le chatelier und braun
Prinzip von le chatelier und braun Pulsar chemie
Pulsar chemie Anionische tenside definition
Anionische tenside definition Podobory chemie
Podobory chemie Soli chemie 9. ročník
Soli chemie 9. ročník Chemie porn
Chemie porn Plyn hexan
Plyn hexan Boeken over kwantumchemie en theoretische chemie
Boeken over kwantumchemie en theoretische chemie Ddt chemie
Ddt chemie Flourmolekül
Flourmolekül Substrat chemie
Substrat chemie Chemie
Chemie Methan oxidationszahl
Methan oxidationszahl Donauchem pischelsdorf
Donauchem pischelsdorf Dobrý sluha ale zlý pán chemie
Dobrý sluha ale zlý pán chemie Impuls chemie
Impuls chemie Schilling chemie
Schilling chemie Chemie für mediziner
Chemie für mediziner Chemie k
Chemie k Danke für eure aufmerksamkeit chemie
Danke für eure aufmerksamkeit chemie Gefahrensymbole physik
Gefahrensymbole physik Chemie
Chemie Sattelpunkt
Sattelpunkt Nico rutten
Nico rutten Scheikunde chemie overal vwo 4
Scheikunde chemie overal vwo 4 Krasové jevy chemie
Krasové jevy chemie Kanonieken
Kanonieken Chemie
Chemie Obory chemie
Obory chemie Naturfasern übersicht
Naturfasern übersicht Impuls chemie
Impuls chemie Klinische chemie
Klinische chemie Dreieck chemie
Dreieck chemie Chemie
Chemie Impuls chemie
Impuls chemie