KWANTUMCHEMIE Wat kan het nieuwe natuurkunde programma voor









































- Slides: 50

KWANTUMCHEMIE Wat kan het nieuwe natuurkunde programma voor het vak scheikunde betekenen?

TWEE FUNDAMENTELE VRAGEN UIT DE CHEMIE Waarom verlopen reacties? Hoe ontstaat binding, wat houdt de boel bij elkaar? 2

NIET IN DE SYLLABUS Zijn het wel relevante vragen voor bovenbouw VWO? Nee: de antwoorden zijn te complex, te wiskundig. Hoort thuis op de universiteit. Een leerling kan er niets mee, hooguit wat reproductie. Groot kloof tussen de theoretische grondslagen en toepassingen van een theorie. 3

WEL AAN DE ORDE STELLEN Ja, een zichzelf respecterende wetenschap/ schoolvak moet zijn fundament op orde hebben. Zeker op het VWO. Ja, je mag leerlingen niet afschepen met modellen die niet deugen. Scheikunde en natuurkunde moeten coherente modellen leveren, aansluiten . 4

MOTIVATIE PRESENTATIE H-H • Chemische binding is een centraal begrip in chemie onderwijs • Leerlingen leren hoofdzakelijk, regels hoe te tekenen, terminilogie, regels voor gebruik. • We zoeken een verklaring voor binding die aansluit bij de kwantummechanica uit het natuurkunde programma. 5

HISTORISCH: 1850 Frankland Valentiestreepjes 6

1850 FRANKLAND VALENTIESTREEPJES Geen idee wat de boel bij elkaar houdt. 7

1897 THOMSON ONTDEKT HET ELEKTRON Plumpudding/ krentenbolmodel 8

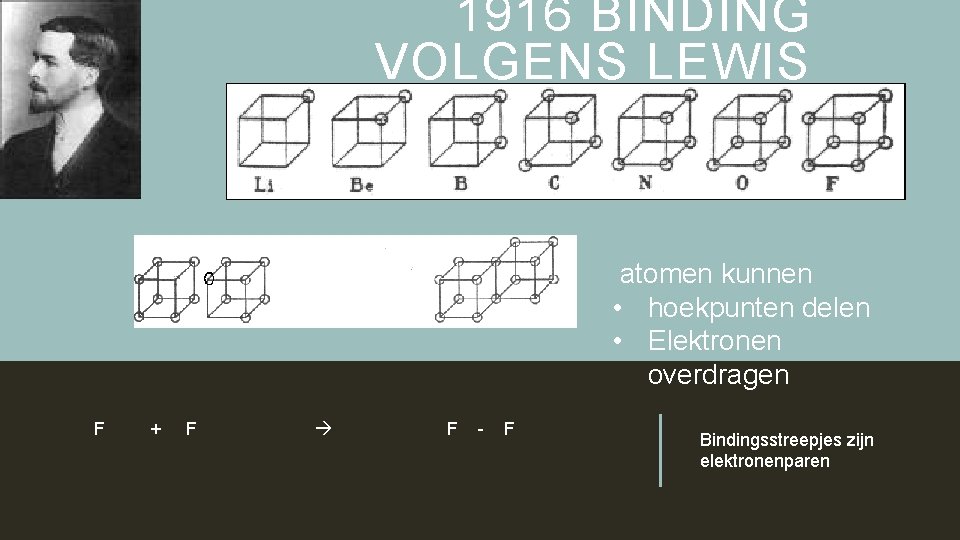
GILBERT NEWTON LEWIS 1902: CUBICAL ATOM Elektronen zijn gerangschikt op de acht hoekpunten van concentrische kubussen Lewis legt verband tussen onbezette hoekpunten en • Elektrovalenties: opvullen/ leegmaken buitenste kubus • Covalentie: gemeenschappelijke elektronen Lewis publiceert zijn cubical atom pas in 1916, 15 jaar later, vlak voor hij naar Frankrijk vertrekt (WOI)

1916 BINDING VOLGENS LEWIS atomen kunnen • hoekpunten delen • Elektronen overdragen F + F F - F Bindingsstreepjes zijn elektronenparen

RUTHERFORD IN 1911 Plumpudding model van Thomson voldoet niet meer, want de positieve lading is geconcentreerd in zeer kleine kern. Atoom is vooral leeg Nieuw probleem: Wat houdt de boel uit elkaar? 11

BIJ RUTHERFORD ZWERMEN ELEKTRONEN ROND KERN. Zo’n atoom kan klassiek helemaal niet ! Een elektron dat in een cirkelbaan beweegt versneld (en is derhalve een oscillerende dipool) en zal volgends de klassieke natuurkunde EM-straling uitzenden en dus energie verliezen. Uiteindelijk zal het elektron op de kern storten.

Drie artikelen, na elkaar gepubliceerd: 1 Het waterstofatoom 2 Atomen met dan een elektron 3 Chemische Binding in moleculen

1913 BOHR’S EERSTE ARTIKEL: Het elektron in het waterstofatoom kan alleen in bepaalde banen ronddraaien Kwantisatie van het hoekmoment: L = m. v. r = n. h/2 pi met n= 1, 2, 3 , . . h constante van Planck. • Verklaart de spectraallijnen. • “Verklaart” waarom elektron niet op de kern stort ( n > 0 )

1913 BOHR’S TWEEDE ARTIKEL : ATOMEN MET MEERDERE ELEKTRONEN. • weer geldt kwantisatie hoekmoment. • de elektronen draaien in cirkels rond de kern in eenzelfde vlak • Atoom is dus plat. Poging periodiek systeem te verklaren: Geen succes

1913 BOHR’S DERDE ARTIKEL: CHEMISCHE BINDING. Berekenen bindingsenergie, valenties: geen succes

1916 LEWIS REAGEERT OP BOHR Lewis komt met zijn statische model en wijst nadrukkelijk Bohr’s model af.

1916 LEWIS TEGEN BOHR Bohr’s platte model met rondcirkelende elektronen kan fysisch niet én is in strijd met wat chemici ontdekt hebben aan moleculaire structuren: denk aan tetraederstructuur, vaste bindingshoeken, … Lewis postuleert zijn statische model waarin elektronen vaste posities innemen. Waarom vallen de elektronen niet op de kern? Lewis denkt dat de wet van Coulomb niet geldt voor kleine afstanden.

LEWIS 1916 Kubisch atoom verklaart wel de enkele binding in bv Cl 2 en dubbele binding in O 2 Maar hoe moet N 2 volgens het kubische model. Lewis laat de elektronen verschuiven van de hoekpunten naar het midden van de ribben • (soort van) tetraëder structuur • Elektronenparen!

1923 LEWIS SCHRIJFT HET NOG EEN KEER OP EN ZET ER EEN PUNT ACHTER. Valence and the Structure of Atoms and Molecules • Kubisch atoom wordt vervangen door ‘tetraedrische’ elektronenparen • De magnetische eigenschappen van elektronen zorgen er mogelijk voor dat elektronen paren vormen • Nadruk ligt op schillenmodel, alleen de elektronen in de buitenste schil zijn betrokken bij binding. • Ionair, polair en apolair passen in eenzelfde systeem • de elektronenpaar is cruciaal bi chemische binding. • De octetregel is niet heilig: PCl 5, SF 6 Lewis erkent dat hij niet weet wat de oorzaak is van de chemische binding. 20

LEWIS MODEL OKTETREGEL, GEMEENSCHAPPELIJKE ELEKTRONENPAREN (VSEPR) Zeer bruikbaar hulpmiddel voor chemici ØCovalentie Ødipool, ion, radicaal Øreactiemechanisme ØRuimtelijke structuur voorspelbaar Onzin voor fysici ! ØWaarom elektronen in paren ØModel kan niet statisch zijn

BOHR: TOT 1925 Rond 1922 tekende Bohr dit model voor de elektronenbanen in Xenon. • Bohr Sommerfeld atoommodel • Geen cirkels meer en de banen liggen niet meer in een vlak. • De ellipsen zijn niet vast maar vertonen precessie • Buitenste banen met zes of vier elektronen per baan. 22

1924 - 1927 KWANTUMMECHANICA

DE BROGLIE EN HET ATOOM De golflengte en dus ook kinetische energie zijn gerelateerd aan de ruimte die het deeltje ter beschikking heeft.

DEELTJE IN ÉÉNDIMENSIONALE POTENTIAALPUT

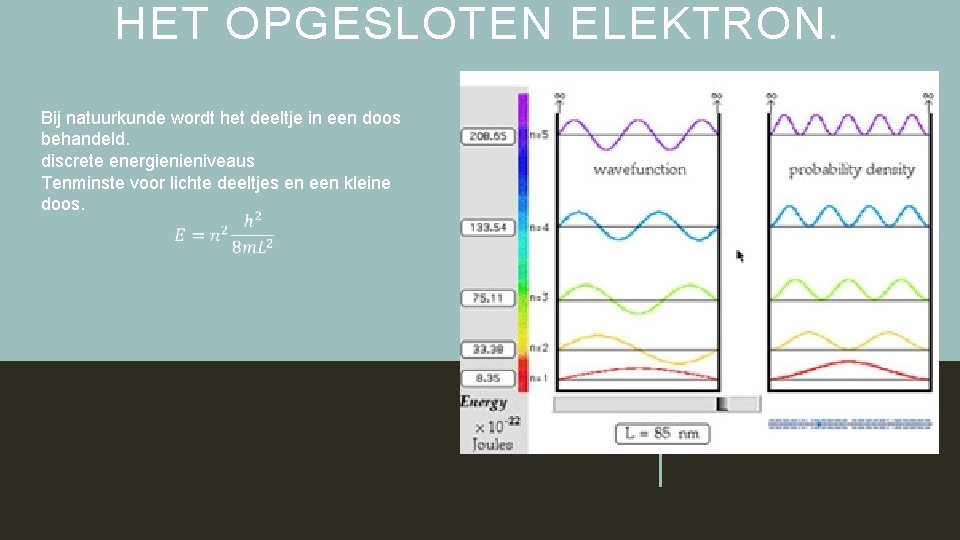
HET OPGESLOTEN ELEKTRON. Bij natuurkunde wordt het deeltje in een doos behandeld. discrete energienieniveaus Tenminste voor lichte deeltjes en een kleine doos.

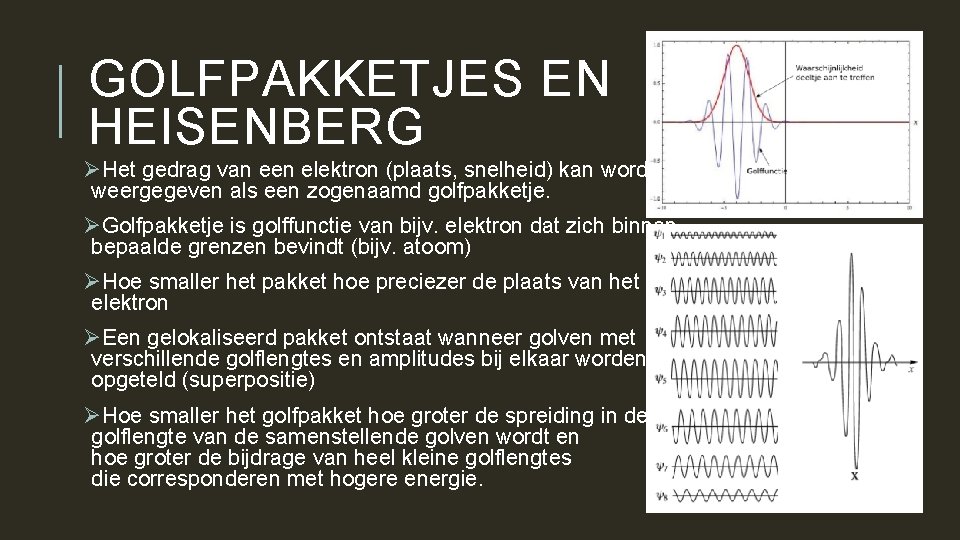
GOLFPAKKETJES EN HEISENBERG ØHet gedrag van een elektron (plaats, snelheid) kan worden weergegeven als een zogenaamd golfpakketje. ØGolfpakketje is golffunctie van bijv. elektron dat zich binnen bepaalde grenzen bevindt (bijv. atoom) ØHoe smaller het pakket hoe preciezer de plaats van het elektron ØEen gelokaliseerd pakket ontstaat wanneer golven met verschillende golflengtes en amplitudes bij elkaar worden opgeteld (superpositie) ØHoe smaller het golfpakket hoe groter de spreiding in de golflengte van de samenstellende golven wordt en hoe groter de bijdrage van heel kleine golflengtes die corresponderen met hogere energie.

DE GOLFFUNCTIES BIJ HET WATERSTOFATOOM: ORBITALEN

NOG MEER ORBITALEN VOOR WATERSTOF

PROBLEEM : MEERDERE ELEKTRONEN Voor een systeem waarin meerdere atomen elkaar beïnvloeden is geen exacte oplossing voorhanden. De golffunctie voor deze atomen worden benaderd met behulp van de golffuncties (orbitalen) zoals die berekend zijn voor het waterstofatoom. Pauliprincipe: er kunnen maar maximaal twee elektronen in een orbitaal geplaatst worden. Elektronen ontwijken elkaar van de elektrische afstoting dus bij voorkeur niet in eenzelfde orbitaal. Als het alternatief een orbitaal is met een hogere energie zullen elektronen toch “een paar vormen”, dwz hetzelfde orbitaal bezetten. Gepaard betekent dat de elektronen tegengestelde spin hebben, up en down

ELEKTRONENCONFIGURATIE S EN ONTAARDING Elektronenconfiguratie van neon: Het 2 p energieniveau is drievoudig ontaard

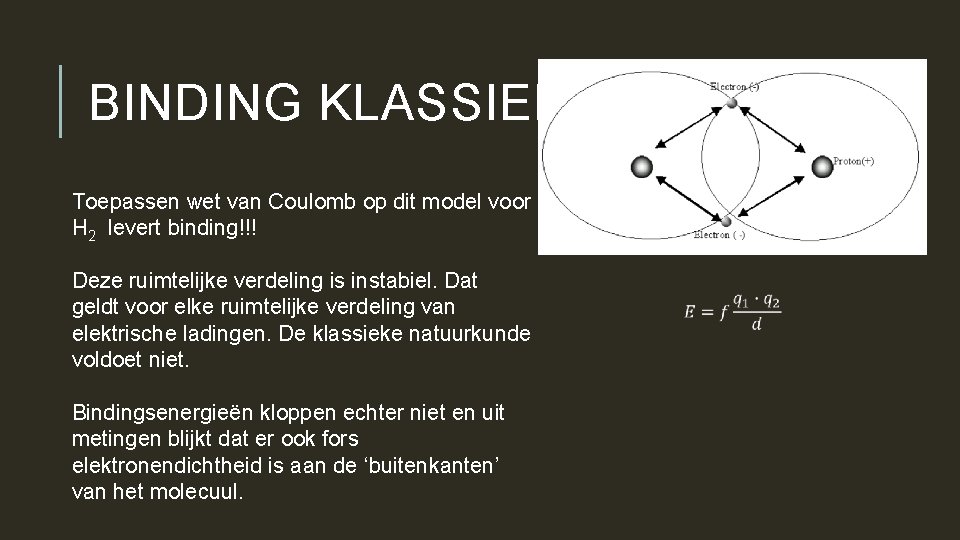
BINDING KLASSIEK Toepassen wet van Coulomb op dit model voor H 2 levert binding!!! Deze ruimtelijke verdeling is instabiel. Dat geldt voor elke ruimtelijke verdeling van elektrische ladingen. De klassieke natuurkunde voldoet niet. Bindingsenergieën kloppen echter niet en uit metingen blijkt dat er ook fors elektronendichtheid is aan de ‘buitenkanten’ van het molecuul.

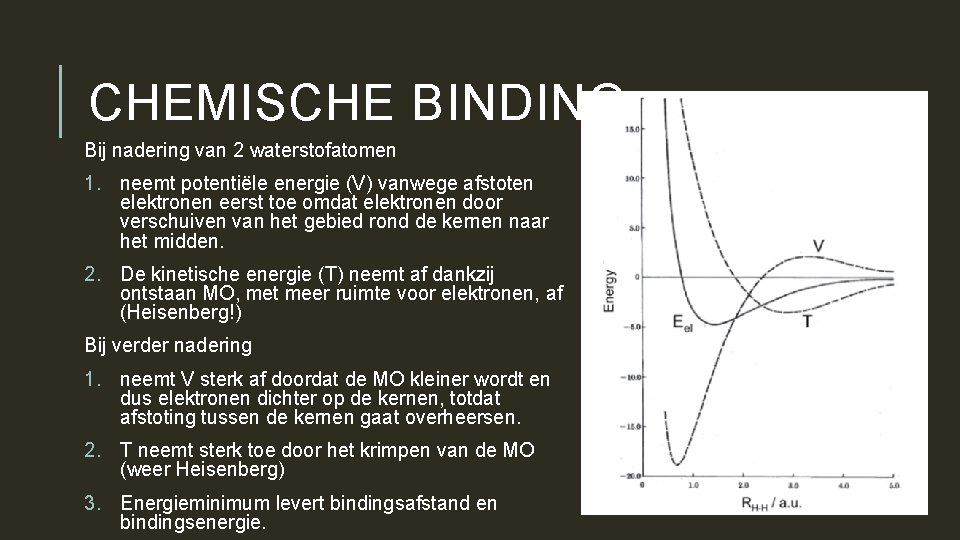
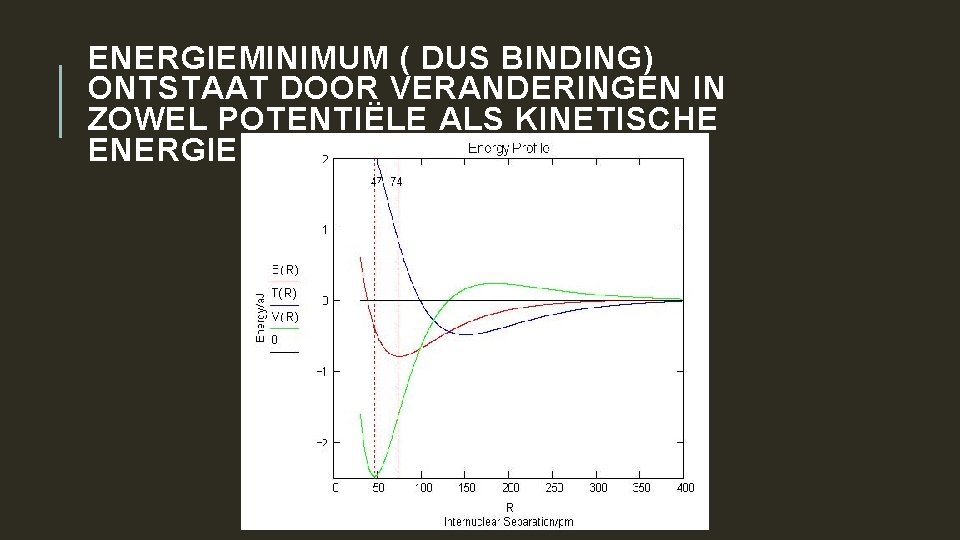
CHEMISCHE BINDING Bij nadering van 2 waterstofatomen 1. neemt potentiële energie (V) vanwege afstoten elektronen eerst toe omdat elektronen door verschuiven van het gebied rond de kernen naar het midden. 2. De kinetische energie (T) neemt af dankzij ontstaan MO, met meer ruimte voor elektronen, af (Heisenberg!) Bij verder nadering 1. neemt V sterk af doordat de MO kleiner wordt en dus elektronen dichter op de kernen, totdat afstoting tussen de kernen gaat overheersen. 2. T neemt sterk toe door het krimpen van de MO (weer Heisenberg) 3. Energieminimum levert bindingsafstand en bindingsenergie.

ENERGIEMINIMUM ( DUS BINDING) ONTSTAAT DOOR VERANDERINGEN IN ZOWEL POTENTIËLE ALS KINETISCHE ENERGIE

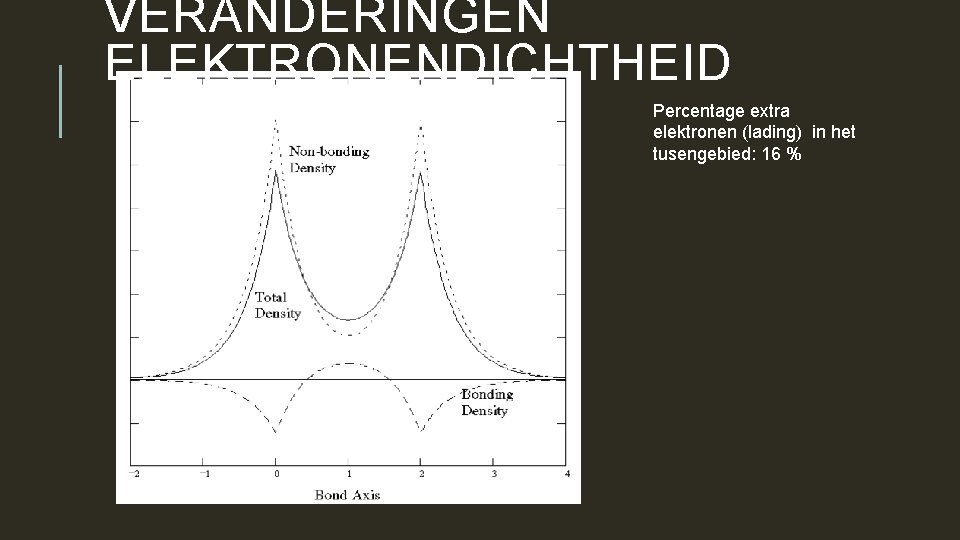
VERANDERINGEN ELEKTRONENDICHTHEID Percentage extra elektronen (lading) in het tusengebied: 16 %

VEEL VOORKOMENDE FOUTEN BIJ VERKLAREN CHEMISCHE BINDING • The covalent bond is presented as a purely electrostatic phenomenon. Electron kinetic energy is never mentioned, even though the total energy of a molecule is a sum of kinetic and potential energy contributions, and atomic and molecular stability cannot be understood solely in terms of potential energy. • It is claimed that the electron density in the inter-nuclear (bond) region has a lower potential energy because it is attracted to two nuclei. Actually using simple electrostatic arguments it is easy to show that the electron-nuclear potential energy is higher in the internuclear region than it is closer to the nuclei. On the basis of potential energy alone the electrons would prefer to be in the nucleus. • An energy minimum, or molecular ground state, is achieved because of increases in nuclear-nuclear and electron-electron repulsions as the internuclear separation decreases. As will be shown later, the immediate cause of the molecular ground state is a sharp increase in electron kinetic energy. • The amount of electron density transferred to the bonding region is greatly overstated, sometimes implying that a pair of electrons is shared between two nuclei rather than by two nuclei.

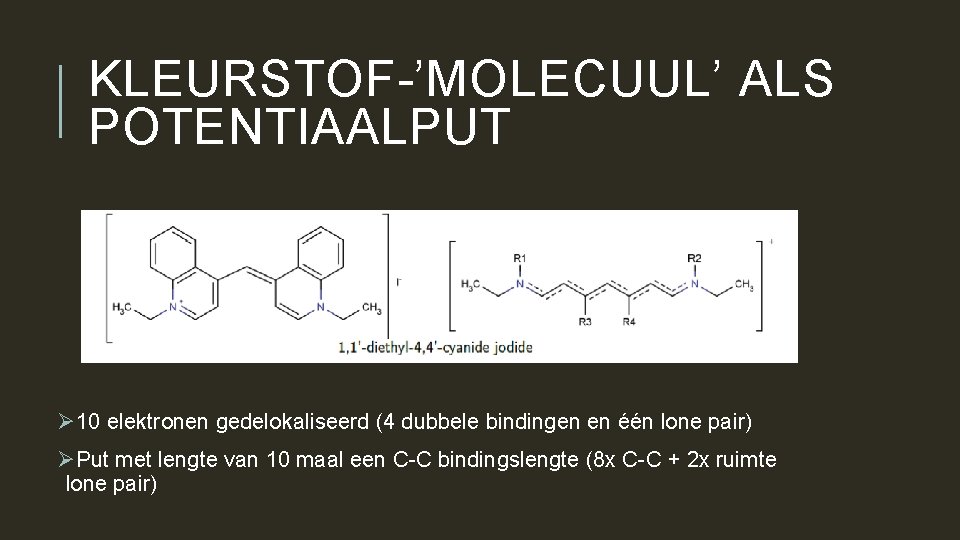
KLEURSTOF-’MOLECUUL’ ALS POTENTIAALPUT Ø 10 elektronen gedelokaliseerd (4 dubbele bindingen en één lone pair) ØPut met lengte van 10 maal een C-C bindingslengte (8 x C-C + 2 x ruimte lone pair)

DE HOMO-LUMO OVERGANG

DE GEABSORBEERDE GOLFLENGTE

FOTOSYNTHESE, INVANGEN VAN FOTONEN DOOR KLEURSTOFFEN Vergelijk de berekende HOMO-LUMO overgang van chlorofyl met haar absorptiespectrum. ØScheiden kleurstoffen uit spinazie-extract mbv kolomchromatografie ØSpectra meten van fracties waaronder chlorofyl a en chlorofyl b ØBereken HOMO LUMO voor deeltje in twee dimensionale potentiaalput ØVergelijk berekende golflengte met spectra

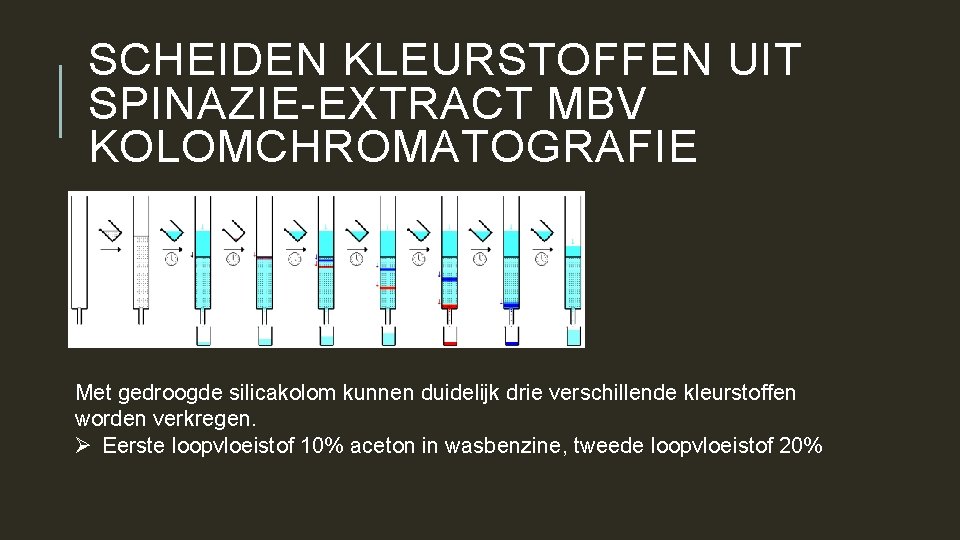
SCHEIDEN KLEURSTOFFEN UIT SPINAZIE-EXTRACT MBV KOLOMCHROMATOGRAFIE Met gedroogde silicakolom kunnen duidelijk drie verschillende kleurstoffen worden verkregen. Ø Eerste loopvloeistof 10% aceton in wasbenzine, tweede loopvloeistof 20%

SPINAZIE-EXTRACT OP EEN SILICAKOLOM

DE FRACTIES NA CHROMATOGRAFIE

SPECTRA METEN VAN FRACTIES WAARONDER LUTEÏNE EN CHLOROFYL A Luteïne Spinazie extract Chlorofyl-a

BEREKEN HOMO LUMO VOOR DEELTJE IN TWEEDIMENSIONALE POTENTIAALPUT (I)

BEREKEN HOMO LUMO VOOR DEELTJE IN TWEEDIMENSIONALE POTENTIAALPUT (II) 26 elektronen plaatsen in de MO’s levert de HOMO met bijbehorende energie.

VERGELIJK BEREKENDE GOLFLENGTE MET SPECTRA Golflengte berekening vergelijken met pieken uit zelf gemeten absorptiespectra. Welke piek van chlorofyl a hebben we berekend met de HOMO-LUMOovergang?

EINDE

LITERATUUR Lewis The atom and the molecule 1916 http: //scarc. library. oregonstate. edu/coll/pauling/bond/papers/corr 216. 3 -lewispub-19160400. html Niels Bohr between physics and chemistry Helge Kragh http: //scitation. aip. org/docserver/fulltext/aip/magazine/physicstoday/66/5/PT. 3. 1978. pdf? expires=1428359280&id=id&accname=guest&checksum=3 FC 63 D 632 B 3 FD 8 AE 52 CD 5 A B 96 A 5460 BC Kinetic Energy and the Covalent Bond in H 2+ FRANK RIOUX http: //www. users. csbsju. edu/~frioux/26 rio 897. pdf Frank Rioux The Covalent Bond Clarified Through the Use of the Virial Theorem, http: //www. users. csbsju. edu/~frioux/h 2 -virial/virialh 2. htm The Uncertainty Principle and Covalent Bonding http: //www. fh. huji. ac. il/~ronnie/Papers/guy 2005. pdf Boeken Lewis: Valence 1923 Pauling: The chemical bond Cathedrals of science The Personalities and Rivalries That Made Modern Chemistry door Patrick Coffey 49

STELLINGEN Chemische binding is niet uit te leggen zonder kwantummechanica Het is wenselijk nadrukkelijk te erkennen dat klassieke argumenten niet voldoen. Het is zinvol de relatie duidelijk te maken tussen bewegingsvrijheid van het elektronen en kinetische energie. Dat inzicht is fundamenteel voor de chemische binding, verklaart bv de rol van overlappende elektronenwolken en verklaart ook het stabiliserend effect van mesomere structuren.
 Water kruipt waar het niet gaan kan
Water kruipt waar het niet gaan kan Hoe leer je voor natuurkunde
Hoe leer je voor natuurkunde Boeken over kwantumchemie en theoretische chemie
Boeken over kwantumchemie en theoretische chemie Cursus het nieuwe rijden
Cursus het nieuwe rijden Het nieuwe trivium
Het nieuwe trivium Kan ve kan yapıcı organlara ilişkin ameliyatlar
Kan ve kan yapıcı organlara ilişkin ameliyatlar Si-stelsel
Si-stelsel Geloof in die ene reden waarom het wel kan
Geloof in die ene reden waarom het wel kan Omrekenen eenheden oefenen
Omrekenen eenheden oefenen Leerlijnen voor het basisonderwijs
Leerlijnen voor het basisonderwijs Bedankt om te luisteren
Bedankt om te luisteren Opwekking 464 tekst
Opwekking 464 tekst Psalm 145 vers 6
Psalm 145 vers 6 Mic biologie
Mic biologie Bedankt voor het welkom heten
Bedankt voor het welkom heten Dank u voor het kruis heer tekst
Dank u voor het kruis heer tekst Boekhouden voor het hbo deel 2
Boekhouden voor het hbo deel 2 Immunolgie
Immunolgie Waar komt het poolklimaat voor
Waar komt het poolklimaat voor Bedrijfseconomie voor het besturen van organisaties
Bedrijfseconomie voor het besturen van organisaties 10 voorbeelde van omgewingsgesondheid kwessies
10 voorbeelde van omgewingsgesondheid kwessies Regenead
Regenead Heupbeen walvis
Heupbeen walvis Smout hespe en spek tekst
Smout hespe en spek tekst Feodaal stelsel
Feodaal stelsel Stamboom aartsvaders
Stamboom aartsvaders Uit het oog uit het hart
Uit het oog uit het hart Wat zijn voor en achtervoegsels
Wat zijn voor en achtervoegsels Hoe ziet een panda eruit
Hoe ziet een panda eruit Dank u dank u wel voor alles wat u hebt gegeven
Dank u dank u wel voor alles wat u hebt gegeven Kosten openbare verkoop biddit
Kosten openbare verkoop biddit Taalverskynsels
Taalverskynsels Blaasspoelen suprapubische katheter
Blaasspoelen suprapubische katheter Wat is een domein middeleeuwen
Wat is een domein middeleeuwen Wat is de bedrijvende vorm
Wat is de bedrijvende vorm Bijwoordelijke bepaling voorbeeld
Bijwoordelijke bepaling voorbeeld Voorbeeld tekst inleiding-kern-slot
Voorbeeld tekst inleiding-kern-slot Burning of the books poem
Burning of the books poem Menselijke cel
Menselijke cel Wat is het bijwoord
Wat is het bijwoord Perfectum uitgangen
Perfectum uitgangen Vegetatieve schikking
Vegetatieve schikking Meewerkend voorwerp
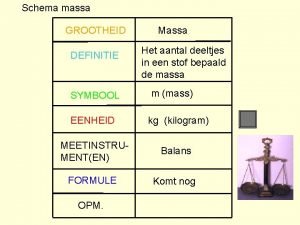
Meewerkend voorwerp Wat is het symbool van massa
Wat is het symbool van massa Zinsdelen benoemen
Zinsdelen benoemen Wat staat er meestal in het middenstuk van een tekst
Wat staat er meestal in het middenstuk van een tekst Wat is een aanwijzend voornaamwoord
Wat is een aanwijzend voornaamwoord Verkorte bezittelijke voornaamwoorden
Verkorte bezittelijke voornaamwoorden Gezegde
Gezegde Omaha classificatie
Omaha classificatie Wat kost het ijzer
Wat kost het ijzer