Scheikunde Chemie overal Week 1 1 1 Chemie


































































- Slides: 79

Scheikunde Chemie overal Week 1

1. 1 Chemie om je heen • Scheikunde is overal – Scheiden of zuiveren van stoffen – Veranderen van grondstoffen in bruikbare stoffen – Drinkwater uit zeewater – Poetsen – Enz.

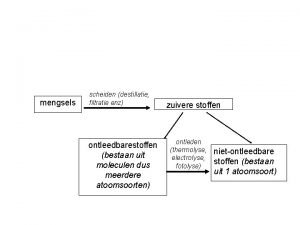
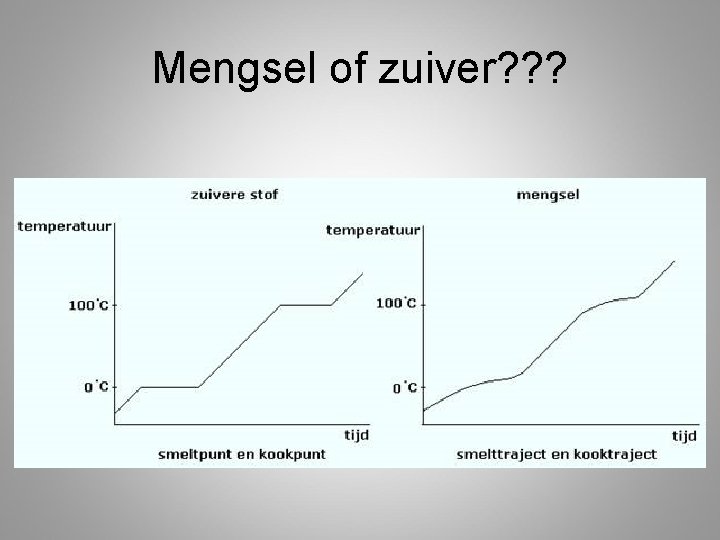
1. 2 Zuivere stoffen en mengsels • Zuivere stof: – Maar 1 soort deeltjes (moleculen) – Niet kleiner te krijgen – Vb: gedestilleerd water, suiker • Mengsel (onzuiver): – Meerdere soorten deeltjes (moleculen) – Kun je door scheiden uit elkaar halen – Vb: suikerwater

Stofeigenschappen – Kleur – Geur – Smaak – Smeltpunt en kookpunt – Dichtheid of soortelijke massa – oplosbaarheid – Brandbaarheid

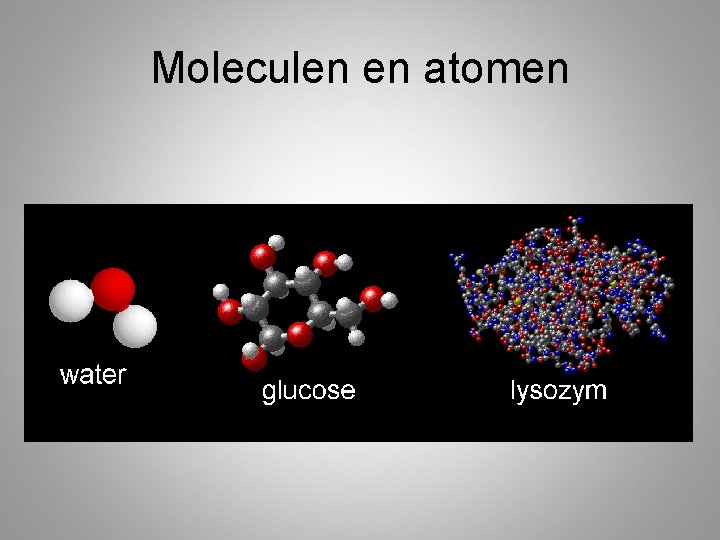
Moleculen en atomen

Element of een verbinding • Een zuivere stof kan een element of een verbinding zijn • Element bestaat uit 1 soort atomen • Verbinding bestaat uit meerdere soorten atomen

Elementen • Fientje Cliedert Bruine Inkt Op Haar Neus – Fluor (F), – Chloor (Cl), – Broom (Br), – Jood (I), – Zuurstof (O), – Waterstof (H), – Stikstof (N) • Twee atomige elementen

Mengsel of zuiver? ? ?

Hydrofiel/hydrofoob • Hydro = water • Fiel = houden van • Foob = vrezen • Hydrofiel = houdt van water – Lost dus makkelijk op in water (zout) • Hydrofoob = Houdt niet van water – Lost dus niet makkelijk op in water (Olie)

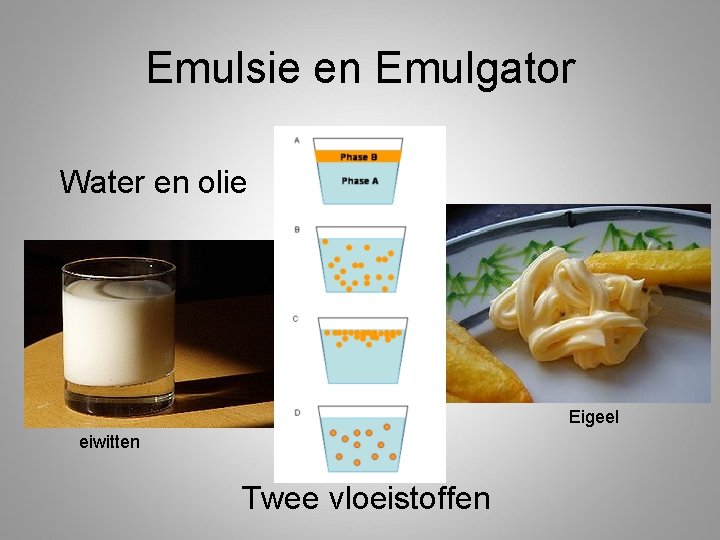
Soorten mengsels • Oplossing: helder, doorzichtig – Kleurloos of gekleurd (nooit wit) • Suspensie: troebel, ondoorzichtig – wit of gekleurd (nooit kleurloos) – Vaste stof in vloeistof die niet goed oplossen • Emulsie: troebel, ondoorzichtig – Wit of gekleurd (nooit kleurloos) – Vloeistof in vloeistof die niet goed oplossen

Emulsie en Emulgator Water en olie Eigeel eiwitten Twee vloeistoffen

Hoe werkt een emulgator • Kop en staart principe • Kop is hydrofiel en staart is hydrofoob

Scheikunde Week 2

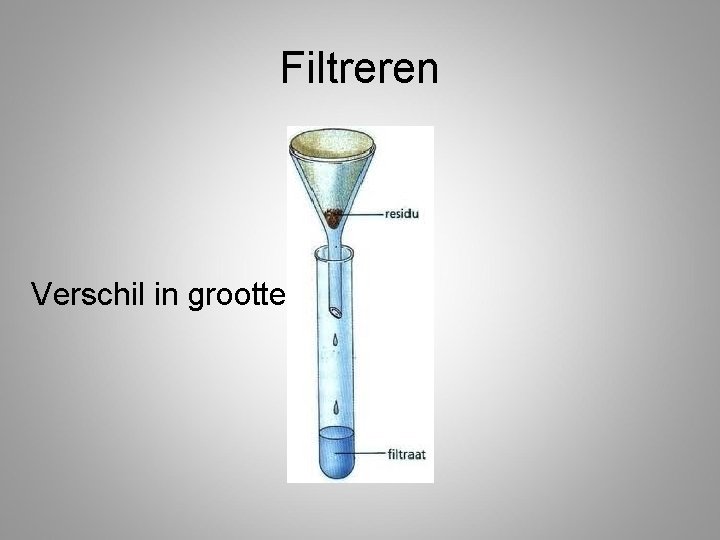
1. 3 Scheidingsmethoden • • • Methode Zeven Filtreren Indampen Destilleren Extraheren Bezinken verschil in eigenschap deeltjesgrootte kookpunt oplosbaarheid dichtheid

Zeven Deeltjesgrootte

Filtreren Verschil in grootte

Bezinken of Centrifugeren • Verschil in massa of dichtheid • Bezinken

Indampen Verschil in kookpunt

Destilleren Verschil in kookpunt

Extraheren • Twee vaste stoffen uit elkaar halen • Een vaste stof eerst oplossen en daarna filtreren en indampen • Voorbeeld zand en zout • Verschil in oplosbaarheid

Adsorberen • Bepaalde stoffen aan een stof onttrekken • Vaak kleurstoffen • Bijv – actieve kool en limonade siroop – Gasmaskers – Norrit (allemaal actieve kool)

Chromatograferen • Verschil in aanhechtingsvermogen en oplosbaarheid van het oplosmiddel • Bij zuivere stof 1 vlek bij mengsel meerdere vlekken

Scheikunde week 3

Bouwstenen van stoffen

2. 2 De bouw van een atoom • Modellen • Dalton: een atoom is een massief bolletje. Elk atoomsoort heeft zijn eigen afmetingen

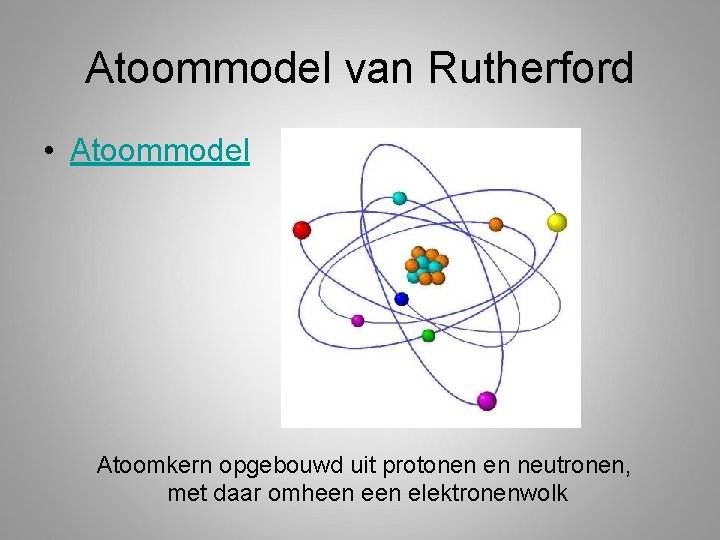
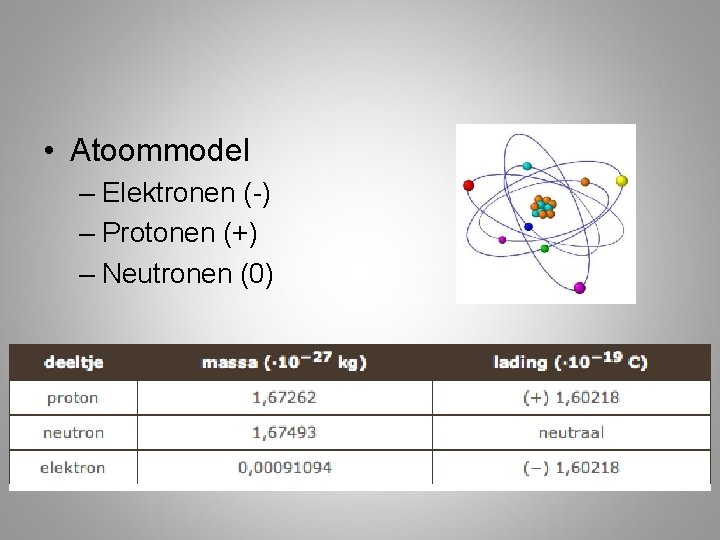
Atoommodel van Rutherford • Atoommodel Atoomkern opgebouwd uit protonen en neutronen, met daar omheen elektronenwolk

• Atoommodel – Elektronen (-) – Protonen (+) – Neutronen (0)

Atoomnummer en massagetal • Atoomnummer geeft aan hoeveel protonen en elektronen in een atoom zitten • Massagetal geeft de som van protonen en neutronen aan

Voorbeeld K atoomnummer: 19 K massagetal: 39 Aantal protonen en elektronen= 19 Aantal neutronen= 39 -19= 20

Elektronen-verdeling • De elektronen zijn over schillen verdeeld: Schil naam 1 e schil K schil Maximaal aantal elektronen 2 2 e schil L schil 8 3 e schil M schil 18 4 e schil N schil 32 • De elektronen worden van binnenuit naar buiten toe opgevuld • Uit het periodiek systeem is de elektronen-verdeling (elektronenconfiguratie) per atoom af te leiden

Het atoomnummer geeft het aantal protonen in de kern aan Dit komt overeen met de kernlading (+) en het aantal elektronen in de elektronenwolk (-)

Elektronenconfigatie: elektronenverdeling over de 4 schillen (banen) Valentie-elektronen: De elektronen in de buitenste schil

Isotopen • Isotopen zijn elementen met hetzelfde atoomnummer maar met een verschillend massagetal • Aantal neutronen bij een atoom verschillen • Bijv waterstof: – “Gewoon” waterstof 1 proton geen neutronen – “Zwaar” waterstof 1 proton 1 neutron – Tritium 1 proton 2 neutronen

Chloor Lichtere soort komt 3 x zovaak voor Het gemiddelde massagetal wordt dan: Massagetal: (3*35+1*37)/4 = 35, 5 Dit is de atoommassa!!!

Scheikunde Week 4

2. 3 Periodiek systeem Periode G R O E P E N

Groepen • Groep 1 Alkalimetalen (Film) – Reageren heftig met water • Groep 2 Aardalkalimetalen – Reageren heftig met lucht (felle vlam) • Groep 17 Halogenen – F, Cl, Br, I reageren goed metalen • Groep 18 Edelgassen – Verbinden zich niet en tasten niets aan

Atomen • Kleinste deeltjes van een molecuul • Symbolen – Eerste letter van de Latijnse naam – Bijvoorbeeld: • Koolstof = Carboneum dus C • Koper = Cuprum dus Cu • Denk aan hoofdletter kleine letter!!!

Elementen • Fientje Cliedert Bruine Inkt Op Haar Neus – Fluor (F), – Chloor (Cl), – Broom (Br), – Jood (I), – Zuurstof (O), – Waterstof (H), – Stikstof (N) • Twee atomige elementen

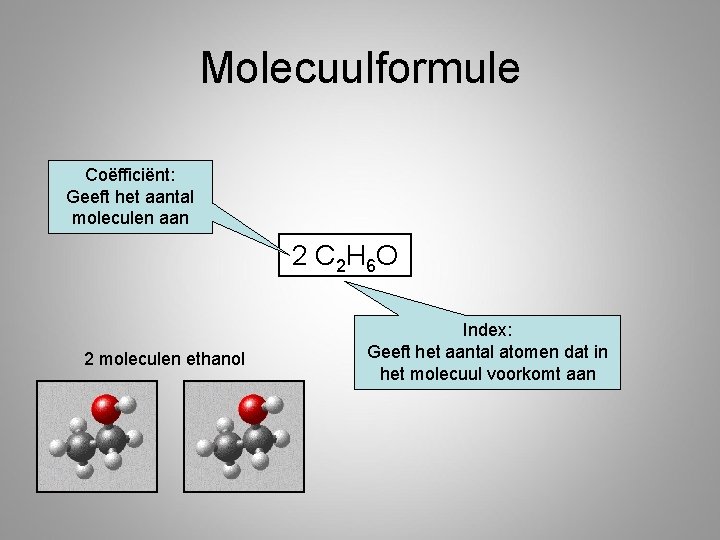
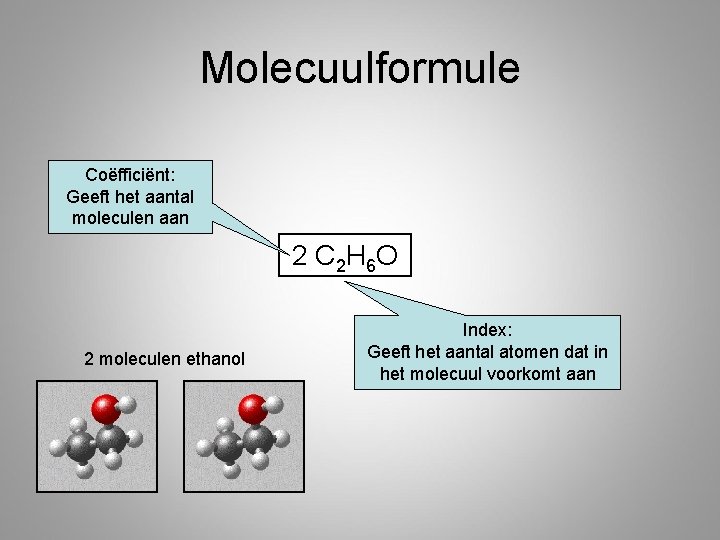
Molecuulformule Coëfficiënt: Geeft het aantal moleculen aan 2 C 2 H 6 O 2 moleculen ethanol Index: Geeft het aantal atomen dat in het molecuul voorkomt aan

Atoombinding • Covalentie: het aantal elektronen dat een atoom beschikbaar heeft voor de atoombinding

Atoombinding Er zijn ook atomen die meer dan een covalentie hebben. Bijvoorbeeld: Zwavel (S) covalentie 2, 4 en 6

Molecuulformule • Koolstof en zwavel atomen Covalentie aantallen vereenvoudigen : C : 4 : 2 : 1 S 2 4 2 Formule : CS 2 Koolstofdisulfide

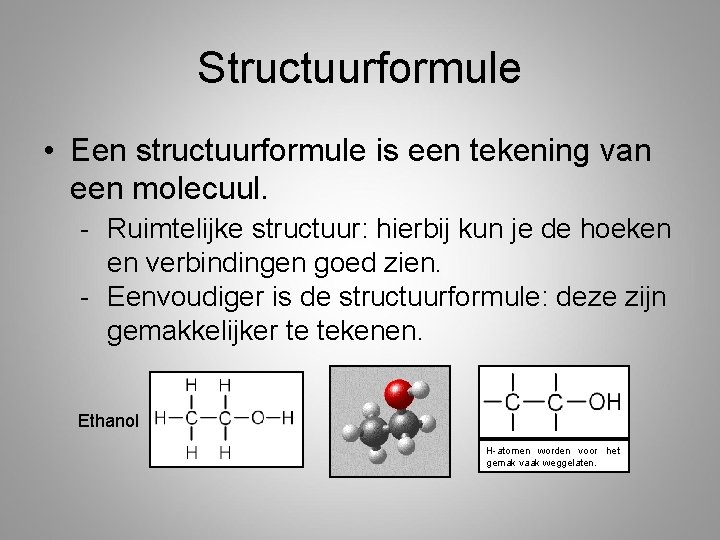
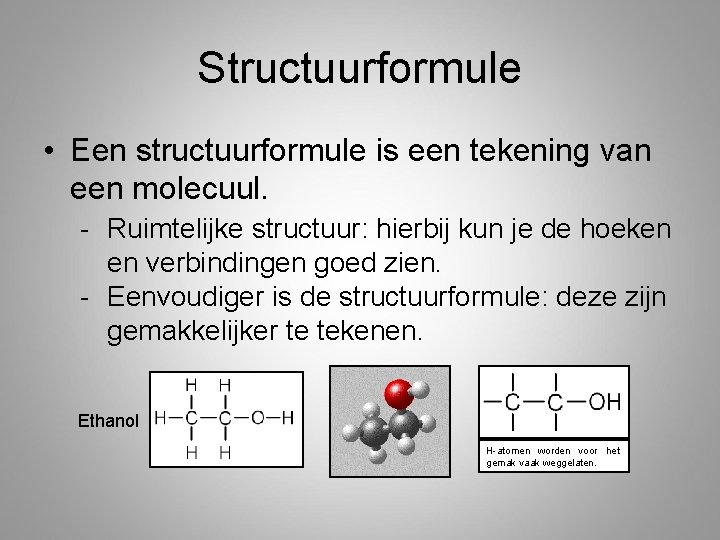
Structuurformule • Een structuurformule is een tekening van een molecuul. - Ruimtelijke structuur: hierbij kun je de hoeken en verbindingen goed zien. - Eenvoudiger is de structuurformule: deze zijn gemakkelijker te tekenen. Ethanol H-atomen worden voor het gemak vaak weggelaten.

Scheikunde Week 5

2. 4 Ionen • • • Atomen met een lading Sterkere aantrekkingskracht Hogere smeltpunten Kern blijft altijd gelijk Elektronen kunnen veranderen Ionen willen lijken op edelgassen

Ionen • Atomen kunnen elektronen opnemen of afstaan (buitenste schil) • Atomen willen zijn als edelgas • Atomen uit groep 1 staan makkelijk 1 elektron af (elektron positief) • Atomen uit groep 17 nemen makkelijk 1 elektron op (elektron negatief)

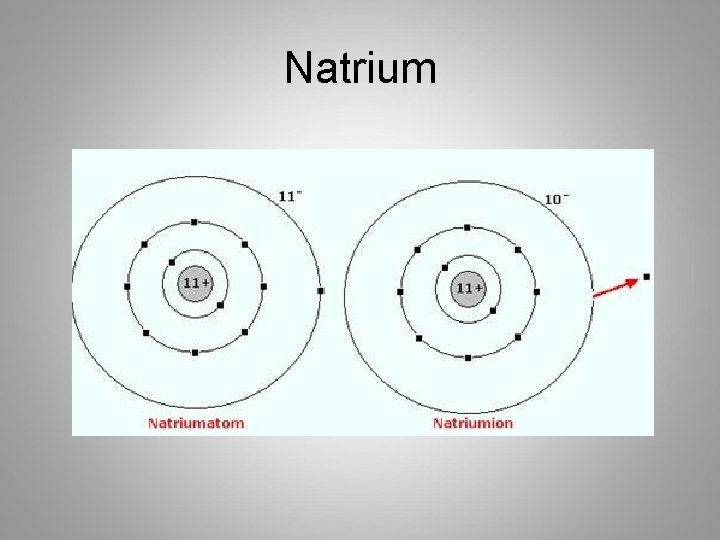
Bijvoorbeeld Na • • Atoomnummer 11 Kernlading is dus +11 11 protonen en 11 elektronen Na kan 1 elektron afstaan – Buitenste schil 1 e • 11 P 10 E (+11 -10= +1) • Natrium ion (Na+-ion)

Natrium

Bijvoorbeeld Cl • • • Atoomnummer 17 Kernlading is dus +17 17 protonen en 17 elektronen Cl kan 1 elektron opnemen 17 P 18 E (+17 -18= -1) Chloride (Cl- ion)

Periodiek systeem en ionen • Atomen uit groep 1 – 1 afstaan dus lading van 1+ • Atomen uit groep 2 – 2 afstaan dus lading van 2+ • Atomen uit groep 16 – 2 opnemen dus lading van 2 - • Atomen uit groep 17 – 1 opnemen dus lading van 1 -

Waardigheid van atomen • Ook wel elektovalentie • Atomen uit groep 1 – Waardigheid van 1 • Atomen uit groep 2 – Waardigheid van 2 • Atomen uit groep 15 – Waardigheid van 3 • Atomen uit groep 17 – Waardigheid van 1

2. 5 naamgeving van ionen • Positieve ionen behouden dezelfde naam – Mg 2+ = Magnesium ion – Na+ = Natrium ion – K+ = Kalium ion

Metalen • Er zijn metalen die meerdere valenties kunnen hebben • Fe 2+ of Fe 3+ • Deze geven we aan met romeinse cijfers • Ijzer(II) ion of ijzer(III)ion • Cu+ en Cu 2+ • Koper(I)ion en Koper(II)ion

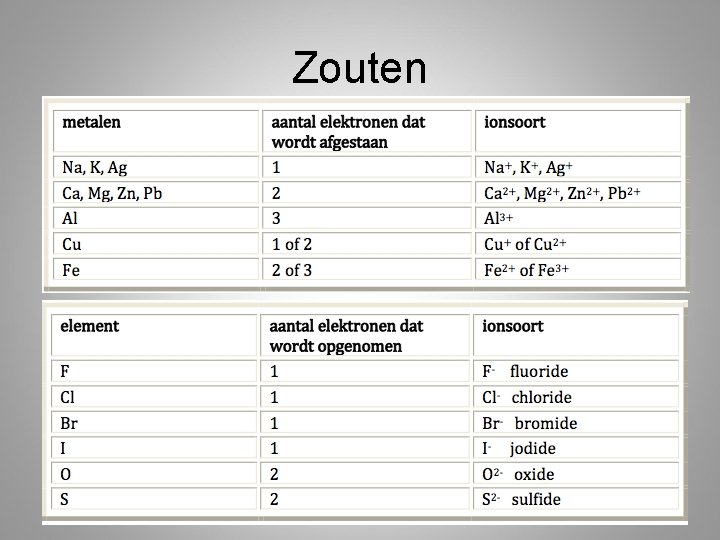
Valenties van metalen Metaal valentie Na, K, Ag (1) + Mg, Ba, Ca, Zn, Ni 2+ Al, Cr, Au 3+ Fe 2+ en 3+ Cu, Hg 1+ en 2+ Pb, Sn 2+ en 4+ Uitzondering: Waterstof (enige niet metaal) positieve valentie: H+

Valenties niet metalen Niet-metaal Valentie F, Cl, Br, I (1) - O, S 2 - N, P 3 -

Negatieve ionen • Achtervoegsel –ide – F– Cl– Br – I– O 2– S 2– N 3 - Fluoride Chloride Bromide Jodide Oxide Sulfide Nitride

Scheikunde Week 6

3. 3 structuurformules en namen van moleculaire stoffen • Molecuul bestaat altijd uit 2 of meer atomen • Altijd niet-metalen • Covalentie • structuurformules

Molecuulformule Coëfficiënt: Geeft het aantal moleculen aan 2 C 2 H 6 O 2 moleculen ethanol Index: Geeft het aantal atomen dat in het molecuul voorkomt aan

Atoombinding • Covalentie: het aantal elektronen dat een atoom beschikbaar heeft voor de atoombinding

Atoombinding Er zijn ook atomen die meer dan een covalentie hebben. Bijvoorbeeld: Zwavel (S) covalentie 2, 4 en 6

Structuurformule • Een structuurformule is een tekening van een molecuul. - Ruimtelijke structuur: hierbij kun je de hoeken en verbindingen goed zien. - Eenvoudiger is de structuurformule: deze zijn gemakkelijker te tekenen. Ethanol H-atomen worden voor het gemak vaak weggelaten.

Structuurformule • Dubbele bindingen • Drievoudige bindingen

Molecuulformule • Koolstof en zwavel atomen Covalentie aantallen vereenvoudigen : C : 4 : 2 : 1 S 2 4 2 Formule : CS 2 Koolstofdisulfide

Index en naamgeving Index Voorvoegsel 1 Mono 2 Di 3 Tri 4 Tetra 5 Penta 6 Hexa

Naamgeving • H 2 O – Diwaterstofmono-oxide • P 2 O 5 – Difosforpenta-oxide • Monostikstofdioxide – NO 2

huiswerk • Opdracht: 21 t/m 33 • Niet maken: 22, 26, 29.

Scheikunde Week 7

3. 2 elektrisch geleidingsvermogen • Een stof kan stroom geleiden wanneer – De stof moet bestaan uit geladen deeltjes – De geladen deeltjes moeten vrij kunnen bewegen

Onderscheid in stoffen 1. Moleculaire stoffen 2. Zouten (opgebouwd uit ionen) 3. Metalen

Welke stoffen geleiden niet? • • Gedestilleerd water Alcohol Hout perspex Moleculaire stoffen (bestaan uit niet-metalen): Dit komt doordat deze stoffen geen vrije elektronen bevatten!!

Zouten • Stoffen opgebouwd uit positieve en negatieve ionen

Zouten bestaan uit: een metaal en een niet-metaal • Natrium en Chloor – Natrium staat steeds 1 elektron af – Chloor neemt steeds 1 elektron op • Er ontstaat Natriumchloride (keukenzout)

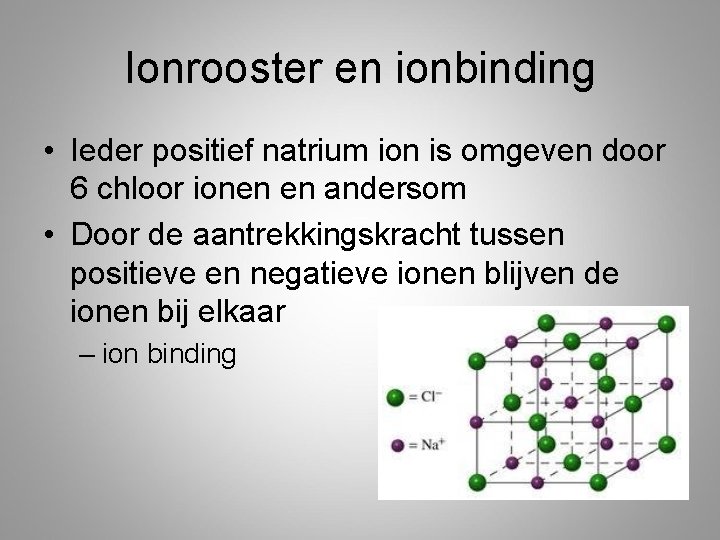
Ionrooster en ionbinding • Ieder positief natrium ion is omgeven door 6 chloor ionen en andersom • Door de aantrekkingskracht tussen positieve en negatieve ionen blijven de ionen bij elkaar – ion binding

Metalen • Eigenschappen van metalen – Glanzend uiterlijk – Hoog smeltpunt – Geleiden goed warmte – Geleiden elektrische stroom – Goed vervormbaar door walsen en smeden – In gesmolten toestand goed te mengen

Even terug • IJzer atoomnummer 26 • Aantal protonen is dus: 26 (positief) • Aantal elektronen is dus: 26 (negatief) • IJzer staat graag 2 elektronen af • Dan krijgt ijzer een lading van: +2 • Dat is het ijzer ion

IJzer • Bestaat uit veel positieve ijzer ionen en uit twee keer zo veel vrije elektronen • De ijzerionen zijn gerangschikt in een rooster • Hierin bewegen de vrije elektronen zich kris kras tussen de positieve ijzerionen door. • Deze zorgen voor de binding Metaalrooster

Metaalrooster • Bestaat dus uit positieve metaalionen en uit vrije elektronen die voor de binding (metaalbinding) in het rooster zorgen • Wanneer het metaal aangesloten wordt op stroom gaan alle elektronen dezelfde kant op – De beweging van vrije elektronen wordt gericht
 Scheikunde chemie overal vwo 4
Scheikunde chemie overal vwo 4 Groene chemie scheikunde
Groene chemie scheikunde De mens wordt vrij geboren maar verblijft overal in ketenen
De mens wordt vrij geboren maar verblijft overal in ketenen Rolwrijving
Rolwrijving Natuurkunde boek havo 4
Natuurkunde boek havo 4 Aardrijkskunde is overal
Aardrijkskunde is overal Week by week plans for documenting children's development
Week by week plans for documenting children's development Berekenen reactiewarmte
Berekenen reactiewarmte Zijde verven scheikunde examen
Zijde verven scheikunde examen Veiligheidsregels scheikunde
Veiligheidsregels scheikunde Telwoorden scheikunde
Telwoorden scheikunde Rekenschema scheikunde
Rekenschema scheikunde Gemalen koffie mengsel of zuivere stof
Gemalen koffie mengsel of zuivere stof Buisje scheikunde
Buisje scheikunde Zilvernitraat formule
Zilvernitraat formule Bolbuis scheikunde
Bolbuis scheikunde Mol berekenen scheikunde
Mol berekenen scheikunde Scheidingsmethoden scheikunde schema
Scheidingsmethoden scheikunde schema Extractiemiddel scheikunde
Extractiemiddel scheikunde Hydrolyse vetten
Hydrolyse vetten Binas tabel 99
Binas tabel 99 Oplosvergelijking in water
Oplosvergelijking in water Organische structuren
Organische structuren Index betekenis scheikunde
Index betekenis scheikunde Centrifugeren scheikunde
Centrifugeren scheikunde Soli chemie 9. ročník
Soli chemie 9. ročník Chemie
Chemie Schilling chemie
Schilling chemie Esterhydrolyse
Esterhydrolyse Naturfasern chemie
Naturfasern chemie Chemie k
Chemie k Chemie koncovky
Chemie koncovky Impuls chemie 4 lösungen pdf
Impuls chemie 4 lösungen pdf Substrat chemie
Substrat chemie Chemie
Chemie Planaire structuur chemie
Planaire structuur chemie Impuls chemie 4
Impuls chemie 4 Hochofen stahlherstellung
Hochofen stahlherstellung Dreieck chemie
Dreieck chemie Chemie für mediziner
Chemie für mediziner Autohaus bonnemann
Autohaus bonnemann Impuls chemie 4 lösungen pdf
Impuls chemie 4 lösungen pdf Sbr6 chemie
Sbr6 chemie Tensidklassen
Tensidklassen Semesterapparat hhu
Semesterapparat hhu Donauchem pischelsdorf
Donauchem pischelsdorf Krasové jevy chemie
Krasové jevy chemie Burgerlijk ingenieur chemie
Burgerlijk ingenieur chemie Klasvorming chemie
Klasvorming chemie Areny chemie
Areny chemie Jodometrie
Jodometrie Chemie
Chemie Chemie názvosloví
Chemie názvosloví Impuls chemie
Impuls chemie Organická chemie
Organická chemie Sucha chemie
Sucha chemie Chemie
Chemie Chemie teilgebiete
Chemie teilgebiete Impuls chemie
Impuls chemie Ppp chemie
Ppp chemie Substrat chemie
Substrat chemie Lnky
Lnky Impuls chemie
Impuls chemie Prinzip von le chatelier
Prinzip von le chatelier Chemie
Chemie Pulsar college
Pulsar college Voda prezentace chemie
Voda prezentace chemie Chmia
Chmia Dichloor
Dichloor Podobory chemie
Podobory chemie Skelettschreibweise
Skelettschreibweise Bahenný plyn
Bahenný plyn Chemie k
Chemie k Ddt chemie
Ddt chemie 12 principes groene chemie
12 principes groene chemie Chemie
Chemie Chemie
Chemie Katedra fyziky chemie a odborného vzdělávání
Katedra fyziky chemie a odborného vzdělávání Dobrý sluha ale zlý pán chemie
Dobrý sluha ale zlý pán chemie Fehlvorstellungen chemie
Fehlvorstellungen chemie