Wglowodory aromatyczne areny cz II waciwoci chemiczne arenw













- Slides: 26

Węglowodory aromatyczne – areny (cz. II) Ø ü ü ü właściwości chemiczne arenów, reakcje substytucji elektrofilowej, efekty kierujące podstawników, reakcje addycji, reakcje utlenienia, reakcje związków alkiloaromatycznych, reakcje arenów o pierścieniach skondensowanych

Reakcje substytucji elektrofilowej v Substytucja elektrofilowa - SE: Ø typową reakcja arenów, w której ujemny biegun układu aromatycznego jest atakowany przez kation lub dodatni biegun cząsteczki polarnej (elektrofil), Ø podstawieniu ulega atom wodoru związany z atomem węgla w pierścieniu aromatycznym, Ø większa reaktywność układów aromatycznych w reakcja substytucji (w porównaniu do węglowodorów nienasyconych) wynika z dużej polaryzowalności cząsteczek i ruchliwości elektronów π w pierścieniu aromatycznym,

Reakcje substytucji elektrofilowej v Substytucja elektrofilowa – SE cd. : Ø niesymetryczny rozkład ładunków (w przypadku obecności podstawników lub niesymetrycznych pierścieni aromatycznych) nadaje cząsteczce układu aromatycznego trwały moment dipolowy, Ø każda cząsteczka układu aromatycznego posiada określoną podatność na polaryzację pod wpływem oddziaływań zewnętrznych (cząsteczki rozpuszczalnika, katalizatory, ściany naczynia, promieniowanie widzialne i nadfioletowe), uzyskując dodatkowy moment dipolowy, Ø spolaryzowana cząsteczka układu aromatycznego ulega stosunkowo łatwo reakcji podstawiania heterolitycznego (reakcja przebiegająca wg mechanizmu jonowego),

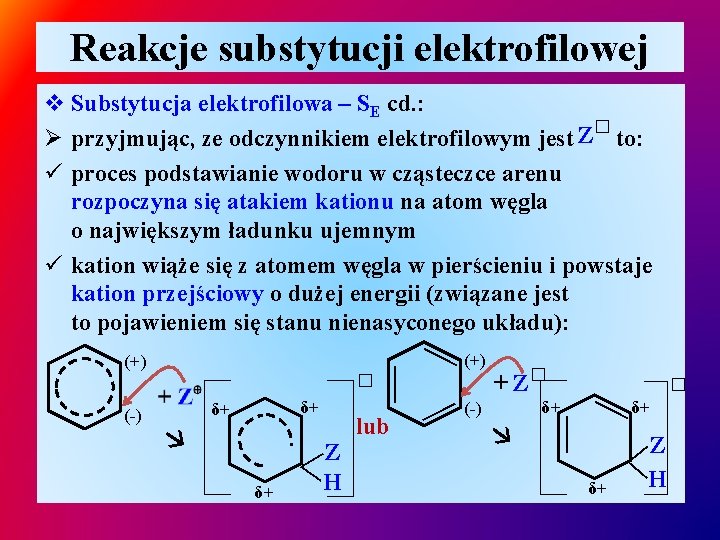
Reakcje substytucji elektrofilowej v Substytucja elektrofilowa – SE cd. : � Ø przyjmując, ze odczynnikiem elektrofilowym jest Z to: ü proces podstawianie wodoru w cząsteczce arenu rozpoczyna się atakiem kationu na atom węgla o największym ładunku ujemnym ü kation wiąże się z atomem węgla w pierścieniu i powstaje kation przejściowy o dużej energii (związane jest to pojawieniem się stanu nienasyconego układu): δ+ ——Z H — lub — (-) + Z� δ+ — δ+ δ+ � � — (-) (+) — (+) δ+ δ+ Z —— H

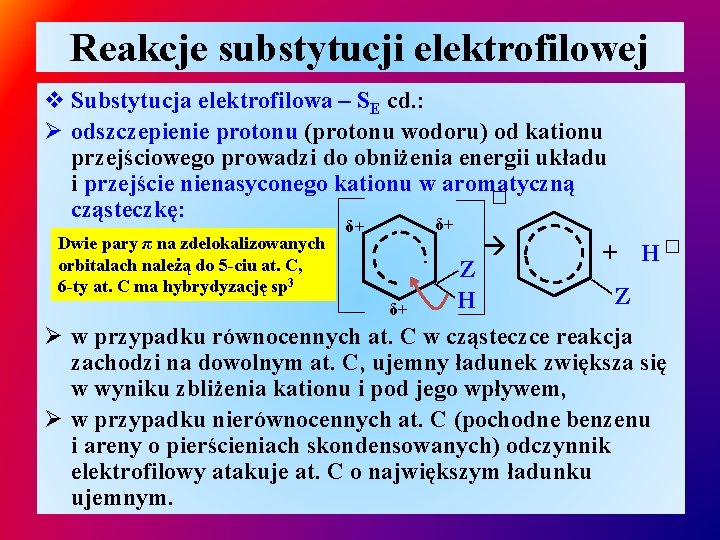
Reakcje substytucji elektrofilowej v Substytucja elektrofilowa – SE cd. : Ø odszczepienie protonu (protonu wodoru) od kationu przejściowego prowadzi do obniżenia energii układu i przejście nienasyconego kationu w aromatyczną � cząsteczkę: Dwie pary π na zdelokalizowanych orbitalach należą do 5 -ciu at. C, 6 -ty at. C ma hybrydyzację sp 3 δ+ δ+ δ+ ——Z H + H� — Z Ø w przypadku równocennych at. C w cząsteczce reakcja zachodzi na dowolnym at. C, ujemny ładunek zwiększa się w wyniku zbliżenia kationu i pod jego wpływem, Ø w przypadku nierównocennych at. C (pochodne benzenu i areny o pierścieniach skondensowanych) odczynnik elektrofilowy atakuje at. C o największym ładunku ujemnym.

Reakcje substytucji elektrofilowej v Reakcja fluorowcowania (halogenowanie): Ø chlorowanie lub bromowanie wobec katalizatora Fe. Cl 3, Fe. Br 3, [w reakcji można zastosować rozdrobnione żelazo, które w obecności fluorowca wchodzi w reakcję i powstaje chlorek lub bromek żelaza(III)], Ø heterolityczny rozpad cząsteczki fluorowca pod wpływem halogenku żelaza(III): ü Br 2 + Fe. Br 3 [Fe. Br 4]- + Br+ Ø atak elektrofila na cz. związku aromatycznego: ü Ar – H + Br+ [Ar. HBr]+ Ar – Br + H+ Ø regeneracja katalizatora ü [Fe. Br 4]- + H+ Fe. Br 3 + HBr

Reakcje substytucji elektrofilowej v Reakcja fluorowcowania (halogenowania) cd. : Ø w istocie reakcja przebiega na elektrofilowym ataku cząsteczki X 2, Ø cząsteczka X 2 ulega początkowo polaryzacji, natomiast dysocjacja cząsteczki halogenu X – X następuje po kompleksowym związaniu się z Fe. X 3, Ø dysocjacja przebiega w kompleksie Ar. H X – X przez przyłączenie Fe. X 3 ü Ar. H + X 2 Ar. HX 2 ü Ar. HX 2 + Fe. X 3 Ar. H X – X Fe. X 3 ü Ar. H X – X Fe. X 3 Ar. H X+Fe. X 4ü Ar. H X+Fe. X 4 - Ar. H – X + [Fe. X 4]+ ü Ar. H – X + [Fe. X 4]+ Ar – X + HX + Fe. X 3

Reakcje substytucji elektrofilowej v Reakcja nitrowania: Ø reakcja polega na podstawieniu atomu wodoru układu aromatycznego grupą nitrową – NO 2, Ø nitrowanie wykonuje się mieszaniną nitrującą (stężonego H 2 SO 4 i HNO 3, w wyniku reakcji, w której kwas siarkowy zachowuje się jako protonodoner – kwas, a kwas azotowy jako protonoakceptor – zasada: ü 2 H 2 SO 4 + HO-NO 2 2 HSO 4 - + NO 2+ + H 3 O+ Ø kation nitrowy NO 2+ jako czynnik elektrofilowy atakuje pierścień aromatyczny: ü Ar – H + NO 2+ Ar. HNO 2+ ü Ar. HNO 2+ Ar – NO 2 + H+ Ø zapis sumaryczny reakcji: ü Ar – H + HO-NO 2 Ar – NO 2 + H 2 O

Reakcje substytucji elektrofilowej v Reakcja sulfonowania: Ø reakcja polega podstawieniu atomu wodoru układu aromatycznego grupą sulfonową – SO 3 H, która zachowuje właściwości kwasu siarkowego(VI), Ø produkt reakcji – kwas sulfonowy jest mocnym kwasem organicznym, dobrze rozpuszczalnym w wodzie, tworzy trwałe krystaliczne sole, Ø reakcja polega na ataku czynnika elektrofilowego – kationu sulfoniowego SO 3 H+, który powstaje w stężonym kwasie siarkowym(VI), ü H 2 SO 4 ↔ SO 3 H+ + OH-

Reakcje substytucji elektrofilowej v Reakcja sulfonowania cd. : Ø czynnikiem elektrofilowym może być SO 3 w nadmiarze rozpuszczonym w stężonym kwasie siarkowym(VI) – oleum, ü Ar – X + SO 3 H+ Ar. HSO 3 H+ ü Ar. HSO 3 H+ Ar – SO 3 H + H+ Ø sumaryczne równanie reakcji: ü reakcja jest odwracalna, w 60% roztworze i w podwyższonej temperaturze kwas sulfonowy ulega hydrolizie: ü Ar – H + H 2 SO 4 ↔ Ar – SO 3 H + H 2 O

Reakcje substytucji elektrofilowej | v Reakcja alkilowania i acylowania (reakcja Friedela – Craftsa): Ø związki aromatyczne reagują z halogenkami alkilowymi: (R – X) lub acylowymi (R – COX) w obecności bezwodnego halogenku glinu (Al. X 3), żelaza(Fe. X 3), Ø w reakcji następuje podstawienie atomu wodoru w pierścieniu aromatycznym grupą alkilową (– R) || O lub acylowąR C , | Ø halogenek glinu ułatwia zerwanie wiązania C – X cząsteczki halogenku alkilu lub acylu i utworzenie z nią związku kompleksowego

Reakcje substytucji elektrofilowej v Reakcja alkilowania i acylowania (reakcja Friedela – Craftsa) cd. : δ+ δü R – Cl + Al. Cl 3 ↔ R Cl Al. Cl 3 || O δ+ ü R C + Al. Cl 3 ↔ R C δCl Al. Cl 3 Cl …. . | Ø związek kompleksowy przekształca się w parę jonową: δ+ δü R Cl Al. Cl 3 ↔ R+Cl-Al. Cl 3 …. . || O δ+ | üR C || O Cl …. . δ- ↔ Al. Cl 3 R – C+Cl-Al. Cl 3

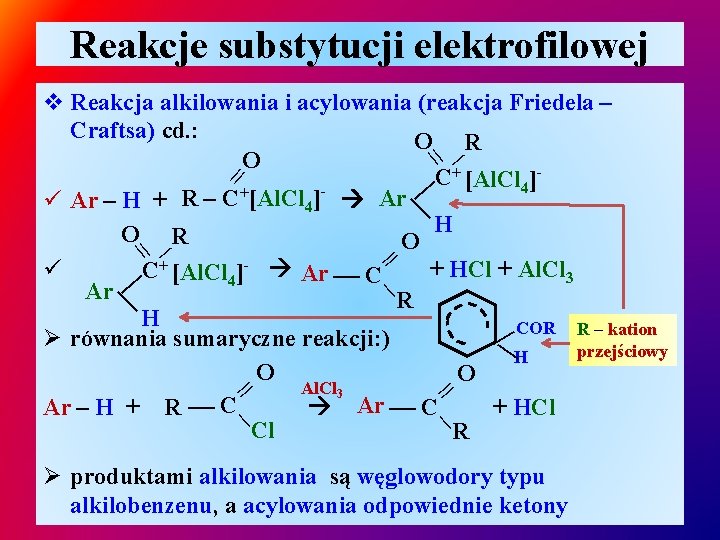
Reakcje substytucji elektrofilowej v Reakcja alkilowania i acylowania (reakcja Friedela – Craftsa) cd. : Ø karbokation pary jonowej staje się czynnikiem elektrofilowym - alkilującym / acylującym, układ aromatyczny, Ø dodatnio naładowany atom wegla karbokationu atakuje atom węgla pierścienia aromatycznego: ü Ar – H + R+[Al. Cl 4]- [Ar – HR]+[Al. Cl 4]ü [Ar – HR]+[Al. Cl 4]- Ar – R + HCl + Al. Cl 3 Ø równania sumaryczne reakcji: Al. Cl 3 ü Ar – H + R – Cl Ar – R + HCl

Reakcje substytucji elektrofilowej – – | v Reakcja alkilowania i acylowania (reakcja Friedela – Craftsa) cd. : O R || O || + C [Al. Cl ] 4 ü Ar – H + R – C+[Al. Cl 4]- Ar H O R O || ü + HCl + Al. Cl 3 C+ [Al. Cl 4]- Ar C Ar R H COR R – kation Ø równania sumaryczne reakcji: ) — — przejściowy H O O Al. Cl 3 C C Ar – H + R Ar + HCl Cl R | | – || | – – – Ø produktami alkilowania są węglowodory typu alkilobenzenu, a acylowania odpowiednie ketony

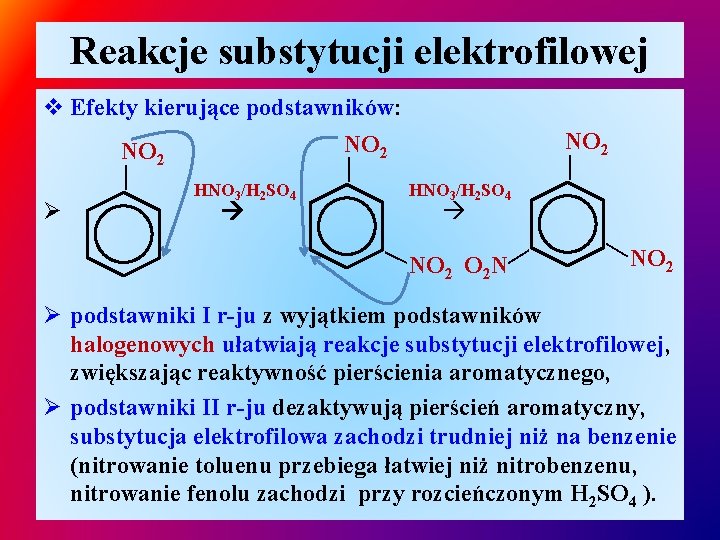
Reakcje substytucji elektrofilowej v Efekty kierujące podstawników: Ø podstawniki związane z pierścieniem benzenowym wywierają wpływ na kierunek ataku czynnika elektrofilowego, Ø podstawniki są podzielone na dwa rodzaje: ü podstawniki I rodzaju - kierujące kolejne podstawniki na pozycje orto / para: grupy alkilowe (-CH 3; - CH 2 - CH 3), halogenowe (-F; -Cl, -Br, -I), grupa hydroksylowa (- OH), grupy alkoksylowe ( R–O -) grupy aminowe (-NH 2; -NHR; -NR 2) ü podstawniki II rodzaju – kierujące kolejne podstawniki na pozycję meta: grupa nitrowa (-NO 2), grupa sulfunowa (-SO 3 H), grupa nitrylowa (-C≡N), karboksylowa (-COOH), grupa karbonylowa (R–C=O)

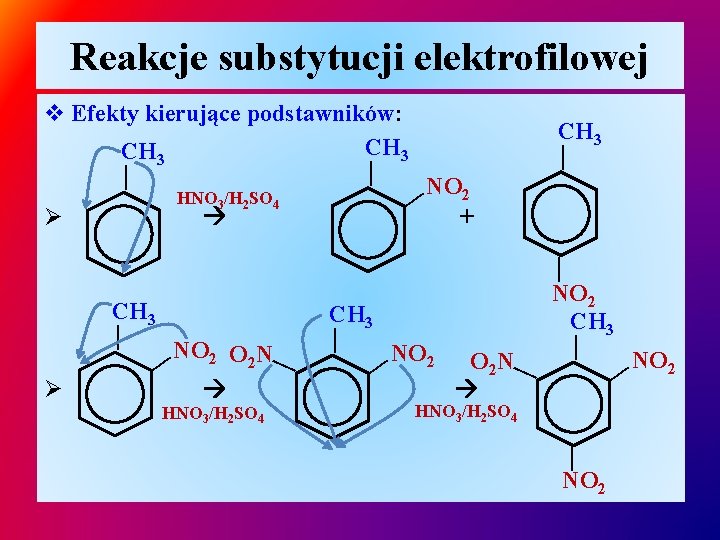
Reakcje substytucji elektrofilowej HNO 3/H 2 SO 4 Ø NO 2 — + — CH 3 — — — v Efekty kierujące podstawników: CH 3 O 2 N — NO 2 — HNO 3/H 2 SO 4 — NO 2 O 2 N — — Ø CH 3 — — CH 3 NO 2 —

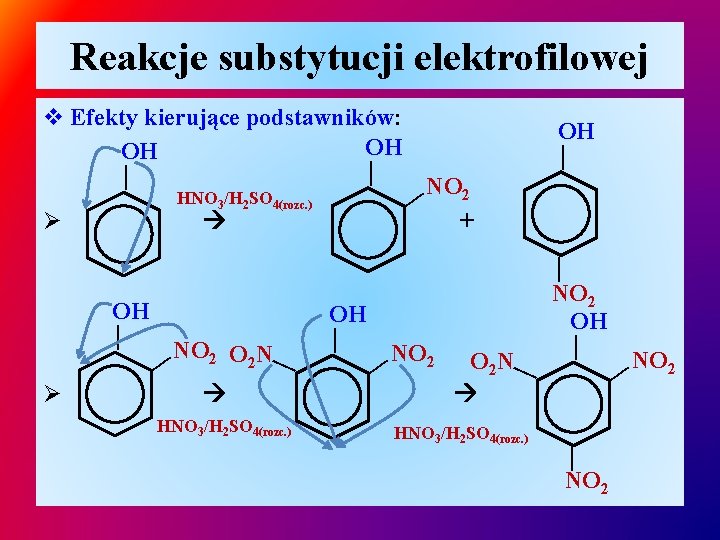
Reakcje substytucji elektrofilowej Ø HNO 3/H 2 SO 4(rozc. ) NO 2 — + — OH — — — v Efekty kierujące podstawników: OH OH HNO 3/H 2 SO 4(rozc. ) O 2 N — NO 2 — HNO 3/H 2 SO 4(rozc. ) — — NO 2 O 2 N — — Ø OH — — OH NO 2 —

Reakcje substytucji elektrofilowej Ø HNO 3/H 2 SO 4 — — 2 NO 2 HNO 3/H 2 SO 4 — NO 2 O 2 N — NO 2 — — v Efekty kierujące podstawników: NO 2 NO Ø podstawniki I r-ju z wyjątkiem podstawników halogenowych ułatwiają reakcje substytucji elektrofilowej, zwiększając reaktywność pierścienia aromatycznego, Ø podstawniki II r-ju dezaktywują pierścień aromatyczny, substytucja elektrofilowa zachodzi trudniej niż na benzenie (nitrowanie toluenu przebiega łatwiej niż nitrobenzenu, nitrowanie fenolu zachodzi przy rozcieńczonym H 2 SO 4 ).

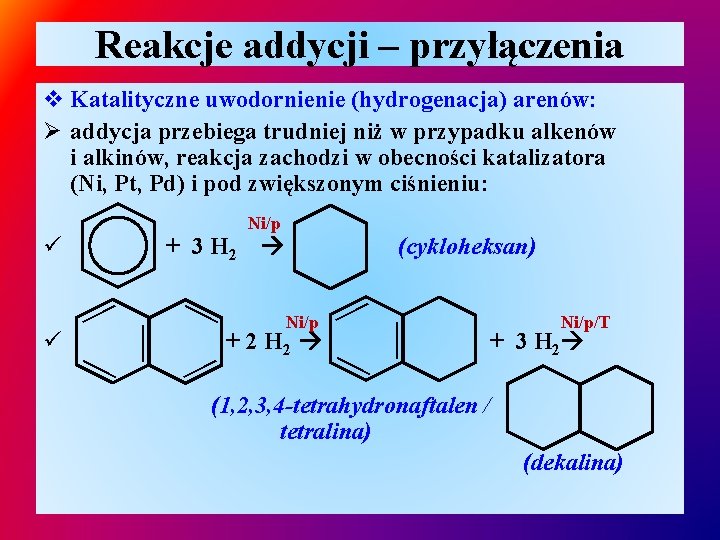
Reakcje addycji – przyłączenia v Katalityczne uwodornienie (hydrogenacja) arenów: Ø addycja przebiega trudniej niż w przypadku alkenów i alkinów, reakcja zachodzi w obecności katalizatora (Ni, Pt, Pd) i pod zwiększonym ciśnieniu: Ni/p ü Ni/p + 2 H 2 — — — (cykloheksan) Ni/p/T + 3 H 2 — — — ü + 3 H 2 (1, 2, 3, 4 -tetrahydronaftalen / tetralina) (dekalina)

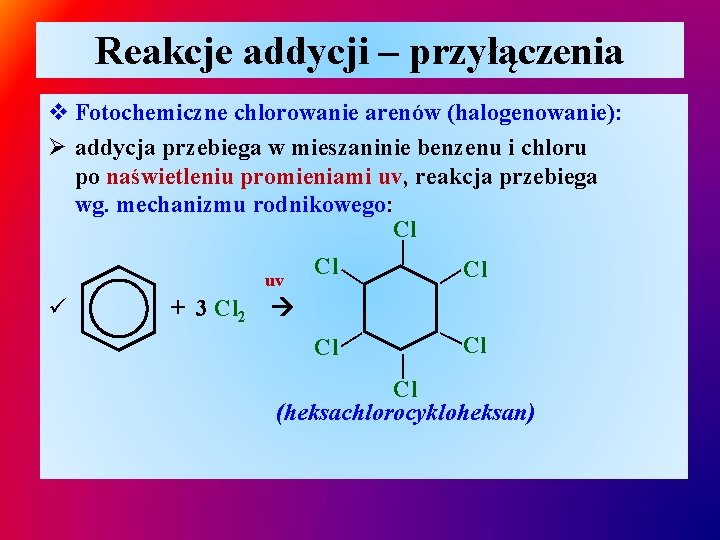
Reakcje addycji – przyłączenia Cl — + 3 Cl 2 —Cl — ü Cl — uv — v Fotochemiczne chlorowanie arenów (halogenowanie): Ø addycja przebiega w mieszaninie benzenu i chloru po naświetleniu promieniami uv, reakcja przebiega wg. mechanizmu rodnikowego: Cl Cl (heksachlorocykloheksan)

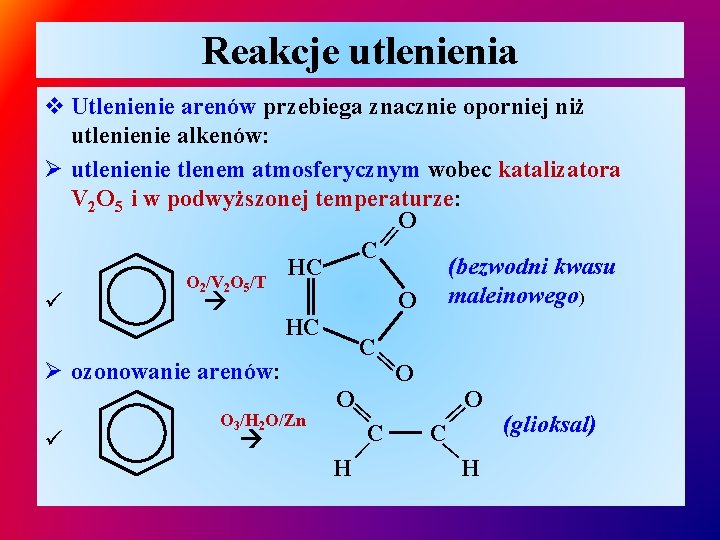
Reakcje utlenienia | || || || v Utlenienie arenów przebiega znacznie oporniej niż utlenienie alkenów: Ø utlenienie tlenem atmosferycznym wobec katalizatora V 2 O 5 i w podwyższonej temperaturze: || O C (bezwodni kwasu HC O 2/V 2 O 5/T O maleinowego) ü HC C Ø ozonowanie arenów: O O 3/H 2 O/Zn (glioksal) C C ü | H H

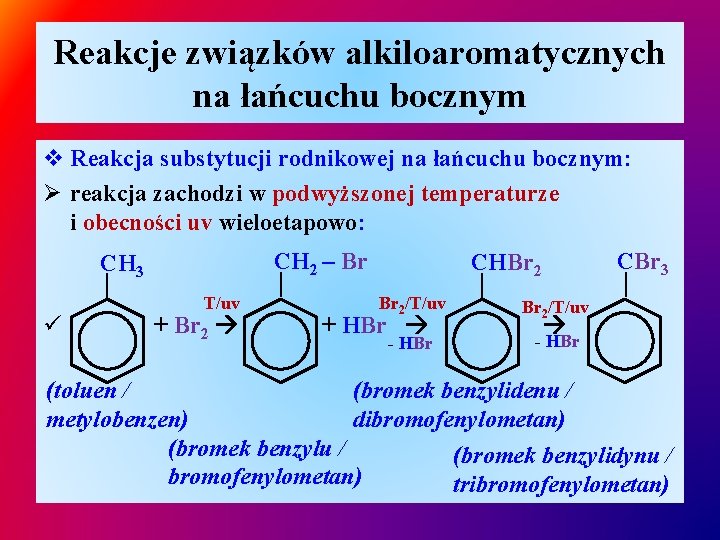
Reakcje związków alkiloaromatycznych na łańcuchu bocznym v Reakcja substytucji rodnikowej na łańcuchu bocznym: Ø reakcja zachodzi w podwyższonej temperaturze i obecności uv wieloetapowo: + Br 2 CBr 3 Br 2/T/uv + HBr - HBr — CHBr 2 — — ü T/uv — CH 2 – Br CH 3 Br 2/T/uv - HBr (toluen / (bromek benzylidenu / metylobenzen) dibromofenylometan) (bromek benzylu / (bromek benzylidynu / bromofenylometan) tribromofenylometan)

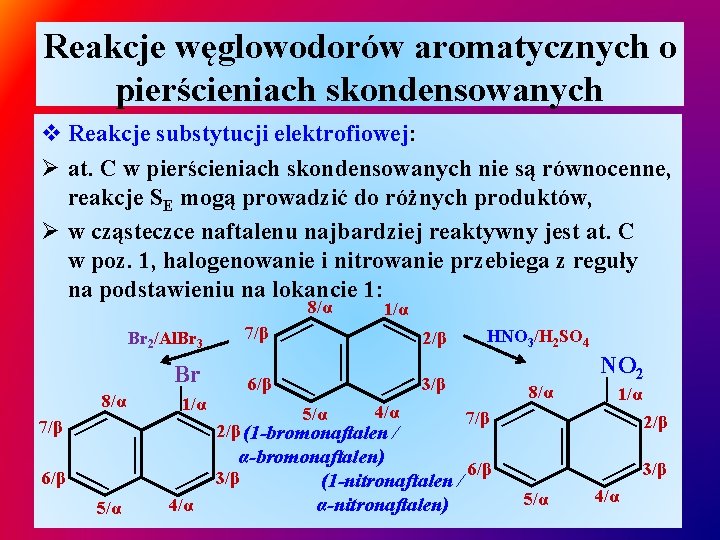
Reakcje węglowodorów aromatycznych o pierścieniach skondensowanych v Reakcje substytucji elektrofiowej: Ø at. C w pierścieniach skondensowanych nie są równocenne, reakcje SE mogą prowadzić do różnych produktów, Ø w cząsteczce naftalenu najbardziej reaktywny jest at. C w poz. 1, halogenowanie i nitrowanie przebiega z reguły na podstawieniu na lokancie 1: 5/α — 2/β (1 -bromonaftalen / 8/α 7/β α-bromonaftalen) 6/β 3/β (1 -nitronaftalen / α-nitronaftalen) — 5/α NO 2 — — — 4/α 3/β — 4/α HNO 3/H 2 SO 4 — — — 6/β — 5/α 2/β — 7/β 1/α — 8/α 6/β — 1/α — Br 7/β — Br 2/Al. Br 3 1/α — 8/α 2/β 3/β — 4/α

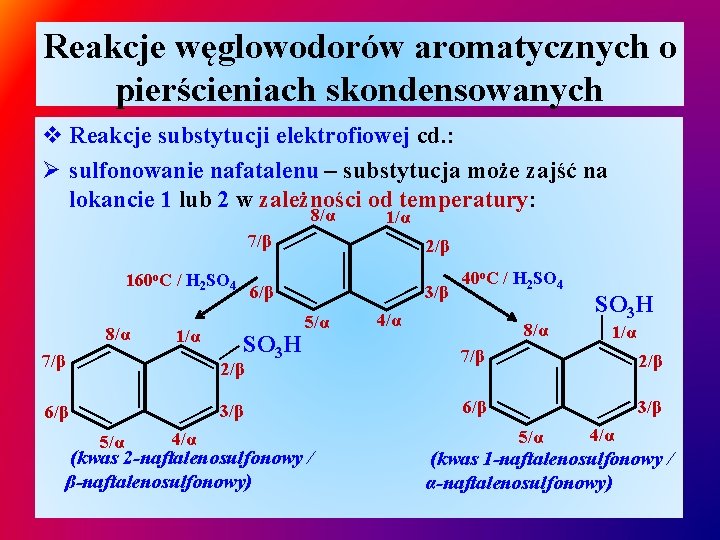
Reakcje węglowodorów aromatycznych o pierścieniach skondensowanych v Reakcje substytucji elektrofiowej cd. : Ø sulfonowanie nafatalenu – substytucja może zajść na lokancie 1 lub 2 w zależności od temperatury: 5/α — 2/β — 4/α 3/β 7/β 6/β — 5/α SO 3 H — — (kwas 2 -naftalenosulfonowy / β-naftalenosulfonowy) 8/α — — — 6/β — SO 3 H 5/α 3/β — 4/α 40 o. C / H 2 SO 4 — 7/β 1/α — 8/α 6/β 2/β 1/α — 160 o. C / H 2 SO 4 — — 7/β 1/α — 8/α 2/β 3/β — 4/α (kwas 1 -naftalenosulfonowy / α-naftalenosulfonowy)

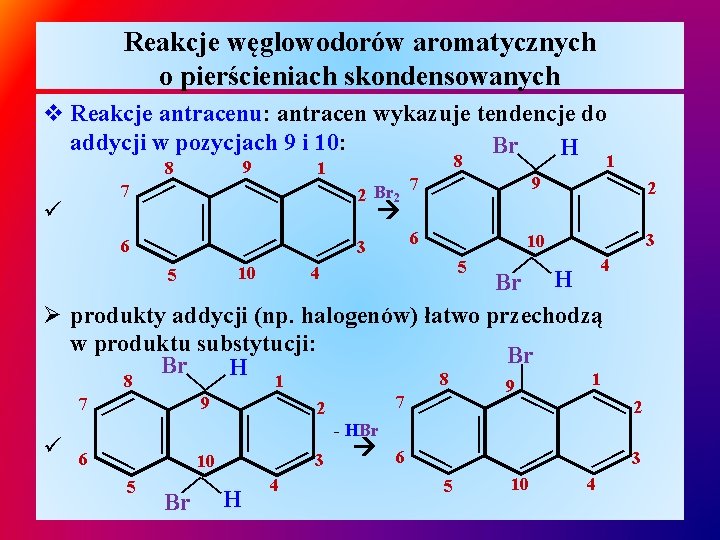
Reakcje węglowodorów aromatycznych o pierścieniach skondensowanych v Reakcje antracenu: antracen wykazuje tendencje do addycji w pozycjach 9 i 10: Br H 1 8 9 — 8 1 10 — — 4 6 3 9 — — — 10 — — — 6 — — ü 7 2 Br 2 — 7 3 — 4 — Br H Ø produkty addycji (np. halogenów) łatwo przechodzą w produktu substytucji: Br Br H 8 1 9 — - HBr 6 5 — — — 4 3 7 — — Br H — — — 5 10 2 — 6 9 — 10 — ü — — 7 5 — 5 2 2 3 — 4

Reakcje węglowodorów aromatycznych o pierścieniach skondensowanych — 5 — 3 4 7 6 — — — — — 6 2 5 — — 7 — — v Reakcje antracenu cd. : Ø Nitrowanie i sulfonowanie antracenu prowadzi do powstania mieszaniny produktów podstawionych w różnych położeniach. v Reakcje fenantrenu: Ø reakcje przebiegają analogicznie jak w przypadku antracenu w poz. 9 i 10: Br H H Br 10 9 — Br 2 9 10 8 8 1 1 ü 2 — 3 4