Siarka Wystpowanie i odmiany alotropowe Waciwoci fizyczne Waciwoci





























- Slides: 32

Siarka Występowanie i odmiany alotropowe Właściwości fizyczne Właściwości chemiczne Ważniejsze związki siarki

Siarka • Występowanie: w stanie wolnym jako siarka rodzima, w stanie związanym w minerałach: piryt Fe. S 2, galena Pb. S, blenda cynkowa Zn. S, gips krystaliczny Ca. SO 4. 2 H 2 O, siarczany(VI) magnezu i sodu rozpuszczone w wodzie morskiej, siarka towarzyszy złożom węgla kamiennego, ropy naftowej, gazu ziemnego w postaci H 2 S, gazach wulkanicznych w postaci SO 2 i H 2 S

Siarka • Odmiany alotropowe siarki: • Siarka tworzy odmiany alotropowe zarówno w stanie ciekłym, jak i w stanie stałym: - siarka rombowa (siarka α), stan skupienia stały, tworzy żółte kryształy zbudowane z 8 -mioatomowych cząsteczek, trwała w warunkach temp. pokojowej - siarka jednoskośna ( siarka β), stan skupienia stały, tworzy jasnożółte igłowe kryształy, powstaje z siarki rombowej po jej podgrzaniu do temp. 95, 6 o. C, o Tt = 119 o. C

Siarka rodzima – romboidalna Cząsteczka siarki S 8

Siarka • Właściwości fizyczne siarki: -w temp. powyżej Tt = 119 o. C, siarka przechodzi w ruchliwą ciecz barwy jasnożółtej, w trakcie dalszego podgrzewania gęstnieje i przybiera barwę brunatną jako efekt łączenia się cząsteczek S 8 w długie łańcuchy – odmiana alotropowa μ (polisiarka), -w temp powyżej 200 o. C łańcuchy polisiarki rozpadają się na krótsze i siarka przechodzi ponownie w ruchliwą ciecz. Gwałtowne schłodzenie prowadzi do powstania siarki plastycznej barwy brunatnej, która po kilku dniach przechodzi w siarkę jednoskośną a ta z kolei w siarkę rombową.

Siarka • Właściwości fizyczne siarki - cd: - w temp. 445 o. C (Tw) przechodzi w stan pary zawierające cząsteczki S 8, w miarę wzrostu temp. rozpadają się one w cząsteczki S 6, S 4, S 2 - Schłodzone pary resublimują w postaci drobnych kryształów – kwiat siarczany - Siarka nie rozpuszcza się w wodzie, słabo rozpuszcza się w etanolu, bardzo dobrze rozpuszcza się w CS 2 - w temp. 250 o. C spala się niebieskim płomieniem

Siarka – spalanie Spalanie siarki w tlenie atmosferycznym

Siarka: właściwości chemiczne • Główne stopnie utlenienia w związkach: –II, +IV i +VI, trwałe stopnie utlenienia –II i +VI • W temp. pokojowej nie reaguje z wodą i tlenem, natomiast reaguje z F oraz niektórymi metalami: litowce, cięższe berylowce oraz Hg, Ag, Cu S(s) + 3 F 2(g) SF 6(g) 2 K + S K 2 S Hg + S Hg. S 2 Ag + S Ag 2 S Cu + S Cu. S • W podwyższonej temp. reaguje z pozostałymi fluorowcami, wodorem – H 2 S (400 o. C), z innymi metalami, z tlenem – SO 2 (250 o. C)

Siarka: właściwości chemiczne - cd • Roztwarzanie siarki w kwasach utleniających i silnych zasadach: S + 2 HNO 3 H 2 SO 4 + 2 NO 3 S + 6 Na. OH Na 2 SO 3 + 2 Na 2 S + 3 H 2 O • Ogrzewanie siarki z kauczukiem: między atomami siarki powstają wiązania podwójne oraz powstają mostki siarczkowe (proces sieciowania kauczuku), w gumach dodatek siarki stanowi od 1 do 5%, przy większej zawartości siarki otrzymuje się ebonit

Siarka – otrzymywanie i zastosowanie • Otrzymywanie: na skalę przemysłową metodami górniczymi, lub wytapianie przegrzaną parą wodną, katalityczne utlenianie siarkowodoru 2 H 2 S + O 2 2 S + 2 H 2 O • Zastosowanie: wulkanizacja kauczuku (produkcja gumy i ebonitu), produkcja kwasu siarkowego(VI), zapałek, nawozów mineralnych, pestycydów, siarczku węgla, prochu strzelniczego

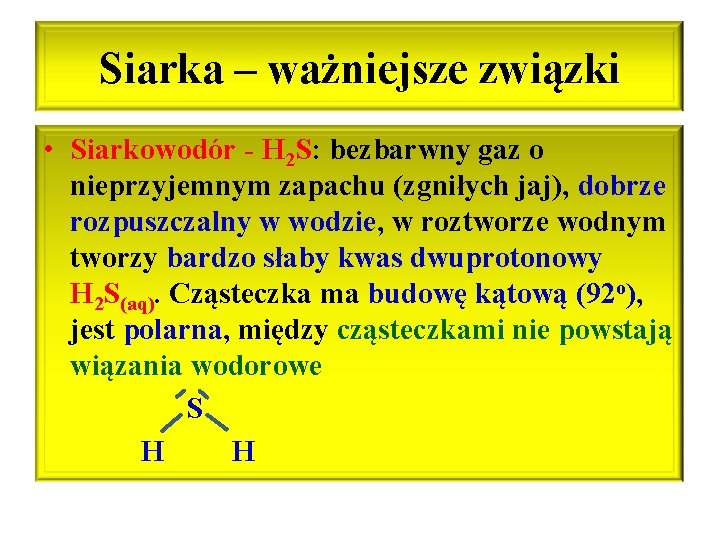
Siarka – ważniejsze związki • Siarkowodór - H 2 S: bezbarwny gaz o nieprzyjemnym zapachu (zgniłych jaj), dobrze rozpuszczalny w wodzie, w roztworze wodnym tworzy bardzo słaby kwas dwuprotonowy H 2 S(aq). Cząsteczka ma budowę kątową (92 o), jest polarna, między cząsteczkami nie powstają wiązania wodorowe S H H

Siarkowodór – H 2 S(g) • Otrzymywanie: Fe. S + HCl Fe. Cl 2 + H 2 S • Właściwości: siarkowodór jest gazem trującym (wiąże się z kationami Fe 2+ hemoglobiny w nierozpuszczalny Fe. S), palnym (spala się niebieskim płomieniem), wykazuje silne właściwości redukcyjne, w zależności od utleniacza może utlenić się do siarki elementarnej, SO 2 lub SO 3 2 H 2 S + 3 O 2 2 H 2 O + 2 SO 2 (nadmiar) 2 H 2 S + O 2 2 H 2 O + 2 S (niedobór)

Kwas siarkowodorowy – H 2 S(aq) i jego sole – siarczki • Dysocjacja elektrolityczna: H 2 S + H 2 O ↔ H 3 O+ + HSHS- + H 2 O ↔ H 3 O+ + S 2 • Sole kwasu siarkowodorowego: może tworzyć siarczki i wodorosiarczki, siarczki litowców oraz Sr, Ba, amonu są rozpuszczalne w wodzie, odczyn wodnych roztworów tych soli jest zasadowy – hydroliza anionowa S 2 - + H 2 O ↔ HS- + OHHS- + H 2 O ↔ H 2 S + OH-

Siarczki • Siarczki pozostałych metali: są praktycznie rozpuszczalne w wodzie, powstają one w trakcie wysycania wodnych roztworów danych soli gazowym siarkowodorem lub po dodaniu roztworu rozpuszczalnej soli siarczku (Na 2 S) Ni 2+(aq) + H 2 S(g) Ni. S(s) + 2 H+ 2 Fe 3+(aq) + 3 S 2 -(aq) Fe 2 S 3(s) Wodne roztwory siarczków litowców mają zdolność rozpuszczania siarki i tworzenia jonów polisiarczkowych Sn 2 - (n = 2 ÷ 9), np. piryt Fe. S 2 , atomy siarki jonach połączone są liniowo

Związki siarki – tlenek siarki(IV) SO 2 • Właściwości fizyczne SO 2: gaz bezbarwny o duszącym zapachu i podrażniającym błony śluzowe, o gęstości większej od gęstości powietrza, dobrze rozpuszcza się w wodzie, cząsteczka polarna o budowie kątowej. • Właściwości chemiczne SO 2: tlenek o właściwościach kwasowych, w reakcji z wodą powstaje kwas siarkowy(IV) – H 2 SO 3 [hydrat tlenku siarki(IV) SO 2. H 2 O] SO 2 + H 2 O H 2 SO 3

Związki siarki – tlenek siarki(IV) SO 2 • Otrzymywanie SO 2: • Metody laboratoryjne – rozkład siarczanów(IV) mocnymi kwasami lub redukcja kwasu siarkowego(VI) miedzią, spalanie siarki Na 2 SO 3 + 2 HCl SO 2 + 2 Na. Cl Cu + 2 H 2 SO 4 Cu. SO 4 + SO 2 + 2 H 2 O • Metody przemysłowe – spalanie siarki, pirytu lub innych związków, redukcja anhydrytu węglem, spalanie siarkowodoru S + O 2 SO 2 4 Fe. S 2 + 11 O 2 8 SO 2 + 2 Fe 2 O 3 2 Zn. S + 3 O 2 2 Zn. O + 2 SO 2 2 Ca. SO 4 + C 2 SO 2 + 2 Ca. O + CO 2 2 H 2 S + 3 O 2 2 SO 2 + 2 H 2 O

Związki siarki – tlenek siarki(IV) SO 2 • Zastosowanie SO 2: produkcja kwasu siarkowego i siarczanów(VI), środek wybielający w przemyśle tekstylnym i papierniczym, środek dezynfekcyjny (szklarnie beczki na wino i piwo), konserwujący w przemyśle spożywczym (susz owocowy, soki i przeciery owocowe), oznaczanie ilościowe wody w rozpuszczalnikach organicznych, stężenia SO 2 w powietrzu z wykorzystaniem czułej reakcji z jodem SO 2 + I 2 + 2 H 2 O H 2 SO 4 + 2 HI • Uwaga: tlenek jest gazem toksycznym, w połączeniu w wodą (HSO 3 -) uszkadza DNA, niszczy barwniki w tym chlorofil, jest przyczyną kwaśnych deszczy

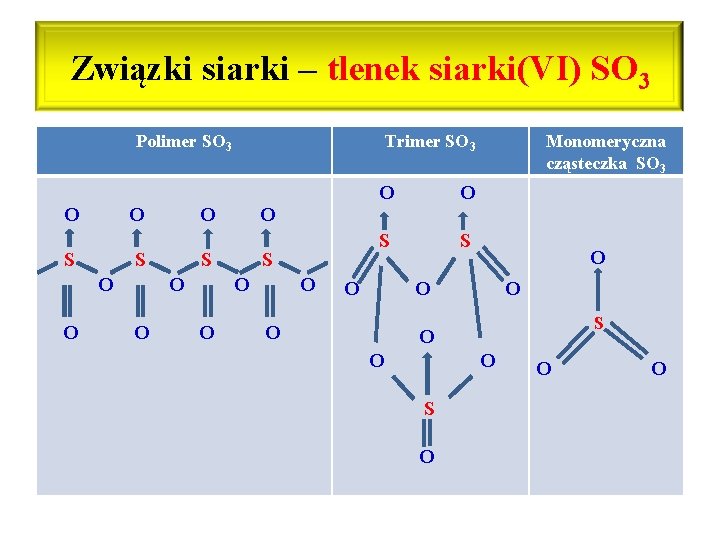
Związki siarki – tlenek siarki(VI) SO 3 • Właściwości fizyczne SO 3: wykazuje skłonności do polimeryzacji, stąd występuje w wielu odmianach, które różnią się właściwościami fizycznymi Zakres temp. Struktura Właściwości fizyczne Poniżej 17 o. C Polimer łańcuchowy Krystaliczna, bezbarwna substancja stała (podobna do lodu) 17 -45 o. C Trimer cykliczny Bezbarwna lotna ciecz Powyżej 45 o. C Monomeryczne cząsteczki Bezbarwny gaz

Związki siarki – tlenek siarki(VI) SO 3 Polimer SO 3 O O S O O Trimer SO 3 S O O O S S O Monomeryczna cząsteczka SO 3 O O S O O O

Związki siarki – tlenek siarki(VI) SO 3 • Właściwości chemiczne SO 3: bardzo dobrze rozpuszcza się w wodzie (lepiej w H 2 SO 4), produktem są trudne do kondensacji pary kwasu siarkowego(VI), tlenek jest silnie higroskopijny, ma właściwości kwasowe, w trakcie rozpuszczania w kwasie siarkowym(VI) powstaje mieszanina (oleum) kwasu siarkowego(VI) i kwasów polisiarkowych SO 3 + H 2 O H 2 SO 4 SO 3 + H 2 SO 4 H 2 S 2 O 7 (H 2 S 3 O 10, H 2 S 4 O 13) • Otrzymywanie SO 3: katalityczne utlenianie (V 2 O 5 lub Pt) tlenku siarki(IV) 2 SO 2 + O 2 2 SO 3

Związki siarki – kwas siarkowy(IV) H 2 SO 3 • Właściwości H 2 SO 3: nietrwały, dwuprotonowy kwas średniej mocy, występuje tylko w dużych rozcieńczeniach, ulega dysocjacji dwustopniowej H 2 SO 3 +H 2 O ↔ H 3 O+ + HSO 3 - + H 2 O ↔ H 3 O+ + SO 32 - • Kwas tworzy dwa typy soli – siarczany(IV); SO 32 i wodorosiarczany(IV); HSO 3 • Siarczany(IV) i wodorosiarczany(IV) litowców i amonu są dobrze rozpuszczalne w wodzie, odczyn wodnych roztworów soli litowców jest zasadowy – ulegają hydrolizie anionowej (odczyn wodnego roztworu Na. HSO 3 jest kwasowy) SO 32 - + H 2 O HSO 3 - + OHHSO 3 - + H 2 O H 2 SO 3 + OHH 2 SO 3(aq) SO 2(g) + H 2 O

Związki siarki – siarczany(IV) • Właściwości siarczanów(IV): • Właściwości redukujące w kontakcie z silnymi utleniaczami 2 KMn. O 4 + 5 Na 2 SO 3 + 3 H 2 SO 4 K 2 SO 4 + 5 Na 2 SO 4 + 2 Mn. SO 4 + 3 H 2 O 2 KMn. O 4 + Na 2 SO 3 + 2 KOH 2 K 2 Mn. O 4 + Na 2 SO 4 + H 2 O 2 KMn. O 4 + 3 Na 2 SO 3 + H 2 O 2 Mn. O 2 + 2 KOH + 3 Na 2 SO 4 • Zastosowanie siarczanów(IV): środki dezynfekcyjne i bielące w przemyśle spożywczym, papierniczym [Ca(HSO 3)2 – otrzymywanie celulozy z masy drzewnej], włókienniczym, w analizie chemicznej i fotografii (Na 2 SO 3) Pirosiarczany(IV): powstają w trakcie odparowania wody konstytucyjnej z wodorosiarczanów(IV), w trakcie dalszego ogrzewania pirosiarczany ulegają rozkładowi, kwas pirosiarkowy(IV) występuje tylko w solach 2 Na. HSO 3 Na 2 S 2 O 5 + H 2 O Na 2 S 2 O 5 Na 2 SO 3 + SO 2(g)

Związki siarki – kwas siarkowy(VI) H 2 SO 4 • Właściwości fizyczne H 2 SO 4: bezbarwna, bezwonna oleista ciecz, o gęstości 1, 84 g/cm 3, z wodą miesza się w dowolnych stosunkach, proces rozcieńczenia jest silnie egzoenergetyczny, max. stężenie 98%, silnie higroskopijny (stosowany jako osuszacz gazów), silne właściwości żrące i utleniające, powoduje zwęglenie związków organicznych C 6 H 12 O 6 6 C + 6 H 2 O

Związki siarki – kwas siarkowy(VI) H 2 SO 4 • Właściwości chemiczne H 2 SO 4: • Stężony H 2 SO 4 pasywuje metale Fe, Al, Cr warstewką ich tlenków, metale te roztwarzają się w kwasie rozcieńczonym • Stężony H 2 SO 4 (gorący) jest redukowany przez Cu, Ag, Hg (a także Zn i Mg) do tlenku siarki(IV) – metale te roztwarzają się z wydzielaniem wody, w przypadku Cu, Ag i Hg reakcje nie zachodzą z rozcieńczonym kwasem Cu + 2 H 2 SO 4 Cu. SO 4 + SO 2 + H 2 O

Związki siarki – kwas siarkowy(VI) H 2 SO 4 • Właściwości chemiczne H 2 SO 4: • Roztwarzanie metali o niskich wartościach potencjałach standardowych z wypieraniem wodoru 2 Na + H 2 SO 4 Na 2 SO 4 + H 2 Ca + H 2 SO 4 Ca. SO 4 + H 2 • Utlenianie niektórych niemetali C + 2 H 2 SO 4(stęż) CO 2 + 2 SO 2 + 2 H 2 O S + 2 H 2 SO 4(stęż) 2 SO 2 + 2 H 2 O

Związki siarki – kwas siarkowy(VI) H 2 SO 4 • Właściwości chemiczne H 2 SO 4: • Dysocjacja elektrolityczna dwustopniowa, kwas jest silnym elektrolitem, rozcieńczony jest praktycznie całkowicie zdysocjowany, w stężonych roztworach K 2 jest stosunkowo niewielki H 2 SO 4 + H 2 O ↔ H 3 O+ + HSO 4 - + H 2 O ↔ H 3 O+ + SO 42 Wypieranie kwasów słabych i bardziej lotnych Na. Cl + H 2 SO 4 Na. HSO 4 + HCl 2 KCl + H 2 SO 4 K 2 SO 4 + 2 HCl

Związki siarki – siarczany(VI) • Kwas siarkowy(VI) tworzy dwa rodzaje soli: wodorosiarczany(VI) i siarczany(VI), siarczany(VI) są z reguły dobrze rozpuszczalne w wodzie (wyjątki: Ba, Sr, Pb), siarczan(VI) wapnia jest słabo rozpuszczalny • Odczyn wodnych roztworów siarczanów(VI) jest obojętny (sole mocnych zasad) lub kwasowy (sole słabych zasad) – hydroliza kationowa, natomiast wodorosiarczanów(VI) kwasowy ze względu na dysocjację jonu HSO 4

Związki siarki – siarczany(VI) • Wodorosiarczany(VI): ogrzewane tworzą disiarczany(VI) – pirosiarczany(VI), które ulegają termicznemu rozkładowi 2 Na. HSO 4 Na 2 S 2 O 7 + H 2 O Na 2 S 2 O 7 Na 2 SO 4 + SO 2 • Otrzymywanie kwasu siarkowego na skalę przemysłową: • I etap: otrzymanie SO 2 w procesie utlenienia S, Fe. S 2, H 2 S • II etap: utlenienie SO 2 do SO 3 w obecności katalizatora V 2 O 5 lub Pt • etap III: rozpuszczanie SO 3 w stężonym H 2 SO 4 SO 3 + H 2 SO 4 H 2 S 2 O 7 • Etap IV: rozcieńczanie wodą oleum [mieszaniny kwasów polisiarkowych(VI)] do otrzymania 98% roztworu H 2 S 2 O 7 + H 2 O 2 H 2 SO 4

Ważniejsze sole kwasu siarkowego(VI) • Siarczan(VI) sodu Na 2 SO 4: bezbarwna, krystaliczna substancja, dobrze rozpuszczalna w wodzie, występuje jako hydrat Na 2 SO 4. 10 H 2 O – sól glauberska, stosowany w produkcji szkła, papieru, proszków do prania oraz farb • Siarczan(VI) potasu K 2 SO 4: bezbarwna substancja krystaliczna, dobrze rozpuszczalna w wodzie, stosowany w produkcji szkła oraz jako nawóz potasowy • Siarczan(VI) magnezu Mg. SO 4: bezbarwna krystaliczna substancja, dobrze rozpuszczalna w wodzie, gorzki w smaku, występuje jako hydrat Mg. SO 4. 7 H 2 O, stosowana w medycynie jako odtrutka i środek przeczyszczający

Ważniejsze sole kwasu siarkowego(VI) • Siarczan(VI) wapnia Ca. SO 4 – anhydryt: biała, krystaliczna substancja słabo rozpuszczalna w wodzie, występuje w postaci hydratu Ca. SO 4. 2 H 2 O (gips, alabaster), stosowany do produkcji farb, w budownictwie, medycynie, metalurgii • Siarczan(VI) glinu Al 2(SO 4)3: bezbarwna, drobnokrystaliczna substancja, dobrze rozpuszczalna w wodzie, występuje w postaci hydratu Al 2(SO 4)3. 18 H 2 O, stosowany w przemyśle papierniczym, garbarstwie i farbiarstwie, surowiec do otrzymywania Al 2 O 3 • Siarczan(VI) miedzi(II) Cu. SO 4: bezbarwna, krystaliczna substancja, po rozpuszczeniu w wodzie przyjmuje barwę niebieską, występuje jako hydrat Cu. SO 4. 5 H 2 O – niebieskie kryształy dobrze rozpuszczalne w wodzie, stosowany do produkcji pestycydów, jest składnikiem farb, w galwanoplastyce oraz barwienia metali, np. cynku i miedzi, odczynnik chemiczny , ma właściwości toksyczne

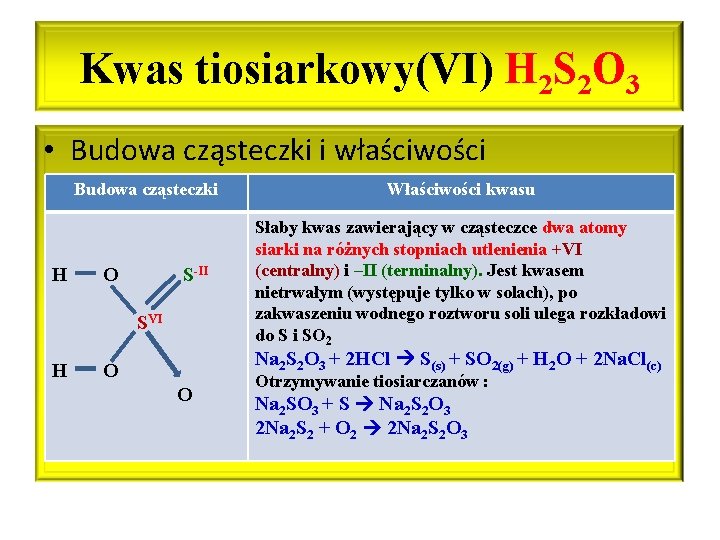
Kwas tiosiarkowy(VI) H 2 S 2 O 3 • Budowa cząsteczki i właściwości Budowa cząsteczki H O S-II SVI H Właściwości kwasu Słaby kwas zawierający w cząsteczce dwa atomy siarki na różnych stopniach utlenienia +VI (centralny) i –II (terminalny). Jest kwasem nietrwałym (występuje tylko w solach), po zakwaszeniu wodnego roztworu soli ulega rozkładowi do S i SO 2 Na 2 S 2 O 3 + 2 HCl S(s) + SO 2(g) + H 2 O + 2 Na. Cl(c) O O Otrzymywanie tiosiarczanów : Na 2 SO 3 + S Na 2 S 2 O 3 2 Na 2 S 2 + O 2 2 Na 2 S 2 O 3

Tiosiarczan(VI) sodu Na 2 S 2 O 3 • Tiosiarczany należą do trwałych soli: Na 2 S 2 O 3 ma właściwości redukujące (występowanie siarki na –II stopniu utlenienia), mają zdolność rozpuszczania osadów chlorku i bromku srebra(I) poprzez tworzenie związków kompleksowych, sól ma zastosowanie w analizie chemicznej oraz w fotografii jako utrwalacz, w reakcji z chlorem wykorzystywany jest do usuwania chloru po procesie ich bielenia tkanin, w reakcji z jodem do oznaczania zawartości jodu – jodometria S 2 O 32 - + 4 Cl 2 + 5 H 2 O 2 SO 42 - + 8 Cl- + 1 OH+ 2 S 2 O 32 - + I 2 S 4 O 62 - + 2 I-
 Fosfor występuje w czterech odmianach alotropowych
Fosfor występuje w czterech odmianach alotropowych S8 siarka
S8 siarka Odmiany alotropowe węgla
Odmiany alotropowe węgla Odmiany alotropowe cyny
Odmiany alotropowe cyny Siarka wystepowanie
Siarka wystepowanie Konfiguracja elektronowa atomu chloru
Konfiguracja elektronowa atomu chloru Godowy lub inkubacji krzyżówka
Godowy lub inkubacji krzyżówka Odmiany szlifowania
Odmiany szlifowania Typy organizacji produkcji
Typy organizacji produkcji Stopnie utlenienia manganu
Stopnie utlenienia manganu Etylocyklopentan
Etylocyklopentan Struktura organizacyjna piekarni
Struktura organizacyjna piekarni Wychowanie fizyczne net
Wychowanie fizyczne net Wlasciwosci fizyczne alkanow
Wlasciwosci fizyczne alkanow Edukacja zdrowotna podstawa programowa
Edukacja zdrowotna podstawa programowa Na czym polegają biologiczne metody utrwalania żywności
Na czym polegają biologiczne metody utrwalania żywności Spalanie niecałkowite
Spalanie niecałkowite Wielkości fizyczne jednostki i pomiary zadania
Wielkości fizyczne jednostki i pomiary zadania Podstawa programowa wf 1-3
Podstawa programowa wf 1-3 Topologia hierarchiczna
Topologia hierarchiczna Zjawisko fizyczne a reakcja chemiczna klasa 7
Zjawisko fizyczne a reakcja chemiczna klasa 7 Paradoks olbersa
Paradoks olbersa Dopasowanie prostej do wyników pomiarów
Dopasowanie prostej do wyników pomiarów Tcza
Tcza Właściwości fizyczne fenolu
Właściwości fizyczne fenolu Właściwości fizyczne wodoru
Właściwości fizyczne wodoru Zjawiska fizyczne w przyrodzie
Zjawiska fizyczne w przyrodzie Nowa podstawa programowa z wychowania fizycznego
Nowa podstawa programowa z wychowania fizycznego
















































