Wystpowanie chromu i jego otrzymywanie Waciwoci chemiczne chromu










- Slides: 12

Występowanie chromu i jego otrzymywanie, --Właściwości chemiczne chromu i jego związków -

W przyrodzie występuje tylko w postaci związanej, ważniejsze minerały: Chromit – Fe. Cr 2 O 4 Krokoit – Pb. Cr. O 4

1. Aluminotermia (wyjaśnienie procesu znajduje się w prezentacji dotyczącej manganu) Fe. Cr 2 O 4 + 2 Al 2 Cr + Fe. O + Al 2 O 3 2. Redukcja chromitu węglem Fe. Cr 2 O 4 + 2 C 2 Cr + Fe + 2 CO 2 Elektroliza wodnych roztworów soli chromu +III 3. Metal twardy, srebrzystobiały, błyszczący z niebieskim odcieniem


1. Pasywacja w reakcji z tlenem 4 Cr + 3 O 2 2 Cr 2 O 3 (tlenek barwy zielonej) 2. W podwyższonej temperaturze reaguje z siarką i fluorowcami 3. Reaguje z kwasami HCl i rozcieńczonym H 2 SO 4 z wydzieleniem wodoru 4. Ulega pasywacji w obecności stężonych kwasów utleniających (HNO 3, H 2 SO 4), powstaje warstewka Cr 2 O 3

1. Chrom na +II jest silnym reduktorem 4 Cr. Cl 2 + 4 HCl + O 2 4 Cr. Cl 3 + 2 H 2 O (niebieski) (czerwono-fioletowy) Rozkład wody w warunkach beztlenowych 2 Cr. Cl 2 + 2 H 2 O Cr. Cl 2 OH + H 2 (fioletowo-zielony) 2. Chrom na +VI jest silnym utleniaczem K 2 Cr 2 O 7 + 3 Na 2 SO 3 + 4 H 2 SO 4 3 Na 2 SO 4 + Cr 2(SO 4)3 + K 2 SO 4 + 4 H 2 O (fioletowo-zielony) Cr. O 3 + 2 NH 3 N 2 + 3 H 2 O + Cr 2 O 3

Właściwości zmieniają się wraz ze zmianą stopnia utlenienia: na +II jest zasadowy na +III ma charakter amfoteryczny na najwyższym +VI ma charakter kwasowy

1. Cr. O – czarny, Cr(OH)2 – ciemnobrunatny; związki o właściwościach zasadowych , nierozpuszczalne w wodzie Otrzymywanie: Cr. Cl 2 + 2 Na. OH Cr(OH)2 + 2 Na+ + 2 Cl. Cr(OH)2 Cr. O + H 2 O (ogrzewanie) (wodne roztwory zawierające Cr 2+ mają barwę niebieską) 2. Cr 2 O 3 – zielony, Cr(OH)3 – szarozielony; związki o właściwościach amfoterycznych , nierozpuszczalne w wodzie Cr(OH)3 + 3 HCl Cr. Cl 3 + 3 H 2 O Cr(OH)3 + Na. OH Na+ + [Cr(OH)4]Cr(OH)3 + 3 Na. OH 3 Na+ + [Cr(OH)6]3 - Otrzymywanie Cr(OH)3: Cr. Cl 3 + 3 NH 3. H 2 O Cr(OH)3 + 3 NH 4+ + 3 Cl- Cr 2 O 3: 2 Cr(OH)3 Cr 2 O 3 + 3 H 2 O (ogrzewanie)

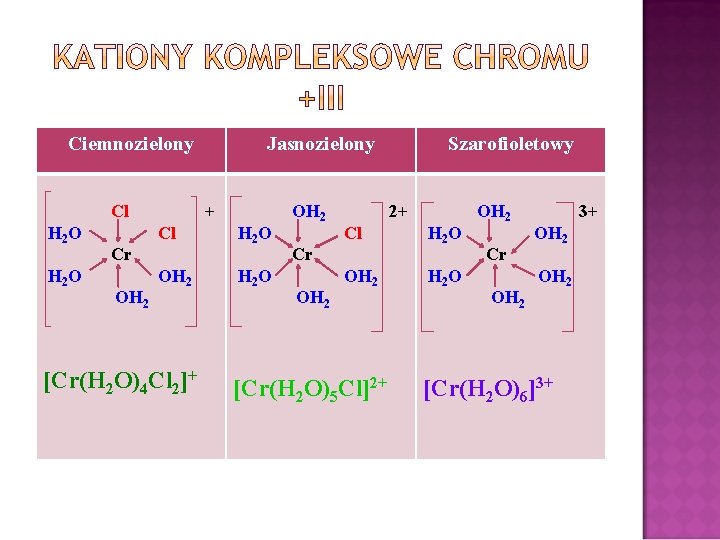
1. Cr 2(SO 4)3 – barwy różowej w roztworze wodnym tworzy dwa kompleksy o różnej barwie [Cr(H 2 O)4(SO 4)4]+ - barwa zielona [Cr(H 2 O)6]3+ - brawa filetowa 2. Cr. Cl 3 – brawa czerwono-fioletowa w wodnych roztworach tworzy trzy kompleksy o różnych barwach [Cr(H 2 O)4 Cl 2]+ - ciemnozielony [Cr(H 2 O)5 Cl]2+ - jasnozielony [Cr(H 2 O)6]3+ - szafirowo-fioletowy

Ciemnozielony Cl H 2 O + Cl Cr OH 2 Jasnozielony OH 2 [Cr(H 2 O)4 Cl 2]+ H 2 O OH 2 2+ Cl Cr OH 2 Szarofioletowy OH 2 [Cr(H 2 O)5 Cl]2+ H 2 O OH 2 Cr OH 2 3+ OH 2 [Cr(H 2 O)6]3+

3. Cr. O 3 – pomarańczowo-czerwony - ma właściwości kwasowe Cr. O 3 + H 2 O H 2 Cr. O 4 (kwas chromowy(VI) W środowisku kwasowym (H+) kwas chromowy(VI) przechodzi w kwas dichromowy(VI) 2 H 2 Cr. O 4 H 2 Cr 2 O 7 + H 2 O Sole chromiany(VI) mają barwę żółtą Sole dichromiany(VI) mają barwę pomarańczową Aniony Cr 2 O 72+ są trwałe w środowisku kwasowym 2 Cr. O 42 - + 2 H+ Cr 2 O 72 - + H 2 O Aniony Cr. O 42 - są trwałe w środowisku zasadowym Cr 2 O 72 - + 2 OH- 2 Cr. O 42 - + H 2 O

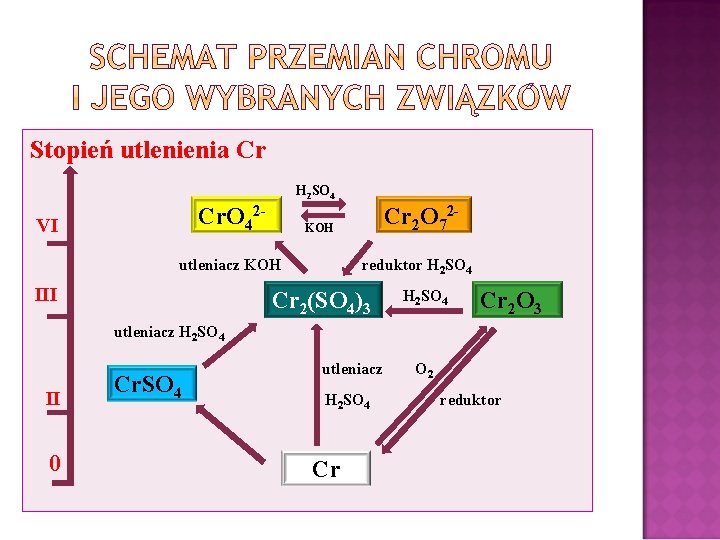
Stopień utlenienia Cr H 2 SO 4 Cr. O 42 - VI KOH utleniacz KOH III Cr 2 O 72 reduktor H 2 SO 4 Cr 2(SO 4)3 H 2 SO 4 Cr 2 O 3 utleniacz H 2 SO 4 II 0 Cr. SO 4 utleniacz H 2 SO 4 Cr O 2 reduktor
 Tlenek chromu iv
Tlenek chromu iv Chrom elektrony walencyjne
Chrom elektrony walencyjne Otrzymywanie wodorotlenków
Otrzymywanie wodorotlenków Właściwości chemiczne miedzi
Właściwości chemiczne miedzi Wodorotlenki to związki chemiczne zbudowane z
Wodorotlenki to związki chemiczne zbudowane z Reaktory chemiczne
Reaktory chemiczne Grupa tiolowa
Grupa tiolowa Stała sprzężenia nmr
Stała sprzężenia nmr Spirala logarytmiczna
Spirala logarytmiczna Rodzaje oparzeń
Rodzaje oparzeń Ani żadnej rzeczy która jego jest prezentacja
Ani żadnej rzeczy która jego jest prezentacja Podaj cechy kodu genetycznego
Podaj cechy kodu genetycznego Laikat i jego rola w kościele
Laikat i jego rola w kościele