Fluorowce chlor Oglna charakterystyka fluorowcw Wystpowanie i waciwoci


















- Slides: 20

Fluorowce - chlor -Ogólna charakterystyka fluorowców -Występowanie i właściwości chloru -Ważniejsze związki chloru

Fluorowce • Ogólna charakterystyka: fluor, chlor, brom i jod są niemetalami, astat jest półmetalem promieniotwórczym • Promień atomowy fluorowców: rośnie w grupie wraz ze wzrostem liczby atomowej Z, natomiast energia jonizacji maleje w grupie wraz ze wzrostem liczby atomowej Z • Typowe stopnie utlenienia: –I, V i VII, fluor występuje wyłącznie na stopniu utlenienia –I (najsilniejszym utleniacz), najtrwalszym stopniem utlenienia fluorowców jest –I • Aktywność pierwiastków: w grupie maleje wraz ze wzrostem liczby atomowej Z

Fluorowce • Charakter wiązań fluorowców: fluorowce w związkach z metalami ( głównie litowce i berylowce) tworzą związki jonowe, natomiast z pozostałymi pierwiastkami związki o wiązaniach kowalencyjnych lub kowalencyjnych spolaryzowanych • Tlenki fluorowców: tlenki o ogólnych wzorach E 2 O 5 i E 2 O 7 mają charakter kwasowy • Związki w wodorem: wodorki o ogólnym wzorze EH są wodorkami kwasowymi

Fluorowce – chlor • Występowanie chloru: chlor w przyrodzie występuje wyłącznie w postaci związanej - sole chlorkowe rozpuszczone w wodzie, w minerałach (halit Na. Cl, karnalit KCl. Mg. Cl 2. 6 H 2 O, sylwin KCl, kainit KCl. Mg. SO 4. 3 H 2 O) • Właściwości fizyczne chloru: gaz barwy żółtozielonej, o charakterystycznym ostrym i duszącym zapachu, o gęstości większej od gęstości powietrza, słabo rozpuszczalny w wodzie (jednak lepiej niż tlen czy azot), woda chlorowa ma barwę również żółtozieloną, bardzo dobrze rozpuszcza się w czterochlorku węgla CCl 4

Fluorowce – chlor

Fluorowce – chlor • Otrzymywanie chloru: • Na skalę przemysłową: • elektroliza wodnych roztworów chlorku sodu (sumaryczny przebieg procesu i rekcje elektrodowe) 2 Na. Cl + 2 H 2 O 2 Na. OH + Cl 2 + H 2 A(+): 2 Cl- Cl 2 + 2 e. K(-): 2 H 2 O +2 e- H 2 + 2 OH • utlenianie chlorowodoru 4 HCl + O 2 2 Cl 2 + 2 H 2 O

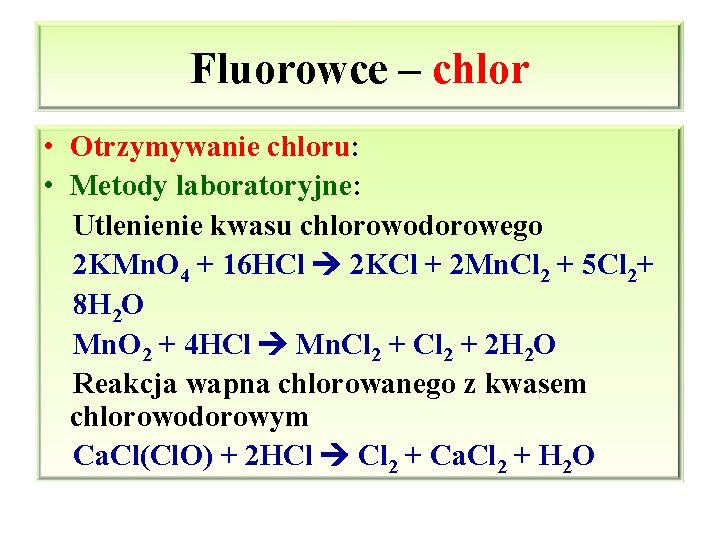
Fluorowce – chlor • Otrzymywanie chloru: • Metody laboratoryjne: Utlenienie kwasu chlorowodorowego 2 KMn. O 4 + 16 HCl 2 KCl + 2 Mn. Cl 2 + 5 Cl 2+ 8 H 2 O Mn. O 2 + 4 HCl Mn. Cl 2 + 2 H 2 O Reakcja wapna chlorowanego z kwasem chlorowodorowym Ca. Cl(Cl. O) + 2 HCl Cl 2 + Ca. Cl 2 + H 2 O

Fluorowce – chlor • Właściwości chemiczne chloru: • Dysproporcjonowanie chloru w reakcji z wodą Cl 2(g) + H 2 O ↔ HCl(aq) + HCl. O(aq) (woda chlorowa) • Woda chlorowa, tak jak sam chlor ma właściwości utleniające, które wynikają z reakcji rozkładu HCl. O pod wpływem uv HCl. O HCl + O; 2 HCl. O 2 HCl + O 2 • Chlor w stanie suchym jest bardzo aktywny chemicznie, aktywność jego wzrasta w obecności wilgoci, wchodzi w reakcje bezpośrednio z większością pierwiastków (wyjątek N, Cl, helowce) oraz z innymi związkami chemicznymi

Fluorowce – chlor • Właściwości chemiczne chloru - cd: • Reakcje z metalami Pt + 2 Cl 2(g) Pt. Cl 4 2 Au + 2 Cl 2(g) 2 Au. Cl 3 Cu + Cl 2(g) Cu. Cl 2 2 Fe + 3 Cl 2(g) 2 Fe. Cl 3 • Reakcje z niemetalami H 2(g)+ Cl 2(g) 2 HCl(g) (temp. lub uv, iskra elektr. ) • Utlenienie chloru pierwiastkowego Cl 2 + F 2 2 Cl. F(g) (temp. 270 o. C)

Fluorowce – chlor • Właściwości chemiczne chloru - cd: • Wypieranie (utlenianie) jonów Br- i I 2 Na. Br + Cl 2(g) 2 Na. Cl + Br 2(g) 2 KI + Cl 2(g) 2 KCl + I 2 • Jon chlorkowy jest wypierany (utleniany) przez fluor 2 KCl + F 2(g) 2 KF + Cl 2(g) • Reakcja chloru z roztworami zasad (r. dysproporcjonowania) 2 KOH + 0 Cl 2(g) K-ICl + K+ICl. O + H 2 O

Ważniejsze związki chloru – tlenki • Tlenki chloru: Cl 2 O; Cl. O 2; Cl 2 O 6; Cl 2 O 7 mają charakter kwasowy, reagują z wodą i roztworami zasad • Cl 2 O – żółtobrązowy gaz, wybucha w reakcji z związkami o właściowościach redukujących • 2 Cl 2 + 2 Hg. O Hg. Cl. Hg. O + Cl 2 O • Cl 2 O + 2 Na. OH 2 Na. Cl. O + H 2 O • Cl. O 2 – czerwonożółty gaz, o silnych właściwościach utleniających, ulega wybuchowemu rozkładowi przy lekkim ogrzaniu • 2 Ag. VCl. O 3 + 0 Cl 2 2 Ag-ICl + 2 IVCl. O 2 + O 2 • 2 IVCl. O 2 + 2 KOH KIIICl. O 2 + KVCl. O 3 + H 2 O

Ważniejsze związki chloru – tlenki • Tlenki chloru - cd: • Cl 2 O 6 – ciecz barwy ciemnoczerwonej o silnych właściwościach utleniających 4 Cl. O 2 + 2 O 3 2 Cl 2 O 6 + O 2 (temp. 0 o. C) VICl 2 O 6 + 2 Na. OH Na. VCl. O 3 + Na. VIICl. O 4 + H 2 O • Cl 2 O 7 – bezbarwna ciecz, otrzymuje się przez odwodnienie HCl. O 4 przez P 4 O 10 2 HCl. O 4 ↔ Cl 2 O 7 + H 2 O Cl 2 O 7 + 2 KOH 2 KCl. O 4 + H 2 O

Ważniejsze związki chloru – chlorowodór HCl i kwas chlorowodorowy HCl(aq) • Właściwości fizyczne HCl: gaz bezbarwny, o duszącym zapachu, o gęstości większej od gęstości powietrza, niepalny, silnie higroskopijny, dymi w powietrzu, bardzo dobrze rozpuszcza się w wodzie tworząc kwas chlorowodorowy • Właściwości fizyczne kwasu HCl(aq): bezbarwna ciecz ( techniczny ma odcień żółtawy) max stężenie roztworu 38%, o gęstości 1, 19 g/cm 3 na powietrzu dymi z powodu ulatniającego się chlorowodoru

Ważniejsze związki chloru – chlorowodór HCl i kwas chlorowodorowy HCl(aq) • Właściwości chemiczne chlorowodoru HCl: • W stanie suchym jest mało aktywny, nie reaguje z metalami i niemetalami, w podwyższonej temp. reaguje z litowcami i cięższymi berylowcami oraz krzemem 2 Na + 2 HCl 2 Na. Cl + H 2 Ba + 2 HCl Ba. Cl 2 + H 2 • Otrzymywanie chlorowodoru: Na. Cl + H 2 SO 4 Na. HSO 4 + HCl (temp. pokojowa) Na. Cl + Na. HSO 4 Na 2 SO 4 + HCl (podwyższona temp. ) H 2 + Cl 2 2 HCl ( na skalę przemysłową pod wpływem uv lub iskry elektrycznej, lub podwyższonej temp. ) • Zastosowanie chlorowodoru: syntezy organiczne – np. chlorku winylu, otrzymywanie kwasu chlorowodorowego, chlorków metali

Ważniejsze związki chloru – chlorowodór HCl i kwas chlorowodorowy HCl(aq) • Właściwości kwasu chlorowodorowego: • Mocny kwas, roztwarza większość metali o ujemnych wartościach potencjałów standardowych z wydzielaniem wodoru (ołów ulega pasywacji pokrywając się warstewką nierozpuszczalnego Pb. Cl 2) Fe + HCl(aq) Fe. Cl 2(aq) + H 2 Zn + HCl(aq) Zn. Cl 2(aq) + H 2 • Sole – chlorki: są dobrze rozpuszczalne w wodzie (wyjątki Pb. Cl 2, Ag. Cl), wodne roztwory chlorków mają odczyn obojętny – nie ulegają hydrolizie lub odczyn kwasowy – sole pochodzące od słabych zasad, ulegają hydrolizie kationowej

Ważniejsze związki chloru – kwasy chlorowe i ich sole • HCl. O – kwas chlorowy(I): bardzo słaby kwas, istnieje tylko w roztworach rozcieńczonych, pod wpływem uv ulega rozkładowi: HICl-IIO H-ICl + 0 O • Otrzymywanie HCl. O: rozpuszczanie chloru lub Cl 2 O w wodzie Cl 2(g) + H 2 O HICl. O(aq) + H-ICl(aq) Cl 2 O(g) + H 2 O 2 HCl. O(aq) 0 • Chlorany(I): są trwalsze od kwasu, mają właściwości utleniające, otrzymuje się przepuszczając chlor przez zasady 0 Cl + 2 KOH K-ICl + KICl. O + H O 2 2 • Chlorany(I) ogrzewane ulegają rozkładowi lub dysproporcjonowaniu 3 KICl. O 2 K-ICl + KVCl. O 3 2 KICl-IIO 2 K-ICl + 0 O 2 • Chloran(I) sodu i chloran(I) wapnia mają zastosowanie jako środki bielące

Ważniejsze związki chloru – kwasy chlorowe i ich sole • HCl. O 2 – kwas chlorowy(III): kwas średniej mocy, istnieje tylko w roztworze wodnym, jego sole (chlorany(III)) są trwalsze od kwasu, kwas i sole maja właściwości utleniające • Chlorany(III): otrzymuje się w reakcji rozpuszczania Cl. O 2 w zasadach 2 IVCl. O 2 + 2 KOH KIIICl. O 2 + KVCl. O 3 + H 2 O • Chlorany(III) ogrzewane ulegają rozkładowi lub dysproporcjonowaniu KIIICl-IIO 2 K-ICl + 0 O 2 3 KIIICl. O 2 K-ICl + 2 KVCl. O 3

Ważniejsze związki chloru – kwasy chlorowe i ich sole • HCl. O 3 – kwas chlorowy(V): mocny, nietrwały kwas, istnieje tylko w roztworach, max 40%, w wyższych stężeniach ulega rozkładowi – reakcja dysproporcjonowania 3 HVCl. O 3 HVIICl. O 4 + 2 O 2 + 0 Cl 2 + H 2 O • Chlorany(V): trwałe sole, otrzymuje się przepuszczając Cl 2 O 6 przez zasady lub chlor przez roztwory zasad VICl O + 2 KOH V VIICl. O + H O 2 6 (aq) K Cl. O 3 + K 4 2 30 Cl 2 + 6 KOH(aq) 5 K-ICl + KVCl. O 3 + 3 H 2 O • Chlorany(V) ogrzewane ulegają rozkładowi i dysproporcjonowaniu 4 KVCl. O 3 K-ICl + 3 KVIICl. O 4 2 KVCl. O 3 2 K-ICl + 3 O 2 • Chloran(V) stosowany jest do produkcji zapałek, materiałów wybuchowych i pirotechnicznych

Ważniejsze związki chloru – kwasy chlorowe i ich sole • HCl. O 4 – kwas chlorowy(VII): trwały, mocny kwas, oleista ciecz, łatwo wybuchająca, ma bardzo silne właściwości utleniające • Otrzymywanie: rozpuszczanie Cl 2 O 7 w wodzie Cl 2 O 7 + H 2 O 2 HCl. O 4 • Chlorany(VII): sole trwałe, o silnych właściwościach utleniających, otrzymuje się w reakcji dysproporcjonowania chloranów(V) lub reakcji Cl 2 O 7 z roztworami zasad Cl 2 O 7 + 2 KOH 2 KCl. O 4 + H 2 O • Chloran(VII) potasu jest krystaliczną, bezbarwną substancją, trudno rozpuszczalną w wodzie, stosowaną do produkcji środków wybuchowych

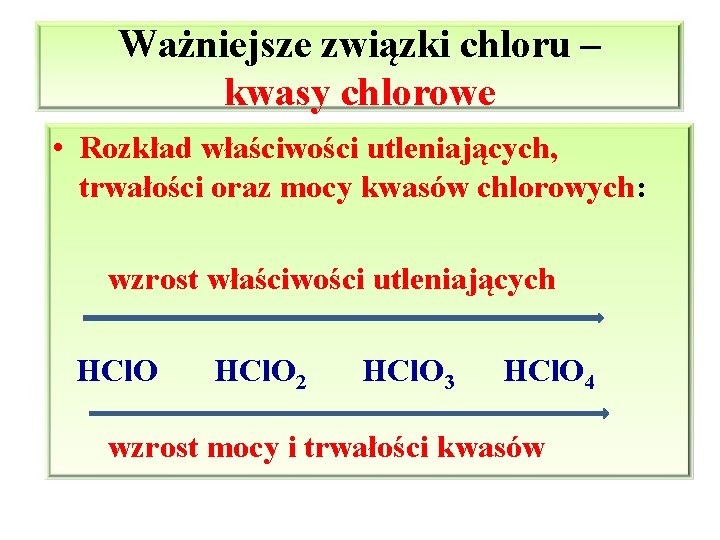
Ważniejsze związki chloru – kwasy chlorowe • Rozkład właściwości utleniających, trwałości oraz mocy kwasów chlorowych: wzrost właściwości utleniających HCl. O 2 HCl. O 3 HCl. O 4 wzrost mocy i trwałości kwasów
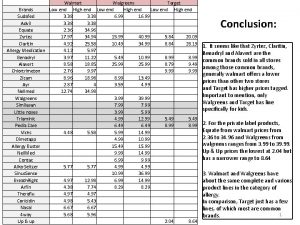
 Tabela mocy kwasów
Tabela mocy kwasów Chlor využití
Chlor využití Chlor-rid industrial cleaning
Chlor-rid industrial cleaning Hybrydyzacja diagonalna
Hybrydyzacja diagonalna Halogenierung von benzol
Halogenierung von benzol Fluor chlor brom jod
Fluor chlor brom jod Chlor trimeton walmart
Chlor trimeton walmart Vorkommen von halogenen
Vorkommen von halogenen Stabilizator parametryczny z diodą zenera
Stabilizator parametryczny z diodą zenera Autorytet zaworu regulacyjnego
Autorytet zaworu regulacyjnego Orły hobbit charakterystyka
Orły hobbit charakterystyka Pustynia lodowa klimat
Pustynia lodowa klimat Pojezierze wielkopolskie jeziora
Pojezierze wielkopolskie jeziora Srebrzysto bialy cd
Srebrzysto bialy cd Strategia lidera kosztowego
Strategia lidera kosztowego Kultura minojska i mykeńska prezentacja
Kultura minojska i mykeńska prezentacja Iwona oprzędkiewicz
Iwona oprzędkiewicz Dioda schottky'ego charakterystyka
Dioda schottky'ego charakterystyka Agata charakterystyka
Agata charakterystyka Charakterystyka impulsowa
Charakterystyka impulsowa Transport lotniczy charakterystyka
Transport lotniczy charakterystyka